THE EFFECTIVENES OF ETANOL EXTRACT, PARTITION N-HEKSANA, AND CROMATHOGRAPHY FRACTION OF MOMORDICA CHARANTIA L. TO LOWER BLOOD GLUCOSE LEVEL
on
Buletin Veteriner Udayana
pISSN: 2085-2495; eISSN: 2477-2712
Online pada: http://ojs.unud.ac.id/index.php/buletinvet
Volume 9 No. 2: 202-208
Agustus 2017
DOI: 10.21531/bulvet.2017.9.2.202
Efektivitas Ekstrak Ethanol, Partisi N-Heksana dan Fraksi Kromatografi Momordica charantia Dalam Menurunkan Glukosa Darah
(THE EFFECTIVENES OF ETANOL EXTRACT, PARTITION N-HEKSANA, AND CROMATHOGRAPHY FRACTION OF MOMORDICA CHARANTIA L. TO LOWER BLOOD GLUCOSE LEVEL)
Ni Luh Putu Kusuma Clara Dewinda1*, I Nyoman Suartha2, Luh Made Sudimartini3 1Mahasiswa Program Profesi Dokter Hewan, 2Laboratorium Penyakit Dalam Veteriner, 3Laboratorium Farmasi, Fakultas Kedokteran Hewan Universitas Udayana,
Jl. PB. Sudirman Denpasar, Bali Telp. (0361) 223791
*Email: clara.dwiendz@gmail.com
ABSTRAK
Penelitian ini bertujuan untuk mengetahui efektivitas ekstrak etanol, partisi n-heksana, dan fraksi kromatografi buah pare (Momordica charantia L.) dalam menurunkan kadar glukosa darah pada tikus putih jantan diabetik eksperimental. Penelitian ini menggunakan 25 ekor tikus putih jantan yang dibagi menjadi lima kelompok perlakuan P0 (kontrol negatif), P1 (kontrol positif), P2 (ekstrak etanol), P3 (partisi n-heksana), dan P4 (fraksi kromatografi), variable yang diamati kadar glukosa darah selama 21 hari. Kadar glukosa darah dianalisa pada hari ke -1, 0, 4, 11, 18. Rancangan yang
digunakan berupa rancangan acak lengkap (RAL). Data yang diperoleh kemudian dianalisis dengan menggunakan Split in Time. Hasil penelitian menunjukkan pemberian fraksi kromatografi pare 50 mg/kg berat badan mampu menurunkan kadar glukosa darah pada tikus hiperglikemik lebih baik dibandingkan dengan pemberian ekstrak etanol 200 mg/kg berat badan dan pertisi n-heksana 50 mg/kg berat badan.
Kata kunci: glukosa darah; diabetes mellitus; pare; partisi n-heksana; fraksi kromatografi
ABSTRACT
This study aims to determine the effectiveness of the ethanol extract, partition n-hexane, and chromatography fractions Momordica charantia L. in lowering blood glucose levels in experimental diabetic male rats. This study used 25 male rats were divided into five treatment groups P0 (negative control), P1 (positive control), P2 (ethanol extract), P3 (partition n-hexane), and P4 (chromatographic fraction) the variable observed glucose levels blood for 21 days. Blood glucose levels were analyzed on days -1, 0, 4, 11, 18. The bill, which is used in the form of a completely randomized design (CRD). The data obtained and analyzed by using Split in Time. The results showed of giving chromatographic fractions bitter melon 50 mg / kg body weight can reduce blood glucose levels in hyperglycemic rats better than the ethanol extract 200 mg / kg body weight and partition n-hexane 50 mg / kg body weight
Keywords: blood glucose; diabetes mellitus; biter melon; partition n-hekasana; chromatography
fraction
PENDAHULUAN
Diabetes Mellitus (DM) adalah suatu penyakit degeneratif, yang ditandai dengan kadar glukosa dalam darah tinggi. Walaupun tubuh mampu memproduksi insulin tetapi karena reseptor insulin kurang memadai jumlahnya sehingga membuat tidak berdaya. Hal lain yang dapat memicu DM, karena tubuh tidak menghasilkan insulin akibat sel- sel beta pankreas rusak (Alwan, 2010).
Pada hewan percobaan, DM sering
disebabkan
akibat
pemberian
streptozotocin, aloksan, asam urat, asam dehidroaskorbat, asam dialurat, dan asam ksanturenat yang dapat mengakibatkan kerusakan pada sel beta Langerhans pankreas. Streptozotocin (STZ) telah banyak digunakan untuk menciptakan kondisi diabetik eksperimental pada
hewan.
Mekanisme kerja yang
ditimbulkan oleh STZ bersifat toksik
terhadap sel beta pankreas, struktur STZ juga sangat mirip dengan molekul glukosa. Streptozotocin dapat merusak sel-sel pulau pankreas dan menstimulasi sintesis poli nuclear (ADP-ribosa), nicotinamide adenine dinucleotide (NAD+), dan NAP yang kemudian akan menghambat atau menghalangi sintesis proinsulin dan akhirnya menyebabkan diabetes. Secara klinis, gejala diabetes akan jelas terlihat pada tikus dalam waktu 2-4 hari setelah injeksi tunggal secara intravena atau intraperitoneal dengan dosis 60mg/kg STZ (Elias et al., 1994).
Penggunaan obat-obatan sintetis memiliki efek samping yang cukup tinggi. Alternatif pengobatan yang dilakukan dengan menggunakan bahan–bahan yang berasal dari alam. Berbagai jenis tanaman telah dilaporkan berkasiat menurunkan kadar glukosa darah diantaranya ekstrak buah naga (Dharmayuda et al., 2013), ekstrak daun sirih merah (Dewi et al., 2014) dan ekstrak buah pare (Suartha et al., 2014). Selain itu buah pare juga dapat digunakan untuk pencegahan dan pengobatan penyakit lain seperti malaria, sariawan dan batuk. Tanaman pare memiliki kandungan metabolit berupa saponin, flavonoid, polifenol, karoten, momordisin, glikosida cucurbitacin, charantin, asam butirat, asam palmitat, asam linoleat, dan asam stearat. Flavonoid berfungsi sebagai antimikroba dan triterpenoid sebagai insektisida dan mempengaruhi sistem saraf (Subahar, 2004).
Penggunaan ekstrak etanol buah pare telah terbukti mampu menurunkan kadar glukosa darah. Pemisahan kandungan senyawa yang terdapat dalam ekstrak etanol dapat dilakukan dengan metode partisi dengan menggunakan larutan yang memiliki sifat kepolaran yang berbeda, salah satunya adalah pelarut n-heksana yang memiliki sifat larutan non polar. Hasil partisi larutan non polar N-heksana juga mampu menurunkan kadar glukosa darah tikus putih (Suartha et al., 2014). Penelitian ini bertujuan untuk mengetahui
efektivitas ekstrak etanol, partisi n-heksana, dan fraksi kromatografi buah pare (Momordica charantia L.) dalam menurunkan kadar glukosa darah pada tikus putih jantan diabetik eksperimental.
METODE PENELITIAN
Ekstraksi Etanol Buah Pare
Ekstrak buah pare dibuat dengan cara menimbang sebanyak 50 gram buah pare segar, kemudian dihancurkan dengan menggunakan mortar. Bahan tersebut kemudian ditambahkan pelarut etanol 70% dengan dimasukan ke dalam wadah, ditutup dan dibiarkan selama dua hari terlindung dari cahaya sambil diaduk, disaring sehingga didapat maserat. Ampas dimaserasi dengan etanol 70% menggunakan prosedur yang sama, maserasi dilakukan sampai diperoleh maserat yang jernih. Semua maserat etanol digabungkan dan diuapkan dengan menggunakan alat penguap vakum putar pada suhu 40°C sampai diperoleh ekstrak etanol kental, kemudian dikeringkan menggunakan freeze dryer (Harbone, 1987).
Ekstrak etanol buah pare dipartisi dengan N-heksan untuk memisahkan metabolit yang terkandung di dalamnya dengan metabolit yang lain. Ekstrak etanol buah pare dipartisi dengan n-heksan dengan perbandingan 1:10 (satu bagian ekstrak etanol dengan 10 bagian N-heksan). Dicampurkan dan didiamkan selama 24 jam. Supernatan diambil sebagai larutan partisi N-heksan. Ekstrak n-heksan (EH) dikumpulkan kemudian dievaporasi sehingga diperoleh ekstrak n-heksan
Partisi N-heksana 2%
Partisi n-heksana ditimbang sebanyak 2 gram kemudian dilarutkan dengan aquabides sampai 100 ml dan dihomogenkan untuk mendapatkan larutan partisi n-heksana 2%.
Kromatografi kolom
Kromatografi bertujuan untuk memisahkan komponen-komponen di
dalam ekstrak hasil partisi agar diperoleh senyawa tunggal. Proses kromatografi kolom ini menggunakan kolom dengan panjang 50 cm, diameter 4 cm, dan volume 500 mL. Fase diam yang digunakan adalah silika gel 60 sebanyak 60 gram, fase geraknya adalah campuran pelarut n-heksana: etilasetat (6,0:4,5). Tahapan
kromatografi kolom sebagai berikut:
Pembuatan bubur silika.
Sekitar 60 gram silika G 60 setelah diaktifkan dengan cara memanaskan di dalam oven 110oC selama dua jam, lalu disuspensikan ke dalam 100 mL pelarut yang akan digunakan sebagai fase gerak, kemudian diaduk sampai menjadi bubur.
Pengisian kolom.
Kolom kaca dipasang tegak lurus dengan bantuan statif dan klem. Kolom dengan posisi keran tertutup, dimasukan 50 mL fase gerak, kemudian dimasukkan glasswool atau kapas yang digunakan sebagai penyangga fase diam bagian bawah kolom. Setelah kolom siap maka bubur silika gel dimasukan secara perlahan-lahan menggunakan pipet tetes sambil kran bagian bawah kolom dibuka secara perlahan-lahan. Pengisian fase diam diusahakan agar merata pada setiap permukaan kolom. Fase diam diisi ke dalam kolom sampai tanda batas yang diinginkan (sekitar 5 cm di bawah ujung kolom bagian atas). Kolom dielusi menggunakan fase geraknya selama 5-6 jam agar kemampatan kolom homogen.
Pemasukan dan Elusi Sampel.
Setelah kolom homogen, maka permukaan fase gerak diturunkan dengan jalan mengeluarkannya melalui keran sampai permukaan fase gerak sedikit di atas permukaan fase diam. Pada saat itu sampel dimasukkan ke dalam kolom secara merata di atas permukaan fase diam, lalu ditambahkan fase gerak sambil keran dibuka pelan-pelan. Kecepatan alir fase gerak dalam kolom diatur 3 mL/5 menit. Eluat ditampung setiap 3 mL pada botol kecil yang sudah
dipersiapkan. Elusi kolom dihentikan jika diperkirakan semua komponen sudah keluar dari kolom.
Penggabungan hasil Kolom.
Eluat pada masing-masing botol diuji komponennya dengan cara kromatografi lapis tipis menggunakan fase diam silika gel GF254 dengan eluen yang sesuai seperti fase gerak pada kolom. Setiap botol eluat ditotolkan pada bagian tepi pelat KLT kemudian dielusi dalam chamber kromatografi. Elusi dihentikan sampai eluen mencapai tanda batas, lalu pelat KLT dikeringkan dengan diangin-anginkan dan dideteksi nodanya menggunakan sinar lampu UV atau disemprot dengan reagen pewarna. Setiap botol eluat yang menunjukkan pola noda yang sama dapat digabungkan menjadi satu fraksi, sehingga diperoleh beberapa fraksi.
Perlakuan Terhadap Tikus
Tikus yang digunakan dalam penelitian ini adalah tikus putih (Rattus norvegicus) jantan sebanyak 25 ekor. Tikus berumur 3 bulan dengan berat badan tikus berkisar ± 150 – 200 gram, yang diadaptasi selama 14 hari. Tikus dibagi menjadi lima kelompok perlakuan yaitu : kontrol positif (+), kontrol negatif (-), ekstrak etanol, partisi n-heksana, dan fraksi kromatografi. Masing-masing
perlakuan terdiri dari lima ekor tikus yang ditempatkan dalam kandang terpisah, dilengkapi dengan tempat pakan dan minum. Pakan yang diberikan adalah pakan konsentrat dan air minum diberikan secara ad libitum. Sebelum diberikan perlakuan, tikus dipuasakan terlebih dahulu selama 24 jam. Semua tikus ditimbang berat badannya dan disuntikkan STZ, dengan dosis 45 mg/kg BB secara intraperitoneal kecuali tikus kontrol negatif (-).
Pengambilan Darah
Untuk keperluan pemeriksaan glukosa darah, darah diambil dari vena caudalis tikus. Sebelum perlakuan tikus
dipuasakan, pengambilan sampel darah dilakukan sebelum tikus diinjeksi dengan streptozotocin, pada hari ke-0 (saat tikus hiperglikemia), hari ke-4, 11, 18, setelah pemberian fraksi buah pare.
Analisis Data
Data kadar glukosa darah yang diperoleh dianalisis dengan perhitungan statistik menggunakan SPSS 20.0 for Window. Uji ini dianalisis dengan menggunakan RAL pola Split in Time dilanjutkan degan uji Duncan.
HASIL DAN PEMBAHASAN
Hasil pemeriksaan kadar glukosa darah pada ke 25 ekor tikus putih (Rattus norvegicus) jantan diabetik eksperimental yang diberikan ekstrak etanol, partisi n-heksana, dan fraksi kromatografi buah pare (Momordica charantia L.) menggunakan alat Gluko-Dr® test meter menunjukkan hasil seperti Tabel 1 dan Gambar 1.
Tabel 1 Hasil Pemeriksaan Kadar Glukosa Darah Tikus Putih (Rattus norvegicus) Jantan
Kadar glukosa darah (mg/dl) Perlakuan
|
-1 |
0 |
4 |
11 |
18 | |
|
P0 |
100.33 ± 5.85Aa |
105.67 ± 3.05 Aa |
102.33 ± 5.13 Aa |
100.00 ± 9.16 Aa |
94.67 ± 20.84 Aa |
|
P1 |
107.00 ± 6.24 Aa |
146.00 ± 6.92 Aa |
255.67 ± 37.90 Ca |
446.00 ± 70.93 Bb |
415.00 ± 6.08 Bb |
|
P2 |
92.33 ± 10.01 Aa |
138.00 ± 2.64 Aa |
118.33 ± 2.64 Aa |
124.33 ± 4.04 Aa |
118.00 ± 9.53 Aa |
|
P3 |
108.00 ± 8.18 Aa |
167.33 ± 43.10 Bb |
153.33 17.21 Bb |
113.67 ± 12.50 Aa |
100.67 ± 4.72 Aa |
|
P4 |
108.33 ± 9.71 Aa |
142.33 ± 31.62 Aa |
118.33 ± 10.78 Aa |
97.33 ±13.50 Aa |
96.67 ± 9.01 Aa |
Keterangan : Nilai dengan huruf yang sama kearah kolom (huruf besar) menujukkan tidak berbeda nyata (p<0,05), dan sebaliknya nilai ke arah baris (huruf kecil) menunjukkan berbeda nyata (p>0,05). P0 (Kontrol negatif (-) tanpa pemberian streptozotocin), P1 (Kontrol positif (+) dengan pemberian streptozotocin), P2 (Ekstrak etanol), P3 (Partisi n-heksana), P4 (Fraksi kromatografi).
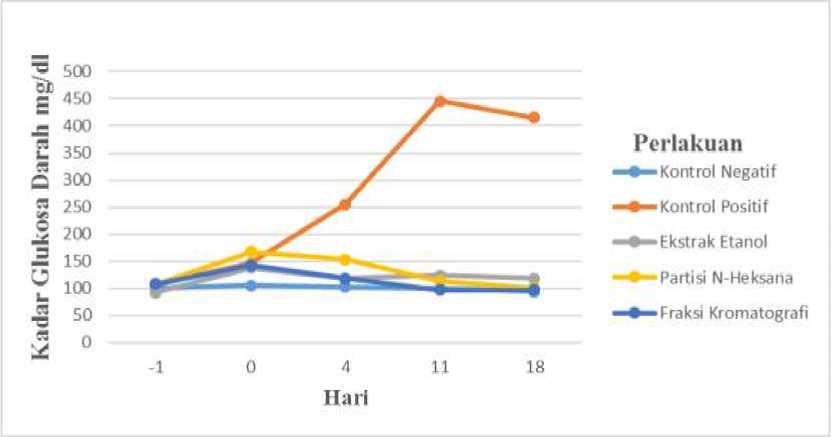
Gambar 1 Grafik Pengukuran Kadar Glukosa Darah
Kadar glukosa darah tikus pada hari pertama pada kelima kelompok perlakuan tampak tidak berbeda nyata (p<0,05). Pada hari ke 0 dapat dilihat kadar glukosa darah pada kelompok perlakuan P3 berbeda nyata dengan kelompok P0, P1, P2, dan P4. Pada hari ke 4, 11, dan 18 kadar glukosa darah pada kelompok perlakuan P1 tampak berbeda nyata dengan kelompok perlakuanP0, P2, P3, dan P4.
Pada Gambar 1 terlihat perlakuan yang menunjukkan kemampuan
menurunkan kadar glukosa darah pada tiga perlakuan dengan dosis ekstrak pare yang berbeda, yaitu P2, P3, dan P4. Perlakuan P4 memperlihatkan kemampuan menurunkan kadar glukosa darah yang lebih baik dibandingkan perlakuan P2 dan P3.
Pada hari pertama kadar glukosa darah pada kelima kelompok perlakuan tidak berbeda nyata. Hal ini disebabkan karena pada hari pertama semua tikus pada lima kelompok perlakuan belum mendapatkan injeksi streptozotocin dan kadar glukosa darah tikus pada kelima kelompok perlakuan masih normal. Menurut penelitian yang dilakukan oleh Saad et al, (2015) kadar gula darah tikus normal berkisar antara 70 – 110 mg/dL. Setelah dilakukan pengambilan darah maka kelompok P0, P1, P2, P3, dan P4 diberikaninjeksi STZ. Pada hari ke 0 kadar glukosa darah pada keempat kelompok perlakuan yang diinduksi streptozotocin mulai mengalami peningkatan,
peningkatan kadar glukosa dicapai setelah penyuntikan streptozotocin. Pada
kelompok perlakuan kontrol positif (P1) yang diberikan streptozotocin
memperlihatkan kadar glukosa darah lebih tinggi dibandingkan dengan perlakuan lainnya. Hal ini menunjukkan bahwa pemberian streptozotocin 40 mg/kg berat badan mampu meningkatkan kadar glukosa darah dan mencapai puncaknya pada hari ke 11 dengan kadar glukosa darah tertinggi pada penelitian ini adalah 446 mg/dl, kondisi ini disebut diabetik eksperimental.
Respons tikus putih terhadap streptozotocin untuk menjadikan tikus tersebut hiperglikemia berbeda-beda. Hal tersebut akibat perbedaan kepekaan dari masing-masing individu tikus, dan tingkat kondisi stres masing-masing hewan (Suartha et al, 2016). Pemberian streptozotocin dapat mengakibatkan kerusakan pada sel β pulau langerhans. Streptozotocin bekerja dengan cara membentuk radikal bebas sangat reaktif yang dapat menimbulkan kerusakan pada membran sel, protein dan deoxyribonucleic acid (DNA), sehingga menyebabkan gangguan produksi insulin oleh sel-sel β pulau langerhans (Erwin, 2013). Okamoto dan Yamamoto (1983), juga mengatakan bahwa streptozotocin terbukti mampu memproduksi radikal bebas pada tubuh yang secara spesifik merusak rantai DNA sel β pulau langerhan sehingga mengakibatkan gangguan fungsi dan kehancuran sel β pulau langerhans melalui nekrosis.
Pada hari ke empat kadar glukosa darah pada kelompok perlakuan P3 menunjukkan penurunan hingga hari ke 18 setelah pemberian ekstrak etanol. Kadar glukosa darah pada kelompok perlakuan P3 pada hari ke 18 adalah 100,67 mg/dl. Sedangkan pada kelompok perlakuan P2 kadar glukosa darah pada hari ke 11 menunjukkan peningkatan kadar glukosa darah 124,33 mg/dl. Hal ini mungkin disebabkan karena hewan coba stress pada saat dilakukan pengambilan darah sehingga menyebabkan peningkatan kadar glukosa darah. Pada hari ke 18 kadar glukosa darah pada kelompok perlakuan P2 mulai menunjukkan penurunan dengan kadar glukosa darah akhir pada hari ke 18 adalah 118 mg/dl. Jika dibandingkan kadar glukosa darah antara perlakuan P2 dan P3 yaitu antara kelompok perlakuan yang diberikan ekstrak etanol dan partisi n-heksana menunjukkan partisi n-heksana lebih efektif dalam menurunkan kadar glukosa darah.
Pada kelompok perlakuan P4 kadar glukosa darah hari ke empat menunjukkan penurunan kadar glukosa darah yang sangat signifikan dari 142,33 mg/dl menjadi 118,33 mg/dl. Hal ini menunjukkkan fraksi kromatografi lebih cepat menurunkan kadar glukosa darah dari pada ekstrak etanol dan partisi n-heksana. Lebih efektifnya fraksi kromatografi dalam menurunkan kadar glukosa darah dari pada ekstrak etanol dan partisi n-heksana mengindikasikan bahwa senyawa-senyawa pada fraksi kromatografi dalam menurunkan kadar glukosa darah diduga bersifat antagonis. Sehingga fraksi kromatografi yang paling efektif dalam menurunkan kadar glukosa darah (Kartini, 2015).
Pemberian ekstrak buah pare pada tikus putih hiperglikemia memiliki banyak mekanisme yang baik, yaitu 1) Mencegah penyerapan glukosa dalam saluran pencernaan, 2) Meningkatkan penyerapan glukosa oleh jaringan, 3) Meningkatkan metabolisme glukosa, dan 4) Meningkatkan kerja insulin dan menstimulasi sel β pankreas. Selain itu, ekstrak pare juga dapat menghambat enzim metabolisme karbohidrat seperti alpha-amilase, alpha-glucosidase, dan lipase pankreas sehingga membatasi penyerapan glukosa melalui dinding usus.
Penggunaan fraksi kromatografi buah pare mampu menurunkan kadar glukosa darah pada tikus pada hari ke empat lebih cepat daripada pemberian ekstrak etanol dan partisi n-heksana. Hal ini dapat disebabkan karena kandungan senyawa murni pada buah pare yang diberikan lebih tinggi dibandingkan ekstrak etanol dan partisi n-heksana. Senyawa yang berpotensi sebagai penurun glukosa darah pada tikus putih adalah senyawa golongan flavonoid dan polifenol yang terkandung pada buah pare (Yuda et al., 2013). Hal tersebut disebabkan kedua golongan senyawa tersebut merupakan senyawa antioksidan.
SIMPULAN DAN SARAN
Simpulan
Pemberian fraksi kromatografi lebih cepat menurunkan kadar glukosa darah dibandingkan dengan pemberian ekstrak etanol dan partisi n-heksana. Kandungan senyawa non polar yang dimiliki buah pare berpotensi untuk menurunkan kadar glukosa darah.
Saran
Perlu dilakukan penelitian lebih lanjut tentang efek pemberian ekstrak n-heksana, partisi n-heksana, dan fraksi kromatografi buah pare (Momordica charantia) pada tikus putih (Rattus norvegicus)
hiperglikemia dengan pengaruhnya terhadap gambaran histopatologi pada sel β pulau langerhans dalam kelenjar pankreas.
UCAPAN TERIMAKASIH
Pada kesempatan ini penulis mengucapkan terimakasih kepada Direktorat Penelitian dan Pengabdian Kepada Masyarakat, Direktorat Jendral Pendidikan dan Kebudayaan Republik Indonesia atas bantuan dana penelitian melalui Lembaga Penelitian dan Pengabdian Masyarakat Universitas Udayana (LPPM-UNUD), dengan kontrak No.: 104.18/UN.14.2/PNL.01.03.00.2014.
DAFTAR PUSTAKA
Alam MA. 2015. Benificial Role of Bitter Melon Supplementasion in Obesity and Related Complications in Metabolic Syndrome. Hindawi J Lipids 2015: 496169.
Alwan A. 2010. Raising The Priority Accorded To Diabetes In Global Health And Development. Int J Diabetes Melitus 2: 139-140.
Dewi YF, Anthara MS, Dharmayudha AAGO. 2014. Efektifitas Ekstrak Daun Sirih Merah (Piper crocatum) Terhadap Penurunan Kadar Glukosa Darah Tikus Putih Jantan (Rattus novergicus) Yang Di Induksi
Aloksan. Buletin Veteriner Udayana 6(1): 73-79.
Dharmayudha AAGO, Anthara MS. 2013. Identifikasi Golongan Senyawa Kimia Dan Pengaruh Ekstrak Etanol Buah Naga Daging Putih (Hylocereus undatus) Terhadap Penurunan Kadar Glukosa Darah Serta Bobot Badan Tikus Putih Jantan (Rattus novergicus) Yang Diinduksi Aloksan. Buletin Veteriner Udayana 5(1): 3140.
Elias D, Prigozin H, Polak N, Rapoport M, Lohse AW, Cohen IR. 1994. Autoimmune diabetes induced by the b-Cell toxin STZ. Diabetes 43: 9928.
Erwin. 2013. Ekspresi Insulin pada Pankreas Mencit (Mus Musculus) yang Diinduksi dengan Streptozotocin Berulang. Jurnal Kedokteran Hewan. 7(2): 97-100.
Kartini KS. 2015. Isolasi Dan Identifikasi Senyawa Aktif Ekstrak Etanol Buah Pare (Momordica charantia) Yang Dapat Menurunkan Kadar Glukosa Darah. Tesis Program Studi Kimia Terapan. Denpasar: Universitas
Udayana.
Okamoto H, Yamamoto H. 1983. DNA strand breaks and poly (ADP-ribose) synthetase activation in pancreatic islets--a new aspect to development of insulin-dependent diabetes an pancreatic B-cell tumors. Princess Takamatsu. Symp.13:297—308.
Rowland NE, LL Bellush. 1989. Diabetes melitus: Stress, Neurochemistry, and
Behavior. Neuroscience and
Biobehavioral Rev 13(4):99-206.
Saad MI, Kamel, Maher A, Hanafi, Mervat Y. 2015. Modulation of
Adipocytokines Production and Serum NEFA Level by Metformin, Glimepiride, and Sitagliptin in HFD/STZ Diabetic Rats. Hindawi Biochemistry Res Int 2015: 138134.
Suartha IN, Wiwik SR, Suantara MD. 2014. Penggunaan Partisi Buah Pare (Momordica charantia L) Untuk Menurunkan Kadar Gula Darah. Prosiding SEMNASTEK. 18-19 September 2014.
Suartha IN, Suantara MD, Wiwik SR. 2016. Ekstrak Etanol dan Fraksi Heksan Buah Pare (Momordica charantia) Sebagai Penurun Kadar Glukosa Darah Tikus Diabetes. J Veteriner 17(1): 30-36.
Subahar TS. 2004. Khasiat dan Manfaat Pare. Penerbit Agromedia Pustaka, Jakarta
Wilson GL, LeDoux SP. 1989. The Role of Chemical In The
Etiology of Diabetes Mellitus. J Toxicologic Pathol 17: 357-362.
Yuda IKA, Anthara MS, Dharmayudha AAGO. 2013. Identifikasi Golongan Senyawa Kimia Ekstrak Etanol Buah Pare (Momordica charantia) dan Pengaruhnya terhadap Penurunan Kadar Glukosa darah Tikus Putih Jantan (Rattus novergicus) yang diinduksi Aloksan. Buletin
Veteriner Udayana 5(2): 87-95.
208
Discussion and feedback