ISOLASI TOXOPLASMA GONDII PADA AYAM BURAS
on
Buletin Veteriner Udayana
ISSN : 2085-2495
Vol. 3 No.2. :63-69
Agustus 2011
ISOLASI TOXOPLASMA GONDII PADA AYAM BURAS
(ISOLATION OF TOXOPLASMA GONDII IN FREE-RANGE CHICKEN)
Apsari, I.A.P1.; Artama, W.T.2; Sumartono2; Damriyasa, I M.1
Oka, I.B.M1. dan Swacita, I.B.N1.
1.Fakultas Kedokteran Hewan Universitas Udayana.
Jl.P.B.Sudirman Denpasar Bali tlp.0361-701808, Email iapapsari@yahoo.co.id
2
2Fakultas Kedokteran Hewan Universitas Gadjah Mada.
Jl. Fauna 2 Karangmalang-Yogyakarta, 55281
ABSTRAK
Telah dilakukan penelitian terhadap Toxoplasma gondii yang diisolasi dari otak dan jantung ayam buras di Bali. Tujuan penelitian ini untuk mengetahui seroprevalensi Toxoplasma gondii pada ayam buras dan untuk mengisolasi Toxoplasma gondii dari jantung dan otak ayam buras. Untuk mencapai tujuan penelitian ini diamati 311 sampel serum ayam buras dengan metode ELISA dan diteliti 225 otak dan jantung ayam buras dengan metode digesti. Seluruh sampel ayam buras diambil dari 9 kabupaten di Bali. Hasil penelitian menunjukkan bahwa seroprevalensi Toxoplasma gondii pada ayam buras sebesar 91,64%. Isolasi Toxoplasma gondii dari jantung dan otak ayam buras berhasil ditemukan bentuk sista pada inokulat jantung dan otak, tetapi dengan uji bioassay pada mencit selama 4 minggu pengamatan tidak berhasil menemukan bentuk takizoit pada exudat peritonial.
Kata Kunci : Ayam buras, metode digesti, ELISA, Toxoplasma gondii, bioassay
ABSTRACT
A study was conducted Toxoplasma gondii isolate from the brain and the heart of free-range chickens in Bali. The aim of this study to determine the seroprevalence and to isolate Toxoplasma gondii from free-range chicken heart and brain. To achieve of this study observed 311 free-range chicken serum samples with ELISA method and examined 225 free-range chicken brain and heart used digestion method. All of the samples taken from 9 districts in Bali. The results showed that the seroprevalence of Toxoplasma gondiiin freerange chicken has 91.64%. Isolation of Toxoplasma godii from the heart and the brain freerange chicken found the cyst on inoculate heart and brain, but by bioassay in mice for 4 weeks observation failed to find tachyzoite form in peritonial exudat.
Keywords: Free-range chicken, digestion method, ELISA, Toxoplasma gondii, bioassay
PENDAHULUAN
Toxoplasma gondii adalah parasit protozoa yang bersel satu dan merupakan parasit intrasel. Sebagai parasit intrasel, Toxoplasma gondii dapat menginvasi berbagai sel inang, baik sel fagositik maupun nonfagositik. Parasit ini mempunyai kecenderungan berbiak di dalam sel macrofage (Cornain, 1991). Toxoplasma gondii masuk ke dalam sel inang dengan cara invasi aktif, yaitu mengeluarkan protein dari 3 organela sekresi yaitu mikronema, roptri dan granula padat (Ajioka et al.,2001).
Toxoplasma gondii dapat menginvasi dan memperbanyak diri di dalam sel dari semua hewan berdarah panas termasuk unggas Levine, 1995; Dubey et al.,2005; Dubey et al.,2006). Selama perjalanan siklus hidup Toxoplasma gondii ada stadium yang berkembang dengan cepat disebut takizoit yang terdapat pada cairan sekresi dan ekskresi, sedangkan stadium yang berkembang secara lambat menetap pada jaringan membentuk sista, serta stadium resisten disebut oosista (Chandra, 2001).
Beberapa peneliti telah berhasil melakukan isolasi pada ayam dan itik di Mesir, Brazil dan India (Dubey et al., 2003 dan Sreekumar et al., 2003) dan El-Massry et al (2003) meneliti prevalensi antibodi Toxoplasma pada kalkun, ayam dan itik. Beberapa peneliti di Indonesia yang pernah meneliti Toxoplasma pada
ayam yaitu Hermawan (1988) mengenai sero prevalensi ayam kampung di Lamongan terdeteksi dengan uji hemaglutinasi 23%. Priyana (2000) di Jakarta menemukan 52,5% ayam kampung seropositif dengan metode IHA (Inhibitor Haemagglutination). Mufasirin dkk. (2003) menemukan pada telur ayam buras di Surabaya terdeteksi antigen Toxoplasma 100% dengan uji ELISA Dot Blot. Suwanti (2005) di Surabaya dapat mendeteksi sista Toxoplasma pada otak dan jaringan organ ayam dengan uji bioassay sebesar 30%. Dari sedikit penelitian Toxoplasma pada ayam di Indonesia seperti disebut diatas, bahkan dengan hasil yang beragam maka penelitian Toxoplasma pada ayam buras di Bali ingin diteliti. Tujuan utama penelitian ini ingin mendapatkan isolat Toxoplasma dari ayam buras di Bali, karena penelitian selama ini yang dilakukan hanya sebatas deteksi antibodi serum saja.
Jadi masalah yang diteliti dalam penelitian ini adalah : Berapa persen prevalensi infeksi Toxoplasma gondii pada ayam buras di Bali, apakah metode digesti pepsin HCl berhasil mengisolasi Toxoplasma dari organ ayam buras serta bagaimana patogenitas isolat Toxoplasma dari ayam buras pada mencit (uji bioassay pada mencit).
Tujuan Penelitian : untuk mengetahui seroprevalensi Toxoplasma gondii pada
ayam buras di Bali, untuk dapat mengisolasi Toxoplasma gondii dari organ ayam buras dengan metode digesti serta untuk mengetahui patogenitas Toxoplasma gondii dari ayam buras pada mencit (hasil uji bioassay).
MATERI DAN METODE
Bahan yang digunakan : sampel ayam buras sejumlah 225 ekor berasal dari 9 kabupaten di Bali. Bahan-bahan pemeriksaan ELISA : coating buffer, blocking buffer, washing buffer, substrat buffer, conjugate anti-chicken IgY (IgG) whole molecule alkaline phosphatase (Sigma), ESA (Excretory secretory antigen) Toxoplasma gondii dan substrat. Bahan-bahan digesti pepsin HCl : pepsin, HCl, saline, PBS, Potasium G penisilin dan streptomisin. Mencit sebanyak 90 ekor.
Alat-alat yang diperlukan : Tabung serum, obyek glas, cover glas, spuit (1 ml, 3 ml, 5 ml dan 10 ml), mikroplate ELISA, mikropipet, tip (kuning dan biru), mikroskup, sentrifuge, waterbath, conical (10 ml, 25 ml dan 50 ml), ELISA reader (BioRad), blender, effendorf, becker glas (250 ml, 1000 ml), pemisah supernatan dan petridish.
Metode Penelitian : Ayam buras dikumpulkan yang berasal dari 9 kabupaten di Bali, diambil darahnya dan serumnya dipisahkan untuk selanjutnya diperiksa dengan metode ELISA,
menggunakan antigen ESA. Ayam dibunuh untuk diambil jantung dan otaknya untuk isolasi parasit dengan metode digesti pepsin HCl (Dubey, 1998). Dilakukan pooling tiap 15 jantung dan otak ayam masing-masing untuk dilakukan digesti dengan pepsin HCl. Masing-masing inokulat jantung dan otak ayam buras diperiksa terhadap adanya bentuk sista, selanjutnya diinokulasi ke mencit (uji bioassay). Setiap inokulat diinokulasi pada 2 ekor mencit.
Pengamatan pada mencit dilakukan selama 4 minggu. Setelah 4 minggu pengamatan, mencit dieuthanasia dengan menghirup ether. Exudat peritonial diambil dan diperiksa dibawah mikroskup terhadap adanya takizoit pada cairan peritonial.
HASIL DAN PEMBAHASAN
Seroprevalensi Toxoplasma gondii pada ayam buras dengan metode ELISA ditemukan sebesar 91,64%. Hasil ini ternyata jauh lebih tinggi dari hasil Hermawan di Lamongan (Hermawan, 1988), Priyana di Jakarta (Priyana, 2000) dan Suwanti di Surabaya (Suwanti, 2005). Berbedanya hasil yang diperoleh kemungkinan karena metode pemeriksaan yang digunakan dan kemungkinan juga akibat kondisi wilayah yang berbeda. Perbedaan ini terkait dengan keberadaan kucing di wilayah tersebut serta kebiasaan makan dari ayam buras yang
biasa mencari makan dengan mengais makanan di tanah (Tenter et al., 2000).
Isolasi Toxoplasma gondii dari daging pertama dikenalkan oleh Dubey (1997) merupakan metode yang akurat untuk memperoleh inokulat sebagai bahan uji bioassay pada mencit. Inokulat yang
diperoleh mengandung bentuk sista T.gondii. Jumlah inokulat otak dari seluruh sampel yaitu 18, ditemukan 9 positif (50%) mengandung sista, sedangkan 18 jumlah inokulat jantung ditemukan 9 positif (50%) mengandung sista T. gondii (Tabel 1).
Tabel 1. Hasil Digesti Pepsin HCl Organ Otak dan jantung Ayam Buras
|
Aul -jj∣url |
^1Pπ |
IfDklLlxl |
Hiul |
|
⅛puτ |
Diik 2 |
DOL SDIT UT SJ n |
Nrphi |
|
Jj∣dlEL' 2 |
ħτwhl NeejIi! | ||
|
I Jilt I DlikZ JuiUltJ JunatZ |
DOI DDE DTI DTE |
>⅛⅛f FcujbJ1 Mttif Fφw∣∣Γ | |
|
fetlhCW |
OfA L ∣Jιιk.' UimE 1 Juu∣± |
DDL WE UT EM E |
Jfrilllf NEpni NfpM Ntpnr |
|
IWipLrrr |
M I Mz lInciE-E I |
DOI DDIl Ul Sl n |
Ffrw ∏ I FfrWiiE ħι∣∣ιf hnlif |
|
RntrKif |
Ml ’ DO Γ lha2 kwn |
S^pu' Nrrdif ⅛ιlιΓ | |
|
JunafiZ |
PJ E |
Ntpni | |
|
T.l' JlLXJ |
ClA I DtJJ LHAj DDIL |
NttmT Jtndif NeCUiZ NepnT | |
|
Jjmuc J |
PJ Il | ||
|
Eizal: |
CiA I DOL L∏A2 Q03 IiFJirf-I TJlI IiidH=L-Z Dlli |
Jv-Ilif Ffriiil Wtlf Nrrihi | |
|
K I-LRjlIfrin f |
IHA I DlAZ |
SDIL UI SI E |
h⅛if Jtoihf N*pM Jtoihf |
|
lππ⅞fi I IjiJiea-Z | |||
|
GlJITTTir |
IHAI DOI ChAZ DD ∏ Jiuizif I D1I JirnQfI PJII |
Nepnr Nrrjhf Jfriihf Nepni | |
Keterangan : Otak 1 adalah pooling otak berasal dari sampel ayam buras nomor 1- 15 (DO I) Otak 2 adalah pooling otak berasal dari sampel ayam buras nomor 15-30 (DO II) Jantung 1 adalah pooling jantung berasal dari sampel nomor 1 – 15 (DJ I) Jantung 2 adalah pooling jantung berasal dari sampel nomor 16 – 30 (DJ II) Negatif artinya tidak ditemukan bentuk sista pada cairan inokulat Positif artinya ditemukan bentuk sista pada cairan inokulat.
Hasil ini menunjukkan bahwa metode digesti efektif untuk mengisolasi Toxoplasma gondii dari organ jantung dan otak ayam buras dengan ditemukan bentuk sista pada inokulat.
Uji bioassay pada mencit, selama 4 minggu pengamatan ternyata pada penelitian ini belum berhasil menemukan bentuk takizoit bebas pada exudat peritonial mencit. Pada exudat peritonial terlihat banyak macrofage yang terkandung bentukan takizoit intrasel.
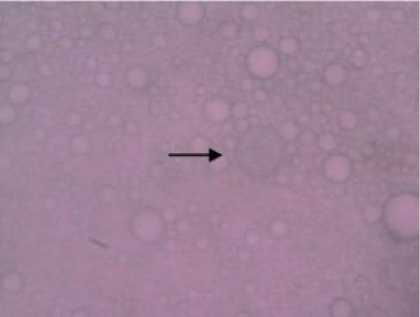
Gambar 1. Bentuk sista pada inokulat otak ayam buras (Pembesaran 400x)
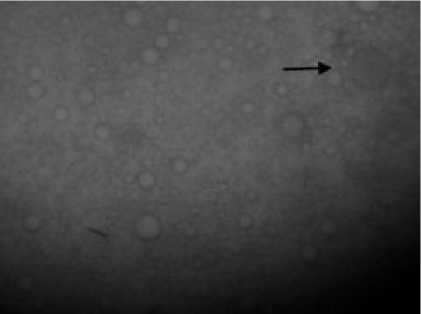
Gambar 2 : Bentuk sista pada inokulat jantung (Pembesaran 400x )
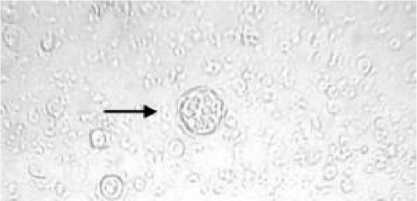
Gambar 3. Takizoit intrasel (dalam macrofage) pada exudat peritonial. (Pembesaran 400 x)
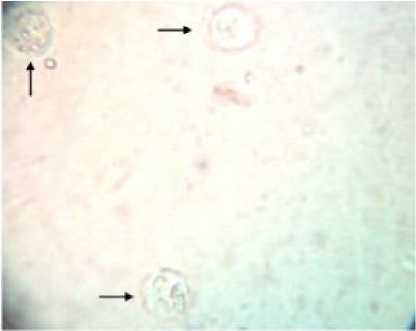
Gambar 4. Beberapa macrofage pada exudat peritonial mencit (Pembesaran 400 x)
SIMPULAN DAN SARAN
Simpulan
Dengan metode ELISA
seroprevalensi Toxoplasma gondii pada ayam buras di Bali 91,64%. Metode digesti pepsin HCl untuk mengisolasi organ ayam buras 50 %
berhasil menemukan bentuk sista dari inokulat otak dan jantung ayam buras. Uji bioassay pada mencit tidak berhasil menemukan takizoit ekternal (takizoit bebas) pada exudat peritonial mencit.
Saran
Disarankan melakukan uji bioassay pada mencit untuk waktu pengamatan yang lebih lama (8 minggu) dan pemeriksaan histologi dari organ mencit.
UCAPAN TERIMAKASIH
Terimakasih kepada DP2M Dikti atas dana penelitian dan kepada semua pihak yang ikut membantu pelaksanaan penelitian ini.
DAFTAR PUSTAKA
Ajioka James W., Jenifer M.Fitzpatrick and Christopher P. Reitter 2001. Toxoplasmosis Gondii genomic: shedding ligth on Pathogenesis and Chemotherapy. Expert Review In Moleculer medicine. Januari 2003.
Bio-Rad. 2000. Benchmark Microplate ELISA Reader, User Manual. BioRad Laboratories.
Chandra, G 2001. Toxoplasma gondii : Aspek Biologi, Epidemiologi, Diagnosis dan Penatalaksanaannya. Medika XXVII (5): 297-304.
Cornain, S.; Suryana, E.J.; Sugiharto; Jacoeb, T.Z.; Rahman, I.A.; Lubis, N.S. dan Gusmiarti, N. 1991. Aspek immunolog dan pendekatan immunoterapi pada infeksi toksoplasma. Majalah Kedokteran Indonesia. 41(7): 395-401.
________1997. Distribution of tissue cyst in organ of rats fed Toxoplasma gondii oocysts. J. Parasitol. 83(4) : 755-757.
________1998. Refinement of
Pepsin digestion method for isolation of Toxoplasm gondiifrom infected tissue. Vet.Parasitol 74: 7577.
Dubey, JP; Graham DH; Dahl, E; Hilali, M; El-Ghaysh, A; Sreekumar, C; Kwok, OCH; Shen, SK; and Lehman, T 2003 a Isolation and Moleculer Characterization of Toxoplasma gondiifrom Chickens and Ducks from Egypt. Vet. Parasitol 114: 89-95
Dubey, JP; Paula, L and lehmann, T 2005. Characterization of Toxoplasma gondii Isolates in free-ranging chickens from argentina. J.Parasitol 91(6):1335-1339.
Dubey, JP; Su, C; Oliviera, J; Morales, JA; Bolanos, RV; Sundar, N; Kwok, OCH and Shen, SK 2006. Biologic andCharacterization of Toxoplasma gondii isolates in free-ranging chickens from Costa Rica, Central America. Vet Parasitol 139:
El-Massry, A; Mahdy, OA; El-Gaysh, A and Dubey, JP 2003. Prevalence of Toxoplasma gondii Antibodies n Sera of Turkey, Chicken and Duck from Egypt. J.Parasitol 86(3) : 627628.
Hermawan, P 1988. Surey Serologis terhadap Toksoplamosis pada Ayam Buras di Kabupaten Lamongan dengan
Uji Haemaglutinasi tak
Langsung. Skripsi. FKH-UNAIR. Surabaya.
Levine, ND 1995. Protozoologi Veteriner. Indonesia Edisi. Gadjah Mada University Press.
Mufasirin; Suprihati, E dan Suwanti, L.T. 2003. Studi Toksoplasmosis pada Telur Ayam yang dijual sebagai campuran jamu di kota Surabaya dan Kabupaten Sidoarjo menggunakan uji Dot Blot. Jurnal Penelitian Medika Eksakta. 4(2): 113-119.
Priyana, A.2000. Antibodi Anti Toxoplasma pada Ayam Kampung (Gallus domestius) di Jakarta. Majalah Kedokteran Indonesia. 50(11): 504-507.
Suwanti, LS.T. 2005. Deteksi Kista Jaringan Toxoplasma gondii pada beberapa organ Ayam. Airlangga University Library.
Tenter, AM; Heckeroth, AR; Weiss, LM 2000. Toxoplasma godii : From Animals to humans. International Journal of
Parasitology 30 : 1217-1258.
69
Discussion and feedback