BIO-MOLECULAR STUDY OF JEMBRANA VIRUS: AS BASIC DEVELOPMENT OF TISSUE CULTURE VACCINE
on
Buletin Veteriner Udayana
pISSN: 2085-2495; eISSN: 2477-2712
Volume 8 No. 2: 187-202
Agustus 2016
Studi Bio-Molekuler Virus Penyakit Jembrana: Sebagai Dasar Pengembangan Tissue Culture Vaksin
(BIO-MOLECULAR STUDY OF JEMBRANA VIRUS:
AS BASIC DEVELOPMENT OF TISSUE CULTURE VACCINE)
I Wayan Masa Tenaya
Balai Besar Veteriner Denpasar
Jln. Raya Sesetan No.266, Sesetan, Denpasar-Bali, Email: masatenaya62@yahoo.co.id
ABSTRAK
Patogenesis dan bio-molekuler virus penyakit Jembrana (JDV) hanya menyerang B-cells sebagai target selnya, sehingga antibodi (kekebalan humoral) tidak terbentuk sampai 2-3 bulan pasca infeksi. Peningkatan populasi CD8+ T-cells secara signifikan dan menurunnya CD4+ T-cells secara drastis selama phase akut berakibat turunnya rasio CD8:CD4 yang menyebabkan meningkatnya kepekaan hewan terhadap infeksi sekunder. Sembilan ekor sapi bali yang digunakan dalam penelitian ini dikelompokkan berdasarkan status infeksi terkait pengambilan sampel. Tujuh ekor diinfeksi dengan JDV isolate Tabanan/87 dan 2 ekor lainnya diinfeksi dengan BIV isolate R29, sebagai kontrol negatif (Non-JDV infected cattle). Sampel diuji terhadap identitas selular dan target sel, kekebalan selular dan ekpresi sitokin. Sampel diuji dengan uji Flow cytometry dan dianalisis dengan uji varian. Hasil penelitian menunjukkan bahwa perubahan sub-populasi sel-sel T terkait penyembuhan infeksi JDV memperkuat peranan kekebalan seluler dalam proses kesembuhan penyakit Jembrana. Bukti-bukti atas meningkatnya ekpresi gen-gen sitokin yang diproduksi oleh sel-sel T CD8 terutama, IFN-γ dan IL-2, mengindikasikan pentingnya gen-gen ini dalam proses infeksi dan kesembuhan.
Kata kunci: virus penyakit jembrana, sapi bali, sitokin dan in vitro
ABSTRACT
Phatogenesis and bio-molecular of jembrana disease virus (JDV) only attack B-cell as a target, causing no produced antibody until 2-3 months post infection. Significantly increasing the number of CD8+ T-cells and significantly decreasing of CD4+ T-cells during acute phase affecting in decreased of CD8+:CD4+ ratio, that resulting in increasing sensitifity of animal to secunder infection. Nine bali cattle used in this study grouped based on infection status related to sample collected. Seven bali cattle infected by JDV isolate Tabanan/87 and two other cattle infected by BIV isolate R29, as a negative control (Non-JDV infected cattle). Samples tested of cellular identity and targeted cell, cellular immunity and cytokine expressions. Samples tested by flow cytometry and analyzed by variance. The result showed that the change of T-cell sub-population related to recovery of JVD infection strengthen the role of cellular immunity in a process of healing Jembrana disease. Evidences of enhancement of cytokine gene expressions produced by CDB T-cell mainly by IFN-γ and IL-2, indicated the importance of those genes in an infection process and recovery.
Keywords: Jembrana disease virus, bali cattle, cytokine and in vitro
PENDAHULUAN
Sapi bali, merupakan plasma nutfah Indonesia yang penting dalam industri daging (Martojo, 2003; Wiryosuhanto, 1996). Ternak ini pupulasinya sangat
tinggi (sekitar 2,6 juta dari sekitar 5,3 juta total populasi sapi) dan tersebar di beberapa daerah terutama Bali, Sumatra, Kalimantan, Sulawesi and Maluku (Talib et al., 2002). Disamping keunggulan yang dimiliki, sapi bali sangat peka
terhadap penyakit Jembrana dan ini menjadi kendala utama dalam industri daging di Indonesia. Kerugian akibat penyakit jembrana dapat berupa kerugian ekonomi (kematian, nilai jual turun, pengobatan, nilai kerja hewan menurun) dan terhambatnya penyebaran sapi bali dari daerah endemis ke daerah bebas yang memerlukan pemeliharaan sapi bali.
Penyebab utama penyakit ini sudah diidentifikasi sebagai bovine lentivirus, disebut Jembrana disease virus (JDV) (Chadwick et al., 1995a) dan penemuan ini memungkinkan sejumlah penemuan lanjutan yang sangat berguna untuk meningkatkan pemahaman reaksi sapi bali terhadap infeksi JDV. Dalam penelitian terdahulu banyak aspek pathogenesis penyakit Jembrana belum diteliti, khususnya target sel dan respon immunopathologi. Karena gambaran histologi tentang reaksi proliferasi hebat di daerah “non-follicular (T-cell) pada jaringan limpoid dan gambaran haematologi tentang lymphopenia, yang menjadi ciri khas penyakit jembrana (Soesanto et al., 1990), maka ada asumsi bahwa JDV mungkin menyerang T-cells (Dharma et al., 1991; Dharma et al., 1994), walapun teman dekat JDV, BIV adalah menyerang multi sel (Heaton et al., 1998).
Di dalam paper ini akan dipaparkan hasil penelitian tentang (1) identitas selular terhadap infeksi JDV dan target sel JDV, yang sangat penting terkait upaya pembuatan vaksin kutur jaringan (tissue culture vaccine), (2) hasil studi tentang kekebalan selular untuk mengungkap status kesembuhan majoritas (80%) hewan terinfeksi pada saat phase kritis (akut) dimana belum terbentuknya antibodi dan (3) hasil studi tentang peranan gene “Cytokine” untuk mengungkap keterlibatan gen dalam kesembuhan penyakit Jembrana, yang secara keseluruhan bertujuan mempelajari aspek ilmiah terkait pembuatan vaksin kutur jaringan.
MATERI DAN METODA
Penelitian Identitas Selular Dan Target Sel.
Sembilan ekor sapi bali yang digunakan dalam penelitian ini dikelompokkan berdasarkan status infeksi terkait pengambilan sampel (Tabel 1). Tujuh ekor diinfeksi dengan JDV isolate Tabanan/87 dan 2 ekor lainnya diinfeksi dengan BIV isolate R29, sebagai kontrol negatif (Non-JDV infected cattle). Jenis dan jumlah sampel yang diteliti mewakili semua sistem organ yang diambil dari hewan pada saat infeksi akut dan dalam keadaan normal (Tabel 2). Reagensia biologis yang digunakan meliputi “primary polyclonal” atau “monoclonal antibodies” dan “secondary monoclonal antibodies” yang didapat dari beberapa sumber (Tabel 3). Uji yang digunakan meliputi Immunohistokimia (IHK), Double Immunostaining (DS), Insitu hybridisasi (ISH).
Table 1. Hewan dan phase infeksi ketika pengambilan sample dilakukan
Kode Isolat Virus Waktu pengambilan sampel hewan
|
CB10, |
JDVTab/87 |
Phase demam (Deman hari |
|
CB212 |
ke 2) | |
|
CB203, |
JDVTab/87 |
Phase pasca demam (5-6 |
|
CB205, CB206, CB208, CB.210 |
hari pasca infeksi) | |
|
CB198, |
BIV-R29 |
42 hari pasca infeksi |
|
CB199 |
(kontrol negatif) | |
|
Table |
2. Jenis |
dan jumlah sample |
|
jaringan yang diambil | ||
|
Sistim organ |
Jenis jaringan |
|
Syaraf pusat |
Otak besar |
|
Pernapasan |
Paru-paru |
|
Pencernaan |
Pancreas, hati, rumen, reticulum, omasum, abomasum, duodenum. jejunum, ilium dan colon |
|
Lymphoretikuler |
Spleen, lymph nodes (prescapular, retropharyngeal, , mediastinal, mesenteric), tonsil, thymus |
|
Haematopoietic |
Jantung and sumsum tulang |
|
Reproduksi |
Ovaries, uterus dan kelenjar mammary |
|
Urinaria |
Kantong kencing, ginjal dan anak ginjal |
Penelitian Kekebalan Selular
Lima sapi bali digunakan dalam penelitian ini juga diinfeksi dengan JDV isolat Tab/87 seperti di atas (point 1). Sampel darah diambil setiap hari selama 21 hari pasca infeksi dan hari ke 21 hewan dibunuh. Tabung steril mengandung EDTA (Greiner Bio-One) digunakan untuk mengambil sample darah untuk pemurnian sel darah putih
(limposit) menggunakan Ficoll-Paque plus (Amersham Biosciences). Sampel limposit ini juga disiapkan untuk studi ekpresi “cytokine” yang dijelaskan pada point 3. Reaksi pewarnaan dilakukan dengan pewarnaan tidak langsung memakai antibodi dan penanda selular (Tabel 4). Sampel diuji dengan uji Flow cytometry dan dianalisa dengan uji statistik ANOVA.
Table 3. Daftar reagen biologis yang digunakan.
|
Antibodi |
Antigen specificity |
IgG isotype |
Reactivity in cells |
Konsentrasi antibodi |
|
MAb BD2 |
JDV capsid (CA) |
IgG1 kappa |
Cytoplasmic |
N/A |
|
Anti-human CD3 |
T-cell |
N/A |
Surface nor |
0.6 mg/ml |
|
(F7.2.38) |
cytoplasmic | |||
|
CD79αcγ (HM57) |
B-cell |
IgG1 kappa |
Cytoplasmic |
0.25 mg/ml |
|
MAC387 |
Macrophage |
IgG1 kappa |
Cytoplasmic |
0. 375 mg/ml |
|
Rabbit anti-bovine IgG |
Whole molecule bovine IgG |
2.4 mg/ml |
|
Table 4. |
“Primary and |
secondary | |
|
antibodies” |
yang |
digunakan |
untuk uji |
|
“flow cytometry” | |||
|
Antibody |
Source |
Isotype / clone |
Cat./Lot No |
|
Primary antibody Mouse anti- |
Serotec |
IgG2a/CC8 |
MCA1653G |
|
bovine CD4 Mouse anti-bovine CD8 |
Serotec |
IgG2a/CC63 |
MCA1653G |
|
Mouse anti- |
Santa |
IgG2b/CC51 |
SC-101835 |
|
bovine CD21 |
Cruz | ||
|
Secondary antibody Goat anti- |
Invitro- |
Alexa Fluor |
A-11029 |
|
mouse |
gen |
488 | |
Penelitian Ekpresi Sitokin
Jumlah, jenis hewan dan sample limposit yang digunakan dalam penelitian ini sama dengan untuk penelitian flow cytometry. Total RNA dari limposit diisolasi dengan kit isolasi RNA. Jenis dan jumlah gene yang diteliti disesuaikan dengan dugaan keterlibatan gene tersebut dalam infeksi JDV (Tabel 5). Pemilihan primer untuk sitokin genes IL-1, IL-2, Il-6, TNF-α and FN-γ, and glyceraldehyde 3-phosphate dehydrogenase (GAPDH) sebagai kontrol internal didapat dari publikasi sebelumnya (Konnai et al., 2003; Leutenegger et al., 2000).
Tabel 5. Sekuwen primers dan spesifikasinya untuk real-time RT-PCR.
|
Gene |
Primer sequences (5’-3’) (forward & reverse) |
Length | |
|
Prime r (bp)a |
Product (bp) | ||
|
IL-1α b |
GATGCCTGAGACACCCAA GAAAGTCAGTGATCGAGGG TTTT TAC GTC CCC AAG |
18 19 |
173 |
|
IL-2b |
GTT AA |
20 |
217 |
|
CGT TTA CTG TTG CATCATCA |
20 | ||
|
IL-6 b |
TCCAGAACGAGTATGAGG CATCCGAATAGCTCTCAG TCTTCTAAGCCTCAAGTAA |
18 18 |
236 |
|
TNF-αc |
CAAGT CCATGAGGGCATTGGCATA C TGGATATCATCAAGCAAGA |
N/A |
103 |
|
INF-γ c |
CATGTT ACGTCATTCATCATCACTTT CATGAGTTC GGCGTGAACCACGAGAAGT |
N/A |
151 |
|
GAPDH c |
ATAA CCCTCCACGATGCCAAAGT GGGAGACCCCGTCAGATG |
N/A |
120 |
|
JDV pold |
TGGA TGGGAAGCATGGACAATC AG |
N/A |
121 |
Keterangan : a bp: base pairs b Konnai et al. (2003). c Leutenegger et al. (2000). d Stewart et al. (2005).
Semua sekwen primer (Table 5) dikonfirmasi dengan evaluasi BLASTIN
program (Zhang and Madden, 1997). Sedangkan primers untuk RNA JDV didapat dari publikasi tentang RT-PCR untuk penyakit Jembrana (Stewart et al., 2005). Sampel kemudian diuji dengan “Real Time PCR” sesuai prosedur dan protocol yang di dapat dari publikasi diatas.
HASIL DAN PEMBAHASAN
Penelitian Identitas Selular Dan Target Sel.
Dari pengujian terhadap sel-sel B, sel-sel T, sel-sel dentritik dan sel-sel macrophage, menggunakan penanda sel yang spesifik diketahui bahwa dengan menggunakan antibodi monoclonal anti JDV, sel sel yang positif JDV (gambar 1) pada jaringan limpa sangat mirip dengan sel sel B dewasa ( sel sel plasma) yang diidentifikasi dengan penanda sel plasma (gambar 2). Jadi identitas sel sel yang mengandung/positif JDV hanya mirip terhadap sel sel B dewasa (sel plasma) dan sama sekali tidak menyerupai sel lainnya.
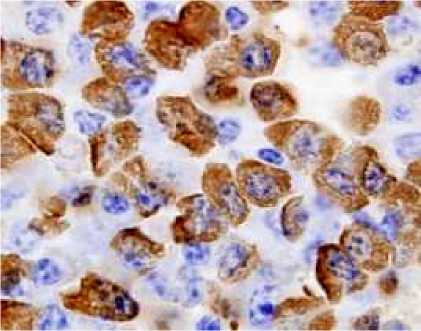
Gambar 1. Sel positif JDV
Dengan pengujian “double staining” ternyata sel sel plasma (gambar 3) dan sel sel positif JDV (gambar 4) menjadi positif ganda (gambar 5) yang mengindikasikan bahwa JDV menginfeksi. Reaksi ini tidak terjadi pada sel sel T (gambar 6) dan sel sel macrophage (gambar 7). Positif ganda ditandai dengan warna kuning yang
merupakan kombinasi gabungan antara warna merah (positif JDV) dengan warna hijau (positif sel B, T atau nacrophage).
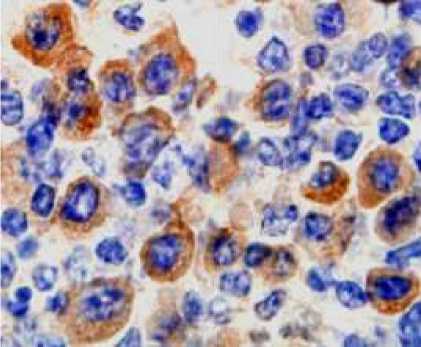
Gambar 2. Sel B dewasa (sel plasma)
Keberadaan JDV-RNA dengan uji ISH juga terdeteksi pada sel yang mirip sel sel plasma yang mendukung kuat bahwa JDV menginfeksi sel plasma (gambar 7).
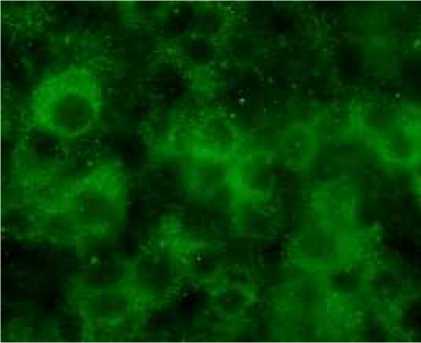
Gambar 3. Sel-sel plasma
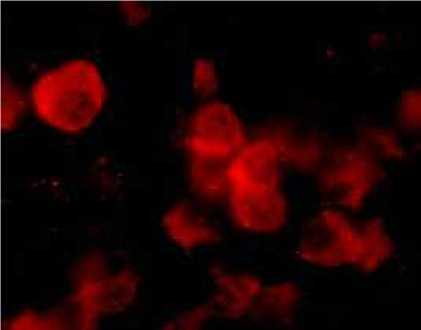
Gambar 4. Sel-sel positif JDV
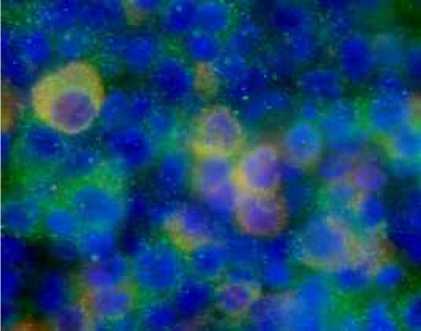
Gambar 5. Merger 3 dan 4 (positif ganda)

Gambar 6. Sel-sel T (Tidak terinfeksi JDV)
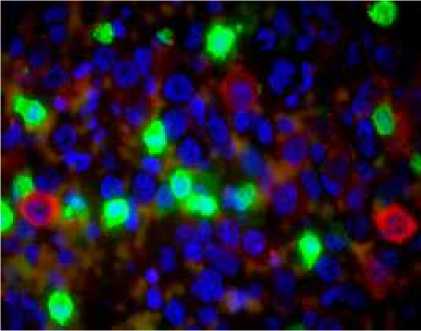
Gambar 7. sel macrophage (Tidak terinfeksi JDV)
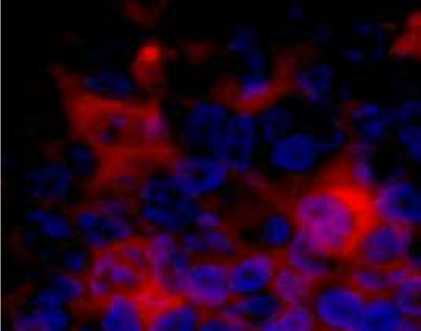
Gambar 8. Sel positif JDV-RNA (Sel-sel mirip sel B terinfeksi JDV)
Penelitian Kekebalan Selular
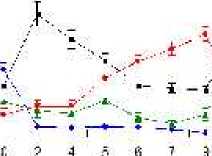
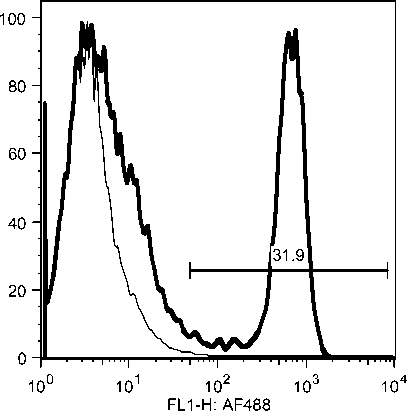
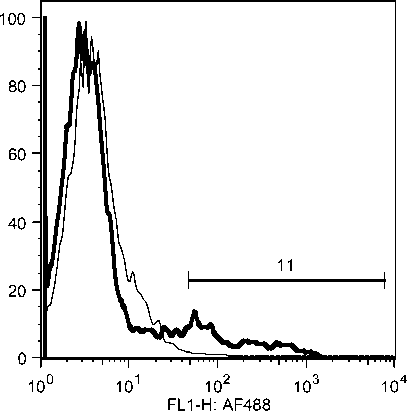
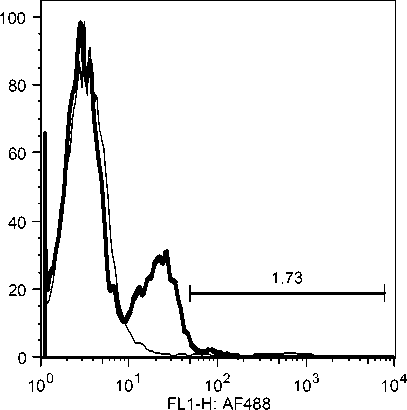
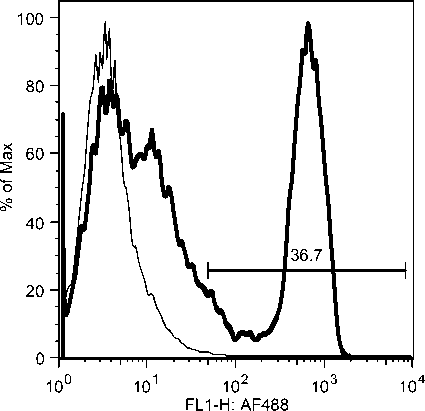
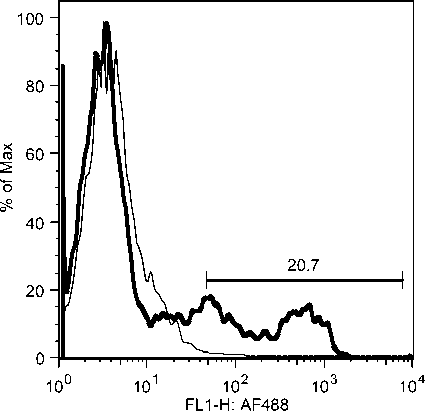
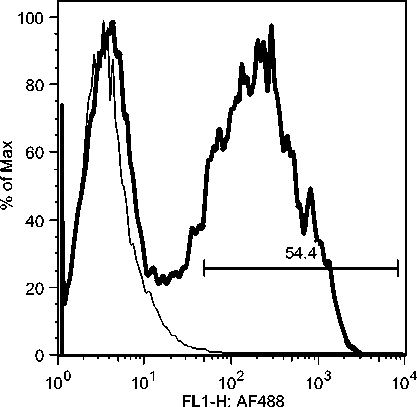
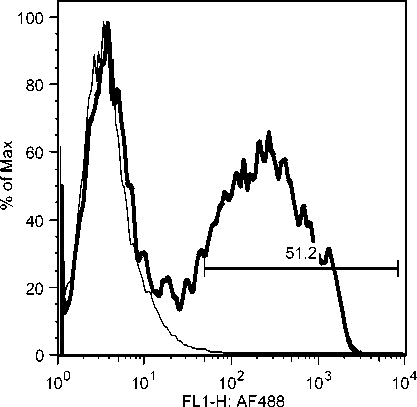
Selama phase akut semua komponen limposit menurun, namun menjelang kesembuhan sel T CD4, tetap menurun drastis sedangkan sel B dan sel T CD8 meningkat tajam. Fluktuasi populasi limposit terjadi secara significant selama infeksi JDV (Gambar 9). Uji flow cytometry menunjukkan bahwa terjadi fluktuasi populasi limposit selama infeksi JDV (Gambar 10a,b,c).
5 i’ 40« E
3 30« g ZCC ⅛ ICOO
42.03 _
-41.03 j
V 40.03 g’ j - 36.03 ^
I ♦ 3&O3 “
IG
□■y. pnr* i τ<yo∙
-^Vtt∣ CDl -*-Mea i C33-^ ∙.1tfc∣ι CC21 →-1/*rι 7tτιμ.
Gambar 10. Fluktuasi limposit selama infeksi JDV. Selama demam (akut) semua komponen limposit menurun tajam terutama sel T CD4 dan sel T CD8. Tetapi pada awal kesembuhan hanya sel T C4 yang tetap dibawah normal secara significant (p<0.05) sedangkan sel lainnya meningkat tajam secara significant (p<0.05).
% of Max % of Max % of Max
C5: Day 0 Pre-infection
C5: Day 10 Acute Phase
C5: Day 19 Early Recovery Phase
C7: Day 0 Pre-infection
C7: Day 10 Acute Phase
C7: Day 19 Early Recovery Phase
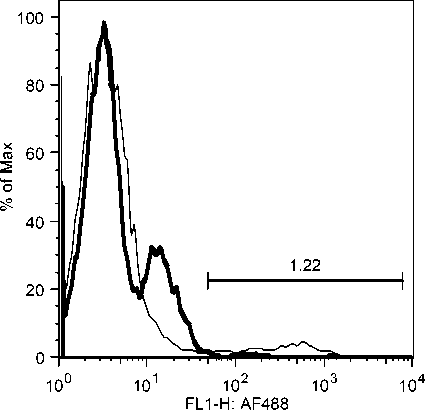
Gambar 10a. Penurunan sel sel T CD4 secara significant selama infeksi JDV.
C5: Day 0 Pre-infection
C7: Day 0 Pre-infection
C5: Day 10 Acute Phase
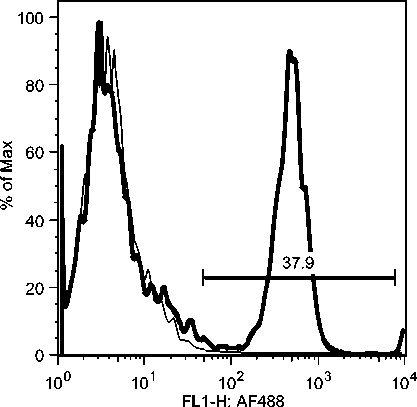
C7: Day 10 Acute Phase
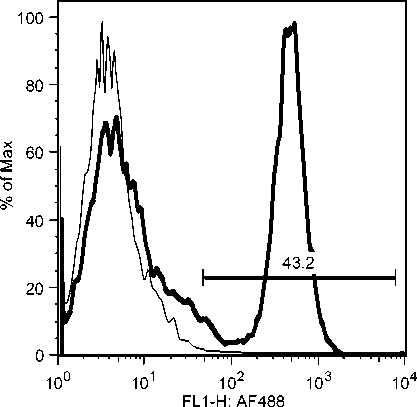
C5: Day 19 Early Recovery Phase
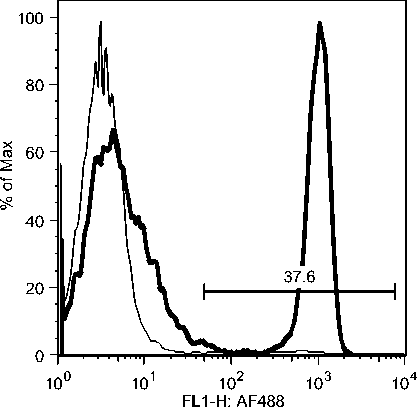
C7: Day 19 Early Recovery Phase
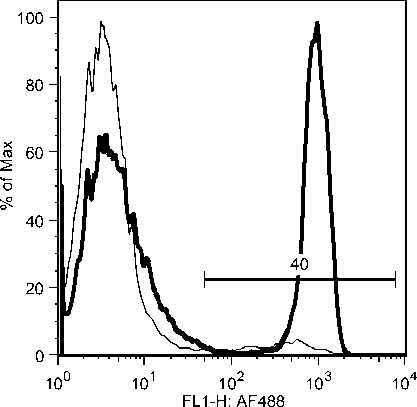
Gambar 10b. Peningkatan sel-sel T CD8 secara significant selama infeksi JDV.
% of Max % of Max % of Max
C5: Day 0 Pre-infection
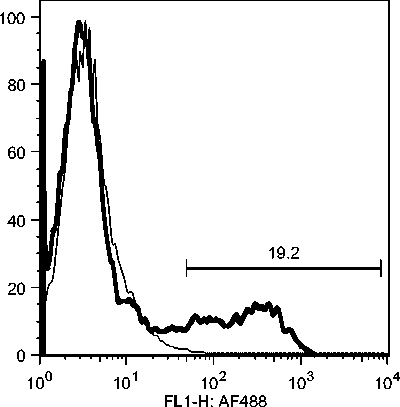
C5: Day 10 Acute Phase
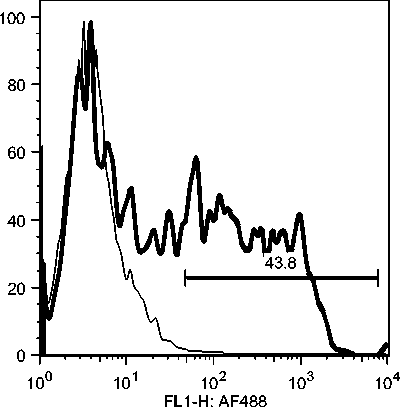
C7: Day 0 Pre-infection
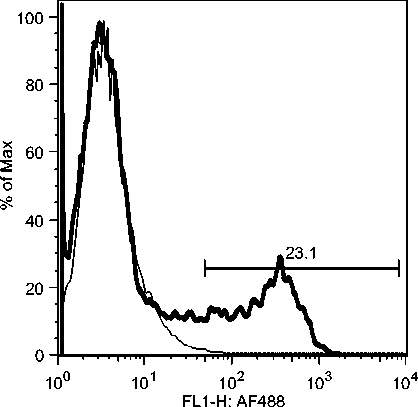
C7: Day 10 Acute Phase
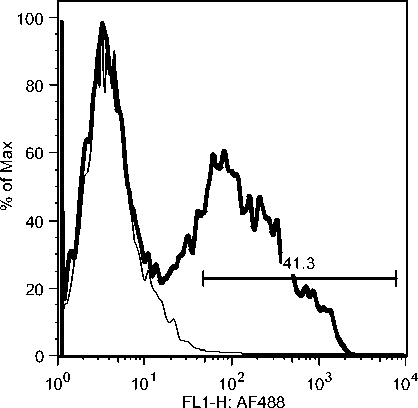
C5: Day 19 Early Recovery Phase C7: Day 19 Early Recovery Phase
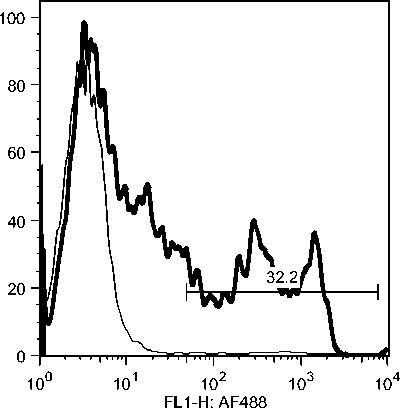
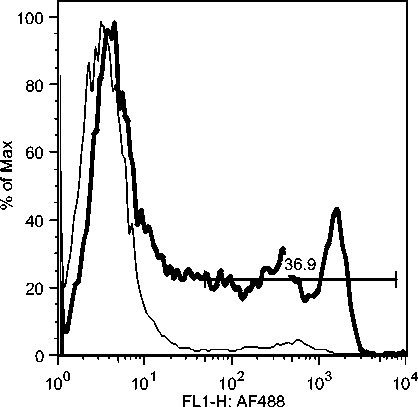
Gambar 10c. Fluktuasi sel B CD21 selama infeksi JDV.
Penelitian Ekpresi Sitokin
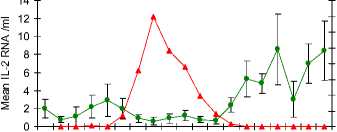
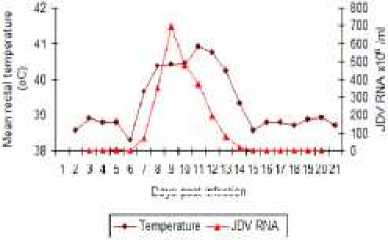
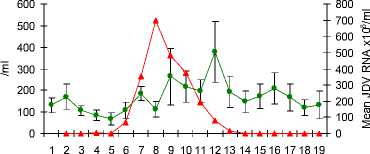
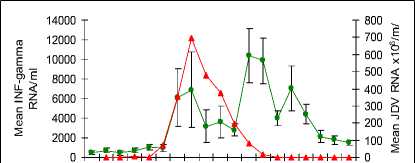
Konfirmasi keberhasilan kloning di analisa dengan agarore gel (gambar 11) dan keberhasilan amplifikasi cDNA untuk pembuatan “standard curve” yang diperlukan dalam uji Real Time PCR (RT-PCR) dilakukan dengan uji PCR (gambar 12). Spesifisitas hasil/produk PCR dikonfimasi dengan sekwensing (gambar 13). Uji RT PCR menunjukkan bahwa gene IL-2, INF-gamma dan TNF-alpha (Gambar 14a,b,c) terekpresi secara significant (p<0.05) selama dan setelah demam.

Gambar 11. Konfirmasi cloning.

Gambar 12. Konfirmasi amplifikasi cDNA
-
1. GENE ID: 280943 TNF|tumor necrosis factor(TNFsuperfamily, member 2)
[Bos taurus] (Over 10 PubMed links)
Score = 91.6 bits (49),
Expect = 1e-15 Identities = 49/49 (100%), Gaps = 0/49 (0%) Strand=Plus/Plus
Query 29
TCTCCGGGGCAGCTCCGGTGGTGG GACTCGTATGCCAATGCCCTCATG G 77
|||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 330
TCTCCGGGGCAGCTCCGGTGGTGG GACTCGTATGCCAATGCCCTCATG G 378
-
2. GENE ID: 281237 IFNG | interferon, gamma [Bos taurus] (Over 10 PubMed links)
Score = 104 bits (114), Expect = 3e-19 Identities = 58/59 (98%), Gaps = 0/59 (0%) Strand=Plus/Plus
Query 16
TGNACTCATCAAAGTGATGAATGA CCTGTCGCCAAAATCTAACCTCAG AAAGCGGAAGA 74
|| |||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 40 TGAACTCATCAAAGTGATGAATGA CCTGTCGCCAAAATCTAACCTCAG AAAGCGGAAGA 46
-
3. GENE ID: 280822 IL2 | interleukin 2 [Bos taurus] (10 or fewer PubMed links) Score = 255 bits (282), Expect = 5e-65 Identities = 167/180 (92%), Gaps = 3/180 (1%) Strand=Plus/Plus Query 8
ATGTTAAGAGTTTACTTGAAGAA-TCAA-
CTTCTAGAGGAAGTGCTAAATTAA GCTCCAA 65
|| ||||| ||||||| |||||| |||| |||||||||||||||||||||| |||||||| Sbjct 234 ATCTTAAGTGTTTACTAGAAGAAC TCAAACTTCTAGAGGAAGTGCTAA ATTTAGCTCCAA 293 Query 66 GCACAAAGG-
GAAACCCAGAGAGATCAAGGATTC AATGGACAATATCAACCGAATCGT TT 124
||| ||| ||| ||||||||||||||||||||||||||||||||||| ||||||||| Sbjct 294 GCAAAAACCTGAACCCCAGAGAG ATCAAGGATTCAATGGACAATATC AAGAGAATCGTTT 353 Query 125 TGGAACTACAGGGATCTGAAACAA GATTCACATGTGAATATGATGATG CAACAGTAAACG 184
|||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 354
TGGAACTACAGGGATCTGAAACAA GATTCACATGTGAATATGATGATG CAACAGTAAACG 413
-
4. gb|EU276071.1| EB Bos taurus interleukin 6 (IL6) mRNA,complete cds Length=641 GENE ID: 280826 IL6 | interleukin 6 (interferon, beta 2) [Bos taurus] (10 or fewer PubMed links) Score=320 bits (354), Expect=3e-84 Identities = 177/177 (100%), Gaps=0/177 (0%) Strand=Plus/Plus
Query 26
CAGAACACTGATCCAGATCCTGAA GCAAAAGATCGCAGATCTAATAAC CACTCCAGCCAC 85
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 446
CAGAACACTGATCCAGATCCTGAA GCAAAAGATCGCAGATCTAATAAC CACTCCAGCCAC 505
Query 86
AAACACTGACCTGCTGGAGAAGAT GCAGTCTTCAAACGAGTGGGTAAA GAACGCAAAGAT 145
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 506
AAACACTGACCTGCTGGAGAAGAT GCAGTCTTCAAACGAGTGGGTAAA GAACGCAAAGAT 565
Query 146
TATCCTCATCCTGAGAAACCTTGA GAATTTCCTGCAGTTCAGCCTGAG AGCTATTCG 202
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sbjct 566
TATCCTCATCCTGAGAAACCTTGA GAATTTCCTGCAGTTCAGCCTGAG AGCTATTCG 622
Gambar 13. Hasil sekwensing produk PCR untuk konfirmasi homologi terhadap “bovine cytokine genes”. Prosentase homologi (92% to 100%) dengan referen standard ditunjukan.
Hasil penelitian terbaru dalam sejarah penelitian penyakit Jembrana. Identitas selular dan target sel diketahui bahwa proliferation seluler hebat yang
terjadi di daerah T sel dalam jaringan limpoid selama phase akut sebetulnya bukan dibebabkan oleh akumulasi populasi sel T seperti diasumsikan sebelumnya (Dharma et al., 1991), melainkan karena infiltrasi sel B muda (centroblast-like cells) yang mengekpresi IgG dan terindikasi sebagai sel yang memproduksi antibodi. Infeksi JDV yang ditunjukkan oleh immunoperoxidase test (uji IHK), memperlihatkan bahwa JDV terdeteksi di dalam sel sel yang secara morphologi dan distribusinya sama dengan sel sel B muda (centroblast-like cells) dan bukan di dalam sel-sel T atau sel-sel macrophage. Hasil/bukti ini dikuatkan oleh hasil uji “doubleimmunolabelling” yang biasa digunakan oleh para ahli lainnya untuk mendeteksi sel target suatu microorganisma (Espinoza and Kuznar, 2009; Mason et al., 2000). Kecocokan antara sel sel yang postitif JDV dengan dengan sel sel positif IgG yang ditunjukkan oleh test ”immunofluorescent” mendukung fakta sel sel positif JDV adalah sebenarnya sel sel B yang memproduksi antibodi.
Perbedaan mendasar proses penyakit pada infeksi JDV dengan infeksi lentivirus lainnya (Soesanto et al., 1990), khususnya terkait phase akut dan stabilitas JDV selama ini (Desport et al., 2007), predileksi JDV untuk menginfeksi hanya sel sel B dan bukan sel sel T atau sel sel macrophage dari kebanyakan lentivirus lainnya tidaklah sesuatu yang aneh. Sel sel B sebagai sel target JDV dapat menjelaskan menurunnya populasi sel-sel B muda di daerah follicular (Dharma et al., 1991) dan terlambatnya produksi antibodi sampai 2-3 bulan pasca infeksi (Hartaningsih et al., 1994; Wareing et al., 1999). Adalah sangat logik bahwa proses normal produksi antibodi terganggu karena terinfeksi dan matinya sel sel B. Kedua BIV dan JDV secara genetika relatif stabil dan mutasi viral relatif rendah dari genom lentiviral lainnya terkait dengan sel target dari
virus ini untuk sel sel plasma dengan masa hidup yang relatif lama (Carpenter et al., 2000; Desport et al., 2007).
1 2 3 4 5 6 7 8 9 1011 1213141516171819
Days post-infection
E≡ IL-2-RNA —A— JDV RNA
B
Djys Mii π'Hbθn
A
800
700 ∈ 600 §
500 Z 400
300 Q
200 ⊂
100 2 0
Days post-infection
—∙— TNF-alpha RNA —*— JDV RNA
C
1 2 3 4 5 6 7 8 9 1011 1213141516171819
Days post-infection
∣→-INF-gamma RNA A JDV RNA
D
Gambar 14 (A,B,C,D) Uji RT PCR menunjukkan peningkatan viral load pada phase akut, dan peningkatan ekpresi gene IL-2, INF-gamma dan TNF-alpha selama demam dan pada awal phase kesembuhan dari infeksi JDV.
Tidak ada bukti bahwa sel sel marcophage diinfeksi JDV mungkin
Volume 8 No. 2: 187-202 Agustus 2016 menjelaskan tidak adanya gejala klinis syaraf pada penyakit Jembrana. Gejala syaraf yang dilaporkan pada pasient positif HIV biasanya dikaitkan dengan infeksi sel sel microglia (Gonzalez-Scarano and Martin-Garcia, 2005) dan juga pada infeksi SIV, adanya gejala syaraf dikaitkan dengan terdeteksinya monosit/macrophage positif SIV di jaringan otak (Bissel et al., 2008).
Bukti predileksi JDV terhadap sel sel B dewasa (sel plasma) dan tidak hidup di dalam sel sel T atau sel sel macrophage adalah unik dan tidak dilaporkan pada lentivirus lainnya. Wakaupun beberapa lentivirus juga menginfeksi sel sel B tapi juga menginfeksi sel sel lainnya, misalnya BIV menginfeksi sel sel B, T dan monocytes (Heaton et al., 1998), SIV menginfeksi sel sel CD4+ and CD8+ T-cells, macrophages dan sel sel B in vivo (O'Neil et al., 1999), dan HIV-1 mengimfeksi sel sel CD4+ T-cells, macrophages and sel sel dendritik, walaupun tidak jelas terkait infeksi langsung kepada sel sel B (Clapham and McKnight, 2002; Conge et al., 1998; Muro-Cacho et al., 1995; Shirai et al., 1992). Lentivirus lain yang juga menyebabkan infeksi akut tapi tidak menyerang sel sel B seperti: EIAV pada kuda menyerang sel sel macrophage (Murakami et al., 1999; Oaks et al., 1998) dan SIVsmmPBj14 pada kera hanya menginfeksi sel sel macrophages. Adalah sangat penting untuk menentukan reseptor JDV dan penyebarannya kepada sel sel lain yang mungkin menjelaskan mengapa hanya sapi bali yang peka terhadap infeksi JDV (Soeharsono et al., 1990).
Untuk memahami mekanisme kesembuhan majoritas hewan terinfeksi (80%) setelah infeksi JDV telah dilakukan analisa limposit dengan uji flow cytometry. Hasil ini mendukung terjadinya lymphopenia pada infeksi JDV, salah satu ciri khas hematologi infeksi JDV pada phase akut (Soesanto et
al., 1990) adalah karena disebabkan oleh penurunan populasi sel sel T CD4+ dan CD8+. Karena JDV terlihat tidak menginfeksi sel T (CD3) adalah mungkin bahwa proses penurunan sel sel T pada infeksi JDV mungkin sama dengan yang terjadi pada infeksi EIAV pada kuda dimana juga terjadi penurunan populasi sel sel T CD4 walupun sel-sel ini bukan target EIAV. Kejadian ini dijelaskan bahwa infeksi tidak langsung dari partikel atau bagian virus EIAV terhadap selsel T CD4 menyebabkan populasi sesel tersebut turun tajam (Murakami et al., 1999). Penurunan drastis CD4+ pada penyakit Jembrana sepertinya mendukung terjadinya immunosuppressi dan infeksi sekender seperti haemorrhagic septicaemia, sebagai dilaporkan pada penyakit Jembrana (Dharma et al., 1994).
Expansi hebat sel-sel CD3+ T-cells di jaringan limphoid selama demam cocok dengan peningkatan populasi sel-sel T CD8+ sesuai hasil uji flow cytometry. Penyebab utama kejadian ini tidak diketahui secara pasti. Pada infeksi akut SIVsmmPBj14, gene Nef diduga bertanggung jawab sebagai mitogenik yang mengaktifkan limposit (Stephens et al., 1998), dan walaupun gene nef tidak ditemukan pada JDV, sebuah gene tmx ditemukan dilokasi yang sama dengan nef pada lentiviruses primata (Chadwick et al., 1995b) dan mungkin mengekpresi sebuah protein yang berfungsi sebagai Nef.
Peningkatan populasi sel-sel T CD8 yang terjadi segera setelah demam turun mungkin berkaitan dengan kesembuhan majoritas (80%) hewan yang terserang JDV (Soesanto et al., 1990). Hal ini juga berkaitan dengan resistensi hewan yang pernah terinfeksi JDV terhadap infeksi ulangan dan tidak kambuhnya penyakit Jembrana dari hewan yang sudah sehat (Soeharsono et al., 1990). Meningkatnya populasi sel-sel T CD8 juga dilaporkan pada pasien HIV-1 yang tidak
menunjukkan gejala klinis (Copeland et al., 1995; Zagury et al., 1998), dan oleh infeksi SIV pada kera walaupun gagal mengeradikasi virus dari tubuhnya (Migueles et al., 2002; Pantaleo et al., 1997a). Karena peningkatan populasi sel-sel T CD8 terkait kesembuhan alamiah pada infeksi JDV, diduga kuat bahwa sel-sel tersebut menghasilkan zat-zat biologis untuk mengontrol JDV. Adalah sangat penting untuk melanjutkan penelitian ini untuk menjawab kinetic respon kesembuhan ini.
Penelitian in vivo yang dilakukan berhasil mengungkap perubahan ekpresi sitokin selama infeksi JDV. Meningkatnya ekpresi IFN-γ mRNA menggunakan RT-PCR berkorelasi positif dengan peningkatan ekpresi protein IFN-γ yang dideteksi dengan ELISA. Walaupun kit yang sama tidak digunakan untuk mendeteksi hubungan antara mRNA dengan ekpresi protein dari sitokin yang lainnya, hal ini diasumsikan bahwa kejadinya mungkin saja sama. Meningktnya ekpresi mRNA terjadi utamanya terhadap IL-2 and IFN-γ dibawah regulasi Th1 (Abbas et al., 1996). Peningkatan populasi sitokin IL-2 dan IFN-γ berkorelasi positif dengan meningkatnya populasi sel-sel T CD8 darah tepi, yang menguatkan bukti tambahan bahwa sel-sel ini mengalami peningkatan regulasi (up-regulation) secara in vivo dan memperkuat aksi cytikines tersebut dalam membantu proses kesembuhan. Peningkatan yang sama antara sitokin IL-2 dan IFN-γ diduga berperan dalam menghilangkan kejadian “ persistent lymphocytosis” pada infeksi Bovine leukaemia virus (Kabeya et al., 1999). Penelitian lanjutan yang lebih intensif perlu dilakukan untuk mengetahui sifat kinetic dan durasi sitokin yang telah diteliti dan sitokin terkait lainnya tidak hanya dari darah tepi tetapi juga dari dalam jaringan untuk meningkatkan pengertian tentan peranan
sitokins dalam respon penyakit dan kesembuhan.
SIMPULAN DAN SARAN
Simpulan
Hasil penelitian menunjukkan bahwa perubahan sub-populasi sel-sel T terkait penyembuhan infeksi JDV memperkuat peranan kekebalan seluler (cell-mediated immune response) dalam proses kesembuhan penyakit Jembrana. Bukti bukti atas meningkatnya ekpresi gen-gen sitokin yang diproduksi/dilepaskan oleh sel-sel T CD8 terutama, IFN-γ and IL-2, mengindikasikan pentingnya gen gen ini dalam proses infeksi dan kesembuhan.
Saran
Peranan penting sel-sel B dalam pathogenesis infeksi JDV membuka alur pengetahuan kita untuk lebih memahami proses penyakit. Juga menyiapkan jalan alternatif untuk mengkultivasi JDV secara in vitro untuk keperluan pengembangan vaksin hidup (tissue culture vaccines).
UCAPAN TERIMA KASIH
Pada kesempatan ini penulis mengucapkan terimakasih Kepala Balai Besar Veteriner Denpasar atas kesempatan yang diberikan untuk melakukan penelitian, serta pihak-pihak yang telah banyak membantu dalam proses penelitian ini.
DAFTAR PUSTAKA
Abbas AK, Murphy KM, Sher A. 1996.
Functional diversity of helper T lymphocytes. Nature, 383:787-793.
Bissel SJ, Wang G, Bonneh-Barkay D, Starkey A, Trichel AM, Murphey-Corb M, Wiley CA. 2008. Systemic and brain macrophage infections in relation to the development of
simian immunodeficiency virus encephalitis. J Virol, 82: 5031-5042.
Carpenter S, Vaughn EM, Yang J, Baccam P, Roth JA, Wannemuehler Y. 2000. Antigenic and genetic stability of bovine immunodeficiency virus during long-term persistence in cattle experimentally infected with the BIV(R29) isolate. J Gen Virol, 81: 1463-1472.
Chadwick BJ, Coelen RJ, Sammels LM, Kertayadnya G, Wilcox GE, (1995a). Genomic sequence analysis identifies Jembrana disease virus as a new bovine lentivirus. J Gen Virol, 76: 189-192.
Chadwick BJ, Coelen RJ, Wilcox GE, Sammels LM, Kertayadnya G. 1995b. Nucleotide sequence analysis of Jembrana disease virus: a bovine lentivirus associated with an acute disease syndrome. J Gen Virol, 76: 1637-1650.
Clapham PR, McKnight A. 2002. Cell surface receptors, virus entry and tropism of primate lentiviruses. J Gen Virol, 83: 1809-1829.
Conge AM, Tarte K, Reynes J, Segondy M, Gerfaux J, Zembala M,Vendrell JP. 1998. Impairment of B-lymphocyte differentiation induced by dual triggering of the B-cell antigen receptor and CD40 in advanced HIV-1-disease. Aids, 12: 1437-1449.
Copeland KF, McKay PJ, Rosenthal KL. 1995. Suppression of activation of the human immunodeficiency virus long terminal repeat by CD8+ T cells is not lentivirus specific. AIDS Res Hum Retroviruses, 11: 1321-1326
Desport M, Stewart ME, Mikosza AS, Sherida CA, Peterson SE, Chavand O, Hartaningsih N, Wilcox GE. 2007. Sequence analysis of
Jembrana disease virus strains reveals a genetically stable lentivirus. Virus Res, 126: 233-244.
Dharma DM, Budiantono A, Campbell RS, Ladds PW. 1991. Studies on experimental Jembrana disease in Bali cattle. III. Pathology. J Comp Pathol, 105: 397-414.
Dharma DM, Ladds PW, Wilcox GE, Campbell RS. 1994. Immunopathology of experimental Jembrana disease in Bali cattle. Vet Immunol Immunopathol, 44: 31-44.
Espinoza JC, Kuznar J. 2009. Visualization of the infectious pancreatic necrosis virus replication cycle by labeling viral intermediates with a TUNEL assay. Vet Microbiol.
M. (1989). Identification and biologic characterization of an acutely lethal variant of simian immunodeficiency virus from sooty mangabeys (SIV/SMM). AIDS Res Hum Retroviruses, 5: 397-409.
Gonzalez-Scarano F, Martin-Garcia J. 2005. The neuropathogenesis of AIDS. Nat Rev Immunol 5: 69-81.
Hartaningsih N, Wilcox GE, Kertayadnya G, Astawa M. 1994. Antibody response to Jembrana disease virus in Bali cattle. Vet Microbiol, 39: 1523.
Heaton PR, Johnstone P, 1998. Investigation of tropism of immunodeficiency-like Vet Sci, 65, 33-40.
Kabeya H, Ohashi K, Oyunbileg N, Nagaoka Y, Aida Y, Sugimoto C, Yokomizo Y, Onuma M. 1999. Upregulation of tumor necrosis factor alpha mRNA is associated with bovine-leukemia virus (BLV) elimination in the early phase of infection. Vet Immunol Immunopathol, 68: 255-265.
Brownlie J. the cellular bovine virus. Res
Konnai S, Usui T, Ohashi K, Onuma M. 2003. The rapid quantitative analysis of bovine cytokine genes by realtime RT-PCR. Vet Microbiol, 94: 283-294.
Leutenegger CM, Alluwaimi AM, Smith WL, Perani L, Cullor JS. (2000). Quantitation of bovine cytokine mRNA in milk cells of healthy cattle by real-time TaqMan polymerase chain reaction. Vet Immunol Immunopathol, 77: 275-287.
Martojo H. 2003. A simple selection program for smallholder Bali cattle farmers. In Strategies to improve Bali cattle in Eastern Indonesia, pp. 43-53. Edited by K. Entwistle and D. R. Lindsay: Australian Centre for International Agricultural Research.
Mason DY, Micklem K, Jones M. 2000. Double immunofluorescence labelling of routinely processed paraffin sections. J Pathol, 191: 452461.
Migueles SA, Laborico AC, Shupert WL, Sabbaghian MS, Rabin R, Hallahan CW, Van Baarle D, Kostense S, Miedema F. 2002. HIV-specific CD8+ T cell proliferation is coupled to perforin expression and is maintained in nonprogressors. Nat Immunol, 3: 1061-1068.
Murakami K, Sentsui H, Shibahara T, Yokoyama T. 1999. Reduction of CD4+ and CD8+ T lymphocytes during febrile periods in horses experimentally infected with equine infectious anemia virus. Vet Immunol Immunopathol, 67: 131140.
Muro-Cacho CA, Pantaleo G, Fauci AS. 1995. Analysis of apoptosis in lymph nodes of HIV-infected persons. Intensity of apoptosis correlates with the general state of activation of the lymphoid tissue and not with stage
of disease or viral burden. J Immunol, 154: 5555-5566.
Oaks JL, McGuire TC, Ulibarri C, Crawford TB. 1998. Equine infectious anemia virus is found in tissue macrophages during subclinical infection. J Virol, 72: 7263-7269.
O'Neil SP, Mossman SP, Maul DH, Hoover EA. 1999. In vivo cell and tissue tropism of SIVsmmPBj14-bcl.3. AIDS Res Hum Retroviruses, 15: 203-215
Pantaleo G, Soudeyns H, Demarest JF, Vaccarezza M, Graziosi C, Paolucci S, Daucher M, Cohen OJ, Denis F. (1997a). Evidence for rapid disappearance of initially expanded HIV-specific CD8+ T cell clones during primary HIV infection. Proc Natl Acad Sci U S A 94, 9848-9853.
Pantaleo G, Demarest JF, Schacker T, Vaccarezza M, Cohen OJ, Daucher M, Graziosi C, Schnittman SS, Quinn TC. 1997b. The qualitative nature of the primary immune response to HIV infection is a prognosticator of disease progression independent of the initial level of plasma viremia. Proc Natl Acad Sci U S A 94: 254-258.
Shirai A, Cosentino M, Leitman-Klinman SF, Klinman DM. 1992. Human immunodeficiency virus infection induces both polyclonal and virusspecific B cell activation. J Clin Invest, 89: 561-566.
Soeharsono S, Hartaningsih N, Soetrisno M, Kertayadnya G, Wilcox GE. 1990. Studies of experimental Jembrana disease in Bali cattle. I. Transmission and persistence of the infectious agent in ruminants and pigs, and resistance of recovered cattle to re-infection. J Comp Pathol, 103: 49-59.
Soesanto M, Soeharsono S, Budiantono A, Sulistyana K, Tenaya M, Wilcox GE. 1990. Studies on experimental Jembrana disease in Bali cattle. II. Clinical signs and haematological changes. J Comp Pathol, 103: 61-71.
Stephens EB, Mukherjee S, Liu ZQ, Sheffer D, Lamb-Wharton R, Leung K, Zhuge W, Joag SV, Li Z.1998. Simian-human immunodeficiency virus (SHIV) containing the nef/long terminal repeat region of the highly virulent SIVsmmPBj14 causes PBj-like activation of cultured resting peripheral blood mononuclear cells, but the chimera showed No increase in virulence. J Virol, 72, 5207-5214.
Stewart M, Desport M, Hartaningsih N, Wilcox G. 2005. TaqMan real-time reverse transcription-PCR and JDVp26 antigen capture enzyme-linked immunosorbent assay to quantify Jembrana disease virus load during the acute phase of in vivo infection. J Clin Microbiol, 43: 5574-5580.
Talib C, Entwistle K, Sirega A, Budiarti-Turner S, Lindsay D. 2002. Survey of population and production dynamics of Bali cattle and existing breeding programs in Indonesia. In In proceeding of an Aciar Workshop on "Strategies to Improve Bali Cattle in estern Indonesia". Denpasar-Bali-Indonesia.
Wareing S, Hartaningsih N, Wilcox GE, Penhale WJ. 1999. Evidence for immunosuppression associated with Jembrana disease virus infection of cattle. Vet Microbiol, 68: 179-185.
Wiryosuhanto S. 1996. Bali cattle -their economic important in Indonesia. In Workshop on Jembrana Disease and the Bovine Lentiviruses pp. 34-41. Edited by G. E. Wilcox S, Soeharsono, Dharma DMN, Copland
JW. Australian Centre for International Agricultural Research.
Zagury D, Lachgar A, Chams V, Fall LS, Bernard J, Zagury JF, Bizzini B, Gringeri A, Santagostino E. .1998.. C-C chemokines, pivotal in protection against HIV type 1
infection. Proc Natl Acad Sci U S A 95: 3857-3861.
Zhang J, Madden TL. 1997. PowerBLAST: a new network BLAST application for interactive or automated sequence analysis and annotation. Genome Res, 7: 649-656.
202
Discussion and feedback