COMPARISON OF MINI-FLOTAC TECHNIQUE AND FLOTATION TECHNIQUE IN COPROSCOPIC TEST OF WORMS IN GREEN TURTLE FECES
on
Buletin Veteriner Udayana Volume 15 No. 6: 1267-1278
pISSN: 2085-2495; eISSN: 2477-2712 Desember 2023
Online pada: http://ojs.unud.ac.id/index.php/bulvet https://doi.org/10.24843/bulvet.2023.v15.i06.p26
Terakreditasi Nasional Sinta 4, berdasarkan Keputusan Direktur Jenderal Pendidikan Tinggi, Riset, dan Teknologi No. 158/E/KPT/2021
Perbandingan Teknik Mini-Flotac dan Teknik Flotasi dalam Uji Koproskopis Cacing pada Feses Penyu Hijau
(COMPARISON OF MINI-FLOTAC TECHNIQUE AND FLOTATION TECHNIQUE IN COPROSCOPIC TEST OF WORMS IN GREEN TURTLE FECES)
Nurul Audy Baiqhaq Fathonah1*, Ida Bagus Windia Adnyana2, Ida Ayu Pasti Apsari3
-
1Mahasiswa Sarjana Pendidikan Dokter Hewan, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia, 80234;
-
2Laboratorium Patologi Veteriner Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB.
Sudirman, Denpasar, Bali, Indonesia, 80234;
-
3Laboratorium Parasitologi Veteriner Fakultas Kedokteran Hewan Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia, 80234.
*Corresponding author email: windiaadnyana@unud.ac.id
Abstrak
Penyu hijau (Chelonia Mydas) sebagai hewan yang dilindungi merupakan indikator kesehatan ekosistem laut karena merupakan spesies sentinel. Penyebab kematian penyu hijau yang paling sering terjadi adalah karena infeksi endoparasit. Penemuan telur cacing ini didasarkan pada teknik koproskopi dengan menggunakan sedimentasi, desorpsi, sentrifugasi dan flotasi material. Teknik Mini-FLOTAC merupakan metode langsung yang baru-baru ini dikembangkan dari teknik flotasi sebelumnya untuk diagnosis infeksi parasit usus. Penelitian ini bertujuan untuk mengetahui perbandingan hasil pemeriksaan telur cacing menggunakan Teknik Mini-FLOTAC dan Teknik Flotasi. Penelitian menggunakan feses penyu hijau yang berada di Pusat Konservasi dan Edukasi TCEC Serangan Bali. Sampel yang digunakan sebanyak 2 gram untuk setiap jenis teknik pemeriksaan. Selanjutnya dilakukan pemeriksaan dengan Teknik Mini-FLOTAC dan Teknik Flotasi di laboratorium Pusat Konservasi dan Edukasi TCEC Serangan Bali. Hasil kemudian dianalisis dengan penghitungan manual dan bantuan dari kalkulator statistika online. Nilai parameter k yaitu 0 menginterpretasikan bahwa terdapat perbedaan yang signifikan antara Teknik Mini-FLOTAC dan Teknik Flotasi. Interpretasi ini didukung oleh hasil nilai sensitivitas Teknik Mini-FLOTAC mencapai 100% dan Teknik Flotasi Menyetuh 0% yang menunjukkan adanya perbedaan yang signifikan antara hasil pemeriksaan telur cacing berdasarkan taksonominya pada Teknik Mini-FLOTAC dan Teknik Flotasi. Teknik Mini-FLOTAC menunjukkan keefektifan yang lebih unggul dibandingkan dengan Teknik Flotasi untuk mendeteksi telur cacing dalam penelitian ini. Penglihatan telur yang lebih jelas kadang-kadang terlihat pada hasil Teknik Flotasi. Pembuatan saringan pada Fill-Flotac sebesar 250µm untuk pemeriksaan penyu hijau (chelonia mydas) agar dapat menghasilkan hasil yang lebih jernih.
Kata kunci: feses; penyu hijau; parasitologi veteriner; satwa akuatik; teknik koproskopis; teknik Mini-FLOTAC; teknik flotasi.
Abstract
The green turtle (Chelonia mydas) as a protected animal is an indicator of the health of marine ecosystems because it is a sentinel species. The most common cause of green turtle death is endoparasite infection. The discovery of worm eggs is based on coproscopic techniques using sedimentation, desorption, centrifugation and flotation of material. The Mini-FLOTAC technique is a direct method that was recently developed from the previous flotation technique for the diagnosis of intestinal parasitic infections. This study aims to compare the results of examination of worm eggs using the Mini-FLOTAC Technique and the Flotation Technique. The study used green turtle feces at the TCEC Serangan Bali Conservation and Education Center. The sample used 2 grams for each type of technique. Furthermore, an examination was carried out with the Mini-FLOTAC Technique and Flotation Technique in the Turtle Conservation and Education Center TCEC Serangan, Bali laboratory. The results were then analyzed with manual calculations and assistance from an online statistical calculator.
The value of the k parameter is 0, interprets that there is a significant difference between the Mini-FLOTAC Technique and the Flotation Technique. This interpretation is supported by the results of the sensitivity values of the Mini-FLOTAC Technique reaching 100% and the Touch Flotation Technique 0% which indicates a significant difference between the results of examination of worm eggs based on their taxonomy on the Mini-FLOTAC Technique and the Flotation Technique. The Mini-FLOTAC technique showed superior effectiveness compared to the Flotation Technique for detecting worm eggs in this study. Clearer vision of eggs is sometimes seen in the results of the Flotation Technique. Making a filter for Fill-Flotac at 250µm for green turtle (Chelonia mydas) examination in order to produce clearer results.
Keywords: Green aquatic animal; coproscopic technique; faeces; flotation technique; mini-FLOTAC technique; turtle; veterinary parasitology.
PENDAHULUAN
Penyu adalah indikator kesehatan ekosistem laut. Sebagian besar spesies tersebar secara kosmopolitan, dan ditemukan di perairan samudra tropis dan subtropis di seluruh dunia. Afinitas tinggi mereka untuk habitat pesisir, ketergantungan pada lingkungan laut dan darat, dan umur panjang membuat mereka kandidat yang ideal untuk bertindak sebagai populasi spesies sentinel (Aguirre dan Lutz, 2004).
Terdapat tujuh spesies penyu yang hidup di dunia, enam diantaranya dapat ditemukan di perairan Indonesia. Salah satu penyu yang hidup di perairan Indonesia adalah Penyu Hijau (Janawi, 2009). Tiap tahunnya populasi spesies ini terus menurun, untuk itu dikategorikan satwa langka dan dilindungi dalam Red Data Book Convention on International Trade in Endangered Spesies (CITES) yang termasuk dalam Apendix I International Union for Conservation of Nature and Natural Resources (IUCN) (Seminoff, 2002). Flint et al 2010 melakukan nekropsi sepanjang tahun 2006-2009 pada penyu hijau yang terdampar pada Queensland Selatan, Australia untuk mengetahui alasan kematian penyu hijau dan didapatkan bahwa penyebab kematian yang paling sering terjadi adalah infeksi endoparasit, gangguan pencernaan, infeksi umum, dan trauma. Kejadian dan prevalensi penyakit pada penyu dalam banyak kasus kemungkinan besar terkait dengan kesehatan habitat laut (Aguirre dan Lutz, 2004; Flint et al., 2015; Harvell et al., 1999;
Jacobson et al., 2006; Ward dan Lafferty, 2004). Oleh karena itu, dengan memahami prevalensi endoparasit ini kita berpotensi memperoleh wawasan tentang kesehatan asal lingkungan penyu hijau secara keseluruhan.
Endoparasit adalah parasit internal yang dapat menginfeksi penyu hijau. Parasit ini dapat berada di organ, seperti saluran pencernaan, dan dapat menyebabkan berbagai masalah kesehatan. Contoh endoparasit yang dapat menginfeksi penyu hijau antara lain nematoda, cestoda, dan trematoda. Parasit ini dapat menyebabkan malabsorpsi, anemia, dan gejala lainnya, dan pada kasus yang parah bahkan bisa berakibat fatal. Penting bagi peneliti dan konservasionis untuk menyadari keberadaan endoparasit dalam populasi penyu hijau untuk melindungi dan melestarikan hewan dengan baik.
Nematoda Sulcascaris sulcata menginfeksi penyu hijau di Brazil (Freitas dan Lent, 1946) yang dapat menyebabkan ulkus, gastritis fibrinopurulen dan gastritis kronis (Lauckner, 1985). Nematoda dari famili Anisakidae, yaitu Anisakis simplex dan A. typica juga diamati menyebabkan tukak hemoragik, gastritis, dan sistis pada serosa pada penyu hijau penangkaran (Burke dan Rodgers, 1982; Glazebook dan Campbell, 1990) dan pada penyu hijau yang hidup bebas di Brasil (Xavier, 2011). Penularan kemungkinan terjadi melalui konsumsi ikan yang terinfeksi. Karena Anisakis spp. bermigrasi melalui celomic cavity, Anisakis spp. dapat menyebabkan fibrosis jaringan dan granuloma (Glazebook dan Campbell, 1990).
Glazerbook et al pada 1981 menemukan penyu hijau terdampar di dekat Townsville di Queensland utara. Setelah dilaksanakan pemeriksaan klinis dan patologis diketahu penyakit disebabkan oleh infestasi berat cacing dari genus Hapalotrema (Digenea: Spirorchidae) dalam sistem kardiovaskular. Telur yang dilepaskan ke dalam sirkulasi dari jantung dan tempat lain menimbulkan respons granulomatosa fokal umum pada inang. Infeksi Spirorchiidiasis sering terjadi pada penyu dan dapat dideteksi dengan menemukan cacing dewasa yaitu penemuan telur dalam biopsi atau bagian histologis yang digunakan sebagai indikator infeksi secara proksi ( Work et al., 2005; Binoti et al., 2016; Santoro et al., 2017).
Penemuan telur cacing ini didasarkan pada teknik koproskopi dengan menggunakan sedimentasi, desorpsi, sentrifugasi dan flotasi material. Aspek metodologi dari teknik ini dibahas dalam literatur (Bailenger, 1979; Rude et al., 1987; Teichmann, 1986; Ayres et al., 1989, 1992; Gaspard dan Schwartzbrod, 1993a, b).
Untuk melakukan uji pemeriksaan telur cacing pada feses hewan di Fakultas Kedokteran Hewan Universitas Udayana sendiri menggunakan Teknik Flotasi (Limantara, M. A. Y. 2019; Setiawan et al., 2014; Bellantari et al., 2021; Apsari et al., 2022).
Pada awal tahun 1941, Hasil penelitian Kouthz menunjukkan bahwa sentrifugasi menggunakan larutan flotasi tinja ZnSO4 dapat secara signifikan meningkatkan penemuan telur cacing secara umum. Permadi et al. (2023) melaksanakan Teknik Mini-FLOTAC menggunakan larutan zinc sulfate (ZnSO4) sebagai larutan pengapung dalam menemukan telur cacing trematoda. Zahriati et al (2017) menguji tentang perbandingan penggunaan larutan garam jenuh dengan larutan zinc sulfate sebagai pengapung menggunakan Teknik Flotasi dengan hasil rata-rata jumlah telur sama. Namun, Alvarado-Villalobos et al merekomendasikan zinc sulfate (ZnSO4)
untuk pemeriksaan cacing trematoda menggunakan Teknik Mini-FLOTAC. Melihat beberapa penelitian yang telah dilakukan ini maka peneliti memutuskan untuk menggunakan larutan zinc sulfate pada teknik pemeriksaan telur cacing menggunakan Teknik Mini-FLOTAC dan Teknik Flotasi.
Teknik Mini-FLOTAC merupakan metode langsung yang baru-baru ini dikembangkan dari Teknik Flotasi sebelumnya untuk diagnosis infeksi parasit usus. Teknik Mini-FLOTAC berupaya mengatasi tantangan penggunaan teknologi modern yang disesuaikan dengan sensitivitas tinggi, keterjangkauan, dan kesesuaian diagnosis di rangkaian terbatas sumber daya di mana infeksi parasit usus tersebar luas. Studi yang dilakukan oleh Barda et al., (2013) di Dharamsala, India, dan di Bukumbi, Tanzania untuk membandingkan keakuratan dan kelayakan Teknik Mini-FLOTAC dengan metode diagnostik yang saat ini lebih banyak digunakan, seperti apusan feses langsung dan metode konsentrasi formolether. Di antara 180 anak sekolah dasar yang diperiksa, 72% positif terkena infeksi parasit usus. Teknik Mini-FLOTAC mendeteksi jumlah infeksi cacing tertinggi (sensitivitas 90%), sedangkan konsentrasi formolether adalah pendekatan yang paling sensitif untuk infeksi protozoa usus (sensitivitas 88%). Keuntungan logistik Teknik Mini-FLOTAC adalah prosedurnya tidak memerlukan langkah sentrifugasi atau peralatan mahal, dapat dilakukan pada sampel feses segar dan tetap, dan hanya membutuhkan 10–12 menit persiapan sebelum analisis mikroskopis. Data Barda et al., (2013) menunjukkan bahwa Teknik Mini-FLOTAC adalah alat diagnostik yang menjanjikan untuk diagnosis cacing; oleh karena itu, studi tindak lanjut dalam pengaturan lain diperlukan.
Penggunaan Teknik Mini-FLOTAC untuk pemeriksaan koproskopis cacing pada satwa akuatik lain pernah dilakukan oleh Marcer et al., (2022) yang melakukan penelitian perbandingan uji koproskopis
antara sedimentasi-flotasi dan Mini-FLOTAC terhadap 44 cetacea, termasuk lumba-lumba hidung botol (Tursiops truncatus), lumba-lumba belang (Stenella coeruleoalba), paus sperma (Physeter macrocephalus), lumba-lumba Risso (Grampus griseus), paus berparuh Cuvier (Ziphius cavirostris), paus pilot (Globicephala melas), dan paus sirip (Balaenoptera physalus). Dengan hasil Teknik Mini-FLOTAC terbukti lebih baik daripada teknik sedimentasi-flotasi untuk mendekati komposisi fauna cacing dari pemeriksaan feses, memiliki sensitivitas yang lebih tinggi atau sama untuk semua taksa.
Penelitian yang membandingkan teknik koproskopis cacing menggunakan Teknik Mini-FLOTAC dan Teknik Flotasi pada penyu hijau (chelonia mydas) sendiri di Universitas Udayana belum pernah dilakukan, namun untuk perbandingan pada teknik koproskopis telur cacing menggunakan Teknik Mini-FLOTAC dan Teknik Flotasi di dunia sudah dilaksanakan namun penelitian dilaksanakan pada sampel feses manusia yaitu Hussein et al. (2017) menggunakan larutan pengapung ZnSO4 dengan hasil Mini-FLOTAC memiliki nilai 100% pada uji sensitivitas dengan hasil yang lebih baik daripada teknik flotasi yaitu 95,7%. Marcer et al. (2022) melakukan penelitian di mana membandingkan antara Teknik Mini-FLOTAC dan teknik sedimentasi-flotasi dengan salah satu hasil uji cacing trematoda Campula spp. pada lumba-lumba menghasilkan nilai konkordasi 88.6 dan parameter k 0.69 yang memiliki arti menurut Altman (1991) bahwa data yang diperoleh memiliki hasil mendekati sebenarnya dengan kategori bagus. Namun penelitian yang membandingkan antara teknik Mini-FLOTAC dengan Teknik Flotasi belum ada yang dipublikasikan.
Berdasarkan latar belakang ini peneliti ingin mengeksplorasi penggunaan Teknik Mini-FLOTAC jika dibandingkan dengan Teknik Flotasi. Hasil penelitian diharapkan dapat digunakan sebagai acuan dalam
Volume 15 No. 6: 1267-1278
Desember 2023
https://doi.org/10.24843/bulvet.2023.v15.i06.p26 pemilihan teknik uji koproskopis prevalensi cacing pada penyu hijau.
METODE PENELITIAN
Objek Penelitian
Objek penelitian yang diteliti pada penelitian ini adalah feses penyu hijau yang diambil secara steril di TCEC, Serangan. Banyaknya sampel yang diambil pada penelitian ini berjumlah 30 sampel.
Rancangan Penelitian
Rancangan penelitian ini termasuk dalam penelitian komparatif kuantitatif dengan metode penelitian eksperimen. Penelitian kuantitatif adalah pendekatan kuantitatif yang data-datanya numerikal dan diolah dengan menggunakan teknik statistik. Penelitian komparatif ialah penelitian yang dimaksudkan untuk mengetahui tingkat perbedaan suatu variabel dari dua kelompok yang berbeda. Penelitian ini dimaksudkan untuk mengetahui perbedaan hasil uji koproskopis cacing dengan teknik Mini-FLOTAC dan teknik flotasi menggunakan pendekatan kuantitatif dan data-data yang diperoleh diolah menggunakan teknik statistik. Sampel penelitian ini menggunakan teknik purposive sampling yaitu mengambil 30 sampel feses Penyu Hijau yang di rehabilitasi di TCEC.
Variabel Penelitian
Variabel pada penelitian ini untuk variabel bebas yakni teknik koproskopis yang digunakan, serta variabel terikatnya yaitu telur cacing yang ditemukan dan variabel kendalinya adalah penyu hijau.
Cara Pengumpulan Data
Data primer yaitu data yang diambil langsung dari sampel yang digunakan adalah 30 sampel feses penyu hijau. Pengumpulan sampel feses diambil secara langsung dari tangki penyu. Sampel feses yang baru diambil dimasukkan kedalam pot penampung feses dan data sekunder yaitu data yang diambil oleh peneliti dari buku referensi, perhitungan morfometri penyu hijau yang menjadi objek penelitian, dan
lain sebagainya. Untuk dokumentasi, diambil foto-foto saat pengambilan feses, pemeriksaan morfometri, pelaksanaan teknik Mini-FLOTAC dan teknik flotasi.
Prosedur Penelitian
Teknik Mini-FLOTAC
Sampel feses sebanyak 2 gr dimasukkan kedalam Fill – Flotac. Selanjutnya ditambahkan ZnSO4 35 ml lalu homogenkan dan isi kedua ruang apung Mini-FLOTAC (Barda et al., 2013). Diamkan selama 10 menit dan periksa dengan mikroskop pembesaran obyektif 40X.
Teknik Flotasi
Sampel feses sebanyak 2 gr dimasukkan kedalam gelas beker, ditambahkan aquades dan diaduk sampai homogen. Saring dengan wire mesh 250µm. Lalu dituangkan ke dalam tabung sentrifus sampai setinggi 3⁄4 tabung. Sentrifus dilakukan dengan kecepatan 2000 rpm selama 5 menit. Selanjutnya, supernatannya dibuang, dan ditambahkan larutan ZnSO4 sampai volume mencapai 3⁄4 tabung lalu homogenkan. Tabung disentrifus kembali dengan kecepatan 2000 rpm selama 5 menit. Tabung sentrifus diletakkan di atas rak dengan posisi tegak lurus, diteteskan ZnSO4 dengan pipet sampai permukaan cairan di dalam tabung menjadi cembung dan dibiarkan selama 3-5 menit, tempelkan cover glass di atas permukaan yang cembung lalu tempelkan pada object glass (Soulsby, 1982). Lalu periksa dengan mikroskop pembesaran obyektif 40X (Apsari et al., 2017).
Analisis Data
Untuk perbandingan kedua teknik koposkropis, hasil dari Teknik Mini-FLOTAC dan Teknik Flotasi direduksi menjadi pernyataan kualitatif, yaitu positif atau negatif. Konkordansi kedua tes kopromikroskopik dihitung sebagai jumlah sampel dengan hasil yang sama dari jumlah total sampel yang diperiksa (% Kesesuaian [concordance]). Hal ini selanjutnya dievaluasi menggunakan statistik tipe kappa (Landis dan Koch 1977), yang
menyatakan proporsi kesepakatan yang ditentukan di luar kebetulan dengan nilai (parameter k) dari 0 (tidak ada kesepakatan) hingga 1 (persetujuan sempurna). Hasil dari kedua teknik koposkropis kemudian dibandingkan dengan isolasi cacing dari feses, untuk menentukan tes mana yang memiliki sensitivitas tertinggi untuk mendeteksi setiap takson. Spesifisitas kedua tes diasumsikan 100%. Analisis sensitivitas kedua tes dilakukan dengan menggunakan perangkat lunak kalkulator epidemiologi daring EpiTools https://epitools.ausvet.com.au/comparetwo tests.
HASIL DAN PEMBAHASAN
Hasil
Hasil pengukuran morfometri penyu hijau dalam penelitian ini dapat dilihat pada tabel 1 Panjang lengkung karapas atau curve carapace length (CCL) penyu hijau berada pada rentang antara 42-101 cm dengan rata-rata 72.9 cm ± 1.615. Lebar lengkung karapas atau curve carapace length (CCW) penyu hijau memiliki rentang antara 41-91 dengan rata-rata 59.8 ± 4.325.
Dari 30 Sampel Feses penyu hijau ditemukan jenis telur cacing yang penulis klasifikasikan menjadi dua macam tipe (Permadi et al., 2023) sesuai warna telur cacing yaitu tipe satu yaitu berwarna keemasan (golden) pada gambar 1 dan tipe dua yaitu telur cacing berwarna transparan pada gambar 2. Kemudian dalam klasifikasi telur cacing berwarna keemasan dibagi kembali menjadi dua yaitu telur cacing berwarna kuning tua kecoklatan dan kuning muda. Klasifikasi telur cacing berwarna transparan dibagi menjadi dua yaitu telur cacing jernih dan agak gelap.
Pada Tabel 2 dapat dilihat bahwa dari 30 sampel yang diperiksa, dengan Teknik Mini-FLOTAC positif 30 (100%) dan dengan Teknik Flotasi positif 4 (13.3%).
Pada gambar 1A dan 1B memiliki bentuk memanjang dengan dua polar body berwarna kecoklatan memiliki kemiripan dengan jenis telur cacing Hapalotrema
mistroides atau Learedius learedi (Adnyana et al., 2020; Santoro et al., 2020; Murray D. Dailey 1987). Gambar 1C telur berwarna cokelat dengan cangkang tebal beroperkulasi memiliki kemiripan dengan telur Fasciola hepatica (Mas-Coma et al., 2020). Gambar 1D telur cacing berbentuk lonjong berwarna coklat muda dengan kapsul berwarna lebih gelap dan permukaan rata memiliki kemiripan dengan Styphlotrema solitario (Greiner 2013). Gambar 1E telur cacing memiliki unipolar spine satu polar body memiliki kemiripan dengan Carettacola bipora tipe I (Work et al.,2005).
Gambar 2F menunjukkan telur cacing oval berwarna transparan dengan memiliki satu polar body memiliki kemiripan dengan telur cacing Octangium sagitta (Greiner 2013). Pada gambar 2G telur cacing berbentuk oval tanpa polar body berwarna transparan dengan 2 ujung berbentuk lancip serta kapsul yang mulus memiliki kemiripan dengan telur Schizamphistomum sceloporum (Greiner 2013). Telur cacing berbentuk lonjong dengan salah satu berujung lancip pada gambar 2H memiliki kapsul yang tebal dan transparan dan inti telur gelap memiliki kemiripan dengan telur Sulcaris sulcatta (Greiner 2013). Cacing dengan telur yang memiliki bentuk bikonkav pada gambar 2I biasanya mengacu pada telur cacing benang (Acanthocephala) pada penyu hijau (Fisher 1960). Pada gambar 1A dan 1B memiliki bentuk memanjang dengan dua polar body berwarna kecoklatan memiliki kemiripan dengan jenis telur cacing Hapalotrema mistroides atau Learedius learedi (Adnyana et al., 2020; Santoro et al., 2020; Murray D. Dailey 1987). Gambar 1C telur berwarna cokelat dengan cangkang tebal beroperkulasi memiliki kemiripan dengan telur Fasciola hepatica (Mas-Coma et al., 2020).. Gambar 1D telur cacing berbentuk lonjong berwarna coklat muda dengan kapsul berwarna lebih gelap dan permukaan rata memiliki kemiripan dengan Styphlotrema solitario (Greiner 2013). Gambar 1E telur cacing memiliki unipolar
spine satu polar body memiliki kemiripan dengan Carettacola bipora tipe I (Work et al., 2005).
Tabel 3 memberikan gambaran tentang sensitivitas dan spesifisitas kedua teknik dalam mendeteksi keberadaan cacing. Dalam tabel tersebut, terdapat empat kategori yang mencakup hasil positif dan negatif dari masing-masing teknik. Pertama, menunjukkan hasil positif pada Teknik Mini-FLOTAC dan juga pada Teknik Flotasi, dengan jumlah sebanyak 4. Kemudian, hasil negatif pada Teknik Mini-FLOTAC dan hasil positif pada Teknik Flotasi,dengan jumlah sebanyak 0. Hasil positif pada Teknik Mini-FLOTAC, namun hasil negatif pada Teknik Flotasi yaitu berjumlah 25. Sedangkan, yang menunjukkan hasil negatif pada kedua teknik, dengan jumlah sebanyak 0. Nilai parameter k yang dihasilkan adalah 0 yang menunjukkan bahwa tidak ada kesepakatan yang diamati antara kedua Teknik Mini-FLOTAC dan Teknik Flotasi.
Pembahasan
Berdasarkan hasil penelitian ini, Teknik Mini-FLOTAC terbukti lebih baik daripada Teknik Flotasi untuk mendeteksi telur cacing dalam pemeriksaan feses, Teknik Mini-FLOTAC juga memiliki sensitivitas yang jauh lebih tinggi untuk semua jenis telur cacing. Prevalensi dan jumlah sampel feses yang rendah menjadi batas dalam interpretasi hasil sensitivitas. Kendala yang tidak dapat dihindari dalam mendapatkan sampel dari penyu hijau ialah ketidakmungkinan merencanakan jumlah pengambilan sampel karena penyu hijau adalah satwa yang dilindungi oleh negara.
Perbandingan dari dua teknik koposkropis menunjukkan tidak ada kesamaan di antara kedua teknik tersebut. Teknik Mini-FLOTAC telah divalidasi untuk digunakan pada manusia, serta pada hewan domestik dan liar, menunjukkan sensitivitas dan akurasi diagnostik yang lebih tinggi bila dibandingkan dengan teknik tradisional lainnya untuk mendeteksi infeksi cacing (Cardoso et al., 2021; Catalano et al., 2019; Capasso et al., 2019;
Carreca et al., 2018; Coulibaly et al., 2016; Lima et al., 2015; Maurelli et al., 2014; Rinaldi et al., 2014)
Penglihatan telur yang lebih jelas tanpa debris kadang-kadang terlihat pada hasil Teknik Flotasi. Menggunakan ukuran saringan yang tepat dapat memperbaiki masalah ini untuk mengurangi jumlah kotoran tinja pada Mini-FLOTAC. Hasil yang diperoleh penelitian ini menyoroti sensitivitas Teknik Mini-FLOTAC yang jauh lebih besar dibandingkan dengan Teknik Flotasi untuk mendeteksi telur parasit cacing yang berada di feses penyu hijau. Hal ini juga didukung oleh Nilai parameter k=0 yang menunjukkan bahwa tidak ada kesepakatan yang diamati antara kedua Teknik Mini-FLOTAC dan Teknik Flotasi.
Secara ekonomis pada biaya larutan pengapung, Teknik Flotasi jauh lebih murah dibandingkan dengan Teknik Mini-FLOTAC karena Teknik Flotasi hanya membutuhkan sekitar 16-17 ml Zinc Sulfate per satu sampel dimana Teknik Mini-FLOTAC membutuhkan 38 ml. Namun secara alat Teknik Mini-FLOTAC hanya perlu menyiapkan Mini-FLOTAC dan Fill-FLOTAC sedangkan Teknik Flotasi masih membutuhkan alat sentrifugator, saringan, mortar, dll.
SIMPULAN DAN SARAN
Simpulan
Terdapat perbedaan yang signifikan antara hasil pemeriksaan telur cacing metode pemeriksaan Teknik Mini-FLOTAC dan Teknik Flotasi. Dari hasil penelitian ini dapat diketahui bahwa Teknik Mini-FLOTAC mendeteksi jenis telur cacing yang jauh lebih banyak dibandingkan Teknik Flotasi. Teknik Mini-FLOTAC juga memiliki prosedur yang jauh lebih sederhana dan cepat dengan hasil yang lebih baik.
Saran
Pembuatan saringan pada Fill-Flotac sebesar 250µm untuk pemeriksaan penyu
hijau (chelonia mydas) agar dapat menghasilkan hasil yang lebih jernih.
UCAPAN TERIMAKASIH
Penulis mengucapkan terima kasih utamanya kepada Turtle Conservation and Education Center yang telah memfasilitasi penelitian penulis. serta semua pihak yang telah membantu dalam penyelesaian penelitian ini.
DAFTAR PUSTAKA
Adnyana W, W Ladds P, Blair D. 2020. Prevalence and clinico-pathological studies on trematodiasis in marine turtles in Indonesia. Int. J. Sci. Res. Pub. 10(8): 274–295.
Aguirre AA, Lutz P. 2004. Marine turtles as sentinels of ecosystem health: Is fibropapillomatosis an indicator? Eco Health. 1(3): 275-283.
Alvarado-Villalobos MA, Cringoli G, Maurelli MP, Cambou A, Rinaldi L, Barbachano-Guerrero A, Guevara R, Chapman CA, Serio-Silva JC. 2017. Flotation techniques (FLOTAC and mini-FLOTAC) for detecting
gastrointestinal parasites in howler monkeys. Parasit Vectors. 10(1): 586.
Apsari IAP, Kencana GAAY, Mahardika GNK, Astawa NM, Kendran AAS, Suartha IN, Widyastuti S, Suardana IBK, Dewi IGAMK, Sudiarta IP. 2022. Ragam, prevalensi dan intensitas infeksi parasit pada sapi kelompok Tani Niti Sari Desa Baturiti Kabupaten Tabanan, Provinsi Bali. Bul. Vet. Udayana. 14(1): 11.
Ayres RM, Stott R, Lee DL, Mara DD, Silva SA. 1991. Comparison of techniques for the enumeration of human parasitic helminth eggs in treated wastewater. Environ. Technol. 12(7): 617–623.
Ayres RM, Stott R, Mara DD, Lee DL. 1992. Wastewater reuse in agriculture and the risk of intestinal nematode infection. Parasitol. Today. 8(1): 32– 35.
Bellantari, M, Wandia, IN, Dwinata, IM. 2021. Prevalence and identification of gastrointestinal wormon longtailed macaquein Pulaki Temple, Banyupoh, Gerokgak, Buleleng, Bali. Indon. Med. Vet. 10(1): 51–60.
Binoti E, Gomes MC, De Calais Junior A, Werneck MR, Martins IVF, Boeloni JN. 2016. Helminth fauna of Chelonia mydas (Linnaeus, 1758) in the south of Espírito Santo State in Brasil. Helminthologia. 53(2): 195–199.
Burke JB, Rodgers LJ. 1982. Gastric ulceration associated with larval nematodes (Anisakis sp. type 1) in pen reared green turtles (Chelonia mydas) from Torres strait. J. Wildlife Dis. 18(1): 41–46.
Fisher FMJ. 1960. On acanthocephala of turtles, with the description of Neoechinorhynchus emyditoides n. sp. J. Parasitol. 46(2):257–266.
Flint M, Eden PA, Limpus CJ, Owen H, Gaus C, Mills PC. 2015. Clinical and pathological findings in green turtles (Chelonia mydas) from Gladstone, Queensland: Investigations of a
stranding epidemic. Eco Hhealth. 12(2): 298–309
Flint M, Patterson-Kane JC, Limpus CJ, Mills PC. 2006. An epidemiological analysis of causes of disease and mortality. Eco Health. 7(1): 135–145.
Freitas JFT, Lent H. 1946. Porrocaecum sulcatum" (Rudolphi, 1819)
(Nematoda, Ascaroidea). Rev. Bras. Biol. 6: 235–238.
Gaspard P, Schwartzbrod J. 1993a. Determination of the parasitic contamination of irrigated vegetables. Water Sci. Technol. 27(7–8): 295–302.
Gaspard P, Schwartzbrod J. 1993b.
Irrigation with wastewater:
parasitological analysis of soil. Zbl. Hyg. 193: 513–520.
Greiner EC. 2013. 16 Parasites of marine turtles. In: Wyneken J, Lohmann KJ, Musick JA, editors. The biology of sea turtles, volume III. CRC Press. Pp. 428– 443.
Glazebrook JS, Campbell RS, Blair D. 1981. Pathological changes associated with cardiovascular trematodes (Digenea: Spirorchidae) in a green sea turtle Chelonia mydas (L). J. Comp. Pathol. 91(3): 361–368.
Glazerbook JS, Campbell RSF. 1990. A survey of the diseases of marine turtles in northern Australia. Dis. Aquat. Org. (1): 83–95.
Harvell CD, Kim K, Burkholder JM, Colwell RR, Epstein PR, Grimes DJ, Hofmann EE, Lipp EK, Osterhaus ADME, Overstreet RM, et al. 1999. Emerging marine diseases - climate links and anthropogenic factors. Science. 285: 1505–1510.
Hussein AH, Rashed SM, El-Hayawan, IA, Aly NSM, Abou Ouf, EA, Ali AT. 2017. Intestinal parasite infections and accuracy of direct thin and thick smear, formol-ether sedimentation, centrifugal flotation, and miniFLOTAC techniques among patients with gastrointestinal tract disorders from the Greater Cairo Region, Egypt. Am. J. Trop. Med. Hyg. 96(3): 589–594.
Jacobson ER, Homer BL, Stacy BA, Greiner EC, Szabo NJ, Chrisman CL, Origgi F, Coberley S, Foley AM, Landsberg JH, et al. 2006. Neurological disease in wild loggerhead sea turtles Caretta caretta. Dis. Aquat. Organ. 70(1–2): 139–154.
Janawi. 2009. Perkembangan Suhu Sarang Penetasan Buatan pada Penetasan Telur Penyu hijau (Chelonia mydas L.) di Pantai Pangumbahan Kabupatan Sukabumi. [Skripsi]. Fakultas Pertanian Universitas Suryakencana. Cianjur.
Landis JR, Koch GG. 1977. The measurement of observer agreement for categorical data. Biometrics.
33(1):159–174.
Lauckner G. 1985. Diseases of marine animals: introduction, Reptilia, Aves, Mammalia. Helgoland: Biologische
Anstalt Helgoland. 16(2) :553–626.
Limantara MAY. 2019. Prevalensi dan jenis cacing pada penyu yang
direhabilitasi di turtle conservation and education center (TCEC). [Skripsi]. Fakultas Kedokteran Hewan
Universitas Udayana. Jimbaran.
Marcer F, Cassini R, Parisotto N, Tessarin C, Marchiori E. 2022. A comparative study of Mini-FLOTAC with traditional coprological techniques in the analysis of cetacean fecal samples. Front. Vet. Sci. 9: 908486.
Mas-Coma S, Buchon P, Funatsu IR, Angles R, Mas-Bargues C, Artigas P, Valero MA, Bargues MD. 2020. Donkey fascioliasis within a one health control action: Transmission capacity, field epidemiology, and reservoir role in a human hyperendemic area. Front. Vet. Sci. 7: 5.
Murray D, Dailey GHB. 1987. Digenetic Trematodes as Possible Etiologic Agent for Fibropapillomas in Hawaiian Green Turtles (Chelonia mydas). Digenetic Trematodes. 1987: 1.
Permadi A, Adnyana IBW, Suartini IGAA. 2023. Coprological study of trematode infection in rehabilitated green turtles at the turtle conservation and education center Bali. Bul. Vet. Udayana. 15(5): 971-981.
Rude RA, Peeler JT, Risty NG. 1987. Comparison of diethylether and ethylacetate as extracting agents for recovery of Ascaris. J. Assoc. Off. Anal. Chem. 70: 1000–1001.
Santoro M, Greiner EC, Morales JA, Rodríguez-Ortíz B. 2006. Digenetic trematode community in nesting green sea turtles (Chelonia mydas) from Tortuguero National Park, Costa Rica. J. Parasitol. 92(6): 1202–1206.
Santoro M, Di Nocera F, Iaccarino D, Lawton SP, Cerrone A, Uberti BD, D’Amore M, Hochscheid S, Maffucci F, Galiero G. 2017. Pathology and molecular analysis of Hapalotrema mistroides (Digenea: Spirorchiidae) infecting a Mediterranean loggerhead turtle Caretta caretta. Dis. Aquat. Org. 124: 101-108.
Santoro M, Marchiori E, Iaccarino D, Uberti BD, Cassini R, Di Nocera F, Cerrone A, Galiero G, Marcer F. 2019. Epidemiology of Sulcascaris sulcata (Nematoda: Anisakidae) ulcerous
gastritis in the Mediterranean loggerhead sea turtle (Caretta caretta). Parasitol. Res. 118(5): 1457–1463.
Santoro M, Marchiori E, Cassini R, Drigo M, Iaccarino D, Di Nocera F, Degli Uberti B, De Luca G, D’Amore M, Centelleghe C. 2020. Epidemiology of blood flukes (Digenea: Spirorchiidae) in sea turtles from Tyrrhenian and Adriatic Seas, off Italy. Parasit Vectors. 13(1): 52.
Seminoff JA. 2002. Marine Turtle
Specialist Global Green Turtle
(Chelonia mydas) assessment for the IUCN Red List Programme. Laporan untuk Species Survival Commission.
Setiawan DK, Dwinata M, Oka IBM. 2014. Identifikasi jenis cacing nematoda pada saluran gastrointestinal kuda penarik cidomo di Kecamatan Selong, Lombok Timur. Indon. Med. Vet. 3(5): 351–358.
Teichmann A. 1986. Towards the methodology of quanti- tative determination of the occurrence of helminth in municipal wastewater. Appl. Parasitol. 27: 145–150.
Valero MA, Perez-Crespo I, Periago MV, Khoubbane M, Mas-Coma S. 2009. Fluke egg characteristics for the diagnosis of human and animal fascioliasis by Fasciola hepatica and F. gigantica. Acta Trop. 111(2):150–159.
Ward JR, Lafferty KD. 2004. The elusive baseline of marine disease: are diseases in ocean ecosystems increasing? PLoS Biol. 2(4): E120.
Work TM, Balazs GH, Schumacher JL, Amarisa M. 2005. Epizootiology of spirorchiid infection in green turtles (Chelonia mydas) in Hawaii. J. Parasitol. 91(4): 871–876.
Xavier RA. 2011. Análise da fauna parasitológica gastrointestinal de Chelonia mydas (Linnaeus, 1758) no litoral norte e médio do Rio Grande do
Sul, Brasil. Monografia (Trabalho de Zahriati F. 2017. Infeksi cacing tambang. Conclusão de Curso de Graduação em [Skripsi]. Universitas Muhammadiyah Ciências Biológicas). Imbé. Semarang. Semarang.
Tabel 1 Data penyu yang digunakan sebagai objek penelitian
|
No. Tagging CCL (Cm) CCW (Cm) |
Jenis Kelamin |
|
IDB 010206 71 67 IDB 010207 71 67 |
Betina |
|
ID 010209 98 91 ID 010210 91 79 |
Jantan |
|
ID 010211 101 90 IDB 010212 83 76 IDB 010213 74 73 ID 010214 78 69 |
Betina |
|
IDB 010215 83 76 |
Jantan |
|
ID 010216 80 76 IDB 010217 80 78 IDB 010218 78 69 IDB 010219 62 57 ID 010220 44 44 IDB 010221 49 44 ID 010222 57 54 IDB 010223 43 44 ID 010274 42 41 ID 010225 46 44 IDB 010227 50 48 IDB 010228 61 58 IDB 010229 46 42 IDB 010230 45 44 IDB 010232 46 44 ID 010233 45 43 IDB 010234 73 67 ID 010235 61 53 IDB 010236 55 51 IDB 010237 58 53 IDB 010238 67 62 |
Betina |
Keterangan: CCL: curve carapace length; CCW: curve carapace width
|
Tabel 2. Hasil pemeriksaaan telur cacing pada kedua teknik koposkropis | |||
|
No. Tagging |
Sampel |
Teknik Mini-Flotac |
Teknik Flotasi |
|
IDB 010206 |
1 |
Negatif | |
|
IDB 010207 |
2 |
Positif | |
|
ID 010209 |
3 | ||
|
ID 010210 |
4 | ||
|
ID 010211 |
5 | ||
|
IDB 010212 |
6 |
Negatif | |
|
IDB 010213 |
7 | ||
|
ID 010214 |
8 | ||
|
IDB 010215 |
9 | ||
|
ID 010216 |
10 |
Positif | |
|
IDB 010217 |
11 | ||
|
IDB 010218 |
12 | ||
|
IDB 010219 |
13 | ||
|
ID 010220 |
14 | ||
|
IDB 010221 |
15 |
Positif | |
|
ID 010222 |
16 | ||
|
IDB 010223 |
17 | ||
|
ID 010274 |
18 | ||
|
ID 010225 |
19 | ||
|
IDB 010227 |
20 | ||
|
IDB 010228 |
21 | ||
|
IDB 010229 |
22 | ||
|
IDB 010230 |
23 | ||
|
IDB 010232 |
24 | ||
|
ID 010233 |
25 | ||
|
IDB 010234 |
26 | ||
|
ID 010235 |
27 | ||
|
IDB 010236 |
28 | ||
|
IDB 010237 |
29 | ||
|
IDB 010238 |
30 |
Positif | |
Tabel 3. Hasil pemeriksaan telur cacing penyu hijau (Chelonia mydas) secara Teknik Mini-FLOTAC dan Teknik Flotasi
Teknik Mini-FLOTAC
Positif Negatif
|
Teknik Flotasi |
Positif |
4 |
0 |
|
Negatif |
26 |
0 | |
|
Total |
30 |
0 |

Gambar 1. Telur cacing tipe satu berwarna keemasan, A-C telur cacing berwarna kuning muda dan D dan E telur cacing berwarna kuning tua kecoklatan. Pembesaran 40x (Sumber: dokumentasi pribadi)
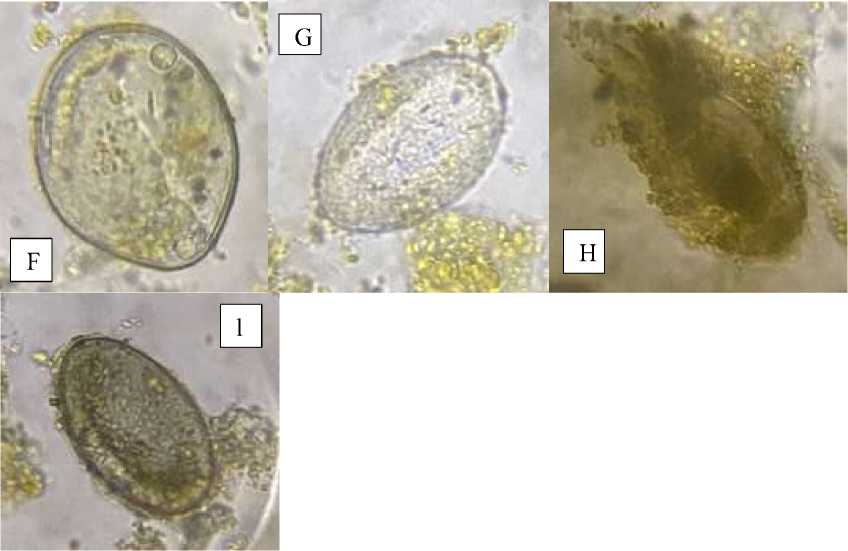
Gambar 2. Telur cacing tipe dua berwarna transparan, F-G telur cacing berwarna jernih dan HI telur cacing berwarna agak gelap. Pembesaran 40x. (Sumber: dokumentasi pribadi)
1278
Discussion and feedback