ADDITION OF VITAMIN E IN SEMENLIFE® DILUENT ON QUALITY AND SHELF LIFE OF SPERMATOZOA OF LANDRACE PIGS
on
Buletin Veteriner Udayana Volume 15 No. 6: 1170-1180
pISSN: 2085-2495; eISSN: 2477-2712 Desember 2023
Online pada: http://ojs.unud.ac.id/index.php/buletinvet https://doi.org/10.24843/bulvet.2023.v15.i06.p16
Terakreditasi Nasional Sinta 4, berdasarkan Keputusan Direktur Jenderal Pendidikan Tinggi, Riset, dan Teknologi No. 158/E/KPT/2021
Penambahan Vitamin E pada Pengencer SemenLife® Terhadap Kualitas dan Lama Simpan Spermatozoa Babi Landrace
(ADDITION OF VITAMIN E IN SEMENLIFE® DILUENT ON QUALITY AND SHELF LIFE OF SPERMATOZOA OF LANDRACE PIGS)
Gede Putra Sanjaya1, Wayan Bebas2*, Tjok Gde Oka Pemayun2, I Gusti Ngurah Bagus Trilaksana2, Desak Nyoman Dewi Indira Laksmi2, Ni Nyoman Werdi Susari3
-
1Dokter Hewan Mandiri, Jl. Raya Abianbase, Perumahan Eka Cakra, Badung, Bali, Indonesia, 80351;
-
2Laboratorium Reproduksi Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia, 80234;
-
3Laboratorium Anatomi Veteriner Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia, 80234.
*Corresponding author email: w_bebas@unud.ac.id
Abstrak
Inseminasi buatan pada babi di Indonesia masih menggunakan semen cair. Oleh karena itu dibutuhkan media spesifik dalam mempertahankan kualitas spermatozoa babi. Penelitian ini bertujuan untuk mengetahui efek penambahan vitamin E (a-tocopherol) pada pengencer SemenLife® (INTTEC) terhadap kualitas dan lama simpan spermatozoa babi landrace. Sampel yang digunakan berupa semen segar yang dikoleksi menggunakan teknik masas yang diambil dari UPTD. Balai Inseminasi Buatan Daerah, Perbibitan Ternak dan Hijauan Pakan/Lembaga Ternak Provinsi Bali. Total sebanyak 24 sampel yang terdiri dari 12 sampel pada pengencer SemenLife® (INTTEC) dan 12 sampel pada pengencer SemenLife® (INTTEC) + vitamin E 400 µg/ml disimpan pada suhu 15-18oC. Pengamatan kualitas spermatozoa (viabilitas dan motilitas) dan lama simpan dilakukan selama 120 jam dengan pengamatan setiap 24 jam terhadap kualitas spermatozoa di bawah mikroskop, kemudian dilakukan pengujian fragmentasi DNA menggunakan Pocrine 8-Hydroxy-desoxyguanosine ELISA Kit. Hasil grafik uji Duncan menunjukkan bahwa, penambahan vitamin E 400 µg/ml memberikan efek yang nyata terhadap kualitas spermatozoa, khususnya pada motilitas dipertahankan di jam ke-48 dan fragmentasi DNA terendah terjadi di jam ke-72. Selanjutnya, penambahan vitamin E tidak mampu memperpanjang lama simpan spermatozoa babi landrace di dalam pengencer. Dimana, terjadi penurunan motilitas dan kenaikan fragmentasi DNA yaitu masing-masing di jam ke-72 dan ke-96, pada viabilitas penurunan terjadi secara berkala dari jam ke-0 sampai ke-120. Dari hasil uji kualitas dan lama simpan yang didapat, selanjutnya spermatozoa dapat diuji dengan melakukan uji fertilitas untuk mengetahui apakah dengan hasil yang didapat mampu meningkatkan litter size.
Kata kunci: Fragmentasi DNA; motilitas; viabilitas; vitamin E
Abstract
Artificial insemination in pigs in Indonesia still uses liquid semen. Therefore, specific media are needed to maintain the quality of pig spermatozoa. This study aims to determine the effect of adding vitamin E (a-tocopherol) to Semenlife® (INTTEC) diluent on the quality and shelf life of spermatozoa of landrace pigs. The sample used was fresh semen which was collected using a mass technique taken from the UPTD. Regional Artificial Insemination Center, Livestock Breeding and Forage/Livestock Institute of Bali Province. A total of 24 samples consisting of 12 samples in the SemenLife® (INTTEC) diluent and 12 samples in the SemenLife® (INTTEC) diluent + vitamin E 400 µg/ml were stored at 15-18oC. Observation of spermatozoa quality (viability and motility) and storage time was carried out for 120 hours with observations of spermatozoa quality under a microscope every 24 hours, then DNA fragmentation was tested using the Pocrine 8-Hydroxy-desoxyguanosine ELISA Kit. The graph results
of Duncan's test showed that the addition of 400 µg/ml vitamin E had a significant effect on the quality of spermatozoa, especially in terms of motility which was maintained at 48 hours and the lowest DNA fragmentation occurred at 72 hours. Furthermore, the addition of vitamin E was not able to extend the shelf life of landrace pig spermatozoa in diluent. Where, there was a decrease in motility and an increase in DNA fragmentation, respectively at 72 and 96 hours, in viability the decrease occurred periodically from the 0 hour to 120 hours. From the results of the quality and shelf-life tests obtained, spermatozoa can then be tested by conducting a fertility test to find out whether the results obtained can increase litter size.
Keywords: DNA fragmentation; motility; viability; vitamin E
PENDAHULUAN
Babi merupakan salah satu komoditas ternak penghasil daging yang potensial untuk dikembangkan karena sifat dan kemampuannya yang menguntungkan, antara lain laju pertumbuhan yang cepat, litter size yang tinggi, efisiensi ransum yang baik (75-80%), dan rasio karkas yang tinggi (65-80%), dan limbah yang dihasilkan dapat dimanfaatkan sebagai pupuk, sumber energi biogas dan pakan ikan (Aritonang, 1993). Babi juga sering digunakan dalam berbagai kegiatan upacara keagamaan, sehingga tidak heran jika babi merupakan komoditas ternak yang menggiurkan dan sudah lama dikembangkan oleh masyarakat Bali (Budaarsa et al., 2016). Tingginya penggunaan daging babi dalam kehidupan masyarakat Bali berdampak pada tingginya permintaan daging babi, sehingga perlu adanya keseimbangan antara permintaan daging babi dengan populasi babi. Peningkatan populasi babi sangat dibutuhkan untuk mencapai keseimbangan ini. Peningkatan populasi babi dapat dilakukan dengan mengoptimalkan efisiensi reproduksinya, salah satunya dengan melakukan kawin suntik atau inseminasi buatan (IB) dengan semen pejantan unggul (Sumardani et al., 2019).
Pelaksanaan IB pada babi di Indonesia masih menggunakan semen cair, dimana pada pengolahan semen cair harus memperhatikan berbagai aspek seperti komposisi bahan pengencer dan penyimpanan semen. Pengencer semen harus dapat memenuhi kebutuhan nutrisi dan dapat mempertahankan fungsi fisiologi spermatozoa selama penyimpanan
(Johnson et al., 2000). Oleh karena itu, untuk meningkatkan jumlah dan kualitas semen yang digunakan dalam inseminasi buatan, maka diperlukan berbagai cara untuk mempertahankan kualitas semen sehingga dapat digunakan untuk menginseminasi ternak betina dalam jumlah yang banyak (Rizal, 2020). Salah satu bahan pengencer untuk semen babi yang tersedia di pasaran adalah SemenLife® (INTTEC). SemenLife® (INTTEC) merupakan bahan pengencer yang diklaim berdaya simpan sedang/medium-term dengan daya tahan 4-7 hari. Pengencer SemenLife® (INTTEC) mengandung glukosa, EDTA, dan sodium bikarbonat. Glukosa berfungsi sebagai sumber energi sel (Yulnawati et al., 2010). EDTA berfungsi untuk menahan aktivitas kalsium sebagai media dalam proses kapasitasi spermatozoa dan reaksi akrosom, sedangkan sodium bikarbonat berperan sebagai penyangga yang dapat menjaga kestabilan pH untuk kelangsungan hidup dari spermatozoa. Dalam proses penyimpanan semen pada suhu dingin, semen akan mengalami peristiwa kejutan dingin (cool shock) dan serangan dari radikal bebas yang dapat mengakibatkan penurunan terhadap kualitas semen berupa penurunan motilitas dan daya hidup spermatozoa.
Penambahan antioksidan berupa vitamin E juga dapat dilakukan untuk menanggulangi serangan radikal bebas. Vitamin E (α-tocopherol) merupakan antioksidan yang larut dalam lemak yang dapat menghentikan lipid peroksidase pada membran plasma selama proses pendinginan (Breininger et al., 2004).
Vitamin E mempunyai kemampuan memutus rantai reaksi peroksidase atau menangkap radikal bebas dengan cara bereaksi secara langsung dengan berbagai radikal peroksi organik, sehingga mencegah terjadinya reaksi berantai dan dapat menekan terjadinya kerusakan peroksidatif yang berpengaruh terhadap kualitas semen babi (Bebas et al., 2016). Berdasarkan informasi diatas, meskipun pengencer SemenLife® (INTTEC) dapat ditemukan dipasaran, namun informasi tentang pengencer ini masih sangat sedikit, untuk itu penelitian ini dilakukan untuk mengetahui penambahan vitamin E pada pengencer SemenLife® ® (INTTEC)
terhadap kualitas dan lama simpan spermatozoa babi landrace”.
METODE PENELITIAN
Rancangan Penelitian
Penelitian ini merupakan penelitian eksperimental laboratorium dengan desain penelitian Rancangan Acak Lengkap (RAL) pola faktorial. Semen babi yang didapatkan kemudian dibagi menjadi tiga kelompok yaitu, K0 (sebagai kontrol: semen babi dengan pengencer SemenLife® (INTTEC)), K1 (semen babi dengan pengencer SemenLife® (INTTEC) + 400 μg/ml vitamin E (Santa-E®)). Semen yang telah diencerkan disimpan pada suhu 15-18oC, kemudian dilakukan pengamatan terhadap kualitas semen dengan kelipatan 24 jam sebagai faktor selama 120 jam.
Persiapan Bahan Pengencer
Pengencer SemenLife® (INTTEC) 60 gram dilarutkan kedalam 1000 ml / 1 liter aquabides kemudian ditambahkan vitamin E 400 µg/ml lalu dimasukan kedalam water bath dengan suhu 37oC agar homogen. Penghitungan jumlah pengencer yang digunakan berdasarkan standar motilitas semen yang digunakan oleh UPTD. Balai Inseminasi Buatan Daerah, Perbibitan Ternak dan Hijauan Pakan/Lembaga Ternak Provinsi Bali, Baturiti, Tabanan.
Volume Tampung X Jumlah Perbandingan
Pengamatan Viabilitas Spermatozoa
Pengamatan terhadap daya hidup spermatozoa dilakukan dengan
menggunakan pewarnaan eosin negrosin sitrat. Sampel diambil satu tetes (0,05 ml) lalu diteteskan pada gelas objek, kemudian ditambahkan eosin negrosin sitrat dua tetes. Selanjutnya, dibuat preparat hapusan dan diangin-anginkan sampai kering, kemudian preparat diperiksa dibawah mikroskop dengan pembesaran 400x untuk menghitung jumlah spermatozoa yang masih utuh beserta membran plasma utuhnya. Penilaian dilakukan dengan sistem skor 0% sampai 100% (Bebas et al., 2016). Spermatozoa hidup ditandai dengan kepala putih, sedangkan yang mati ditandai dengan kepala berwarna merah (Kaka, 2020). Berdasarkan penelitian oleh Mariana dan Alimuddin (2020), penilaian terhadap daya hidup spermatozoa dapat dihitung menggunakan rumus sebagai berikut:
Jumlah spermatozoa hidup
Jumlah spermatozoa yang dihitung × 100%
Pengamatan Motilitas Spermatozoa
Pengamatan terhadap motilitas spermatozoa dilakukan dengan meneteskan semen di atas gelas objek, kemudian diamati di bawah mikroskop cahaya dengan perbesaran 400x (Mariana dan Alimuddin, 2020). Penilaian motilitas dilakukan secara subjektif dengan melihat perbandingan gerakan progresif spermatozoa dari 5 lapangan pandang dengan nilai 0-100% (Kaka, 2020). Berdasarkan penelitian oleh Mariana dan Alimuddin (2020), penilaian terhadap motilitas spermatozoa dapat dihitung menggunakan rumus sebagai berikut:
Jumlah spermatozoa motil
Jumlah spermatozoa yang dihitung × 100%
Pengamatan Fragmentasi DNA
Fragmentasi DNA spermatozoa dapat diamati melalui pemeriksaan kadar 8-OHdG yang terdapat didalam larutan pengencer. Selanjutnya, pemeriksaan 8-
OhdG dapat menggunakan Pocrine 8-Hydroxy-desoxyguanosine ELISA Kit (Nakajima et al., 2012).
Analisis Data
Data hasil penelitian yang didapat selanjutnya dianalisis menggunakan uji varian, kemudian dilanjutkan dengan uji statistik menggunakan uji Duncan.
HASIL DAN PEMBAHASAN
Pengamatan Makroskopis dan Mikroskopis Semen Segar
Pengamatan terhadap kualitas semen dilakukan secara makroskopis dan mikroskopis. Berdasarkan data pada Tabel 1. Pengamatan kualitas semen secara makroskopis didapatkan hasil yaitu volume semen sebesar 300 ml, hal ini sesuai dengan pernyataan dari Shipley (1999); Garner dan Hafez (2000) yang menyatakan bahwa semen babi bersifat voluminous, dengan volume ejakulat mencapai 100- 500 ml dengan konsentrasi spermatozoa yang rendah yaitu 200-300x106 sel/ml. Warna semen yang didapat yaitu putih keruh susu dengan aroma khas babi, dimana warna semen dan bau semen ternak tersebut masih normal (Gadea, 2003). Selanjutnya, konsistenis yang didapat yaitu encer dengan pH 7,5, dimana menurut Feka et al. (2016), konsistensi encer merupakan konsistensi yang normal dan menurut Garner dan Hafes (2000), pH normal semen babi adalah 7,3 – 7,8. Sedangkan, pengamatan kualitas semen secara mikroskopis didapatkan hasil yaitu motilitas semen sebesar 75%, dimana hasil ini masih memenuhi standar motilitas yaitu ≥ 60 (Johnson et al., 2000; Gadea 2003; Robert 2006). Selanjutnya, viabilitas semen sebesar 95% dan abnormalitas semen <20%. Spermatozoa masih layak digunakan apabila abnormalitasnya masih berada dibawah 20%. Hal ini didukung oleh Dethan et al., (2010) bahwa kelainan morfologis biasanya tidak dihubungkan dengan penurunan fertilitas jika proporsi abnormalitas spermatozoa tidak melampaui 20%.
Viabilitas Spermatozoa
Pengamatan terhadap viabilitas spermatozoa babi landrace pada SemenLife® (INTTEC) dan SemenLife® (INTTEC) + vitamin E 400 μg/ml yang disimpan pada suhu 15-18oC dengan pengamatan setiap 24 jam selama 120 jam dapat dilihat pada grafik uji duncan (Gambar 1). Berdasarkan grafik pada Gambar 1 menunjukkan bawah, penambahan vitamin E dosis 400 μg/ml tidak mempengaruhi viabilitas spermatozoa, hal ini dapat dilihat bahwa viabilitas terendah disetiap jam terjadi pada bahan pengencer SemenLife® (INTTEC) + vitamin E 400 μg/ml. Begitupula dengan lama simpan, dimana penambahan vitamin E tidak mampu memperpanjang lama simpan spermatozoa di dalam bahan pengencer, hal ini dapat dilihat bahwa terjadi penurunan seiring lamanya waktu penyimpanan.
Ketidakmampuan vitamin E dalam mempertahankan viabilitas spermatozoa kemungkinan disebabkan oleh dosis yang kurang dan jenis vitamin E yang digunakan. Hartono (2008) menyatakan bahwa, penambahan vitamin E pada dosis 500 μg/ml memberikan hasil yang terbaik dalam mempertahankan daya hidup dan motilitas spermatozoa pada kambing boer. Selanjutnya, terdapat dua jenis vitamin E yaitu yang bersifat alami dan sintetis. Vitamin E yang bersifat alami ditandai dengan kandungan berupa d-a-tocopherol, sedangkan yang sintetis berupa dl-a-tocopherol. Pada penelitian ini, vitamin E yang digunakan adalah vitamin yang bersifat sintetis, sehingga penggunaan vitamin E yang bersifat alami dapat digunakan untuk menunjukkan hasil yang lebih efektif.
Selain itu, faktor lain penyebab terjadinya penurunan viabilitas spermatozoa selama penyimpanan dapat disebabkan oleh meningkatnya jumlah spermatozoa rusak dan mati akibat kekurangan energi (Solihati et al., 2008 dalam Nahak et al., 2022). Pada saat proses pengenceran dan penyimpanan, semen babi
sangat peka terhadap perubahan temperatur karena lapisan lipid pada membran spermatozoa babi sangat tipis sehingga spermatozoa tidak tahan pada suhu rendah. Metabolisme spermatozoa selama penyimpanan akan menghasilkan reaksi antara spermatozoa dengan oksigen yang akan menyebabkan terbentuknya radikal bebas. Radikal bebas yang terbentuk akan memicu terjadinya peroksidasi lemak membran sehingga akan menurunkan daya hidup dan motilitas spermatozoa (Sikka, 1996 dalam Nahak et al., 2022).
Motilitas Spermatozoa
Pengamatan terhadap motilitas spermatozoa babi landrace pada SemenLife® (INTTEC) dan SemenLife® (INTTEC) + vitamin E 400 μg/ml yang disimpan pada suhu 15-18oC dengan pengamatan setiap 24 jam selama 120 jam dapat dilihat pada grafik uji duncan (Gambar 2). Berdasarkan Gambar 2, penambahan vitamin E 400 μg/ml mampu meningkatkan motilitas spermatozoa, dimana persentase motilitas spermatozoa berhasil dipertahankan pada pengencer SemenLife® (INTTEC) + vitamin E 400 μg/ml di jam ke-48. Selanjutnya, penurunan kembali terjadi secara berkala dijam-jam berikutnya. Selain itu, pada Gambar 2 juga menunjukkan bahwa penambahan vitamin E tidak mampu memperpanjang lama simpan spermatozoa di dalam bahan pengencer, dimana motilitas mengalami penurunan di jam-jam berikutnya.
Dipertahankannya motilitas spermatozoa pada jam ke-48 kemungkinan disebabkan oleh mulai menurunnya fungsi dari bahan-bahan aktif yang terkandung di dalam bahan pengencer, mengingat SemenLife® (INTTEC) memiliki daya simpan medium-term/sedang, sehingga penambahan vitamin E dengan dosis 400 μg/ml pada SemenLife® (INTTEC) mulai bekerja untuk menopang motilitas spermatozoa pada jam ke-48. Hal ini juga dapat dilihat bahwa pada jam-jam berikutnya, motilitas spermatozoa kembali menurun, sehingga kemungkinan
disebabkan oleh sudah berkurangnya efektivitas dari vitamin E.
Penelitian yang sama pada pengencer yang berbeda juga telah dilakukan oleh Bebas et al. (2016), dimana penambahan vitamin E dengan dosis berjenjang yaitu 300 μg/ml, 400 μg/ml, dan 500 μg/ml ditambahkan ke dalam pengencer BTS® (Minitube). Hasil pengamatan pada motilitas spermatozoa babi landrace dari ketiga perlakuan tersebut di jam ke-48 menunjukkan bahwa vitamin E dengan dosis 400 μg/ml dan 500 μg/ml menunjukkan persentasi yang baik yaitu berturut-turut 76,00 ± 2,366% dan 76,00 ± 1,673%. Vitamin E (α-tocopherol) merupakan antioksidan yang larut dalam lemak yang dapat menghentikan lipid peroksida membran plasma selama proses pendinginan (Breininger et al., 2004). Vitamin E mempunyai kemampuan memutus rantai reaksi peroksidasi atau menangkap radikal bebas dengan cara bereaksi secara langsung dengan berbagai radikal peroksi organik sehingga mencegah terjadinya reaksi berantai dan dapat menekan terjadinya kerusakan peroksidatif yang berpengaruh terhadap kualitas semen babi. Sehingga, penambahan vitamin E mampu mempertahankan motilitas dari spermatozoa, dimana menurut Bebas et al. (2016) menyatakan bahwa penambahan 400 – 500 μg/ml vitamin E yang ditambahkan ke dalam pengencer mampu mempertahankan motilitas spermatozoa karena terhambatnya proses peroksidasi lipid pada membran plasma sel spermatozoa. Selain itu, menurut Hartono (2008) menyatakan bahwa, penambahan vitamin E pada dosis 500 μg/ml memberikan hasil yang terbaik dalam mempertahankan daya hidup dan motilitas spermatozoa pada kambing boer.
Fragmentasi DNA Spermatozoa
Pengamatan terhadap fragmentasi DNA spermatozoa babi landrace pada pengencer SemenLife® (INTTEC) dan SemenLife® (INTTEC) + vitamin E 400 μg/ml yang disimpan pada suhu 15-18oC yang diamati setiap 24 jam selama 120 jam dapat dilihat
pada grafik uji duncan (Gambar 3). Berdasarkan Gambar 3, penambahan vitamin E 400 μg/ml pada pengencer SemenLife® (INTTEC) memberikan pengaruh terhadap fragmentasi DNA, dimana dari jam ke-0 sampai ke-72 fragmentasi DNA terendah terdapat pada pada SemenLife® (INTTEC) + vitamin E 400 μg/ml, dan mengalami kenaikan di jam ke-96 yang menunjukkan bahwa penambahan vitamin E tidak mampu memperpanjang lama simpan spermatozoa di dalam bahan pengencer. Hal ini juga selaras dengan hasil motilitas, dimana motilitas tertinggi berhasil dipertahankan pada penambahan vitamin E 400 μg/ml pada jam ke-48. Hal ini kemungkinan disebabkan oleh vitamin E yang membutuhkan waktu agar dapat berfungsi secara maksimal dalam melindugi membran sel spermatozoa dari aktivitas reactive oxygen species (ROS) yang dapat menyebabkan peroksidasi lipid.
Kerusakan DNA spermatozoa yang terjadi selama penyimpanan dalam suhu dingin disebabkan oleh peningkatan kadar ROS. Selama proses penyimpanan spermatozoa pada suhu dingin, aktivitas metabolisme tetap aktif yang secara fisiologis menghasilkan senyawa oksigen reaktif, oksigen berperan penting dalam proses metabolisme dengan menghasilkan energi di dalam mitokondria melalui reaksi redoks, yaitu mengoksidasi molekul sehingga menghasilkan Adenosine Tri Phosphate (ATP) sebagai sumber energi (Bebas et al., 2022). Selama proses ini, oksigen memiliki beberapa turunan radikal bebas atau ROS (Juan et al., 2021; Martemucci et al., 2022). Radikal bebas sangat berbahaya bagi kelangsungan hidup spermatozoa karena memiliki sifat yang sangat reaktif untuk menangkap elektron. Mereka akan menyerang dan mengumpulkan elektron dari asam lemak tak jenuh yang membentuk fosfolipid membran plasma sel. Reaksi autokatalitik (reaksi berantai) pada akhirnya dapat merusak semua fosfolipid membran plasma spermatozoa bila tidak dicegah (Prihantoko
et al., 2020). Lebih lanjut dijelaskan oleh Chatterjee et al. (2001) bahwa, ROS terbentuk dari aktivitas metabiolisme sel mulai pada saat penampungan semen, pengenceran, dan penyimpanan. ROS sangat berbahaya bagi kehidupan sel karena mampu bereaksi dengan fosfolipid penyusun membran plasma sel sehingga mengakibatkan hilangnya integritas membran, inaktivasi enzim, kerusakan struktur DNA, dan kematian sel (Hsieh et al., 2006). Hasil produk ROS seperti peroksida lipid akan merusak struktur dan fungsi membran dengan mengacaukan struktur fosfolipid dan fluiditas membran (Aitken, 1995).
Peningkatan Ca2+ ekstraseluer dan intraseluler ditambah adanya peroksida lipid pada membran fosfolipid akhirnya mengubah struktur dan terdegradasinya membran (Awda, 2009). Terdegradasinya membran menyebabkan kerusakan komponen sel yang penting seperti DNA dan protein. Hasil dari peroksidasi lipid ini dapat diuji dengan melakukan DNA oxidation quantification using an 8‐OHdG immunodetection assay, dimana 8-OHdG (8‐hydroxy‐2′‐deoxyguanosine) merupakan salah satu marker terjadinya oksidasi pada DNA spermatozoa (Meneses et al., 2019). Pada oksidasi DNA, nukleotida guanin adalah nukleotida yang rawan terhadap oksidasi ROS, hasil oksidasi guanin adalah 8-hydroksy-2'-deoxyguanosine (8-OH-dG). Dengan teroksidasinya guanin pada untai DNA, maka untai DNA akan kehilangan nukleotida guanin. Jumlah guanin yang hilang tergantung kadar ROS, hal ini menyebabkan keadaan yang disebut mutasi DNA yang selanjutnya dapat menyebabkan kerusakan mtDNA dan nDNA. Kerusakan pada nDNA akan mengganggu proses pembelahan sel sedangkan kerusakan mtDNA mengganggu rantai respirasi sel yang dapat menurunkan energi sel (Hofer, 2001).
Kerusakan DNA spermatozoa sangat berpengaruh terhadap fertilisasi, perkembangan preimplantasi dan perkembangan embrio (Lewis dan Aitken,
2005). Tingkat kerusakan DNA spermatozoa sangat berpengaruh terhadap perkembangan embrio, dimana kerusakan DNA spermatozoa dapat menyebabkan abortus walaupun terjadi fertilisasi (Vassilev et al., 2005) sehingga kasus prolong estrus cycle sering terjadi pada sapi (Nakao et al., 1983). Penambahan vitamin E (α-tocopherol) pada pengencer SemenLife bertujuan untuk melindungi spermatozoa dari fragmentasi DNA, mengingat vitamin E merupakan antioksidan yang larut dalam lemak yang dapat menghentikan lipid peroksida membran plasma selama proses pendinginan (Breininger et al., 2004). Vitamin E mempunyai kemampuan memutus rantai reaksi peroksidasi atau menangkap radikal bebas dengan cara bereaksi secara langsung dengan berbagai radikal peroksi organik sehingga mencegah terjadinya reaksi berantai dan dapat menekan terjadinya kerusakan peroksidatif yang berpengaruh terhadap kualitas semen babi.
Berdasarkan penelitian oleh Bebas dan Agustina (2022) pada semen beku ayam hutan (Gallus varius) dengan penambahan antioksidan berupa astaxanthin, dimana antioksidan ini mampu mempertahankan bentuk membran plasma agar tetap utuh. Penambahan astaxanthin sama halnya dengan penambahan vitamin E yaitu untuk mengatasi peroksidasi lipid membran sel selama proses penyimpanan pada suhu dingin dan pada saat post-thawing (Lee dan Kim 2018: Guo et al., 2021). Astaxanthin saat ini merupakan antioksidan yang paling ampuh untuk memerangi radikal bebas dengan memutuskan O2-, yang bereaksi langsung dengan radikal peroksil (Dose et al., 2016; Brotosudarmo et al., 2020). Kemampuan esterifikasi dan aktivitas antioksidan lebih tinggi dan lebih polar karena struktur molekulnya yang tidak biasa, yang mengandung dua gugus karbonil, dua gugus hidroksi, dan sebelas ikatan rangkap terkonjugasi (Pérez-Gálvez et al., 2020; Pereira et al., 2021). Selain itu, astaxanthin dapat melindungi dan melawan
peroksidasi membran lipid, seperti asam lemak tak jenuh ganda dan protein, fragmentasi DNA, serta efek sinar ultraviolet. Ini memainkan peran penting dalam proses sistem kekebalan tubuh (Bebas dan Gorda 2020; Pereira et al., 2021). Penelitian lain yang serupa oleh Bebas et al., (2022) pada kualitas spermatozoa anjing Kintamani pada pengencer kuning telur + air kelapa yang ditambahkan daun moringa dan esktrak wortel, menunjukkan bahwa antioksidan seperti vitamin E yang terdapat pada wortel dan daun moringa mampu menjaga kualitas semen selama penyimpanan.
SIMPULAN DAN SARAN
Simpulan
Hasil penelitian menunjukkan bahwa penambahan vitamin E 400 μg/ml ke dalam SemenLife® (INTTEC) mampu mempertahankan kualitas spermatozoa babi landrace, khususnya pada motilitas dan fragmentasi DNA masing-masing dijam ke-48 dan dijam ke-72. Selanjutnya, Penambahan vitamin E 400 μg/ml ke dalam SemenLife® (INTTEC) tidak memberikan efek perpanjangan terhadap lama simpan pada spermatozoa babi landrace.
Saran
Perlu dilakukan penelitian lebih lanjut dengan melakukan uji fertilitas untuk mengetahui apakah dengan hasil motilitas, viabilitas, dan fragmentasi DNA yang didapat mampu menyebabkan kebuntingan dan kenaikan dalam liter size.
UCAPAN TERIMAKASIH
Penulis mengucapkan terima kasih kepada UPTD. Balai Inseminasi Buatan Daerah, Perbibitan Ternak dan Hijauan Pakan/Lembaga Ternak Provinsi Bali, Baturiti, Tabanan, yang telah membantu dalam memfasilitasi penelitian dalam proses pengambilan sampel. Ucapan terima kasih juga ditujukan kepada semua pihak yang telah mendukung sehingga penelitian dapat terselesaikan dengan baik.
DAFTAR PUSTAKA
Aitken RJ. 1995. Free Radicals, Lipid Peroxidation and Sperm Function. Reprod. Fertil Dev. 7: 659-668.
Aritonang. 1993. Beternak babi. Penerbit Mutiara, Jakarta.
Awda, Basim J, Mackenzie-Bel Ml, Marry M, Buhr. 2009. Reactive Oxygen Species and Boar Sperm Function. Biol. Reprod. 8: 553-561.
Bebas W, Agustina KK. 2022. Short Communication: The use of lactoseastaxanthin to maintain the quality of Green junglefowl frozen semen. Biodiversitas. 23(11): 5759-5764.
Bebas W, Gorda IW. 2020. The best level of glycerol and dimethylsulfoxide cryoprotectant in the astaxanthin phosphate duck egg yolk extender on the quality of boar frozen semen. J. Vet. 21(1): 115-123.
Bebas W, Geovany LB, Made KB. 2016. Penambahan Vitamin E Pada Pengencer BTS® Terhadap Daya Hidup Dan Motilitas Spermatozoa Babi Landrace Pada Penyimpanan 15° C. Bul. Vet. Udayana. 8(1): 1-7.
Breininger E, Beorlegui NB, OFlaherty CM. 2004. Alpha-tocopherol improves biochemical and dynamic parameters in cryopreserved boar semen.
Theriogenol. 63: 2126- 2135.
Brotosudarmo THP, Limantara L, Setiyono E, Heriyanto. 2020. Structures of astaxanthin and their consequences for therapeutic application. Int. J. Food Sci. 2020: 2156582.
Budaarsa K, Puger AW, Suasta IM. 2016. Ekplorasi komposisi pakan tradisional babi bali. Maj. Ilmiah Pet. 19(1): 6-11.
Chatterjee S, De Lamirande, Gagnon E. 2001. Cryopreservation alters
membrane sulfhydryl status of bull spermatozoa: protection by oxidized glutathione. Mol. Reprod. Dev. 60: 498506.
Dethan AA, Kustono, Hartadi H. 2010. Kualitas dan Kuantitas Sperma Kambing Bligon Jantan yang Diberi Pakan Rumput Gajah dengan
Suplementasi Tepung Darah. Bul. Pet. 34(3): 145-153.
Dose J, Matsugo S, Yokokawa H, Koshida Y, Okazaki S, Seidel U, Eggersdorfer M, Rimbach G, Esatbeyoglu T. 2016. Free radical scavenging and cellular antioxidant properties of astaxanthin. Int. J. Mol. Sci. 17(1): 103.
Feka WV, Dethan AA, Beyleto VY. 2016. Pengaruh Lama Penyimpanan terhadap Viabilitas dan pH Semen Babi Landrace yang Diencerkan
Menggunakan Bahan Pengencer Sitrat Kuning Telur. JAS. 1(3): 34-35.
Gadea J. 2003. Semen extenders used in the artificial insemination of swine. Spanish J of Agri Research. 1(2): 17-27.
Garner DL, Hafez ESE. 2000. Spermatozoa and seminal plasma. In: Hafez B. Hafez ESE, editor. Reproduction in Farm Animals. 7th Ed. Philadelphia (US): Lippincott Williams and Wilkins. Pp. 96-109.
Guo HT, Wang JR, Sun LZ, Jin XH, Shi XY, Lin JY, Yue SL, Zhou JB. 2021. Effects of astaxanthin on plasma membrane function and fertility of boar sperm during cryopreservation. Theriogenol. 164: 58- 64.
Hartono M. 2008. Optimalisasi penambahan vitamin E dalam pengencer sitrat kuning telur untuk mempertahankan kualitas semen kambing boer. J. Indon. Trop. Anim. Agric. 33: 1-9.
Hofer T. 2001. Method Development of Analysis of 8-oxodG as a Biomarker for Oxidative Stress. Departemen Biosains: Institut Karolinska.
Hsieh YY, Chang CC, Lin CS. 2006. Seminal malondialdehyde
concentration but not glutathione
peroxidase activity is negatively
correlated with seminal concentration and motility. Int. J. Biol. Sci. 2: 23-29.
Johnson LA, Weitze KF, Fiser P, Maxwell WMC. 2000. Storage of boar semen. J. Anim. Sci. 62: 143-172.
Juan CA, Pérez de la Lastra JM, Plou FJ and Pérez-Lebeña E, 2021. The chemistry
of reactive oxygen species (ROS) Revisited: outlining their role in
biological macromolecules (DNA, Lipids and Proteins) and induced pathologies. Int. J. Mol. Sci. 22(9): 4642.
Kaka A. 2020. Karakteristik dan Daya Fertilitas Spermatozoa Babi Peranakan Landrace. J. Pet. Indon. 22(3): 277283.
Lee E, Kim D. 2018. Effects of astaxanthin on miniature pig sperm
cryopreservation. Bio. Med. Res. Int. 2018: 6784591.
Lewis SE, Aitken RJ. 2005. DNA damage to spermatozoa has impacts on fertilization and pregnancy. Cell Tissue Res. 322(1): 33-41.
Mariana Y dan Alimuddin. 2020. Penambahan Level Ekstrak Wortel (Daucus carota) pada Pengencer Andromed Dalam Mempertahankan Kualitas Spermatozoa Sapi Bali pada Suhu 5OC. JSTL. 6(2): 241-248.
Martemucci G, Costagliola C, Mariano M, D’andrea L, Napolitano P and D’Alessandro AG, 2022. Free radical properties, source and targets, antioxidant consumption and health. Oxygen. 2(2): 48-78.
Meneses PJS, Alejandro JC, Vidal M, Ana JS, José JG, María RFS. 2019. Ovine sperm DNA oxidation quantification using an 8‐OHdG immunodetection assay. Repord. Dom. Anim. 54 (4):59-64.
Nahak PL, Agustinus AD, Kristofus WK. Kualitas Semen Babi Landrace Dalam Pengencer Semen Sitrat-Kuning Telur yang Ditambah Glukosa Dengan Konsentrasi Berbeda. J. Anim. Sci. 7(1): 12-15.
Nakajima H, Unoda K, Ito T, Kitaoka H, Kimura F, Hanafusa T. 2012. The relation of urinary 8-OHdG, a marker of oxidative stress to dna, and clinical outcomes for ischemic stroke. Open Neurol. J. 6: 51-57.
Nakao T, Sugihashi A, Kawata K, Saga N, Tsunoda N. 1983. Milk progesterone
levels in cows with normal or prolonged estrous cycles, referenced to an early pregnancy diagnosis. Japanese J. Vet. Sci. 45(4): 495-499.
Pereira CPM, Souza ACR, Vasconcelos AR, Prado PS, Name JJ. 2021. Antioxidant and anti-inflammatory mechanisms of action of astaxanthin in cardiovascular diseases (Review). Int. J. Mol. Med. 47: 37-48.
Pérez-Gálvez A, Viera I, Roca M. 2020. Carotenoids and chlorophylls as antioxidants. Antioxidants 9(6): 505.
Prihantoko KD, Yuliastuti F, Haniarti H, Kusumawati A, Widayati DT, Budiyanto A. 2020. The effect of genistein on the plasma membrane integrity of frozen ongole grade bull semen based on skim milk-soy lecithin extender. IOP Conf. Series: Earth Environ. Sci. 465: 012054.
Rizal M. 2020. Diseminasi teknologi inseminasi buatan menggunakan semen kambing peranakan etawa (PE) dengan pengencer air kelapa muda dan kuning telur di Kecamatan Bati Bati Kabupaten Tanah Laut Kalimantan. Panrita Abadi. 1(2): 56-61.
Robertis ED, Robertis EM. 1979. Cell and Moleculer Biology. Philadelphia: Saydesr College.
Shipley CF. 1999. Breeding sounders examination of the boar. Swine Health Prod. 7(3): 117-120.
Sikka SC. 1996. Oxidative stress and role of antioxidant in normal and abnormal sperm function. Front. Biosci. 1: e78-86.
Solihati NR, Rasad SD, Rizal MZ, Fitriati M. 2008. Kualitas spermatozoa cauda epididymis sapi peternakan ongole (PO) dalam pengencer sus, tris dan sitrat kuning telur pada penyimpanan 4-5oC. Anim. Prod. 10(1): 22-29.
Sumardani NLG, Komang B, Tjok IP, Antonius WP. 2019. Umur Memengaruhi Volume Semen dan Motilitas Spermatozoa Babi Landrace di Balai Inseminasi Buatan Baturiti, Tabanan, Bali. J. Vet. 20(3): 324-329.
Vassilev N, Yotov S, Dimitrov F. 2005.
Incidence of early embryonic death indairy cows. Trakia J. Sci. 3(5): 62-64.
Yulnawati, Maheshwari H, Rizal M,
Herdis. 2010. Maltosa
Mempertahankan Viabilitas
Spermatozoa Epididimis Kerbau Belang yang Disimpan dalam Bentuk Cair. J. Vet. 11(1): 126-130
Tabel 1. Hasil Pengamatan Makroskopis dan Mikroskopis Semen Segar
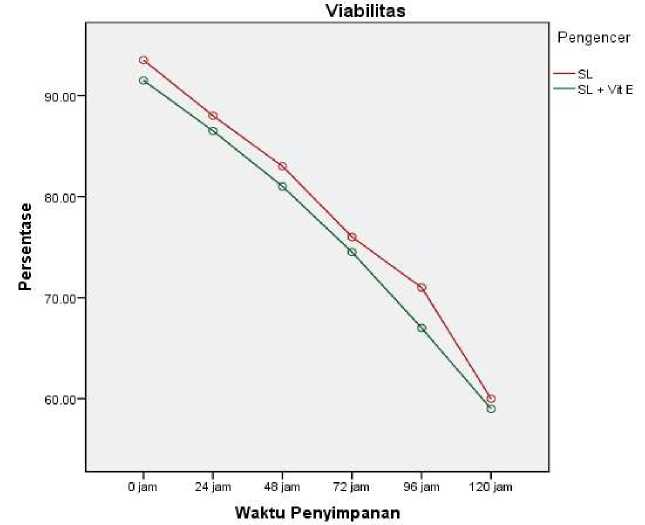
Gambar 1. Grafik Persentase Viabilitas Spermatozoa Babi landrace Selama Penyimpanan
|
Pengamatan |
Kualitas Semen | |
|
Makroskopis |
Volume Warna Konsistensi Aroma pH |
300 mL Putih keruh Encer Bau khas babi 7,5 |
|
Mikroskopis |
Motilitas |
75% |
|
Viabilitas |
95% | |
|
Abnormalitas |
<20% | |
pada Tiga Pengencer.
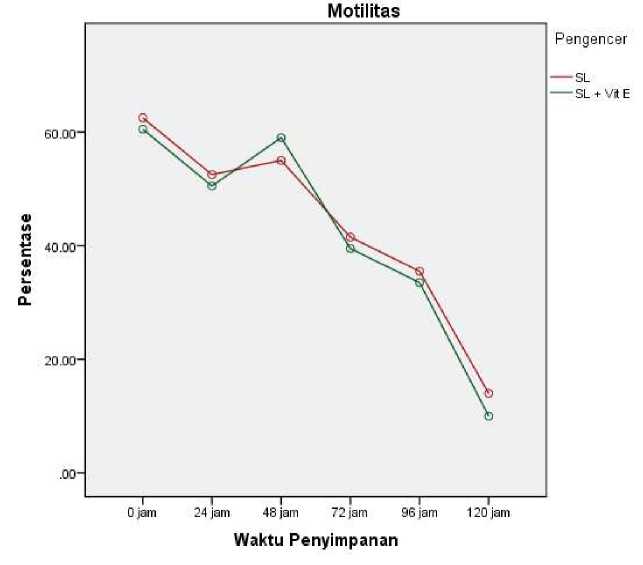
Gambar 2. Grafik Persentase Motilitas Spermatozoa Babi landrace Selama Penyimpanan
pada Tiga Pengencer
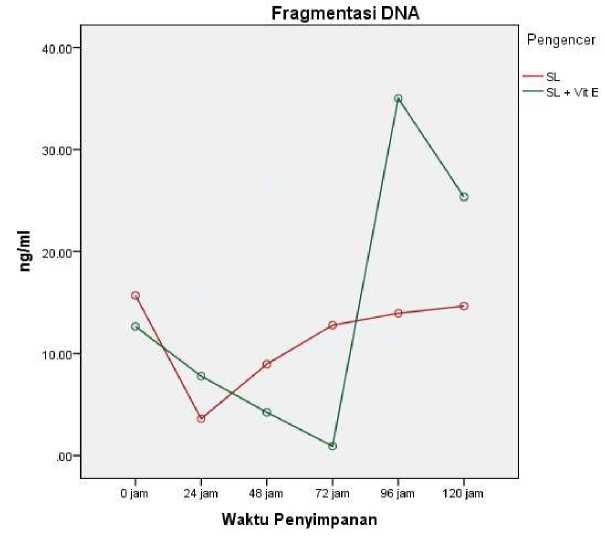
Gambar 3. Grafik Fragmentasi DNA Spermatozoa Babi landrace Selama Penyimpanan pada Tiga Pengencer.
1180
Discussion and feedback