DEVELOPMENT OF ADENOVIRUS VECTORED VACCINE FOR AFRICAN SWINE FEVER VIRUS BASED ON NON-STRUCTURAL PROTEIN
on
Buletin Veteriner Udayana Volume 15 No. 5: 873-887
pISSN: 2085-2495; eISSN: 2477-2712 Oktober 2023
Online pada: http://ojs.unud.ac.id/index.php/buletinvet https://doi.org/10.24843/bulvet.2023.v15.i05.p23
Terakreditasi Nasional Sinta 4, berdasarkan Keputusan Direktur Jenderal Pendidikan Tinggi, Riset, dan Teknologi No. 158/E/KPT/2021
Pengembangan Vaksin Vektor Adenovirus untuk Virus African Swine Fever Berbasis Protein Non-Struktural
(DEVELOPMENT OF ADENOVIRUS VECTORED VACCINE FOR AFRICAN SWINE FEVER VIRUS BASED ON NON-STRUCTURAL PROTEIN)
Made Sumitha Kameswari1*, I Gusti Ngurah Kade Mahardika2, Ida Bagus Kade Suardana2
-
1Program Studi Magister, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia;
-
2Laboratorium Biomedik dan Biologi Molekuler Fakultas Kedokteran Hewan, Universitas Udayana, Jl. Raya Sesetan Gang Markisa 6A, Denpasar, Bali, Indonesia.
Universitas Udayana, Denpasar, Bali
*Corresponding author email: kameswarisumitha@gmail.com
Abstrak
African swine fever (ASF) adalah penyakit virus babi yang menyebabkan kematian yang tinggi serta menyebabkan kerugian ekonomi yang besar pada babi domestik. Penelitian ini memaparkan proses pengembangan vaksin ASF pada vektor adenovirus dengan gen penyandi protein A224L dan A276R virus ASF dan respon imun pada mencit. Sintetik DNA yang berisi gen A224L dan A276R diamplifikasi dan dikloning pada plasmid komersial pAdenoX dengan infusion kloning kit. Sebanyak 106 virus AdenoX-ASF-224L-276R dari sel T293 yang ditransfeksi dengtan plasmid AdenoX-rekombinan, disuntikkan pada 6 ekor mencit secara intra-muskuler, sementara 6 ekor mencit yang lain diberikan ekstrak sel T293 diperlakukan sebagai kontrol. Darah tanpa antikoagulan dikumpulkan dari vena facialis mencit pada minggu 1, 3, 5, dan 7 setelah penyuntikan. Antibodi terhadap ASF diuji dengan ELISA menggunakan sintetik peptida A224L dan A276R sebagai antigen. Rekombinan AdenoX-ASF_A276R_A224L berhasil dihasilkan dan dibuktikan. Penyuntikan rekombinan AdenoX-ASF_A276R_A224L pada mencit dapat memicu respon imun pada minggu ke-7 signifikan lebih tinggi (p=0.00) dibandingkan dengan kontrol, sedangkan minggu ke 1, 3, dan 5 tidak berbeda dengan kontrol (p>0.05). Produksi adenovirus rekombinan pada sel yang monolayer dan kuantifikasi virus perlu ditingkatkan. Pengujian booster perlu dilakukan setelah minggu ke-tiga.
Kata kunci: antibody; ASF; ELISA; Protein; A224L; A276R
Abstract
African swine fever (ASF) is a viral disease of swine which causes high mortality as well as causes high economic losses in domestic pig. This study describes the process to develop an adenovirus vectors ASF vaccine with A224L and A276R coding region and its immune response in mice. Synthetic DNA containing the A224L and A276R genes was amplified and cloned into the commercial plasmid pAdenoX with an infusion cloning kit. A total of 106 AdenoX-ASF-224L-276R viruses from transfected T293 cells were injected into six mice intra-muscularly, while the other six mice were given T293 cell extract and were treated as controls. Blood without anticoagulant was collected from the facial vein of mice at 1, 3, 5, and 7 weeks after injection. Antibodies against ASF were tested by ELISA using synthetic peptides of A224L and A276R as antigens. AdenoX-ASF_A276R_A224L recombinant was successfully generated and proven. Injection of recombinant AdenoX-ASF_A276R_A224L in mice can trigger an immune response at week 7 significantly higher (p=0.00) compared to control, while weeks 1, 3 and 5 are not different from control (p>0.05). Production of recombinant adenovirus in monolayer cells and virus quantification need to be improved. Booster testing needs to be done after the third week.
Keywords: antibody; ASF; ELISA; Protein; A224L; A276R
PENDAHULUAN
African swine fever (ASF) adalah penyakit virus babi yang menyebabkan kematian yang tinggi pada babi domestik (Oura dan Arias, 2021). Penyakit ini menyebabkan kerugian ekonomi penting yang tidak dapat dihindari tanpa adanya vaksin yang efektif. Metode pengendalian penyakit yang tersedia adalah karantina daerah yang terkena, biosekuriti yang ketat, dan pemotongan hewan yang terinfeksi (Gallardo et al., 2015).
African Swine Fever disebabkan oleh virus ASF (ASFV) yang beruntai DNA ganda dari keluarga Asfarviridae (Galindo dan Alonso, 2017). Virus ini dalah satu-satunya virus DNA yang ditularkan oleh Arthropoda, yaitu kutu lunak dari genus Ornithodoros (Anderson et al., 1998; Kleiboeker et al., 1998). Penyakit ASF pertama kali diidentifikasi di Kenya pada tahun 1920-an (Hakizimana et al., 2021b; Penrith dan Kivaria, 2022). Penyakit itu menyebar ke Eropa pada pertengahan abad terakhir, dan kemudian ke Amerika Selatan dan Karibia (Oura dan Arias, 2021). Pada tahun 2007, penyakit itu menyebar lagi dari Afrika ke Kaukasus, terutama Georgia. Pada 2014, virus ASF mencapai wilayah timur Uni Eropa (Cwynar et al., 2019).
Wabah di Asia dimulai dari Cina pada tahun 2018. Cina melaporkan wabah ASF di Shenyang dan menyebar dengan sangat cepat (Zhou et al., 2018). Dampaknya luar biasa karena negara Cina merupakan produsen dan konsumen daging babi terbesar di dunia. Pada 8 Oktober 2018, ASF ditemukan pada delapan propinsi di Cina. Pemasukan ASF ke Cina masih misteri, ada spekulasi bahwa penyakit itu ditularkan dari negara Eropa Timur yang terkena ASF melalui babi atau jeroan selundupan (Vergne et al., 2017). Selanjutnya, virus ASF menyebar di Asia dari Cina ke Mongolia, Vietnam, Kamboja, Korea Utara, Laos, Filipina, Myanmar, Korea Selatan dan Timor-Leste (Lu et al.,
-
2020). ASF muncul di Indonesia pada awal September 2019, dengan episode kematian dilaporkan pada babi pekarangan di Kabupaten Dairi dan Humbang Hasundutan, Provinsi Sumatera Utara. Sejak itu, 521 wabah ASF telah dilaporkan di 21 dari 33 kabupaten di Provinsi Sumatra dan menyebabkan kematian hampir 40.000 babi (Dharmayanti et al., 2021; OIE, 2022). Virus itu juga sudah terkonfirmasi di Bali (Prof IGNK Mahardika, komunikasi pribadi).
Vaksin terhadap ASF belum dipasarkan di dunia. Kesulitan pengembangan vaksin terjadi karena pathogenesis yang kompleks serta gen virus ASF yang menyandi lebih dari 150 protein (Bisimwa et al., 2021; Blome et al., 2020; Correia et al., 2013; Hakizimana et al., 2021a; Olesen et al., 2018). Virus ini mempunyai target utama sel makrofaga sehingga fagositosis menyebabkan sel-sel fagositik terinfeksi dan mengalami kematian (Dixon et al., 2019). Selain itu, protein ASF mengganggu interferon dan apoptosis (Reis et al., 2017). Virus ASF juga sulit dibiakkan dalam biakan sel (Bustos et al., 2002; de Leon et al., 2013; Oura et al., 2013).
Laboratorium Biomedik dan Biologi Molekuler mengembangkan vaksin ASF berbasis vektor adenovirus dengan komponen non-struktural virus A224L dan A276R yang ditandemkan (Prof. IGNK Mahardika, komunikasi pribadi). Protein tersebut telah diungkap berperan dalam pathogenesis dengan mengganggu interferon dan apoptosis alami (Banjara et al., 2017; Correia et al., 2013; Gallardo et al., 2015; Reis et al., 2017; Sanchez-Vizcaino et al., 2012; Wu et al., 2021).
Penelitian ini memaparkan proses pengembangan vaksin ASF dengan protein A224L dan A276R dan pengujian pada mencit. Dalam kajian respon imun, titer antibodi mencit yang tidak vaksin digunakan sebagai kontrol. Pengujian dilakukan dengan ELISA dengan antigen sintetik peptida A224L dan A276R.
METODE PENELITIAN
Plasmid rekombinan pAdenoX-276R-224L ASF
Gen ASF 224L dan 276R ditandemkan dan disintetik secara buatan di GenScript, USA. Konstruksi gen itu ditunjukkan pada Gambar 1. Gen tersebut diamplifikasi dengan primer khas yang mempunyai 5’-infusion sequence di bagian depan dan 3’-end infusion skuens di bagian belakang. Hasil PCR disisipkan pada plasmid AdenoX linier (Takara) yang mempunyai ujung serupa dengan PCR AdenoX-A224L-A276R itu dengan teknik infusion kloning (Takara). Sekuens primer tersebut adalah FPSFAdv (5’-
GTAACTATAACGGTCCTTAAGATGG -3’) dan primer AdvSFBP(5-
ATTACCTCTTTCTCCGGATCCTTAAC CCATTTGCTG-3’). Hasil kloning ditransformasikan ke dalam bakteri Escherichia coli Stellar (Takara) yang telah disediakan dengan teknik pemanasan 42C selama 1 menit. 200 uL bakteri disebar pada media agar dengan antibiotika ampicillin. Setelah 24 jam, koloni dipetik dengan menyentuhkan ujung pipet dan dimasukkan kedalam media bakteri cair dengan ampicillin. DNA dari bakteri diisolasi dengan Chelax 10% dan dibuktikan dengan PCR. Plasmid terpilih diperbanyak dalam media 100 ml, dan plasmid disolasi dengan plasmid isolation kit. Hasil isolasi dikuantifikasi dengan Q-bit. Sebanyak 1 uG plasmid AdenoX-A224L-A276R
ditransfeksikan pada sel T-293 dengan lipofectamine. Sel selanjutnya
ditumbuhkan pada media dengan serum 5% selama 3 hari. Setelah itu sel disonikasi dengan kecepatan rendah dan gen A224L-A276R dibuktikan dengan PCR pada pengenceran media biakan sel 10X, 100X, 1000X dan 10000 X.
Penyuntikan pada mencit
Mencit betina umur 1 bulan divaksinasi dengan supernatant sel T-293 dengan AdenoX-A224L-A276R dengan dosis 100x10-4 dengan injeksi intramuskuler. Mencit kontrol divaksinasi dengan media
sel T-293. Serum mencit dikumpulkan setiap minggu. Antibodi terhadap A224L dan A276R dideteksi dengan menggabungkan peptida sintetik proteinprotein itu yang disintetik secara komersial pada GenScript. Sekuens peptida itu adalah P276R yang terdiri dari peptida dengan kode 76RC (NH2-KELVFNCSVLLEMV-COOH) dan 76RD (NH2-IECAQHCFKLQSYVVD-COOH).
Peptida sintetik p224L yang terdiri dari peptide dengan kode 24LD (NH2-LANAFIPPYRKYIHKI-COOH) dan 24LE (NH2-FKFAAHLLSFHKV-COOH)
Protokol ELISA adalah sebagai berikut. Serum dari mencit perlakuan selanjutnya tahap Uji ELISA menggunakan well ELISA serta coating Buffer Laboratorium Biomedik FKH UNUD. Tahap pertama coating protein selama 24 jam. Berikutnya blocking menggunakan susu skim 5%. Sebelum memasukkan perlakuan di cuci dengan pbs tween (campuran larutan akuabidest 900 ml, PBS 10X (phospat Buffer Saline) 100 ml dan TWEEN 500 mikro selama 5 menit sebanyak 3 kali Sampel (serum) antibodi primer. Lakukan pengulangan pencucian sebelum perlakuan berikutnya menggunakan antibodi sekunder, Penambahan substrat Alkaline Phospatase Conjugate Kit (Bio Rad)
Nilai optical density (OD) antara serum perlakuan dan serum kontrol dibandingkan dengan Student T-test setiap minggu pengamatan. Proses perlakuan dan pemeliharaan hewan coba dimulai pada bulan Januari 2023. Penelitian dilakukan di Laboratorium Biologi dan Molekuler Hewan Fakultas Kedokteran Hewan Universitas Udayana.
Protokol PCR
Plasmid dengan A224L dan A276R yang selanjutnya disebut sebagai plasmid 701 dari Genscript dilarutkan dengan 100 µL akuabidest sehingga konsentrasinya menjadi 40 µg/µL. Satu µL plasmid diencerkan ke dalam 19 µL akuabidest, untuk di-PCR. PCR mix untuk plasmid 701 adalah 5 µL mastermix gotaq green, 0,5 µL primer FPSFAdv, 0,5 µL primer AdvSFBP,
1 µL DNA plasmid, dan 3 µL akuabidest. Mix dimasukkan ke dalam mesin thermal cycler dengan pengaturan: 95°C selama 7 menit, diikuti dengan 35 siklus pada suhu 94°C selama 45 detik, 52°C selama 45 detik, 72 °C selama 2 menit, dan diselesaikan pada suhu 72°C selama 5 menit. Hasil amplicon di-elektroforesis pada gel agarose 1% selama 30 menit pada voltase 100 V. Gel diamati dibawah sinar UV. Ukuran pita target sekitar 1500 BP.
Protokol Persiapan Plasmid
Rekombinan pAdenoX-701ASF
Sebelum pAdenoX DNA dapat dikemas, plasmid rekombinan harus dicerna dengan PacI untuk mengekspos pengulangan terminal terbalik (ITRs) yang terletak di kedua ujung genom adenoviral. Pertama mempersiapkan H20 20 µL,
Plasmid pAdenoX-701ASF (500 ng/µL) 10 µL, 10X PacI Digestion Buffer 4 µL, 10B BSA 4 µL, dan PacI Restriction 2 µl di dalam satu tabung Eppendorf berukuran 1.5 ml. Selanjutnya homogenkan bahan-bahan tersebut dan di-spin down. Dilanjutkan dengan tahap inkubasi selama 2 jam pada suhu 37ºC. Setelah inkubasi, tambahkan 60 µL TE buffer dan 100 µL Phenol: Chloroform: Isoamil alkohol, lalu
sentrifugasi pada 14.000 RPM selama 5 menit. Selesai sentrifugasi, terdapat Fase akueus (di bagian atas) bagian tersebut dikoleksi dan tambahkan 400 µL ethanol absolut, 20 µL Natrium asetat dan 1 µL glikogen kemudian disentrifugasi 14.000 RPM selama 5 menit, supernatan dibuang. Dilanjutkan dengan mencuci pelet menggunakan 300 µL 70% etanol, sentrifugasi kembali pada 14.000 RPM selama 2 menit, supernatan dibuang. Pelet di-Air dry (angin-anginkan) pada suhu kamar selama 15 menit dan tambahkan 10 µL TE buffer. Lakukan kuantifikasi DNA dengan alat Qbit dan DNA disimpan pada lemari pendingin pada suhu -20ºC.
Protokol Transfeksi pada sel T-293
Membuat dua jenis komponen yang disebut Mix A dan Mix B. MiX A terdiri dari Optimem Medium 50 µL, DNA (0.5-5
µl) 1-5 µL, dan P3000 2 µL. Kemudian Mix B terdiri dari Optimen medium 50 µL, dan Lipofectamine 1.5 µL. Gabungkanlah Mix A dan Mix B kemudian inkubasikan selama 15 menit pada suhu kamar. Siapkan Plate Sel T-293 yang telah konfluen (>80%) untuk dicuci dengan NaCl. Mix A dan B yang sudah dicampur ke dalam sel dimasukkan ke dalam biakan sel. Kemudian diinkubasi selama 5 menit. Tambahkan media biakan sel dengan serum 10%. Setelah 3 hari ambillah sel menggunakan alat pengerik (scraper). Kemudian DNA diisolasi, dan Gen ASF dideteksi dengan PCR dengan primer FPSFAdv dan AdvSFBP.
Protokol ELISA
Serum mencit perlakuan dilanjutkan ke tahap Uji ELISA menggunakan well ELISA serta coating Buffer Laboratorium Biomedik Fakultas Kedokteran Hewan Universitas Udayana. Terlebih dahulu coating protein selama 24 jam, setelah 24 jam dilanjutkan ke tahap kedua yaitu blocking menggunakan susu skim konsentrasi 5%. Siapkan PBS Tween (campuran larutan akuabidest 900 ml, PBS (phospat Buffer Saline) 100 ml dan TWEEN 500 µl) untuk mencuci well ELISA selama 5 menit sebanyak 3 kali sebelum tahap ketiga yaitu memasukkan antibodi primer. Lakukan pengulangan pencucian selama 5 menit sebanyak 3 kali sebelum perlakuan keempat memasukkan antibodi sekunder. Tahap terakhir yaitu pemberian Substrate Alkaline Posphatase Conjugate Kit (Bio Rad).
Pengambilan Sampel
Pengambilan sampel serum sebanyak 500 µl darah mencit diambil melalui pembuluh darah vena fasialis menggunakan jarum berukuran 23G. Setelah jarum ditusukkan ke pembuluh darah fasialis maka dengan cepat darah mencit bisa ditampung ke tabung mikro 1.5 ml, selanjutnya diletakkan dalam posisi horizontal, agar serum dapat terpisah dari plasma dengan sempurna. Serum yang telah terpisah ditempatkan pada tabung mikro 1.5
ml baru, kemudian disimpan dalam lemari es dengan suhu -20ºC.
HASIL DAN PEMBAHASAN
Hasil
Gen 701 sintetik dapat diamplifikasi dengan primer FLADX-FP dan FLADX-BP yang mempunyai sekuens 5’-IFS dan 3’-IFS. Hasil PCR ditunjukan pada Gambar 2. Gambar menujukkan pita sesuai target sebesar sekitar 1600 bp.
Produk PCR tersebut dimurnikan dengan Invitrogen Pure Link Quick PCR Purrification Kit dan disisipkan pada plasmid pAdenoX dengan Infusion Kloning Kit (kedua produk merupakan produksi dari Takara) dan ditransformasi pada bakteri Escherichia coli strain Stellar. Koloni yang tumbuh ditunjukkan pada Gambar 3.
Sejumlah lima koloni yang terpisah ditumbuhkan pada media cair dengan Ampicilin selama 24 jam. Selanjutnya DNA diisolasi kembali dan dilakukan PCR seperti diatas. Dari lima koloni itu, satu koloni dapat dikonfirmasi membawa gen 701 yang utuh. Hasilnya PCR ditunjukkan pada Gambar 4.
Jalur satu adalah marker kemudian koloni pada jalur 2 tampak mempunyai produk sebesar sekitar 1600 bp. Sementara 5 koloni yang lain, tidak menunjukkan produk itu. Koloni terpilih diperbanyak dalam kultur 150 ml. Plasmid diisolasi dengan Plasmid Isolation Kit midiprep (Zymo) dan dikuantifikasi dengan QBIT. Hasil yang diperoleh adalah 200 ng/µL dalam 50 µL, sehigga total adalah 10 µG.
Sebelum ditransfeksikan sel T293 ditumbuhkan pada media DMEM dengan 10% FCS, dan gentamisin konsentrasi 0.25% dan ampoterisin konsentrasi 0.5% serta diinkubasi pada inkubator dengan penambahan CO2. Penampakan sel T293 setelah 72 jam ditunjukkan pada Gambar 5 tampak sel tumbuh tetapi tidak membentuk monolayer
DNA dari total sel dan media diisolasi dengan GeneJet Genomic DNA Purrification Kit dan di PCR dengan primer
FPSFADV dan ADV-SFBP. Hasil PCR ditujukan pada gambar 5.6. Hasil tersebut membuktikan biakan sel sudah membawa plasmid pAdenoX-701 sehingga diharapkan mengandung virus AdenoX rekombinan. Hasil pengenceren menujukkan sel masih memberikan signal sampai 10-4. Sehingga 1 µL sel diasumsikan membawa 10-4 adenovirus rekombinan.
Sebanyak 106 virus AdenoX-701 disuntikkan pada 5 ekor mencit secara intra-muskuler, sementara 5 ekor mencit yang lain diberikan ekstrak sel T293 diperlakukan sebagai kontrol. darah tanpa antikoagulan dikumpulkan dari Vena facialis mencit pada minggu 1, 3, 5, dan 7 setelah penyuntikan. Setelah membeku, serum dipisahkan dengan sentrifugasi pada kecepatan 7500 rpm selama 15 menit. Uji elisa dilakukan dengan sintetik peptida ASF A276R dan A224L sebanyak 500 ng semua peptide. Serum diencerkan 50X. Hasil optical density (OD) serum mencit pada minggu 1, 3, 5, dan 7 serta kontrol ditunjukkan pada Tabel 1 karena nilai seragam, nilai OD kontrol hanya ditunjukkan nilai pada minggu ke-3 saja.
Tabel tersebut menunjukkan bahwa beberapa mencit perlakuan mempunyai OD tinggi yaitu diatas 0.4 pada minggu 1 dan 2. Nilai rata-rata pada minggu 1 (0.391) yang disusul minggu ke 3, 5 dan 7 masing-masing 0.356, 0.181, dan 0,182. Semua nilai OD serum perlakuan lebih tinggi dari kontrol. Tabel tersebut menunjukkan standar deviasi (SD) minggu 1, 3, dan 5 sangat besar. Uji Shapiro-Wilk menunjukkan bahwa data pada minggu ketiga (p=0.01) dan minggu ke-5 (p=0.034) yang mempunyai sebaran normal. Nilai uji t-Student test ditunjukkan pada Tabel 5.2. Perlakuan yang signifikan adalah antara minggu ke-7 dengan kontrol saja.
Pembahasan
Rekombinan adenovirus adalah teknologi modern pengembangan vaksin dengan vektor adenovirus. Sepanjang pengetahuan penulis, teknologi ini pertama diterapkan di Indonesia, baik untuk manusia maupun hewan. Di dunia,
teknologi ini sudah diterapkan dan dipasarkan untuk vaksin terhadap virus severe acute respiratory coronavirus 2 (SARS-CoV-2) (Halperin et al., 2022; Kennedy, 2022). Keuntungan teknologi ini adalah cara pemberian lebih mudah dan menginduksi kekebalan lengkap (Chang, 2021).
Tesis ini memaparkan tahap-tahap produksi rekombinan adenovirus. Vektor plasmid adenovirus sudah banyak dipasarkan. Gen ASF diaplikasikan dengan teknik ini mengingat masalah dalam pengembangan vaksin ASF. Produk dan strategi yang dipilih adalah plasmid yang memungkinkan kloning gen asing dengan tidak tergantung sekuens. Kit dalam penelitian ini menggunakan teknik infusi (infusion cloning) (Berrow et al., 2009; Bird et al., 2014; Irwin et al., 2012; Li et al., 2020; Park et al., 2015; Sleight dan Sauro, 2013; Tuo et al., 2015).
African swine fever (ASF) adalah penyakit virus babi yang menyebabkan kematian yang tinggi pada babi domestik (Oura dan Arias, 2021). ASF disebabkan oleh virus ASF (ASFV) yang beruntai DNA ganda dari keluarga Asfarviridae (Galindo dan Alonso, 2017). ASF muncul di Indonesia pada awal September 2019, dengan episode kematian dilaporkan pada babi pekarangan di kabupaten Dairi dan Humbang Hasundutan, Provinsi Sumatera Utara. Sejak itu, 521 wabah ASF telah diberitahukan di 21 dari 33 kabupaten di provinsi itu, menyebabkan kematian hampir 40.000 babi (Dharmayanti et al., 2021; OIE, 2022).
Vaksin terhadap ASF belum dipasarkan di dunia. Kesulitan pengembangan vaksin terjadi karena pathogenesis yang kompleks serta gen virus ASF yang menyandi lebih dari 150 protein (Bisimwa et al., 2021; Blome et al., 2020; Correia et al., 2013; Hakizimana et al., 2021a; Olesen et al., 2018). Virus ini mempunyai target utama sel makrofaga sehingga fagositosis menyebabkan sel-sel fagositik terinfeksi dan mengalami kematian sel akibat ASF (Dixon et al., 2019). Selain itu, protein ASF
mengganggu interferon dan apoptosis (Reis et al., 2017). Virus ASF juga sulit
dibiakkan dalam biakan sel (Bustos et al., 2002; de Leon et al., 2013; Oura et al., 2013). Laboratorium Biomedik dan Biologi Molekuler sedang mengembangkan vaksin ASF berbasis vektor adenovirus dengan komponen non-struktural virus A224L dan A276R yang ditandemkan. Protein tersebut telah diungkap berperan dalam pathogenesis dengan mengganggu interferon dan apoptosis alami (Banjara et al., 2017; Correia et al., 2013; Gallardo et al., 2015; Reis et al., 2017; Sanchez-Vizcaino et al., 2012; Wu et al., 2021).
Hasil tahapan cloning menujukkan rekombinan AdenoX-ASF dapat
diproduksi walaupun efisiensi rendah, karena target gen ASF adalah dua gen, yaitu A224L dan A276R, pilihan yang dibuat adalah DNA sintetik. Kedua gen itu di alam berlokasi terpisah pada genom ASF dengan arah transkripsi berlawanan (Dixon et al., 2013) sehingga DNA sintetik menjadi satu-satunya pilihan.
Tahap produksi berhasil dibuktikan dengan primer khas. Pada transformasi, jumlah koloni yang dihasilkan sangat banyak, tetapi dari 5 koloni yang diuji, hanya satu yang positif membawa gen yang diharapkan. Efisiensi transformasi adalah jumlah koloni yang dihasilkan dari satu satuan massa plasmid (ng atau µg) (Hanahan et al., 1991). Efisiensi tertinggi dapat memperoleh
(4.3 × 108 Transformants∕μg DNA)
(Yildirim et al., 2016). Walaupun banyak koloni yang terjadi setelah transformasi, hanya 1 dari 5 (20%) yang membawa gen target. Tampaknya gen sisipan mengalami degradasi pada bakteri, proses yang sering dilaporkan (Smalla et al., 2015).
Biakan sel yang digunakan pada penelitian ini adalah T293 yang disediakan satu paket dengan AdenoX. Sel T293 atau disebut juga HEK 293 adalah garis sel khusus yang diabadikan yang berasal dari janin yang mengalami keguguran atau aborsi secara spontan atau sel ginjal embrionik manusia yang tumbuh dalam
kultur jaringan yang diambil dari janin perempuan pada tahun 1973 (Kavsan et al., 2011). Berdasarkan keterangan produsen, Adeno-X 293 Cell Line adalah jalur sel ginjal embrio manusia transformasi rendah untuk produksi stok adenovirus. Stok adenovirus dapat diproduksi dengan mentransfeksi sel ini dengan vektor adenoviral yang dilinearisasi (Graham et al., 1977).
Masalah dalam penelitian ini adalah sel tersebut tidak tumbuh sebagai sel satu lapis (monolayer). Komponen dalam media tampaknya belum optimal. Sebab lain belum diketahui. Sel T293 secara teoritis mestinya tumbuh menjadi sel satu lapis (monolayer) (Malm et al., 2020).
Sekalipun demikian, sel itu dapat menghasilkan adenovirus rekombinan, Hal itu ditunjukkan dengan PCR dari ekstrak sel yang dipanen setelah tiga hari (Gambar 6). Pengenceran sel yang masih menunjukkan hasil positif adalah 10-4/ uL. Hasil itu digunakan sebagai patokan untuk kuantitas adenovirus rekombinan yang digunakan dalam vaksin.
Teknik deteksi antibodi yang digunakan adalah ELISA. ELISA, atau enzyme-linked immunosorent assay adalah salah satu bentuk uji serologis yang digunakan untuk mendeteksi dan mengkuantifikasikan beberapa jenis senyawa, seperti antibodi, antigen, protein, glikoprotein dan hormon. Pendeteksian pada ELISA dapat dicapai dengan membentuk kompleks antara antibodi dan antigen untuk menghasilkan hasil yang dapat dikuantifikasi dengan menggunakan jumlah sampel yang sedikit. ELISA sudah digunakan untuk mendiagnosis infeksi HIV, tes kehamilan, dan menentukan golongan darah (Aydin, 2015)., termasuk Covid-19 (de la Guardia et al., 2021), ASF (Gao et al., 2021), Influenza (Velumani et al., 2011) dan lain sebagainya.
Proses ELISA dilakukan pada plate polystyrene yaitu suatu plate yang biasanya memiliki 96 sumuran/well yang diberi suatu coating agar protein dapat terikat dengan lebih kuat. Ragam ELISA adalah
ELISA direk, ELISA indirek. Dalam ELISA direk, antigen dilapiskan pada plate dan dideteksi dengan antibodi yang berpenanda enzim. Dalam Elisa indirek, antigen dideteksi dengan antibodi/serum tanpa berpenanda, dan kemudian dideteksi dengan antibodi terhadap immunoglobulin spesies yang digunakan pada serum pertama. Enzim yang umum digunakan untuk ELISA adalah alkaline phosphatase dan horse-radish peroxidase. Penambahan substrat yang sesuai akan menyebabkan munculnya warna dalam ELISA. Kepekatan warna tersebut dapat dilihat dengan mata atau diukur dengan alat spektrofotometer dalam bentuk optical density (OD). Jika mendeteksi antigen, semakin tinggi OD, konsentrasi antigen semakin banyak. Jika mendeteksi antibodi, semakin tinggi nilai OD, konsentrasi antibodi semakin tinggi.
Bukti bahwa rekombinan adenoX-ASF dapat diproduksi adalah pada penyuntikan pada mencit, beberapa ekor mencit menunjukkan nilai OD lebih dari 0,4, walau belum seragam. Pengujian dengan ELISA menunjukkan bahwa nilai rata-rata tertinggi pada minggu 3 (0.391) yang disusul minggu ke 3, 5 dan 7 maing-masing 0.356, 0.181, dan 0.182. Semua nilai OD serum perlakuan lebih tinggi dari kontrol. Tabel tersebut menunjukkan standar deviasi (SD) minggu 1, 3, dan 5 sangat besar. Pengujian dengan Student t-test menunjukkan hasil yang tak berbeda nyata pada setiap minggu pengamatan. Ini terjadi karena standar deviasi yang sangat besar pada minggu ke-1, 3, dan 5. Tampilan grafis hasil pengukuran OD pada minggu ke 1, 3. 5, dan 7 ditampilkan pada Gambar 7. Gambar tersebut menunjukkan nilai OD menurun setelah minggu ke-3.
Diduga, hal tersebut terjadi karena kuantitas virus adenovirus rekombinan tidak seragam pada semua ulangan. Produksi adenovirus rekombinan pada sel yang monolayer dan kuantifikasi virus perlu ditingkatkan akurasinya. Disamping itu, pengujian booster perlu dilakukan setelah minggu ke-tiga.
SIMPULAN DAN SARAN
Simpulan
Rekombinan AdenoX-
ASF_A276R_A224L berhasil dihasilkan dan dibuktikan. Penyuntikan rekombinan AdenoX-ASF_A276R_A224L pada mencit dapat memicu respon imun pada minggu ke-7 signifikan lebih tinggi (p=0.00) dibandingkan dengan kontrol, sedangkan minggu ke 1, 3, dan 5 tidak berbeda dengan kontrol (p>0.05)
Saran
Produksi adenovirus rekombinan pada sel yang monolayer dan kuantifikasi virus perlu ditingkatkan akurasinya. Pengujian booster perlu dilakukan setelah minggu ketiga.
UCAPAN TERIMAKASIH
Penelitian ini dibiayai dengan skema Publikasi dan Promosi Guru Besar PNB Universitas Udayana Tahun 2020.
DAFTAR PUSTAKA
Anderson EC, Hutchings GH, Mukarati N, Wilkinson PJ. 1998. African swine fever virus infection of the bushpig (Potamochoerus porcus) and its significance in the epidemiology of the disease. Vet. Microbiol. 62: 1-15.
Aydin S. 2015. A short history, principles, and types of ELISA, and our laboratory experience with peptide/protein analyses using ELISA. Peptides. 72: 415.
Banjara S, Caria S, Dixon LK, Hinds MG, Kvansakul M. 2017. Structural insight into African Swine Fever virus A179L-mediated inhibition of apoptosis. J. Virol. 91(6): e02228-16.
Berrow NS, Alderton D, Owens RJ. 2009. The precise engineering of expression vectors using high-throughput InFusion PCR cloning. Methods. Mol. Biol. 498: 75-90.
Bird LE, Rada H, Flanagan J, Diprose JM, Gilbert RJ, Owens RJ. 2014. Application of in-fusion cloning for the parallel construction of E. coli
expression vectors. Methods. Mol. Biol. 1116: 209-234.
Bisimwa PN, Ongus JR, Steinaa L, Bisimwa EB, Bochere E, Machuka EM, Entfellner JD, Okoth E, Pelle R. 2021. The first complete genome sequence of the African swine fever virus genotype X and serogroup 7 isolated in domestic pigs from the Democratic Republic of Congo. Virol. J. 18: 23.
Blome S, Franzke K, Beer M. 2020. African swine fever - A review of current knowledge. Virus Res. 287: 198099.
Bustos MJ, Nogal ML, Revilla Y, Carrascosa AL. 2002. Plaque assay for African swine fever virus on swine macrophages. Arch. Virol. 147: 14531459.
Chang J. 2021. Adenovirus vectors: Excellent tools for vaccine development. Immune Netw. 21: e6.
Correia S, Ventura S, Parkhouse RM. 2013. Identification and utility of innate immune system evasion mechanisms of ASFV. Virus Res. 173: 87-100.
Cwynar P, Stojkov J, Wlazlak K. 2019. African Swine Fever status in Europe. Viruses. 11(4): 310.
de la Guardia C, Rangel G, Villarreal A, Goodridge A, Fernandez PL, Lleonart R. 2021. Development of in-house, indirect ELISAs for the detection of SARS-CoV-2 spike protein-associated serology in COVID-19 patients in Panama. PLoS One. 16: e0257351.
de Leon P, Bustos MJ, Carrascosa AL. 2013. Laboratory methods to study African swine fever virus. Virus Res. 173: 168-179.
Dharmayanti NI, Sendow I, Ratnawati A, Settypalli TBK, Saepulloh M, Dundon WG, Nuradji H, Naletoski I, Cattoli G, Lamien CE. 2021. African swine fever in North Sumatra and West Java provinces in 2019 and 2020, Indonesia. Trans. Emerg. Dis. 68: 2890-2896.
Dixon LK, Chapman DA, Netherton CL, Upton C. 2013. African swine fever
virus replication and genomics. Virus Res. 173: 3-14.
Dixon LK, Sun H, Roberts H. 2019. African swine fever. Antiviral Res.165: 34-41.
Galindo I, Alonso C. 2017. African Swine Fever Virus: A review. Viruses. 9(5): 103.
Gallardo MC, Reoyo AT, Fernandez-Pinero J, Iglesias I, Munoz MJ, Arias ML. 2015. African swine fever: a global view of the current challenge. Porcine Health Manag. 1: 21.
Gao Z, Shao JJ, Zhang GL, Ge SD, Chang YY, Xiao L, Chang HY. 2021. Development of an indirect ELISA to specifically detect antibodies against African swine fever virus: bioinformatics approaches. Virology J. 18: 97.
Graham FL, Smiley J, Russell WC, Nairn R. 1977. Characteristics of a human cell line transformed by DNA from human adenovirus type 5. J. Gen. Virol. 36: 5974.
Hakizimana JN, Ntirandekura JB, Yona C, Nyabongo L, Kamwendo G, Chulu JLC, Ntakirutimana D, Kamana O, Nauwynck H, Misinzo G. 2021a. Complete genome analysis of African swine fever virus responsible for outbreaks in domestic pigs in 2018 in Burundi and 2019 in Malawi. Trop. Anim. Health Prod. 53: 438-438.
Hakizimana JN, Yona C, Kamana O, Nauwynck H, Misinzo G. 2021b. African Swine Fever virus circulation between tanzania and neighboring countries: A systematic review and meta-analysis. Viruses. 13(2): 306.
Halperin SA, Ye L, MacKinnon-Cameron D, Smith B, Cahn PE, Ruiz-Palacios GM, Ikram A, Lanas F, Lourdes Guerrero M, Munoz Navarro SR. 2022. Final efficacy analysis, interim safety analysis, and immunogenicity of a single dose of recombinant novel coronavirus vaccine (adenovirus type 5 vector) in adults 18 years and older: an international, multicentre, randomised,
double-blinded, placebo-controlled phase 3 trial. Lancet. 399: 237-248.
Hanahan D, Jessee J, Bloom FR. 1991. Plasmid transformation of Escherichia coli and other bacteria. Methods Enzymol. 204: 63-113.
Irwin CR, Farmer A, Willer DO, Evans DH. 2012. In-fusion(R) cloning with vaccinia virus DNA polymerase. Methods Mol. Biol. 890: 23-35.
Kavsan VM, Iershov AV, Balynska OV. 2011. Immortalized cells and one oncogene in malignant transformation: old insights on new explanation. BMC Cell Biol. 12: 23.
Kennedy RB. 2022. Efficacy of an adenovirus type 5 vectored SARS-CoV-2 vaccine. Lancet 399: 212-213.
Kleiboeker SB, Burrage TG, Scoles GA, Fish D, Rock DL. 1998. African swine fever virus infection in the argasid host, Ornithodoros porcinus porcinus. J. Virol. 72: 1711-1724.
Li X, Li Y, Chen S, Wang J. 2020. Construction of stable infectious fulllength and eGFP-tagged cDNA clones of Mirabilis crinkle mosaic virus via InFusion cloning. Virus Res. 286: 198039.
Lu G, Pan J, Zhang G. 2020. African swine fever virus in Asia: Its rapid spread and potential threat to unaffected countries. J. Infect. 80: 350-371.
Malm M, Saghaleyni R, Lundqvist M, Giudici M, Chotteau V, Field R, Varley, PG, Hatton D, Grassi L, Svensson T. 2020. Evolution from adherent to suspension: systems biology of
HEK293 cell line development. Sci. Rep. 10: 18996.
OIE 2022. African Swine Fever (OIE).
Olesen AS, Lohse L, Dalgaard MD, Wozniakowski G, Belsham GJ, Botner A, Rasmussen TB. 2018. Complete genome sequence of an African swine fever virus (ASFV
POL/2015/Podlaskie) determined
directly from pig erythrocyte-associated nucleic acid. J. Virol. Methods. 261: 14-16.
Oura CA, Edwards L, Batten CA. 2013. Virological diagnosis of African swine fever--comparative study of available tests. Virus Res. 173: 150-158.
Oura CAL, Arias M. 2021. African swine fever (infection with African swine fever virus) In: OIE (Ed.) Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2021. OIE, Geneva. Pp. 1-18.
Park J, Throop AL, LaBaer J. 2015. Sitespecific recombinational cloning using gateway and in-fusion cloning schemes. Curr. Protoc. Mol. Biol. 110: 3.20.1– 3.20.23: 1-36.
Penrith ML, Kivaria FM. 2022. One hundred years of African swine fever in Africa: Where have we been, where are we now, where are we going? Trans. Emerg. Dis. 69(5): e1179-e1200.
Reis AL, Netherton C, Dixon LK. 2017. Unraveling the armor of a killer: evasion of host defenses by African swine fever virus. J. Virol. 91: e02338-02316.
Sanchez-Vizcaino JM, Mur L, Martinez-Lopez B. 2012. African swine fever: an epidemiological update. Trans. Emerg. Dis. 59(Suppl 1): 27-35.
Sleight SC, Sauro HM. 2013. BioBrick assembly using the in-fusion PCR cloning kit. Methods. Mol. Biol. 1073: 19-30.
Smalla K, Jechalke S, Top EM. 2015. Plasmid detection, characterization, and ecology. Microbiol. Spectr. 3(1): 1-21.
Tuo D, Shen W, Yan P, Li X, Zhou P. 2015. Rapid construction of stable infectious full-length cDNA clone of papaya leaf distortion mosaic virus using in-fusion cloning. Viruses. 7: 6241-6250.
Velumani S, Ho HT, He F, Musthaq S, Prabakaran M, Kwang J. 2011. A novel peptide ELISA for universal detection of antibodies to human H5N1 influenza viruses. PloS One. 6: e20737-e20737.
Vergne T, Chen-Fu C, Li S, Cappelle J, Edwards J, Martin V, Pfeiffer DU, Fusheng G, Roger FL. 2017. Pig empire under infectious threat: risk of African swine fever introduction into the People's Republic of China. Vet. Rec. 181: 117.
Wu L, Yang B, Yuan X, Hong J, Peng M, Chen JL, Song Z. 2021. Regulation and Evasion of Host Immune Response by African Swine Fever Virus. Front. Microbiol. 12: 698001.
Yildirim S, Thompson MG, Jacobs AC, Zurawski DV, Kirkup BC. 2016. Evaluation of parameters for high efficiency transformation of
acinetobacter baumannii. Sci. Rep. 6: 22110.
Zhou X, Li N, Luo Y, Liu Y, Miao F, Chen T, Zhang S, Cao P, Li X, Tian K. 2018. Emergence of African Swine Fever in China, 2018. Trans. Emerg. Dis. 65: 1482-1484.
Gambar 1. Konstruksi gen ASF 276R yang ditandem dengan 224L Susunan DNA tersebut adalah sekuens 5’-end infusion; Swine tissue plasminogen activator signal peptide gene (STPASPG); Protein 1 adalah p276R-ASF; Influenza LPAI-H9N2 Cleavage site; Protein 2 adalah p224L-ASF; Influenza LPAI-H9N2 Cleavage site; T7tag; sekuens 3’-end-infusion.
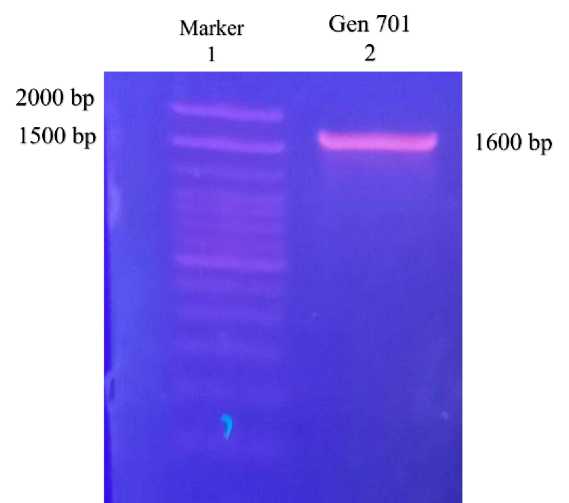
Gambar 2. Hasil PCR gen701 sintetik dengan primer primer FLADX-FP dan FLADX-BP yang mempunyai sekuens 5’-IFS dan 3’-IFS. Jalur 1 adalah marker 100-bp Ladder (Invitrogen). Jalur 2 adalah hasil PCR gen 701.
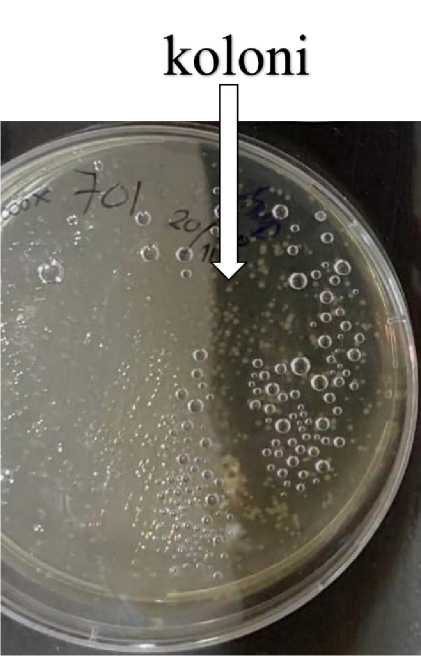
Gambar 3. Koloni sel E. coli Stellar yang ditransformasi pAdenoX-701 dan ditumbuhkan pada media Agar Ampicillin (Thermo Scientific) serta diinkubasi pada suhu 37º C.
Gambar 4. Pengujian PCR terhadap koloni rekombinan pAdenoX-701 dengan PCR seperti diatas.
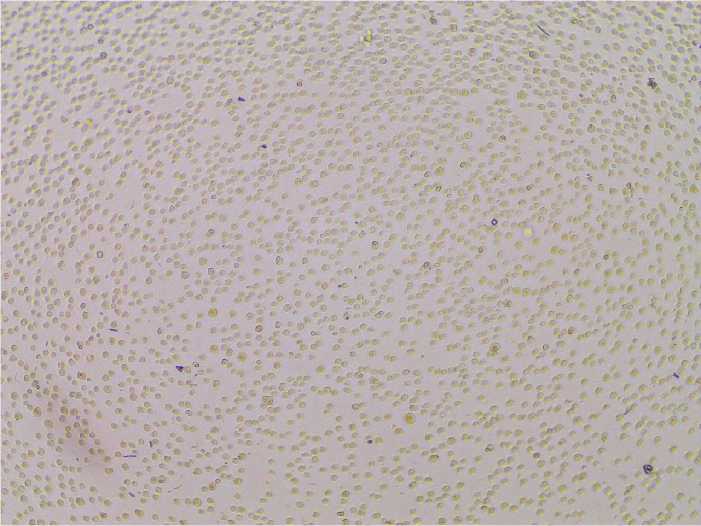
Gambar 5. Pertumbuhan sel T293 umur 72 jam sebelum ditrasfeksi plasmid pAdenoX-701. Gambar dilihat dengan mikroskup phase-contrast (Optika Microscope Italy XDS-2) pembesaran 10x.
Gambar 6. Gambar biakan sel T293 setelah ditransfeksi dengan plasmid pAdenoX-701 umur 72 jam. Tampak sel lebih jarang.
Gen
701
plasmid
kontr°l marked
12 3 4
Gambar 7. Hasil PCR dari ekstrak sel total T293 setelah ditransfeksi dengan pAdenoX-701. Jalur 1 adalah Gen 701, diikuti jalur ke 2 merupakan kontrol, jalur ke 3 yaitu plasmid, dan jalur ke 4 adalah marker.
Table 1. Nilai optical density (OD) serum mencit yang divaksinasi dengan virus AdenoX-ASF 701 yang diambil pada minggu ke-1, 3, 5, dan 7 setelah vaksinasi.
|
Ulangan |
Minggu 1 |
Minggu 3 |
Minggu 5 |
Minggu 7 |
Kontrol |
|
1 |
0.134 |
0.157 |
0.108 |
0.187 |
0.095 |
|
2 |
0.105 |
0.146 |
0.161 |
0.163 |
0.078 |
|
3 |
0.131 |
0.190 |
0.394 |
0.175 |
0.081 |
|
4 |
0.357 |
0.321 |
0.101 |
0.145 |
0.106 |
|
5 |
0.986 |
0.206 |
0.109 |
0.175 |
0.104 |
|
6 |
0.630 |
1.115 |
0.211 |
0.244 |
0.051 |
|
Rataan |
0.391 |
0.356 |
0.181 |
0.182 |
0.082 |
|
SD |
0.354 |
0.377 |
0.113 |
0.034 |
0.021 |
Nilai OD serum mencit kontrol hanya ditunjukkan pada minggu ke-3 setelah vaksinasi.
Tabel 2. Nilai uji student T-test antara nilai OD pada minggu pengamatan yang berbeda dengan kontrol serum mencit yang divaksinasi dengan rekombinan AdenoX-ASF.
|
Minggu 1 |
Minggu 3 |
Minggu 5 |
Minggu 7 |
Kontrol | |
|
Minggu 1 |
- |
0.844 |
0.26 |
0.19 |
0.062 |
|
Minggu 3 |
0.844 |
- |
0.314 |
0.276 |
0.110 |
|
Minggu 5 |
- |
- |
- |
0.986 |
0.069 |
|
Minggu 7 |
- |
- |
- |
- |
0.000 |
Nilai OD
0.45
0.4
0.35
0.3
0.25
0.2
0.15
0.1
0.05
0
1357 Minggu Ke-
Gambar 8. Grafik rataan nilai optikal density Uji ELISA pada minggu ke 1, minggu ke 3, minggu ke 5, dan minggu ke 7.
887
Discussion and feedback