Potential of honey and propolis of Tetragonula laeviceps bees inhibitory to the in vitro growth of Staphylococcus aureus and Escherichia coli bacteria
on
JURNAL BIOLOGI UDAYANA 26(2): 153-164
P ISSN: 1410-5292 E ISSN: 2599-2856
Potensi madu dan propolis lebah Tetragonula laeviceps dalam menghambat pertumbuhan in vitro bakteri Staphylococcus aureus dan Escherichia coli
Potential of honey and propolis of Tetragonula laeviceps bees inhibitory to the in vitro growth of Staphylococcus aureus and Escherichia coli bacteria
Fernando Putra1, Yan Ramona1,2*, I Made Saka Wijaya1
-
1) Program Studi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana
Jl. Raya Kampus Unud, Jimbaran, Kec. Kuta Selatan, Kabupaten Badung, Bali 80361
-
2) Laboratorium terpadu Biosains dan Bioteknologi, Universitas Udayana
Jl. Raya Kampus Unud, Jimbaran, Kec. Kuta Selatan, Kabupaten Badung, Bali 80361
*Email: yan_ramona@unud.ac.id
Diterima 26 Januari 2022 Disetujui 28 Maret 2022
INTISARI
Madu, yang sangat baik untuk kesehatan manusia karena kandungan gizinya yang tinggi, merupakan produk dari lebah Tetragonula laeviceps. Selain madu, lebah ini juga menghasilkan beberapa produk turunan, seperti propolis yang sering digunakan sebagai suplemen kesehatan. Madu dan propolis telah banyak dilaporkan memiliki aktivitas antimikroba. Oleh karena itu, tujuan utama penelitian ini adalah untuk mengetahui efektivitasnya dalam menghambat Staphylococcus aureus dan Escherichia coli pada berbagai uji in vitro (termasuk penentuan nilai MIC dan LC50). Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan lima taraf konsentrasi (15%, 20%, 30%, 40%, dan 50% v/v) untuk menentukan kedua produk lebah tersebut dalam menghambat pertumbuhan in vitro S. aureus dan E. coli. Etanol (etanol 95%) yang digunakan sebagai pelarut dalam percobaan dengan 5 ulangan ini berfungsi sebagai kontrol negatif. Zona hambat dan nilai MIC ditentukan dengan menggunakan metode sumur difusi, sedangkan metode pour plate pada media nutrien agar diterapkan dalam penentuan nilai LC50 madu dan propolis. Hasil penelitian pendahuluan menunjukkan bahwa madu konsentrasi 100% menghambat pertumbuhan S. aureus dan E. coli dengan zona hambat masing-masing 12,50±1,09mm dan 6,60±0,60 mm. Hasil serupa juga ditunjukkan oleh propolis dengan diameter hambatan sebesar 15,50±1,08mm dan 8,10±1,00mm berturut-turut terhadap S. aureus dan E. coli. Pada penelitian utama, madu dan propolis memiliki nilai MIC yang sama yaitu 15% (v/v), sedangkan nilai LC50 pada S. aureus masing-masing adalah 35,15% (v/v) dan 18,25% (v/v), dan pada E. coli masing-masing adalah 35,89% v/v) dan 28,2% (v/v). Propolis memiliki daya hambat yang lebih kuat terhadap S. aureus dan E. coli dibandingkan madu.
Kata kunci: Dual culture assay, Escherichia coli, madu, propolis, Staphylococcus aureus
ABSTRACT
Honey, which is good for human health due to its high nutrition content, is a product of bees that belongs to Tetragonula laeviceps. Besides honey, these bees also produce several derivative products, such as propolis, often used as a health supplement. Honey and propolis have been widely reported to have antimicrobial activity. Therefore, the main aim of this study was to investigate their effectiveness in inhibiting Staphylococcus aureus and Escherichia coli in various in vitro tests (including determination of
MIC and LC50 values). This study used a complete randomized design with five levels of concentrations (15%, 20%, 30%, 40%, and 50% v/v) to determine these two bee’s products ini inhibiting the in vitro growth of S. aureus and E. coli. Ethanol (95% ethanol) used as the solvent in this five replicated experiment, served as nil control. Inhibition zone and MIC values were determined by applying the diffusion well method. In contrast, a pour plate method on a nutrient agar medium was applied in the determination of LC50 values of the honey and propolis. The results of the preliminary study showed that honey of 100% concentration inhibited the growth of S. aureus and E. coli with inhibition zones of 12.50±1.09 mm and 6.60±0.60mm, respectively. Similar results were also shown by propolis with inhibition diameters of 15.50±1.08mm and 8.10±1.00mm on respective lawns of S. aureus and E. coli. Both honey and propolis appeared to have MIC value of 15% (v/v), while their LC50 values on S. aureus were 35.15% (v/v) and 18.25% (v/v), respectively, and on E. coli were 35.89% (v/v) and 28.2% (v/v), respectively. Propolis has a stronger inhibitory effect against S. aureus and E. coli when compared to honey.
Keywords: Dual culture assay, Escherichia coli, honey, propolis, Staphylococcus aureus
PENDAHULUAN
Penyakit infeksi yang disebabkan oleh mikroba patogen merupakan penyakit yang sangat umum ditemukan di negara-negara berkembang. Infeksi oleh mikroba patogen dapat meningkatkan angka mordibilty dan mortality, terutama di negara berkembang karena tingkat pelayanan kesehatan di negara-negara tersebut relatif kurang baik jika dibandingkan dengan negara maju (Putri, 2019). Kelompok mikroba yang paling sering menjadi penyebab infeksi adalah kelompok jamur dan bakteri (Radji, 2011).
Tubuh manusia secara alamiah berasosiasi dengan berbagai mikroba, dan mikroba yang selalu dapat diisolasi dari tubuh manusia disebut dengan mikrobiota normal. Mikrobiota normal tersebut akan menyebabkan penyakit pada tubuh kita, bila jumlahnya berlebih atau tidak seimbang dengan kelompok lain (Fhitryani et al., 2017). Escherichia coli dan S. aureus misalnya, akan menyebabkan permasalahan di dalam saluran pencernaan manusia dan saluran pernapasan, bila kerapatannya sangat tinggi (Fitrianingsih et al., 2014).
Escherichia coli merupakan bakteri fakultatif anaerob dan merupakan salah satu mikrobiota normal pada usus manusia. Pada hewan berdarah panas, kerapatan tertinggi bakteri ini dapat ditemukan pada usus besar atau saluran pencernaan bagian belakang (Hayhurst, 2004). Escherichia coli berperan penting dalam sintesis
vitamin K, konversi asam-asam empedu dan membantu dalam penyerapan makanan di dalam tubuh (Lai et al., 2022). Walaupun merupakan salah satu mikrobiota normal yang sangat penting dalam saluran pencernaan, E. coli dapat menjadi bakteri patogen dan mengeluarkan enterotoksin yang menyebabkan gastroenteritis apabila kerapatannya tidak terkontrol (Suardana et al., 2007).
Selain E. coli, S. aureus juga merupakan mikrobiota normal pada tubuh manusia. Bakteri ini biasanya terdapat pada saluran pernafasan atau pada kulit (Fhitryani et al., 2017). Jenis bakteri ini juga berpotensi menjadi patogen bila kerapatannya melebihi batas normalnya (535 CFU/mL) (Pratami et al., 2013). Dalam kasus tertentu, infeksi bakteri S. aureus dapat menimbulkan penyakit dengan gejala, seperti peradangan, nekrosis, tumbuh jerawat, infeksi folikel rambut dan pembentukan abses (Razak et al., 2013).
Dalam kehidupan sehari-hari, madu sering digunakan dalam mencegah terjadinya infeksi yang sebabkan oleh patogen pada luka permukaan kulit. Madu merupakan cairan kental dari nektar tanaman yang telah diproses oleh lebah madu dan disimpan di dalam sarangnya. Selain dikenal masyarakat sebagai makanan, madu juga memiliki manfaat pada bidang kesehatan dan kecantikan. Madu memiliki sifat sebagai antiinflamasi, antibakteri dan antioksidan. Selain memiliki pH yang rendah, tingkat osmolaritas
yang tinggi serta kadungan hidrogen peroksida pada madu, sangat cocok digunakan sebagai alternatif pengganti penggunaan antibiotik (Yuliati, 2017).
Beberapa jenis lebah mampu menghasilkan jenis madu yang khas, seperti madu klanceng yang dihasilkan oleh lebah Tetragonula laeviceps (Agussalim et al., 2021). Masyarakat Bali mengenal madu klanceng dengan sebutan madu kele (Dewantari & Suranjaya, 2019). Selain menghasilkan madu, lebah ini juga menghasilkan beberapa produk turunan, salah satunya adalah propolis. Madu kele memiliki khasiat yang lebih bagus dibandingkan dengan madu yang dihasilkan oleh lebah madu pada umumnya (Riyandoko, 2016). Propolis yang dihasilkan lebah ini juga memiliki banyak manfaat bagi tubuh (Dewantari et al., 2020).
Berdasarkan pada latar belakang diatas, maka penelitian tentang daya hambat in vitro madu dan propolis yang dihasilkan oleh Tetragonula laeviceps ini dilakukan. Tujuan penelitian ini adalah untuk mengetahui efektivitas kedua produk lebah tersebut dalam menghambat Staphylococcus aureus dan Escherichia coli pada berbagai uji in vitro (termasuk penentuan nilai MIC dan LC50).
MATERI DAN METODE
Tempat dan waktu penelitian
Penelitian ini dilakukan di Laboratorium Mikrobiologi, Program Studi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana pada Januari – Juni 2021.
Bahan dan alat
Sampel yang digunakan adalah madu dan propolis dari lebah Tetragonula laeviceps yang diperoleh di Petapan Park Desa Aan, Klungkung, Bali. Bakteri uji yang digunakan meliputi bakteri S. aureus ATCC 25923 yang diperoleh dari RSUP Sanglah, Denpasar, Bali dan bakteri E. coli diperoleh dari Balai Besar Veteriner, Denpasar, Bali.
Rancangan Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan 5 level konsentrasi madu kele dan propolis (15%, 20%, 30%, 40%, 50% v/v) yang diujikan pada dua spesies bakteri (S. aureus dan E. coli). Larutan pengencer madu (etanol 95%) dan chloramphenicol (225 mg/mL) berperan berturut-turut sebagai kontrol negatif dan kontrol positif. Setiap perlakuan diulang sebanyak 5 kali.
Uji Konfirmasi Bakteri
Isolat bakteri yang didapatkan dilakukan reisolasi ke medium Nutrien Agar (NA) dan diinkubasi pada inkubator selama 1x24 jam pada suhu 37oC. Beberapa uji konfirmasi yang dilakukan pada penelitian ini antara lain uji katalase dengan larutan H2O2 dan pewarnaan Gram sebagai uji konfirmasi jenis bakteri. Pada bakteri E. coli dilakukan uji Methyl Red (MR), Voges Proskauer (VP), indol dan sitrat, sedangkan pada S. aureus dilakukan uji koagulase. Uji-uji ini merupakan uji karakteristik penting dari setiap bakteri yang akan dipakai dalam penelitian ini, sehingga dapat dipastikan bahwa bakteri uji yang dipakai adalah benar species yang dimaksud.
Pembuatan Suspensi Bakteri
Suspensi bakteri E. coli dan S. aureus dibuat dengan menginokulasi biakan murni isolat - isolat tersebut ke dalam medium Nutrient Broth (NB) dan diinkubasi selama 24 jam pada suhu 37oC. Untuk keperluan bioassay, kekeruhan bakteri diatur sebesar 0,5 skala McFarland (5%) yang setara dengan kerapatan sel sebesar 108 sel/mL.
Uji Daya Hambat
Uji daya hambat dilakukan pada larutan uji sampel dengan menggunakan metode sumur difusi (modifikasi metoda Bauer et al. 1966) Sampel dengan konsentrasi 100% sebanyak 20 µL (pada penelitian pendahuluan) dimasukkan ke dalam sumur difusi yang sebelumnya dibuat dengan jarak yang sama pada media Nutrient Agar (NA) yang telah di swab bakteri uji, dibiarkan selama 15 menit sampai larutan uji
sampel berdifusi, dan diinkubasi selama 1x24 jam pada suhu 37oC. Setelah diinkubasi, dilakukan pengukuran zona hambat yang terbentuk dalam empat kuadran, kemudian dihitung rata-rata dan standar deviasinya.
Uji MIC (Minimum Inhibitory Concentration)
Uji MIC dilakukan pada larutan uji sampel dengan variasi konsentrasi antara 15% - 50% terhadap bakteri E. coli dan S. aureus. Cawan Petri yang telah berisi media Nutrient Agar (NA) di swab bakteri uji. Sumur difusi dibuat sesuai jumlah perlakuan yang digunakan. Larutan uji sampel dan pelarut (etanol 95%) sebagai kontrol masing-masing sebanyak 20µL dimasukkan ke dalam sumur difusi yang sebelumnya dibuat, kemudian dibiarkan selama 15 menit sampai larutan uji sampel berdifusi, dan diinkubasi selama 1x24 jam pada suhu 37oC. Setelah diinkubasi, dilakukan pengukuran zona hambat yang terbentuk pada setiap perlakuan dalam empat kuadran yang berbeda, dan hasilnya dirata-ratakan serta dilakukan penentuan nilai standar deviasinya. Konsentrasi terkecil yang memberikan zona hambat pada bakteri uji merupakan nilai MIC dari bahan yang diuji potensinya. Bila konsentrasi terendah dari assay ini menghasilkan zona hambat, maka MIC ditentukan dengan cara mengencerkan larutan madu dan propolis (15%) sehingga diperoleh konsentrasi antara 1-14%.
Uji LC50 (Lethal Concentration 50%)
Pengujian LC50 dilakukan dengan menggunakan metode pour plate (cawan tuang). Sebanyak 1mL larutan uji sampel dengan konsentrasi 15%-50% dimasukkan ke dalam cawan Petri. Selanjutnya, suspensi bakteri sebanyak 1 mL ditambahkan ke dalam cawan Petri lalu dicampurkan dengan media Nutrient agar (NA) secara merata. Homogenisasi dilakukan secara perlahan, kemudian diinkubasi pada suhu 37oC selama 1x24 jam. Pelarut digunakan sebagai pengencer berfungsi sebagai kontrol. Setelah inkubasi, dilakukan perhitungan koloni yang tumbuh dengan menggunakan counter. Hasil yang diperoleh kemudian diplot
pada kurva yang menunjukkan hubungan antara konsentrasi madu dengan kerapatan sel mikroba uji dan ditentukan persamaan regresinya. Nilai LC50 selanjutnya dihitung dari persamaan regresi tersebut.
Analisis Data
Data yang diperoleh (setelah diuji normalitasnya) dianalisis secara kuantitatif dengan menggunakan analisis sidik ragam dengan bantuan software SPSS versi 26. Bila hasil yang diperoleh berbeda nyata (p<0,05), maka dilanjutkan dengan analisis uji jarak berganda Duncan.
HASIL
Efektivitas madu kele dan propolis dalam menghambat pertumbuhan S. aureus dan E. coli dapat dilihat pada Gambar 1. Daya hambat madu kele dan propolis (konsentrasi 100%) terhadap S. aureus secara berturut-turut sebesar 12,50 ± 1,09 mm dan 15,50 ± 1,08 mm, sedangkan daya hambat madu kele dan propolis terhadap Escherichia coli secara berturut-turut sebesar 6,60 ± 0,60 mm dan 8,10 ± 1,00 mm. Diameter yang terbentuk setelah perlakuan dengan madu kele dan propolisnya jauh lebih rendah jika dibandingkan dengan kontrol positif (Chloramphenicol), dan nilai-nilai zona hambat yang ditunjukkan oleh madu kele dan propolisnya berbeda nyata secara statistik, jika dibandingkan dengan kontrol (Tabel 1).
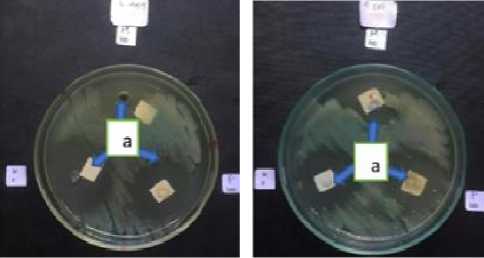
(A) (B)
Gambar 1. Daya hambat madu dan propolis (A) terhadap S. aureus; dan (B) terhadap E. coli. Keterangan: a = Zona hambat, M100 = madu (100%), P100 = propolis (100%), K+ = Kontrol positif (Chloramphenicol)
Tabel 1. Zona Hambat Madu Kele dan Propolis pada S. aureus dan E. coli dalam bioassay menggunakan metoda sumur difusi
|
Perlakuan |
Zona Hambat (mm)* | |
|
S. aureus |
E. coli | |
|
K(+) |
33,20 ± 1,60 e |
24,3 ± 1,86 d |
|
M100 |
12,50 ± 1,09 b |
6,60 ± 0,60 a |
|
P100 |
15,50 ± 1,08 c |
8,10 ± 1,00 a |
*Nilai-nilai pada Tabel 2± standar deviasi merupakan rata-rata dari 5 kali ulangan. Nilai-nilai yang diikuti oleh huruf yang sama merupakan rerata yang tidak berbeda nyata (p>0,05) berdasarkan uji jarak berganda Duncan, setelah dilakukan analisis sidik ragam (Anova). Keterangan: K(+) (antibiotik chloramphenicol), M100 (100% madu Kele), dan P100 (100% propolis).
Uji MIC (Minimum Inhibitory Concentration) yang dilakukan dengan metode sumur difusi, hasilnya ditunjukkan pada Gambar 2. Nilai MIC madu kele dan propolis pada bakteri S. aureus adalah sebesar 15% dengan diameter zona hambat berturut-turut sebesar 12,50 ± 0,85 mm dan 15,50 ± 1,08 mm. Sementara itu, nilai MIC madu kele
dan propolis pada bakteri E. coli juga sebesar 15% dengan diameter zona hambat berturut-turut sebesar 6,60 ± 0,60 mm dan 8,10 ± 1,00 mm (Tabel 2). Secara umum terjadi peningkatan diameter zona hambat pada kedua bakteri uji yang sejalan dengan peningkatan konsentrasi madu dan propolisnya (Tabel 2).
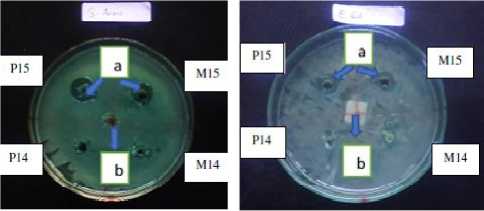
(A) (B)
Gambar 2. Uji MIC madu dan propolis (A) terhadap S. aureus; dan (B) terhadap E.coli. Keterangan: a = zona hambat, b = kontrol (etanol 95%), M15= madu(15%), P15(propolis 15%), M14=
madu(14%), P14(propolis 14%).
Tabel 2. Diameter zona hambat Madu Kele dan Propolis pada bakteri S. aureus dan E. coli yang dipakai untuk menentukan nilai MIC
|
Perlakuan |
Zona Hambat (mm)* | |
|
S. aureus |
E. coli | |
|
K(-) |
0,00 ± 0,00a |
0,00 ± 0,00 a |
|
M15 |
1,25 ± 0,85 b |
0,80 ± 0,48 b |
|
M20 |
2,50 ± 0,68 c |
1,45 ± 0,59 c |
|
M30 |
3,35 ± 0,58 d |
2,25 ± 0,39 d |
|
M40 |
4,05 ± 0,65 e |
2,45 ± 0,76 e |
|
M50 |
6,20 ± 0,65 f |
3,35 ± 0,52 f |
|
P15 |
1,70 ± 0,33 b |
0,85 ± 0,29 b |
|
P20 |
2,60 ± 0,29 c |
1,40 ± 0,29 c |
|
P30 |
4,20 ± 0,33 e |
2,40 ± 0,45 e |
|
P40 |
5,35 ± 0,29 f |
4,00 ± 0,56 f |
|
P50 |
6,50 ± 0,47 g |
4,55 ± 0,65 g |
*Nilai-nilai pada Tabel 3±standar deviasi merupakan rata-rata dari 5 kali ulangan. Nilai-nilai yang diikuti oleh huruf yang berbeda pada kolom yang sama merupakan rerata yang berbeda nyata (p<0,05) berdasarkan uji jarak berganda Duncan, setelah dilakukan analisis sidik ragam (Anova). Keterangan: K(-) (larutan alkohol 95%), M15 (15% madu Kele), M20 (20% madu Kele), M30 (30% madu Kele), M40 (40% madu Kele), M50 (50% madu Kele), P15 (15% propolis), P20 (20% propolis), P30 (30% propolis), P40 (40% propolis), P50 (50% propolis)
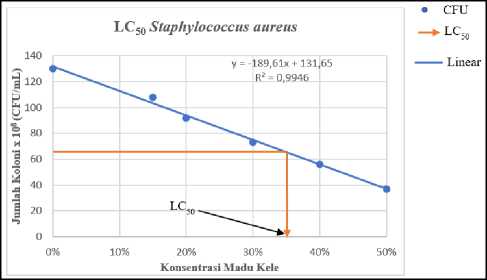
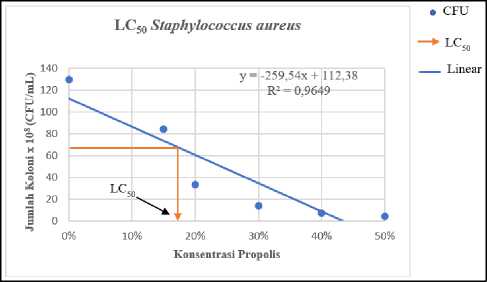
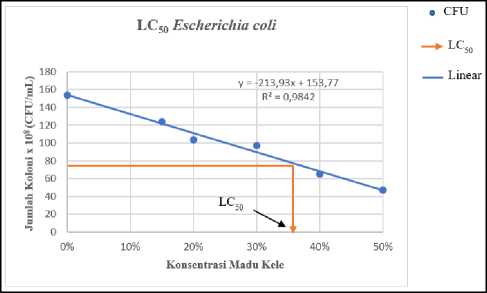
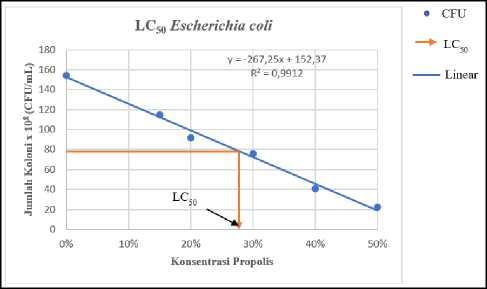
Tabel 3 menunjukkan kerapatan sel bakteri akibat perlakuan yang diberikan. Data tersebut kemudian dibuat grafik yang menunjukkan hubungan antara kerapatan sel bakteri uji terhadap konsentrasi madu kele dan propolisnya, kemudian dilanjutkan dengan menentukan persamaan regresinya (Gambar 3). Persamaan ini
kemudian dipakai untuk perhitungan nilai LC50 dari madu kele dan propolisnya. Berdasarkan hasil perhitungan maka diperoleh nilai LC50 madu kele dan propolis pada S. aureus berturut-turut sebesar 35,15% (Gambar 3A) dan 18,25% (Gambar 3B). Sementara itu, nilai LC50 madu kele dan propolis terhadap E. coli berturut-turut
sebesar 35,89% (Gambar 3C) dan 28,2% (Gambar 3D). Hasil ini memberikan informasi bahwa madu kele dan propolis bersifat lebih toksik terhadap S. aureus, karena konsentrasi
yang diperlukan lebih kecil untuk menghambat 50% populasi bakteri ini jika dibandingkan dengan yang diperlukan untuk menghambat 50% populasi E. coli.
Tabel 3. Pengaruh konsentrasi madu kele dan propolis terhadap kerapatan sel E. coli dan S. aureus setelah terpapar selama 24 jam
(A)
(B)
|
Perlakuan |
Daya Hambat Sampel terhadap Kerapatan Sel Mikrobiota (CFU/mL)* S. aureus E. coli |
|
K M15 M20 M30 M40 M50 P15 P20 P30 P40 P50 |
(130,00 ± 10,77)x108h (154,00 ± 11,40)x108h (108,00 ± 10,65)x108g (124 ± 12,65)x108g (92,00 ± 8,51)x108f (104,00 ± 14,12)x108f (73,00 ± 9,56)x108e (91,00 ± 10,98)x108e (56,00 ± 10,79)x108d (65,00 ± 7,21)x108d (37,00 ± 9,82)x108c (47,00 ± 7,00)x108c (85,00 ± 10,12)x108f (115,00 ± 12,90)x108f (33,00 ± 6,82)x108d (92,00 ± 7,65)x108d (14,00 ± 4,95)x108c (76,00 ± 4,18)x108c (7,00 ± 4,48)x108b (41,00 ± 6,82)x108b (4,00 ± 2,24)x108a (22,00 ± 4,58)x108a |
*Nilai-nilai pada Tabel 4± standar deviasi merupakan rata-rata dari 5 kali ulangan. Nilai-nilai yang diikuti oleh huruf yang sama pada kolom yang sama merupakan rerata yang berbeda nyata (p>0,05) berdasarkan uji jarak berganda Duncan, setelah dilakukan analisis sidik ragam (Anova).
(C)
(D)
Gambar 3. Penentuan nilai LC50 madu dan propolis (A) Nilai LC50 madu terhadap S. aureus adalah 35,15%; (B) Nilai LC50 propolis terhadap S. aureus adalah 18,25%; (C) Nilai LC50 madu terhadap E. coli adalah 35,89%; dan (D) Nilai LC50 propolis terhadap E. coli adalah 28,2%.
PEMBAHASAN
Bakteri S. aureus dan E. coli menunjukkan sifat sensitivitasnya ketika dilakukan uji daya hambat madu dan propolis (Tabel 1), yang dilakukan dengan metode sumur difusi. Berdasarkan data yang ditunjukkan pada Tabel 1, Madu kele dan propolis memiliki kekuatan daya hambat yang tergolong kuat (luas zona hambat 11 – 20 mm) terhadap S. aureus, sedangkan terhadap E. coli kekuatan daya hambatnya tergolong sedang (luas zona hambat 6 – 10 mm). Fenomena yang sama juga ditunjukkan oleh kontrol positif (chloramphenicol), walaupun zona hambat yang ditunjukkan oleh madu kele dan propolisnya pada kedua bakteri uji jauh lebih kecil daripada yang dihasilkan oleh kontrol positif ini (secara statistik berbeda nyata pada p<0,05).
Secara umum terlihat pada Tabel 1 bahwa propolis bersifat lebih toksik terhadap kedua bakteri uji jika dibandingkan dengan madu yang diperlakukan pada taraf konsentrasi 100%. Zona hambat yang dihasilkan propolis pada biakan S. aureus berbeda nyata secara statistik (p<0,05) jika dibandingkan dengan yang ditunjukkan oleh madu kele pada konsentrasi yang sama. Sementara itu, zona hambat yang dihasilkan oleh madu kele dan propolis terhadap biakan E. coli menunjukkan hasil yang tidak berbeda nyata secara statistik (p>0,05), walaupun secara visual zona hambat yang dihasilkan oleh propolis relatif lebih besar daripada madu kele. Zona hambat yang terjadi pada kedua bakteri uji dapat disebabkan oleh beberapa senyawa toksik yang terkandung pada kedua bahan uji. Menurut Leliqia et al. (2021), madu kele mengandung senyawa-senyawa yang termasuk dalam golongan saponin, flavonoid, polifenol, dan steroid/triterpenoid. Beberapa penelitian sebelumnya, seperti Khongkwanmueang et al. (2020) dan Al Kafaween et al. (2019) melaporkan bahwa senyawa-senyawa tersebut mempunyai aktivitas antibakteri. Penelitian serupa yang dilakukan oleh Dewi et al. (2017) juga melaporkan bahwa madu yang dihasilkan oleh lebah dari genus Tetragonula memiliki daya hambat terhadap S. aureus dan E. coli.
Selain golongan senyawa kimia di atas (saponin, flavonoid, polifenol, dan steroid/triterpenoid), tingkat keasaman (pH) madu kele juga diduga sebagai penyebab terbentuknya zona hambat. Dalam penelitian ini dan juga yang dilaporkan oleh Nur et al. (2019) menyebutkan bahwa pH madu kele tergolong asam (pH ±4). Secara umum bakteri patogen dapat dengan mudah mengalami kematian bila terpapar lingkungan asam (Sutrisna et al., 2015). Dalam lingkungan asam akan terjadi aliran proton (dalam bentuk H+) secara berlebih dari lingkungan menuju sitoplasma sel bakteri, sehingga terjadi akumulasi ion H+ di dalam sitoplasmanya. Hal ini akan mengakibatkan terjadinya penurunan pH sitoplasma secara drastis dan pada akhirnya mengganggu proses-proses penting didalam sel, seperti rusaknya fungsi membrane plasma, terganggunya proses sintesa protein, atau terganggunya proses replikasi DNA (Rati et al., 2010). Pada kelompok patogen yang tidak memiliki mekanisme pompa proton, masuknya ion H+ dari luar ke dalam sitoplasmanya akan menyebabkan pH di dalam sitoplasma menjadi lebih rendah daripada lingkungannya. Fenomena ini dapat menjadi penyebab kematian bakteri uji ketika dipaparkan pada lingkungan asam yang disebabkan oleh madu dan propolis pada penelitian ini.
Propolis yang dipakai dalam penelitian ini memberikan zona hambat yang lebih tinggi daripada madu karena kandungan senyawa kimianya lebih kompleks daripada madu (Mentari et al., 2018). Selain flavonoid, tanin dan steroid, propolis juga mengandung pinocembrin, galangin, pinobanksin, kumarat (coumaric), asam kafeat (caffeic acid), prenylated p-coumaric dan diterpenic acids. Semua senyawa tersebut dilaporkan oleh Susilo et al. (2009) mempunyai aktivitas antibakteri. Pinocembrin, selain mempunyai aktivitas anti bakteri, juga dilaporkan memiliki aktivitas anti jamur (Castaldo & Capasso, 2002). Dalam propolis juga terkandung derivat caffeoylquinic acid yang memiliki sifat imunomodulator dan hepatoprotective yang dapat menghambat pertumbuhan beberapa bakteri. Menurut Junior et al. (2015) ekstrak etanol
propolis dapat bekerja secara sinergis dengan berbagai antibiotika, seperti kloramfenikol, gentamisin, netilmisin, tetrasiklin dan vankomisin dalam menghambat pertumbuhan bakteri S. aureus.
Data yang ditunjukkan pada Tabel 1 sejalan dengan laporan Hegazi & El Hady (2001) yang menyatakan bahwa propolis menunjukkan aktivitas antibakteri yang kuat terhadap kelompok bakteri Gram positif seperti S. aureus, tetapi agak lemah terhadap bakteri Gram negatif antara lain E. coli. Mekanisme kerja propolis dalam menghambat pertumbuhan bakteri diulas secara mendalam oleh Takasi et al. (1994) yang menyatakan bahwa propolis menghambat pertumbuhan bakteri dengan cara mencegah pembelahan sel, mengganggu aktivitas sitoplasma sel, melisis dinding sel, dan mengganggu sintesis protein. Yuliana et al. (2015) dan Wibowo et al. (2017) menyatakan selain dapat menghambat bakteri patogen, propolis juga dapat menghambat fungi patogen.
Madu kele dan propolisnya mengandung flavonoid. Flavonoid dapat berperan dalam menghambat pertumbuhan bakteri patogen melalui beberapa mekanisme, yaitu mengganggu sintesis asam nukleat, mengganggu fungsi kerja membran sel dan menyebabkan lisis terhadap dinding sel (Prestianti et al., 2018). Kandungan fenol pada madu dan propolis dapat merusak membran sel dengan cara mendenaturasi protein dinding sel, sehingga mengganggu mekanisme transport materi melewati membran. Dengan kata lain permeabilitas membran akan terganggu akibat protein yang terkandung didalamnya terdenaturasi oleh senyawa fenol yang terkandung dalam madu dan propolis (Pelczar & Chan, 2008). Tidak hanya flavonoid, madu dan propolis juga mengandung saponin yang dapat merusak membran sel, sehingga integritas membran menjadi terganggu atau mengalami kerusakan yang fatal (Hasan et al., 2019). Saponin yang terdiri dari bagian hidrofilik dan lipofilik dapat menyebabkan terjadinya gangguan pada permeabilitas atau rusaknya membran sel bakteri,
sehingga sel dapat mengalami kebocoran yang berujung pada kematian sel.
Dalam uji MIC (Minimum Inhibitory Concentration) tampak jelas efek peningkatan konsentrasi madu dan propolis terhadap peningkatan diameter zona hambat pada kedua bakteri uji (Tabel 2). MIC merupakan konsentrasi terkecil dari sampel uji yang dapat menghambat pertumbuhan S. aureus dan E. coli. Pada penelitian ini diperoleh nilai MIC madu kele dan propolis pada S. aureus dan E. coli sebesar 15% (v/v). Pada Tabel 2 dan 3 jelas terlihat bahwa diameter zona hambat madu kele dan propolis relatif lebih besar terhadap S. aureus dibandingkan terhadap E. coli. Hal ini menunjukkan bahwa S. aureus memiliki sensitivitas yang lebih tinggi terhadap madu kele dan propolis jika dibandingkan dengan E. coli. Jika dibandingkan dengan kontrol, semua perlakuan menunjukkan hasil yang berbeda nyata secara statistik pada p<0,05 (Tabel 2 dan 3). Zona hambat yang terbentuk pada uji ini disebabkan oleh senyawa aktif yang terkandung pada perlakuan, karena pada kontrol negatif tidak terbentuk zona hambat. Penelitian serupa yang dilakukan oleh Rajeswari et al. (2010) melaporkan bahwa konsentrasi minimum madu yang dihasilkan lebah Apis dorsata terhadap S. aureus dan E. coli adalah berturut-turut sebesar 25% dan 40%. Hal ini mengindikasikan bahwa madu kele yang dihasilkan oleh kelompok lebah dari genus Tetragonula lebih toksik terhadap S. aureus dan E. coli daripada madu yang dihasilkan oleh lebah A. dorsata. Penelitian yang dilakukan Ristivojević et al. (2016) juga menunjukkan bahwa zona hambat yang terbentuk lebih besar pada bakteri Gram positif daripada bakteri Gram negatif pada MIC propolis. Rahman et al. (2010) menyatakan nilai MIC kombinasi madu dan propolis dalam menghambat bakteri patogen lebih rendah dibandingkan dengan madu atau propolis dalam menghambat bakteri patogen. Penelitian serupa juga dilakukan oleh Becerril-Sánchez et al. (2021) yang menemukan bahwa kandungan senyawa flavonoid pada madu dan propolis bekerja secara sinergis dalam menghambat pertumbuhan bakteri patogen.
Data pada Tabel 2 dan 3 sejalan dengan yang ditunjukkan pada Gambar 3. Pada uji ini, konsentrasi madu kele dan propolis yang dapat menyebabkan kematian 50% bakteri uji (LC50) ditentukan berdasarkan regresi linier yang menunjukkan hubungan antara kerapatan sel bakteri uji terhadap konsentrasi madu dan propolis. Pada gambar 3A dan gambar 3C terlihat bahwa madu kele relatif lebih toksik terhadap S. aureus jika dibandingkan dengan terhadap E. coli, dengan nilai LC50 berturut-turut sebesar 35,15% dan 35,89%. Fenomena serupa juga ditunjukkan oleh propolis pada bakteri S. aureus dan E. coli dengan nilai LC50 berturut-turut sebesar 18,25% dan 28,2%. Hasil yang diperoleh pada penelitian ini (Gambar 3) sejalan dengan yang dilaporkan oleh Araya et al, (2020) yang menyatakan bahwa madu yang dihasilkan oleh kelompok lebah Tetragonula memiliki tingkat toksisitas yang lebih tinggi pada bakteri Gram positif jika dibandingkan dengan pada bakteri Gram negatif. E. coli memiliki ketahanan yang lebih tinggi dibandingkan dengan S. aureus, dan hal ini disebabkan enzim degradatif dan impermeabilitas selular yang dimiliki oleh E. coli. Selain itu, pada E. coli juga terdapat arabginogalaktan yang membatasi senyawa aktif biosida untuk mencapai daerah target (Zechner et al., 2020). Secara umum, dapat diketahui bahwa daya hambat madu kele dan propolis terhadap S. aureus dan E. coli termasuk golongan bakteriostatik. Bakteriostatik merupakan golongan daya hambat yang mampu menekan pertumbuhan dari suatu bakteri (Przybyłek et al., 2020). Perbedaan daya hambat antara madu dan propolis diakibatkan oleh bahan yang digunakan lebah dalam pembuatan propolis dan madu sehingga dapat mempengaruhi jenis senyawa aktif yang terkandung (Zahra et al., 2021).
SIMPULAN
Madu dan propolis dapat menghambat pertumbuhan S. aureus dan E. coli pada perlakuan 100% konsentrasi. Kisaran zona hambat propolis pada E. coli dan S. aureus berturut-turut adalah 8,10 ± 1,00 mm dan 15,50 ± 1,08 mm , sementara
itu zona hambat madu pada kedua bakteri tersebut berturut-turut sebesar 6,60 ± 0,60 mm dan 12,50 ± 1,09 mm. Daya hambat madu dan propolis terhadap S. aureus termasuk kategori kuat sedangkan terhadap E.coli termasuk kategori sedang. Madu dan propolis dapat menghambat pertumbuhan S. aureus dan E. coli dengan batas konsentrasi hambat minimum sebesar 15%. Nilai LC50 madu terhadap kedua bakteri tersebut sebesar 35,15% dan 35,89%, sedangkan nilai LC50 propolis terhadap kedua bakteri tersebut sebesar 18,25% dan 28,2%. Tingkat toksisitas madu dan propolis lebih besar terhadap S. aureus dibandingkan E. coli.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada Pengelola Petapan Park Desa Aan, Klungkung, Bali yang telah memberikan kesempatan untuk mengambil sampel yang kami perlukan untuk diuji di laboratorium. Penulis juga mengucapkan terima kasih kepada Kepala Laboratorium Mikrobiologi, Prodi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) Universitas Udayana yang telah memberikan izin menggunakan peralatan yang kami perlukan selama penelitian, sehingga penelitian ini dapat terselesaikan.
KEPUSTAKAAN
Agussalim, Umami N, Nurliyani, and Agus A. 2021. The physicochemical composition of honey from Indonesian stingless bee(Tetragonula laeviceps). Biodiversitas 22(8): 3257-3263. DOI:
10.13057/biodiv/d220820.
Andreasen CB. 2008. Staphylococcosis in Diseases of Poultry. 12th ed. Blackwell Publishing: USA.
Araya K, Arpatsorn N, Lars S, and Jakkrawut M. 2020. Physicochemical Profiles, Antioxidant and Antibacterial Capacity of Honey from Stingless Bee Tetragonula laeviceps Species Complex. E3S Web of Conferences 141: 03007. DOI:
10.1051/e3sconf/202014103007
Bauer AW, Kirby WMM, Sherris JC, and Turck M. 1966. Antibiotic Susceptibility Testing by a Standardized Single Disk
Method, American Journal of Clinical Pathology 45: 493–
496, https://doi.org/10.1093/ajcp/45.4_ts.49 3
Becerril-Sánchez AL, Quintero-Salazar, B, Dublán-García, O, and Escalona-Buendía HB. 2021. Phenolic Compounds in Honey and Their Relationship with Antioxidant Activity, Botanical Origin, and
Color. Antioxidants 10: 1700.
https://doi.org/10.3390/antiox10111700.
Cowan MM. 1999. Plant Products as Antimicrobial Agents. Clinical Microbiology Reviews. 12: 564-582.
Dewi MA, Kartasasmita RE, Wibowo MS. 2017. Uji Aktivitas Antibakteri Beberapa Madu Asli Lebah Asal Indonesia Terhadap Staphylococcus aureus dan Eschericia coli. Kartika-Jurnal Ilmiah Farmasi 5(1):27-30.
Dewi MK. 2014. Aktivitas Antibakteri Ekstrak Daun Majapahit (Cresentia cujete) terhadap Pertumbuhan Bakteri Ralstonia
solanacearum Penyebab Penyakit Layu. Jurnal Lentera Bio 3(1) : 51-57.
Dewantari M, Suranjaya IG. 2019. Pengembangan Budidaya Lebah Madu Trigona spp. Ramah Lingkungan di Desa Antapan Kecamatan Baturiti Kabupaten Tabanan. Buletin Udayana Mengabdi 18(1): 114-119.
Dewantari M, Sumardani NLG dan Suranjaya IG. 2020. Pengembangan Budidaya Lebah Madu Lokal “Kele-Kele” (Trigona Spp) Pada Masyarakat Pinggiran Hutan Di Kecamatan Pupuan Kabupaten Tabanan. Buletin Udayana Mengabdi 19(1): 6-11.
Fhitryani S, Suryanto D, Karim A. 2017. Pemeriksaan Escherichia coli,
Staphylococcus aureus dan Salmonella sp. pada Jamu Gendong yang Dijajakan di Kota Medan. BIOLINK(Jurnal Biologi
Lingkungan Industri Kesehatan) 3(2): 14655.
Fitrianingsih SP, Lestari F, Aminah S. 2014. Uji Efek Antioksidan Ekstrak Etanol Kulit Buah Salak (Salacca zalacca Gaertner Voss) Dengan Metode Perendaman DPPH. Prosiding Seminar Nasional Penelitian dan
PKM Sains, Teknologi dan Kesehatan 4(1): 49-54.
Gnanamani A, Hariharan P, Paul-Satyaseela M. 2017. Staphylococcus aureus: Overview of Bacteriology, Clinical Diseases,
Epidemiology, Antibiotic Resistance and Therapeutic Approach. Frontiers
inStaphylococcus aureus 4:28.
Hasan AZ, Artika IM, Popi AK, Lasmiyanti M. 2019. Propolis sebagai Alternatif Bahan Antikaries Gigi. Chemistry Progress 4(1): 45-53.
Hegazi AG, Abd El Hady FK. 2001. Egyptian propolis: 1-antimicrobial activity and
chemical composition of Upper Egypt propolis. Zeitschrift für
Naturforschung 56(1-2): 82-88.
Hemraj V, Diksha, Avneet. 2013. A Review on commonly used Biochemichal Test for Bacteria. Journal of Life Science 1(10): 1-7.
Hayhurst C. 2004. Epidemics Deadly Diseases Throughout History E. coli. The Rosen Publishing Group: New York.
Junior AF, Dalestrin AC, Betoni JEC, Orsi RO, da Cunha MLRS, Montelli AC. 2005. Propolis: Anti-Staphylococcus aureus
activity atid Synergism with Antimicrobial drugs. Mem Inst Oswaldo Cruz. 100(5): 563566.
Khongkwanmueang A, Nuyu A, Straub L, Maitip J. 2020. Physicochemical Profiles, Antioxidant and Antibacterial Capacity of Honey from Stingless Bee Tetragonula laeviceps Species Complex. In E3S Web of Conferences EDP Science 14: 1-6.
Lai Y, Masatoshi H, Ma Y, Guo Y and Zhang B (2022) Role of Vitamin K in Intestinal Health. Front. Immunol. 12: 791565. doi: 10.3389/fimmu.2021.791565.
Leboffe MJ, Pierre BE. 2011. A Photographic Atlas for The Microbiology Laboratory. Morton: London.
Leliqia NPE, Trisna NKCA, Paramita NLPV. 2021. Potensi Madu Kele Bali Dan Kombinasinya Dengan VCO Sebagai Antiacne. SCIENTIA: Jurnal Farmasi dan Kesehatan 11(1): 88-95.
McDevitt SF. 2010. Methyl red test on Escherichia coli and Enterobacter aerogenes. American Society for Microbiology: USA.
Mentari IN, Arifin Z, dan Kurniawan E. 2018. Efektivitas Antibakteri Madu dan Propolis terhadap Bakteri Staphylococcus aureus. Media of Medical Laboratory Science 2(1): 1-12.
Murali A, Patel S. 2017. The Effect of Different Heavy Metal Acetate Solutions on the Inhibition of Catalase Enzyme. Journal of the South Carolina Academy of Science 15(2): 13.
Mustafidah CS, Alimudddin. 2015. Uji Fitokimia, Toksisitas dan Aktivitas Antibakteri dari Ekstrak Berbagai Fraksi Daun Mahang ( Macarang apruinosa (Miq.) Mull. Arg.) terhadap Bakteri Escherichia coli dan Staphylococcus aureus. Jurnal kimia Mulawarman 12(2): 83-88.
Naylor SW, Gally DL, Low JC. 2005. Enterohaemorrhagic E. coli in Veterinary Medicine. International Journal of Medical Microbiology 295(6-7):419-441.
Pelczar MJ, Chan ECS. 2008. Dasar-Dasar Mikrobiologi 2. Penerbit Universitas Indonesia: Jakarta.
Pratami HA, Apriliana E, Rukmono P. 2013. Identifikasi Mikroorganisme pada Tangan Tenaga Medis dan Paramedis di Unit Perinatologi Rumah Sakit Abdul Moeloek Bandar Lampung. Jurnal Majority 2(5): 8594.
Prestianti I, Baharuddin M, Sappewali S. 2018. Uji Aktivitas Antibakteri Ekstrak Sarang Lebah Hutan (Apis dorsata) terhadap
Pertumbuhan Staphylococcus aureus,
Escherichia coli, dan Pseudomonas
aeruginosa, ALCHEMY Jurnal Penelitian Kimia 14(2): 314-322.
Przybyłek I, Karpiński TM. 2019. Antibacterial Properties of Propolis. Molecules. 24(11):
2047.
https://doi.org/10.3390/molecules24112047
Puspawati NN, Nuraida L, Adawiyah DR. 2010. Penggunaan Berbagai Jenis Bahan Pelindung untuk Mempertahankan Viabilitas Bakteri Asam Laktat yang di Isolasi dari Air Susu Ibu pada Proses Pengeringan Beku. Jurnal Teknologi dan Industri Pangan 21(1): 59-59.
Putri RN. 2019. Perbandingan Sistem Kesehatan di Negara Berkembang dan Negara Maju. Jurnal Ilmiah Universitas Batanghari Jambi 19(1): 139-146.
Radji M. 2011. Buku Ajar Mikrobiologi: Panduan Mahasiswa Farmasi dan Kedokteran. EGC: Jakarta.
Rahman MM, Richardson A, and Sofian-Azirun M. 2010. Antibacterial activity of propolis and honey against Staphylococcus aureus and Escherichia coli. African Journal of Microbiology Research 4(16): 1872-1878.
Rajeswari T, Venugopal A, Viswanathan C, Kishmu L, Venil CK, Sasikumar JM. 2010. Antibacterial Activity of Honey Against Staphylococcus aureus from Infected Wounds. Pharmacologyonline 1:537-541.
Razak A, Djamal SH, Revilla G. 2013. Uji Daya Hambat Air Perasan Buah Jeruk Nipis (Citrus aurantifolia s.) Terhadap Pertumbuhan Bakteri Staphylococcus aureus Secara In Vitro. Jurnal Kesehatan Andalas 2(1): 5-8.
Ristivojević P, Dimkić I, Trifković J, Berić T, Vovk I, Milojković-Opsenica D, Stanković S. 2016. Antimicrobial Activity of Serbian Propolis Evaluated by Means of MIC, HPTLC, Bioautography and
Chemometrics. PloS One 11(6): 1-15.
Riyandoko RS. 2016. Memelihara Lebah
Trigona: Panen Madu Tanpa
Tersengat. Lembar Informasi Kanoppi 3: 14.
Sakagami SF. 1978. Tetragonula Stingless Bees of the Continental Asia and Sri Lanka (Hymenoptera, Apidae). Journal Faculty of Science 21(2): 165-247.
Soedarto. 2014. Mikrobiologi Kedokteran : Medical Microbiology. Sagung Seto: Jakarta.
Sridhar RPN. 2006. IMVic reaction. Dept. Of Microbiology. JJMMC: Davangere.
Susanto D, Sudrajat, Ruga R. 2012. Studi Kandungan Bahan Aktif Tumbuhan Meranti Merah (Shorea leprosula Miq) Sebagai Sumber Senyawa Antibakteri.
Mulawarmnan Scientific 11(2): 181-190.
Sutrisna R, Ekowati CN, Sinaga ES. 2015. Pengaruh pH terhadap Produksi Antibakteri oleh Bakteri Asam Laktat dari Usus Itik. Jurnal Penelitian Pertanian
Terapan 15(3): 234-238.
Suardana IW, Sumiarto B., Lukman DW. 2007. Isolasi dan identifikasi E. coli O157:H7 pada daging sapi di Kabupaten Badung Provinsi Bali. Jurnal Veteriner 8(1): 16-23.
Takasi KNB, Schilr H. 1994. Electron microscopic investigation of the possible Mechanism of the antibacterial action of propolis. Provenance Planta Med. 60(3): 222 – 227.
Tripathi N, Sapra A. 2020. Gram Staining. StatPearls: Florida
Wibowo A, Widjiastuti I, Saraswati W. 2017. Konsentrasi Bunuh Minimal (KBM) Ekstrak Propolis Lawang Terhadap Candida albicans. Conservative Dentistry
Journal 7(1): 37-42.
Yuliana R, Sutariningsih E, Santoso HB, Riendrasari SD. 2015. Daya Antimikrobia Sarang Lebah Madu Trigona spp terhadap Mikrobia Patogen. Bioedukasi: Jurnal
Pendidikan Biologi 8(1): 67-72.
Yuliati. 2017. Uji Efektivitas Larutan Madu Sebagai Antibakteri Terhadap Pertumbuhan Staphylococcus aureus dan Pseudomonas aeruginosae dengan Metode Disk Diffusion. Jurnal Profesika Medika 11(1): 7-15.
Zahra NN, Muliasari H, Andayani Y, Sudarma IM. 2021. Analisis Kadar Fenolik Total dan Aktivitas Antiradikal Bebas Madu dan Propolis Trigona sp. Asal Lombok Utara. Analit: Analytical and Environmental Chemistry 6(1): 74-82.
Zechner V, Sofka D, Paulsen P, Hilbert F. 2020. Antimicrobial Resistance in Escherichia coli and Resistance Genes in Coliphages from a Small Animal Clinic and in a Patient Dog with Chronic Urinary Tract Infection. Antibiotics 9(10): 652.
https://doi.org/10.3390/antibiotics9100652
164
Discussion and feedback