The effect of liquid fertilizer formulation based on organic waste with the addition of a phosphate solubilizing microbial consortium on the growth of cayenne pepper Plants (Capsicum frutescens L.)
on
JURNAL BIOLOGI UDAYANA 26(1): 32-44
P ISSN: 1410-5292 E ISSN: 2599-2856
Pengaruh formulasi pupuk cair berbasis limbah organik dan penambahan konsorsium mikroba pelarut fosfat terhadap pertumbuhan tanaman cabai rawit (Capsicum frutescens L.)
The effect of liquid fertilizer formulation based on organic waste with the addition of a phosphate solubilizing microbial consortium on the growth of cayenne pepper Plants (Capsicum frutescens L.)
Ni Putu Yuliatiningsih*, Ida Bagus Gede Darmayasa, Made Ria Defiani
Program Studi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana, Bukit Jimbaran, Bali, Indonesia – 80361
*Email: yuliatiningsihniputu@gmail.com
Diterima 13 Juli 2021 Disetujui 21 Januari 2022
INTISARI
Tanaman cabai rawit (Capsicum frutescens L.) merupakan salah satu tanaman hortikultura yang memiliki nilai gizi dan nilai ekonomi tinggi. Peningkatan produksi cabai dapat dilakukan dengan upaya perbaikan kesuburan tanah melalui pemupukan yang optimal dan ramah lingkungan. Air cucian beras dapat dimanfaatkan sebagai POC yang dikombinasikan dengan molase dan mikroba pelarut fosfat (MPF). Tujuan penelitian untuk mengeksplorasi pemanfaatan formulasi POC terhadap pertumbuhan tanaman cabai rawit dan menentukan perbandingan yang tepat antara air cucian beras dan molase dengan penambahan konsorsium MPF dalam memformulasi POC. Penelitian dilakukan dengan menggunakan Rancangan Acak Lengkap (RAL) satu faktor dengan 4 ulangan. Perlakuan ada 7 yaitu Y1 = Kontrol I (tanpa perlakuan); Y2 = Kontrol II (POC komersial); Y3 = 5% air cucian beras + 5% molase + 10 mL konsorsium MPF; Y4 = 10% air cucian beras + 10% molase + 10 mL konsorsium MPF; Y5 = 15% air cucian beras + 15% molase + 10 mL konsorsium MPF; Y6 = 20% air cucian beras + 20% molase + 10 mL konsorsium MPF; dan Y7 = 25% air cucian beras + 25% molase + 10 mL konsorsium MPF. Hasil penelitian menunjukkan bahwa pemberian perlakuan Y7 memberikan respon yang baik terhadap pertumbuhan tanaman cabai rawit dibandingkan dengan pemberian perlakuan formulasi POC lainnya.
Kata kunci: Aspergillus, Capsicum frutescens, fosfat, media Pikovskaya, Pseudomonas
ABSTRACT
Chili pepper plant is one of the horticultural plants that have high nutritional value and economic value. Increasing chili production can be done by improving soil fertility through optimal and environmentally friendly fertilization. Rice dishwater can be used as a liquid organic fertilizer (LOF) combined with molasses and phosphate solubilizing microbes (PSM). The research objective was to explore the use of LOF formulations on the growth of chili pepper plants and determine the appropriate ratio between rice dishwater and molasses with the addition of a consortium of PSM in formulating LOF. The study was conducted using a one-factor completely randomized design with four replications. There are seven treatment, namely Y1 = first control (without treatment); Y2 = second control (commercial LOF); Y3 = 5% rice dishwater + 5% molasses + 10 mL consortium of PSM; Y4 = 10% rice dishwater + 10% molasses
+ 10 mL consortium of PSM; Y5 = 15% rice dishwater + 15% molasses + 10 mL consortium of PSM; Y6 = 20% rice dishwater + 20% molasses + 10 mL consortium of PSM; and Y7 = 25% rice dishwater + 25% molasses + 10 mL consortium of PSM. The Y7 treatment gave a good response to the growth of chili pepper plants.
Keywords: Aspergillus, Capsicum frutescens, fosfat, Pikovskaya medium, Pseudomonas
PENDAHULUAN
Cabai rawit (Capsicum frutescens L.) merupakan salah satu tanaman hortikultura yang memiliki nilai ekonomi tinggi, karena peranannya yang cukup besar untuk memenuhi kebutuhan domestik sebagai komoditi ekspor dan industri pangan (Nuryati et al., 2016). Produksi cabai rawit di Bali pada tahun 2018 mencapai 31.655 ton dengan luas panen sekitar 3.871 ha (Badan Pusat Statistik, 2018). Namun hasil produksi cabai rawit di Bali pada tahun 2019 mengalami penurunan. Hal ini terlihat dari data luas panen sekitar 3.704 ha dengan produksi cabai rawit sebanyak 28.656 ton (Badan Pusat Statistik, 2019).
Penurunan produksi cabai rawit dapat dipengaruhi oleh beberapa faktor lingkungan, salah satunya rendahnya ketersediaan unsur-unsur hara bagi tanaman, khususnya unsur hara fosfor (Lisa et al., 2018). Unsur hara P sebagian besar terdapat dalam bentuk senyawa kompleks yang terikat oleh koloid tanah dan sulit untuk didegradasi, akibatnya tanaman tidak dapat memanfaatkan semaksimal mungkin unsur P. Adanya pengikatan unsur P tersebut menyebabkan pemberian pupuk tidak efisien.
Salah satu alternatif yang dapat dilakukan untuk meningkatkan efisiensi pemupukan dalam mengatasi rendahnya kandungan P dalam tanah adalah dengan menambahkan mikroorganisme pelarut fosfat (MPF) ke dalam pupuk organik cair (Kalay et al., 2016). Penggunaan pupuk organik cair (POC) merupakan upaya yang dilakukan dalam memperbaiki kesuburan dan struktur tanah, serta ramah lingkungan sehingga hasil produksi terbebas dari bahan kimia yang berbahaya.
Limbah rumah tangga seperti air cucian air beras dapat dimanfaatkan sebagai POC. Air
cucian beras merupakan hasil buangan yang berasal dari suatu proses produksi baik dalam skala industri maupun rumah tangga, serta tidak memiliki nilai ekonomis. Namun demikian, POC dari air cucian beras kaya akan kandungan unsur hara antara lain C-Organik 1,03%; N-Total 0,08%; P 195,90 ppm; K 666,10 ppm; dan C/N 12,86 ratio (Afidah, 2019).
Kandungan C-Organik dan N-Total di dalam POC air cucian beras belum memenuhi persyaratan teknis standar pupuk organik berbentuk cairan yang diatur dalam Permentan No. 70/Permentan/SR.140/10/2011, karena kadar C-Organik dan N-Total yang harus terkandung adalah masing-masing berkisar ≥ 6% dan 3-6%. Sementara hasil analisa kadar C-Organik dan N-Total pada penelitian yang dilakukan oleh Afidah (2019) masing-masing hanya berkisar 1,03% dan 0,08%. Oleh karena itu perlu adanya upaya peningkatan kandungan C-Organik dan N-Total dalam POC air cucian beras dengan dilakukannya penambahan molase. Molase adalah hasil samping industri gula yang mengandung senyawa nitrogen dan kandungan gula yang cukup tinggi. Semakin besar penambahan molase, maka akan semakin besar pula kandungan C-Organik dan N-Total (Kusuma et al., 2017).
Berdasarkan dari potensi limbah air cucian beras sebagai POC terhadap pertumbuhan tanaman, maka perlu dilakukan penelitian mengenai efektivitas limbah air cucian beras dengan penambahan molase dan konsorsium MPF sebagai POC dengan mengamati pertumbuhan pada tanaman cabai rawit.
BAHAN DAN METODE
Tempat dan waktu penelitian
Penelitian dilaksanakan dari bulan Pebruari sampai Mei 2021. Pelaksanaan isolasi, skrining, karakterisasi MPF dan pembuatan formulasi POC dilakukan di Laboratorium Mikrobiologi Program Studi Biologi, Universitas Udayana.
Teknik pengambilan sampel
Pengambilan sampel tanah dilakukan secara purposive sampling yaitu teknik pengambilan sampel dengan menentukan kriteria-kriteria tertentu dengan diambil sampel tanah di rizosfer tanaman cabai rawit di daerah Bukit Jimbaran sebanyak 50 gram dari lapisan tanah horizon O dengan kedalaman 0-25 cm. Sampel tanah yang diperoleh kemudian dibawa ke Laboratorium Mikrobiologi untuk isolasi MPF (Oksana et al., 2020). Limbah air cucian beras yang digunakan yaitu air cucian pertama yang diperoleh melalui proses menggunakan tangan, dimana produk beras yang digunakan adalah beras lokal sebanyak 1 kg dalam 1 liter air.
Isolasi mikroba pelarut fosfat
Teknik isolasi mikroba pelarut fosfat dari sampel tanah dilakukan dengan metode pengenceran platting method (Suartini et al., 2013) yaitu dengan ditimbang sampel sebanyak 10 gram, kemudian dimasukkan ke dalam botol yang telah diisi 90 mL air steril dan dikocok hingga homogen, sehingga diperoleh faktor pengenceran 10-1. Hasil dari faktor pengenceran 10-1 diambil sebanyak 1 mL secara aseptik dan dimasukkan ke dalam tabung reaksi yang telah diisi 9 mL air steril, selanjutnya dikocok dengan vortex hingga homogen dan diperoleh faktor pengenceran 10-2. Pengenceran diulangi hingga diperoleh faktor pengenceran 10-8. Setelah itu, dilakukan penanaman sampel dengan metode pour plate. Faktor pengenceran (10-4, 10-5, 10-6, 10-7, 10-8) masing-masing diambil secara aseptik sebanyak 1 mL, kemudian dituangkan ke dalam cawan Petri steril secara duplo, lalu dituangkan media Pikovskaya. Cawan Petri diputar searah dan berlawanan jarum jam hingga suspensi tersebar merata dan diinkubasi selama 72 jam dengan suhu 37ºC.
Skrining mikroba pelarut fosfat
Isolat MPF diinokulasikan pada cawan Petri yang telah diisi media Pikovskaya, selanjutnya diinkubasi selama 7 hari pada suhu 28oC. Isolat-isolat yang membentuk zona bening dinyatakan sebagai MPF, kemudian dilakukan pengukuran diameter koloni dan zona bening yang terbentuk. Berdasarkan hasil pengukuran, maka dilanjutkan dengan perhitungan indeks kelarutan P dengan menggunakan rumus Sharon et al. (2016) :
IKF =
Keterangan:
DK+ ZB
DKK
IKF = indeks kelarutan P
DK = diameter koloni
ZB = zona bening
Teknik karakterisasi bakteri pelarut fosfat
Pengamatan secara makroskopis koloni bakteri pelarut fosfat yang tumbuh pada media Pikovskaya dilakukan dengan cara diamati zona bening yang terdapat disekitar koloni. Koloni dengan ciri-ciri yang berbeda kemudian dilakukan streak dengan cara diambil koloni menggunakan jarum ose yang selanjutnya digoreskan pada media Pikovskaya dan diinkubasi pada suhu 37ºC selama 24 jam. Koloni murni yang tumbuh pada media tersebut kemudian dilakukan isolasi kembali dengan cara di-streak pada media Pikovskaya miring dan disimpan di pendingin (refrigerator) pada suhu 5oC. Pengamatan secara mikroskopis koloni BPF dilakukan dengan pewarnaan Gram bakteri (Suartini et al., 2013).
Teknik karakterisasi jamur pelarut fosfat
Koloni JPF yang tumbuh pada media Pikovskaya yang memiliki bentuk dan warna yang berbeda kemudian dilakukan reisolasi dengan cara diambil hifa atau spora jamur dengan menggunakan jarum ose dan dibiakan pada cawan Petri steril yang telah diisi media Pikovskaya, kemudian diinkubasi selama 3 hari pada suhu 28oC. Koloni jamur murni yang tumbuh pada media Pikovskaya, setelah itu dilakukan reisolasi kembali pada media PDA (Potato Dextrose Agar)
dengan menggunakan jarum ose dan diinkubasi selama 7 hari pada suhu ruang. Pengamatan karakterisasi secara makroskopis koloni JPF yang tumbuh pada media Pikovskaya dilakukan dengan cara diamati bentuk morfologi dari jamur tersebut yang meliputi warna permukaan koloni jamur, warna sebalik koloni jamur, dan ada atau tidaknya garis radial atau konsentris. Adapun pengamatan secara mikroskopis JPF dilakukan dengan diamatinya hifa atau spora jamur dengan menggunakan mikroskop (Suartini et al., 2013).
Pembuatan suspensi bakteri pelarut fosfat
Isolat BPF yang telah dikultur murni pada media Pikovskaya miring, kemudian diambil dengan menggunakan jarum ose selanjutnya disuspensikan ke dalam 50 mL media Nutrient Broth (NB) yang sudah disterilkan. Tahap selanjutnya diinkubasi pada suhu 37oC selama 48 jam (Alawiah et al., 2015).
Pembuatan suspensi jamur pelarut fosfat
Isolat JPF yang telah dikultur murni pada media PDA kemudian diambil dengan menggunakan jarum tusuk selanjutnya disuspensikan ke dalam 50 mL media Potato Dexstrose Broth (PDB) yang sudah disterilkan. Tahap selanjutnya di-shaker pada kecepatan 120 rpm selama 4 hari (Litaay et al., 2017).
Penentuan formulasi pupuk organik cair
POC dari limbah air cucian beras
dikombinasikan dengan molase dan konsorsium MPF, dimana limbah air cucian beras
diasumsikan 100% dari rendaman beras sebanyak 1 kg dalam 1 liter air. Perbedaan konsentrasi setiap bahan kemudian dibuat formulasi sebagai berikut:
Y1 = Kontrol I (tanpa perlakuan)
Y2 = Kontrol II (POC komersial)
Y3 = 5% limbah air cucian beras + 5% molase + 10 mL konsorsium MPF
Y4 = 10% limbah air cucian beras + 10% molase + 10 mL konsorsium MPF
Y5 = 15% limbah air cucian beras + 15% molase + 10 mL konsorsium MPF
Y6 = 20% limbah air cucian beras + 20% molase + 10 mL konsorsium MPF
Y7 = 25% limbah air cucian beras + 25% molase + 10 mL konsorsium MPF
Pembuatan POC untuk setiap formulasi
Formulasi yang telah dibuat kemudian dipanaskan terlebih dahulu hingga mendidih lalu dimasukkan ke dalam wadah fermentasi sesuai dengan kode untuk setiap masing-masing formulasi. Konsorsium MPF dimasukkan ke dalam wadah fermentasi kemudian diaduk hingga homogen lalu ditutup. Fermentasi ini diberi aerasi dengan bantuan aerator selama 3 hari (Hindersah et al., 2020).
Penyiraman POC
Penyiraman POC dilakukan sesudah tanaman dipindahkan ke polibag sebanyak 50 mL setiap 2 minggu sekali sebanyak 3 kali selama 6 minggu pengamatan. Adapun pengamatan parameter pertumbuhan tanaman cabai rawit yaitu tinggi tanaman, inisiasi bunga, panjang akar utama, berat basah akar dan tajuk, serta berat kering akar dan tajuk.
Analisis data
Data yang diperoleh dalam penelitian ini berupa data kualitatif dan kuantitatif. Data kualitatif meliputi karakterisasi mikroskopis dan makroskopis MPF, sedangkan data kuantitatif yaitu data analisis pertumbuhan tanaman cabai rawit. Data kuantitatif yang diperoleh selanjutnya dianalisis menggunakan analisis sidik ragam (ANOVA) dengan SPSS versi 20 dan jika data yang didapatkan memiliki beda nyata pada taraf uji 5% (P≤ 0,05) maka dilanjutkan dengan uji Duncan untuk mengetahui perbedaan antar perlakuan (Lede et al., 2018).
HASIL
Hasil skrining mikroba pelarut fosfat diperoleh 6 isolat, terdiri dari 5 isolat BPF dan 1 isolat JPF dengan nilai indeks pelarutan fosfat (IKF) yang diperoleh memiliki kemampuan dalam melarutkan fosfat yang berbeda-beda. Nilai rata-
rata IKF terbesar diperoleh pada isolat dengan kode BPF2 yaitu sebesar 3,50 ± 0,71 cm dan terkecil diperoleh pada isolat kode BPF3 yaitu sebesar 1,92 ± 0,40 cm, data selengkapnya disajikan pada Tabel 1. Keenam isolat MPF tersebut memiliki karakteristik morfologi yang berbeda, dimana sebagian besar koloni berwarna putih dan memiliki bentuk bulat dan tidak beraturan. Bagian tepi koloni untuk isolat BPF ada yang berlekuk dan rata, dengan permukaan koloni/elevasi berbukit-bukit dan datar. Data selengkapnya mengenai karakteristik koloni pada masing-masing isolat dapat dilihat pada Gambar 1.
Tabel 1. Nilai rerata IKF dan karakterisasi isolat MPF
|
Isolat |
Rerata Indeks Kelarutan Fosfat ± Standar Deviasi |
|
BPF1 |
2,72 ± 0,40 |
|
BPF2 |
3,50 ± 0,71 |
|
BPF3 |
1,92 ± 0,40 |
|
BPF4 |
2,97 ± 0,52 |
|
BPF5 |
2,45 ± 0,07 |
|
JPF1 |
2,91 ± 0,07 |
Keterangan: Nilai pada Tabel 1 ± standar deviasi
merupakan persentase rata-rata dari dua ulangan

Gambar 1. Karakteristik makroskopis isolat MPF (a) BPF1; (b) BPF2; (c) BPF3; (d) BPF4; (e) BPF5; (f) JPFA.
Hasil pengamatan secara mikroskopis dengan perbesaran 400x terhadap kelima isolat BPF menunjukkan bahwa sebagian besar morfologi sel bakteri berbentuk batang (basil) dengan koloni berwarna merah dan bersifat motil. Hal ini menunjukkan bahwa kelima isolat BPF tersebut tergolong bakteri Gram negatif dengan genus Pseudomonas. Adapun pengamatan secara mikroskopis terhadap isolat JPF dalam
perbesaran 400x terlihat adanya konidia berbentuk bulat, vesikel, tangkai konidia (konidiofor), berbentuk kolumnar dan tampak kompak. Berdasarkan karakteristik mikroskopis tersebut, diketahui bahwa isolat dengan kode JPFA tergolong ke dalam genus Aspergillus. Hasil pengamatan secara mikroskopis koloni isolat MPF disajikan pada Gambar 2 dan Gambar 3.
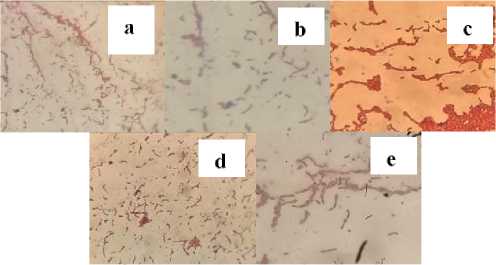
Gambar 2. Pewarnaan Gram isolat BPF menggunakan mikroskop dengan perbesaran 400x (a) BPF1; (b) BPF2; (c) BPF3; (d) BPF4; (e) BPF5

Gambar 3. Isolat JPFA secara mikroskopis dengan perbesaran 400x (a.) konidia; (b.) vesikel; (c.) konidiofor
Pengamatan tinggi tanaman cabai rawit dilakukan setiap minggu mulai dari umur 7 hari, 14 hari, 21 hari, 28 hari, 35 hari dan 42 hari setelah bibit ditanam di polibag. Pemberian perlakuan POC terhadap tinggi tanaman cabai rawit terdapat kecenderungan peningkatan tinggi tanaman pada masing-masing tanaman setelah pindah tanam (Gambar 4) untuk setiap minggunya. Rata-rata tinggi tanaman diakhir pengamatan paling besar diperoleh pada perlakuan Y2 yaitu 36,40 ± 0,14 cm, kemudian diikuti perlakuan Y7 yaitu sebesar 33,35 ± 0,19
cm. Untuk rata-rata tinggi tanaman terkecil diperoleh pada perlakuan Y1 yaitu sebesar 31,43
± 0,10 cm. Data selengkapnya terkait rata-rata tinggi tanaman dapat dilihat pada Tabel 2.
Tabel 2. Pengaruh konsentrasi POC terhadap tinggi tanaman cabai rawit (cm)
|
Perlakuan |
Rerata Tinggi Tanaman Cabai Rawit |
|
POC |
7 HST 14 HST 21 HST 28 HST 35 HST 42 HST |
|
Y1 Y2 Y3 Y4 Y5 Y6 Y7 |
8,08d 12,15e 17,30e 21,28f 25,83f 31,43f 8,80a 15,18a 19,63a 24,43a 30,38a 36,40a 8,15d 12,35de 17,45de 21,53e 26,15e 31,63e 8,23d 12,53d 17,58d 21,65e 26,28e 31,75e 8,43c 12,90c 17,90c 22,08d 26,95d 32,63d 8,55bc 13,00c 17,93c 22,45c 27,20c 32,85c 8,65ab 14,43b 18,30b 22,98b 27,90b 33,35b |
Keterangan: Nilai pada Tabel 2 merupakan rata-rata dari empat ulangan. Nilai-nilai yang diikuti huruf yang sama merupakan rerata yang tidak berbeda nyata (p>0,05) berdasarkan uji Duncan taraf 5%.
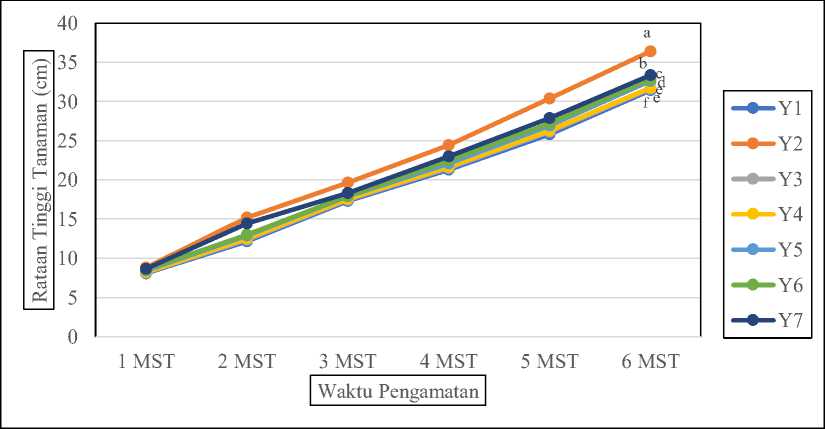
Gambar 4. Grafik rata-rata laju pertumbuhan tinggi tanaman cabai rawit. Notasi huruf yang sama pada grafik yang sama merupakan rerata yang tidak berbeda nyata (p>0,05) berdasarkan uji Duncan taraf 5%. (Y1) tanpa perlakuan; (Y2) POC komersial; (Y3) 5% air cucian beras + 5% molase + 10 mL konsorsium MPF; (Y4) 10% air cucian beras + 10% molase + 10 mL konsorsium MPF; (Y5) 15% air cucian beras + 15% molase + 10 mL konsorsium MPF; (Y6) 20% air cucian beras + 20% molase + 10 mL konsorsium MPF; (Y7) 25% air cucian beras + 25% molase + 10 mL konsorsium MPF
Pengamatan waktu inisiasi bunga dilakukan ketika pertama kali muncul bunga untuk setiap perlakuan dalam hitungan hari (HST). Waktu inisiasi bunga tercepat diperoleh pada perlakuan Y2 pada saat tanaman berumur 56,75 ± 0,96 HST, kemudian diikuti perlakuan Y7 yaitu ketika tanaman berumur 58,25 ± 0,96 HST. Adapun waktu inisiasi terlama diperoleh pada perlakuan Y1 yaitu tanaman berumur 64 ± 0,82 HST. Hasil pengamatan parameter panjang akar dilakukan
saat tanaman berumur 66 HST. Panjang akar tanaman terpanjang diperoleh pada perlakuan Y2 sebesar 24,15 ± 0,13 cm, dan diikuti oleh perlakuan Y7 sebesar 22,73 ± 0,13 cm. Sedangkan panjang akar tanaman terpendek diperoleh perlakuan Y1 sebesar 19,93 ± 0,10 cm. Data selengkapnya dapat dilihat pada Tabel 3.
Pengukuran berat basah tajuk dan berat basah akar tanaman dilakukan setelah dilakukannya pengukuran panjang akar. Berat basah tajuk dan
berat basah tertinggi diperoleh perlakuan Y2 masing-masing sebesar 9,46 ± 0,06 gram dan 7,00 ± 0,05 gram. Perlakuan Y7 menunjukkan nilai tertinggi kedua pada berat basah tajuk dan berat akar masing-masing sebesar 9,43 ± 0,03 gram dan 6,96 ± 0,02 gram. Nilai terendah diperoleh perlakuan Y1 pada berat basah tajuk dan berat basah akar masing-masing sebesar 9,16 ± 0,03 gram dan 6,72 ± 0,07 gram. Pengukuran berat kering tajuk dan berat kering akar tanaman dilakukan setelah dilakukannya pengeringan menggunakan oven. Berat kering akar dan tajuk
tertinggi diperoleh perlakuan Y2 sebesar 2,54 ± 0,10 gram dan 3,58 ± 0,08 gram, diikuti oleh perlakuan Y7 dengan berat kering akar dan tajuk masing-masing sebesar 2,51 ± 0,12 gram dan 3,49 ± 0,06 gram. Sedangkan nilai berat kering akar dan berat kering tajuk terendah diperoleh pada perlakuan Y1 sebesar 1,85 ± 0,26 gram dan 3,10 ± 0,15 gram. Hasil rata-rata pengukuran terhadap berat basah tajuk, berat basah akar, berat kering tajuk dan berat kering akar tanaman cabai rawit selengkapnya dapat dilihat pada Tabel 4.
Tabel 3. Pengaruh pemberian konsentrasi POC terhadap panjang akar utama dan inisiasi bunga tanaman cabai rawit
|
Perlakuan POC |
Parameter | |
|
PA (cm) |
IB (HST) | |
|
Y1 |
19,93 ± 0,10e |
64,00 ± 0,82a |
|
Y2 |
24,15 ± 0,13a |
56,75 ± 0,96d |
|
Y3 |
21,23 ± 0,17d |
61,50 ± 1,29b |
|
Y4 |
21,40 ± 0,08d |
61,25 ± 1,26b |
|
Y5 |
22,30 ± 0,16c |
59,25 ± 0,96c |
|
Y6 |
22,63 ± 0,15b |
59,00 ± 0,82c |
|
Y7 |
22,73 ± 0,13b |
58,25 ± 0,96cd |
Keterangan: Nilai pada Tabel 3 merupakan rata-rata dari empat ulangan. Nilai-nilai yang diikuti huruf yang sama pada kolom yang sama merupakan rerata yang tidak berbeda nyata (p>0,05) berdasarkan uji Duncan taraf 5%. PA= panjang akar utama, IB= inisiasi bunga.
Tabel 4. Pengaruh pemberian konsentrasi POC terhadap berat basah tajuk, berat basah akar, berat kering tajuk dan berat kering akar tanaman cabai rawit
|
Perlakuan |
Parameter |
BK-A (gram) | ||
|
BB-A (gram) |
BK-T (gram) | |||
|
POC |
BB-T (gram) | |||
|
Y1 |
9,16 ± 0,03d |
6,72 ± 0,07d |
3,10 ± 0,15d |
1,85 ± 0,26c |
|
Y2 |
9,46 ± 0,06a |
7,00 ± 0,05a |
3,58 ± 0,08a |
2,54 ± 0,10a |
|
Y3 |
9,18 ± 0,03cd |
6,79 ± 0,05c |
3,20 ± 0,07d |
2,11 ± 0,22b |
|
Y4 |
9,23 ± 0,05c |
6,81 ± 0,05c |
3,22 ± 0,03d |
2,11 ± 0,11b |
|
Y5 |
9,30 ± 0,02b |
6,90 ± 0,08b |
3,35 ± 0,04c |
2,36 ± 0,10a |
|
Y6 |
9,35 ± 0,06b |
6,94 ± 0,01b |
3,40 ± 0,08bc |
2,44 ± 0,08a |
|
Y7 |
9,43 ± 0,03a |
6,96 ± 0,02ab |
3,49 ± 0,06ab |
2,51 ± 0,12a |
Keterangan: Nilai pada Tabel 4 merupakan rata-rata dari empat ulangan. Nilai-nilai yang diikuti huruf yang sama pada kolom yang sama merupakan rerata yang tidak berbeda nyata (p> 0,05) berdasarkan uji Duncan taraf 5%. BB-T= berat basah tajuk, BB-A= berat basah akar, BK-T= berat kering tajuk dan BK-A= berat kering akar.
PEMBAHASAN
Keenam isolat MPF hasil skrining memiliki kesamaan yaitu membentuk zona bening pada media Pikovskaya yang terdapat disekitar koloni
mikroba. Terbentuknya zona bening di sekitar koloni tersebut membuktikan bahwa isolat yang diisolasi memiliki kemampuan dalam
menghasilkan enzim fosfatase yang dapat melepaskan unsur P dari bentuk terikat menjadi dalam bentuk terlarut. Hal ini sesuai dengan pendapat Pagiu (2013) bahwa MPF yang tumbuh pada media Pikovskaya akan membentuk koloni yang di sekelilingnya terdapat zona bening. Zona bening ini terbentuk karena adanya pelarutan P dari sumber P sukar larut yang ada dalam media oleh asam-asam organik yang dihasilkan koloni mikroba (Roekhan et al., 2020).
Perbedaan karakteristik secara makroskopis dari masing-masing isolat BPF (Gambar 1) yang telah diisolasi dari rizosfer tanaman cabai rawit, ada dugaan bahwa masing-masing isolat tersebut memiliki nama genus ataupun spesies yang berbeda-beda. Berdasarkan hal tersebut sangat perlu dilakukannya tahap identifikasi secara molekuler, sehingga masing-masing isolat dapat diketahui tingkat spesiesnya. Menurut Fakruddin et al. (2013) bahwa perbedaan karakteristik makroskopis dari masing-masing isolat BPF disebabkan oleh ekspresi dari gen yang berasal dari spesies bakteri yang berbeda-beda.
Berdasarkan hasil pengamatan secara mikroskopis dengan dilakukannya pewarnaan Gram disajikan pada Gambar 2 dapat dilihat bahwa kelima isolat BPF tersebut tergolong dalam bakteri Gram negatif. Hal ini ditandai dengan bakteri yang tetap mempertahankan warna merah pada saat proses pewarnaan Gram berlangsung. Bakteri Gram negatif akan kehilangan zat warna kristal violet akibat dari pencucian dengan alkohol, sehingga ketika diberikan zat pewarna safranin maka akan tampak berwarna merah. Perubahan warna tersebut terjadi karena adanya pengaruh pada struktur kimiawi dari dinding sel bakteri (Nuraisya et al., 2020). Adapun spesies BPF untuk kelima isolat tersebut adalah Pseudomonas sp. karena memiliki ciri-ciri yaitu memiliki sel berbentuk batang, koloni berwarna merah dan bersifat motil (Larasati et al., 2018).
Isolat JPFA memiliki karakteristik makroskopis yaitu warna permukaan koloni putih dengan warna sebalik koloni tidak memberikan warna, dan tidak adanya garis radial/konsentris.
Hasil pengamatan secara mikroskopis menggunakan mikroskop perbesaran 400x (Gambar 3) menunjukkan adanya konidia berbentuk bulat, vesikel, konidiofor, berbentuk kolumnar dan tampak kompak. Berdasarkan ciriciri tersebut isolat JPFA termasuk ke dalam genus Aspergillus. Menurut Hafsari dan Pertiwi (2017) ciri khas dari genus Aspergillus adalah konidia yang melekat pada fialid, fialid melekat pada bagian ujung konidiofor yang mengalami pembengkakkan (vesikel).
Berdasarkan nilai indeks kelarutan fosfat keenam isolat MPF yang diperoleh memiliki perbedaan kemampuan dalam melarutkan P yang ditunjukkan pada Tabel 1 BPF2 memiliki nilai IKF tertinggi yaitu sebesar 3,50 ± 0,71 cm; BPF4 memiliki nilai IKF sebesar 2,97 ± 0,52 cm; JPFA memiliki nilai IKF sebesar 2,91 ± 0,07 cm; BPF1 memiliki nilai IKF sebesar 2,72 ± 0,40 cm; BPF 5 memiliki nilai IKF sebesar 2,45 ± 0,07 cm; dan yang terendah adalah BPF3 dengan nilai IKF sebesar 1,92 ± 0,40 cm. Zona bening yang terbentuk dan adanya perbedaan indeks zona bening yang terbentuk di sekitar koloni pada media Pikovskaya menunjukkan bahwa kandidat MPF memiliki kemampuan yang berbeda-beda dalam menghasilkan enzim fosfatase. Sesuai dengan pernyataan Pagiu (2013) bahwa aktivitas pelarutan fosfat oleh MPF pada media Pikovskaya dicirikan dengan terbentuknya zona bening di sekitar koloni.
Hasil uji ANOVA menunjukkan bahwa pengaplikasian POC pada tanaman cabai rawit terhadap tinggi tanaman berpengaruh sangat nyata (P≤ 0,05) pada umur 6 MST. Rata-rata laju pertumbuhan tinggi tanaman cabai rawit (Gambar 4) menunjukkan adanya peningkatan tinggi tanaman untuk setiap perlakuan.
Berdasarkan beda rata-rata tinggi tanaman dengan menggunakan uji Duncan taraf 5% ternyata pemberian formulasi limbah organik dengan penambahan konsorsium MPF diperoleh hasil sangat berbeda nyata (P≤ 0,05) jika dibandingkan dengan kontrol negatif (Y1) disetiap pengamatan setelah pindah tanam. Hasil ini secara konsisten ditunjukkan diakhir
pengamatan (6 MST) rata-rata tinggi tanaman yang diberikan perlakuan formulasi limbah organik dengan penambahan konsorsium MPF berpengaruh nyata jika dibandingkan dengan kontrol (Y1). Hal yang menarik juga dapat dilihat, rata-rata tinggi tanaman diantara masing-masing perlakuan formulasi limbah organik dengan penambahan konsorsium MPF menunjukkan adanya perbedaan yang signifikan antara perlakuan Y3, Y4, Y5, Y6 dan Y7. Diduga adanya bahan organik dan mineral yang terkandung dalam limbah organik memberikan kontribusi yang cukup terhadap penyediaan unsur hara bagi tanaman. Molase dan limbah air cucian beras mengandung unsur hara C-Organik dan N.
C-Organik berfungsi sebagai pembangun bahan organik yang berperan penting dalam mengatur berbagai sifat tanah, kemudian sebagai penyangga persediaan unsur-unsur hara bagi tanaman (Cesaria et al., 2018). Sumber C-Organik merupakan kebutuhan utama bagi mikroba untuk melakukan pertumbuhan dan melakukan aktivitasnya, termasuk aktivitas dari MPF dalam melepaskan P yang terikat dalam tanah, sehingga P dalam bentuk ion dapat diserap dan dimanfaatkan oleh tanaman untuk pertumbuhannya. Unsur N merupakan unsur hara utama bagi pertumbuhan tanaman, yang dibutuhkan untuk pembentukan dan pertumbuhan bagian-bagian vegetatif tanaman, seperti daun, batang dan akar (Chairafahmi et al.,2018). Unsur N juga diperlukan oleh mikroba untuk mensistesis protein (Rizki et al., 2015).
Perlakuan Y2 (POC komersial) sebagai kontrol positif memberikan kontribusi yang paling baik terhadap tinggi tanaman jika dibandingkan dengan perlakuan yang lainnya. Hal ini dipengaruhi oleh komposisi unsur hara dan mineral yang lengkap dalam POC komersial merupakan faktor yang menyebabkan laju pertumbuhan tinggi tanaman lebih cepat. Adapun unsur hara dan mineral yang terkandung dalam POC komersial yang digunakan dalam penelitian ini antara lain N 15%; P2O2 12%; K2O 10%; S 1,2%; Mg 0,25%; CaO 1,80%; Fe 0,50%; Mn 1,25%; dan hormon giberelin 2,50%.
Berdasarkan Tabel 3 menunjukkan bahwa pemberian POC memberikan respon nyata (P≤ 0,05) terhadap waktu inisiasi bunga tanaman cabai rawit, karena pemberian POC dapat mendukung proses dekomposisi bahan organik pada media tanam yang berpengaruh langsung terhadap ketersediaan P. Pengaruh langsung yaitu menghasilkan asam-asam organik yang dapat bereaksi dengan Al, Fe dan Ca membentuk ion yang stabil dan melepaskannya. Diketahui bahwa pemberian POC mengandung konsorsium MPF yang mempunyai peranan yaitu melarutkan P, sehingga unsur P dalam keadaan tersedia bagi tanaman. Mamondol (2016) mengemukakan bahwa P diperlukan oleh tanaman untuk merangsang pembungaan. Hal ini diperkuat oleh Restu dan Mappangaja (2005) bahwa proses inisiasi bunga dipengaruhi oleh faktor kimia (hormon dan unsur hara) dan faktor fisik (keterbatasan ketersediaan air). Untuk perkembangan pembungaan, maka unsur hara yang dibutuhkan harus mempunyai kandungan unsur P yang cukup sehingga mampu mempertahankan proses pembentukan bunga hingga menjadi buah yang masak.
Hasil uji menggunakan ANOVA menunjukkan bahwa pemberian POC berpengaruh nyata (P≤ 0,05) terhadap panjang akar. Berdasarkan hasil uji Duncan menunjukkan bahwa perlakuan Y2 sebagai kontrol positif memiliki panjang akar terpanjang dibandingkan dengan perlakuan lainnya yaitu sebesar 24,15 ± 0,13 cm. Analisis data statistik perlakuan Y2 menunjukkan hasil yang berbeda nyata (P≤ 0,05) dengan perlakuan Y1 sebagai kontrol negatif dan perlakuan formulasi POC. Namun demikian, berdasarkan nilai angka menunjukkan bahwa pemberian perlakuan Y7 memiliki nilai rata-rata panjang akar tertinggi yaitu 22,73 ± 0,13 cm dibandingkan dengan perlakuan formulasi POC lainnya. Penambahan panjang akar tanaman cabai pada setiap perlakuan formulasi POC disebabkan karena tanaman mendapatkan unsur hara P yang cukup.
Unsur P dapat tersedia karena adanya penambahan konsorsium MPF. Mikroba tersebut
akan melepaskan P yang terikat dalam koloid tanah, akibatnya P dalam bentuk ion dan dapat dimanfaatkan oleh tanaman. Unsur hara P yang diserap dalam jumlah cukup akan merangsang proses pembelahan dan pemanjangan sel-sel pada akar, sehingga panjang akar akan meningkat (Rahmawati et al., 2018). Selain itu, MPF akan berkoloni di daerah perakaran dan berasosiasi dengan jaringan akar. Sesuai dengan pendapat Istiqomah et al. (2017) bahwa MPF mampu berkoloni di daerah perakaran dan berasosiasi dengan jaringan perakaran sehingga mempengaruhi beberapa proses fisiologis tumbuhan. Unsur N yang terkandung di dalam limbah organik POC mampu merangsang pertumbuhan akar sehingga meningkatkan kapasitas serapan dan kecepatan penyerapan hara P. Menurut Mastur et al. (2015) unsur hara N memiliki peranan utama dalam fase vegetatif melalui penyediaan asimilat untuk diproses menjadi struktur organ maupun dukungannya pada proses-proses metabolisme tanaman.
Berdasarkan hasil uji ANOVA menunjukkan bahwa pemberian POC limbah organik memberikan pengaruh nyata (P≤ 0,05) terhadap berat basah akar dan berat basah tajuk tanaman cabai rawit. Hasil uji Duncan untuk berat basah tajuk dan berat basah akar tanaman pada Tabel 4 menunjukkan bahwa perlakuan Y2 sebagai kontrol positif menunjukkan hasil yang tidak berbeda nyata terhadap perlakuan Y7. Perlakuan Y7 menunjukkan hasil yang berbeda nyata dengan perlakuan Y6, Y5, Y4, Y3 dan Y1. Hasil statistik berat basah tajuk dan berat basah akar tanaman pada perlakuan Y2 masing-masing sebesar 9,46 ± 0,06 gram dan 7,00 ± 0,05 gram, kemudian diikuti dengan perlakuan Y7 masing-masing sebesar 9,43 ± 0,03 gram dan 6,96 ± 0,02. Nilai terendah diperoleh perlakuan Y1 sebesar 9,16 ± 0,03 gram (berat basah tajuk) dan 6,72 ± 0,07 gram (berat basah akar).
Pemberian POC limbah organik dan konsorsium MPF mampu menambah berat basah tanaman karena tanaman tidak kelebihan dan kekurangan unsur hara. Hal ini sesuai dengan pendapat Sari et al. (2018) menyatakan bahwa
ketersediaan unsur hara berperan penting sebagai sumber energi sehingga kecukupan hara berperan dalam mempengaruhi biomassa dari suatu tanaman. Berat basah tanaman dipengaruhi oleh kadar air di dalam jaringan. Pernyataan ini disampaikan oleh Chairafahmi et al. (2018) bahwa berat basah tanaman dapat menunjukkan aktivitas metabolisme tanaman dan nilai berat basah dipengaruhi oleh kandungan air di dalam jaringan, unsur hara dan hasil metabolisme. Kandungan air di dalam jaringan akan meningkat sejalan dengan peningkatan kandungan N, sehingga dapat meningkatkan berat basah suatu tanaman. Berat basah tanaman dipengaruhi oleh ketersediaan unsur hara N yang cukup untuk membantu meningkatkan pertumbuhan tanaman seperti pertumbuhan tinggi tanaman dan pembentukan daun. Semakin banyak daun maka berat basah tanaman juga akan meningkat. Tinggi tanaman juga berpengaruh pada berat basah tanaman. Semakin tinggi tanaman dan semakin banyak jumlah daun, maka berat basah juga akan meningkat (Wijayanti et al., 2019).
Hasil uji ANOVA menunjukkan bahwa pemberian POC memberikan pengaruh nyata (P≤ 0,05) terhadap berat kering akar dan berat kering tajuk tanaman cabai rawit. Hasil uji Duncan pada Tabel 4 menunjukkan bahwa perlakuan Y2 sebagai kontrol positif menunjukkan hasil yang tidak berbeda nyata terhadap perlakuan Y5, Y6 dan Y7 terhadap pengukuran berat kering akar. Berdasarkan nilai angka, bahwa perlakuan Y2 memiliki nilai berat kering akar lebih besar yaitu 2,54 ± 0,10 gram dibandingkan dengan perlakuan lainnya, sedangkan untuk perlakuan formulasi POC dengan kode perlakuan Y7 memiliki nilai lebih besar dibandingkan dengan perlakuan formulasi lainnya yaitu sebesar 2,51 ± 0,12 gram. Nilai berat kering akar terendah diperoleh pada perlakuan Y1 adalah sebesar 1,85 ± 0,26 gram.
Hasil statistik uji Duncan pada perlakuan Y2 terhadap rata-rata berat tajuk tanaman (Tabel 4) menunjukkan tidak berbeda nyata dengan perlakuan Y7 tetapi berbeda nyata dengan perlakuan Y1 (kontrol negatif) dan perlakuan formulasi POC (Y3, Y4, Y5, dan Y6). Namun
berdasarkan nilai angka bahwa perlakuan Y2 memiliki nilai berat kering tajuk lebih besar yaitu 3,58 ± 0,08 gram dibandingkan dengan perlakuan lainnya. Pemberian perlakuan Y7 terhadap berat kering tajuk menunjukkan nilai lebih besar yaitu 3,49 ± 0,06 gram dibandingkan dengan perlakuan formulasi lainnya. Nilai berat kering tajuk tanaman terendah diperoleh pada perlakuan Y1 adalah sebesar 3,10 ± 0,15 gram.
Pemberian kombinasi limbah organik dan konsorsium MPF nyata meningkatkan berat kering tanaman pada akhir masa vegetatif. Hal ini berkaitan dengan unsur hara P yang tersedia dan dimanfaatkan oleh tanaman sehingga mempengaruhi berat kering tanaman. Menurut Akasah et al. (2018) peran penting P adalah penyediaan energi dalam proses metabolisme, merangsang pembelahan dan pemanjangan sel akar, dan transpor energi. Energi yang dihasilkan melalui proses fotosintesis akan diakumulasikan pada bagian tanaman seperti batang dan akar, sehingga dapat menambah berat akar dan batang tanaman. Kondisi ini didukung oleh Chairafahmi et al. (2018) yang menyatakan bahwa berat kering tanaman mencerminkan akumulasi senyawa-senyawa organik yang merupakan hasil sintesa tanaman dari senyawa anorganik yang berasal dari air dan CO2, sehingga memberikan kontribusi terhadap berat kering tanaman.
Unsur N juga berpengaruh terhadap berat kering tanaman. Unsur N meningkatkan pertumbuhan dan pembentukan organ vegetatif seperti daun dan batang, sehingga meningkatkan berat kering tanaman. Hal ini sesuai dengan pendapat Sari et al. (2018) berat kering tanaman dipengaruhi oleh pertumbuhan dan pembentukan organ vegetatif. Kondisi ini didukung oleh Ginting (2017), dengan tersedianya unsur hara dalam jumlah yang cukup dan seimbang untuk pertumbuhan tanaman menyebabkan proses pembelahan, pembesaran dan pemanjangan sel akan berlangsung cepat yang mengakibatkan beberapa organ tanaman tumbuh cepat dan tentunya akan mempengaruhi besarnya berat kering suatu tanaman.
SIMPULAN
Formulasi POC limbah organik dengan penambahan konsorsium MPF berpengaruh nyata terhadap pertumbuhan tanaman cabai rawit pada tinggi tanaman, inisiasi bunga, panjang akar utama, berat basah tajuk, berat basah akar, berat kering tajuk dan berat kering akar. Pemberian 25% limbah air cucian beras + 25% molase + 10 mL konsorsium MPF memberikan respon yang baik terhadap pertumbuhan tanaman cabai rawit dibandingkan dengan pemberian perlakuan formulasi POC lainnya.
UCAPAN TERIMAKASIH
Penulis mengucapkan terimakasih kepada kepala Laboratorium Mikrobiologi Program Studi Biologi Universitas Udayana yang telah memberikan izin penggunaan fasilitas laboratorium kepada penulis untuk melakukan penelitian.
KEPUSTAKAAN
Afidah N. 2019. Kualitas Pupuk Cair Berbahan Dasar Air Teh Basi dan Air Cucian Beras Dengan Variasi Penambahan Molase. (Skripsi). Program Studi Pendidikan Biologi Universitas Muhammadiyah Surakarta. Surakarta.
Akasah W, Fauzi, Damanik MMB. 2018. Serapan P dan Pertumbuhan Tanaman Jagung (Zea mays L.) Akibat Pemberian Kombinasi Bahan Organik dan SP-36 pada Tanah Ultisol. Jurnal Agroekoteknologi. 6(3): 640647.
Alawiah SD, Darmayasa IBG, Sundra IK. 2015.
Isolasi dan Optimalisasi Pertumbuhan Bakteri Pelarut Fosfat (BPF) pada Limbah Tahu Dengan Menggunakan Konsentrasi Karbon (C) yang Berbeda. Jurnal Simbiosis. 3(1): 326-329.
Badan Pusat Statistik. 2018. Produksi Tanaman Sayuran 2018. Bps-Statistic: Jakarta.
Badan Pusat Statistik. 2019. Produksi Tanaman
Sayuran 2019. Bps-Statistic: Jakarta.
Cesaria RY, Wirosoedarmo R, Suharto B. 2014.
Pengaruh Penggunaan Starter Terhadap Kualitas Fermentasi Limbah Cair Tapioka
Sebagai Alternatif Pupuk Cair. Jurnal Sumberdaya Alam dan Lingkungan. 1(2): 814.
Chairafahmi RZ, Suwirmen, Noli ZA. 2018. Aplikasi Pupuk Organik Cair Menggunakan Bioaktivator Mikroorganisme Indigenous HPPB Untuk Pertumbuhan Desmodium heterophyllum pada Tanah Bekas Tambang Batu Kapur PT. Semen Padang. Jurnal Biologi Universitas Andalas. 6(1): 6-14.
Fakruddin M, Mannan KSB, Mazumdar RM, Chowdhury A, Hossain MN. 2013. Identification and Characterization of Microorganism: DNA-fingerprinting
Methods. Songklanakarin Journal of Science and Technology. 35(4): 397-404.
Ginting AK. 2017. Pengaruh Pemberian Nitrogen dan Fosfor Terhadap Pertumbuhan Legum Calopogonium mucunoides, Centrosema pubescens dan Arachis pintoi. (Skripsi). Universitas Jambi. Jambi.
Hafsari AR, Pertiwi VD. 2017. Isolasi dan Identifikasi Kapang Pelarut Fosfat Guang Gua Pawon. Biota. 10(2): 165-180.
Hindersah R, Setiawati MR, Asmiran P, Fitriatin BN. 2020. Formulation of Bacillus and Azotobacter Consortia in Liquid Cultures: Preliminary Research on Microbes-Coated Urea. International Journal of Agriculture System. 8(1): 1-10.
Istiqomah, Aini LQ, Abadi AL. 2017. Kemampuan Bacillus subtilus dan Pseudomonas fluorescens Dalam Melarutkan Fosfat dan Memproduksi Hormon IAA (Indole Acetic Acid) Untuk Meningkatkan Pertumbuhan Tanaman Tomat. Buana Sains. 17(1): 75-84.
Kalay AM, Hindersah R, Talahaturuson A, Langoi AF. 2016. Efek Pemberian Pupuk Hayati Konsorsium Terhadap Pertumbuhan dan Hasil Tanaman Sawi (Brassica juncea L.). Jurnal Agroekoteknologi. 8(2): 131-138.
Kusuma AP, Istirokhatun T, Purwono. 2017. Pengaruh Penambahan Urin Sapi dan Molase Terhadap Kandungan C Organik dan Nitrogen Total dalam Pengolahan Limbah Padat Isi Rumen RPH dengan Pengomposan Aerobik. Jurnal Teknik Lingkungan. 6(1): 19.
Larasati ED, Rukmi MGI, Kusdiyantini E, Ginting RCB. 2018. Isolasi dan Identifikasi
Bakteri Pelarut Fosfat dari Tanah Gambut. Bioma. 20(1): 1-8.
Lede N, Muchtar R, Sholihah SM. 2018. Respon Pertumbuhan dan Hasil Tanaman Cabai Rawit (Capsicum frutescens L.) Terhadap Penggunaan Trichokompos pada Pemupukan Berimbang. Ilmiah Respati. 9(2): 1-9.
Lisa, Widiati BR, Muhanniah. 2018. Serapan Unsur Hara Fosfor (P) Tanaman Cabai Rawit (Capsicum frutescens L.) pada Aplikasi PGPR (Plant Growth Promoting
Rhizotobacter) dan Trichokompos. Jurnal Agrotan. 4(1): 57-73.
Litaay M, Sari K, Gobel RB, Haedar N. 2017. Potensi Abalon Tropis Haliotis asinina L. Sebagai Sumber Inokulum Jamur Simbion Penghasil Antimikroba. Spermonde. 3(1): 42-46.
Mamondol MR. 2016. Respon Beberapa Komoditas Sayuran (Tomat, Cabai Rawit, dan Ketimun) Terhadap Kombinasi Pemberian Bokashi dan Air Cucian Beras. Jurnal Envira. 1(1): 1-13.
Mastur, Syafaruddin, Syakir M. 2015. Peran dan Pengelolaan Hara Nitrogen pada Tanaman Tebu Untuk Peningkatan Produktivitas Tebu. Perspektif. 14(2): 73-86.
Menteri Pertanian Republik Indonesia. 2011. Peraturan Menteri Pertanian Nomor 70/Permentan/SR. 140/10/2011 Tentang
Pupuk Organik, Pupuk Hayati dan Pembenah Tanah. Percetakan Negara: Jakarta.
Nuraisya, Pata’dungan YS, Hasanah U. 2020. Bakteri Pelarut Fosfat Indigen Rizosfer Kopi (Coffea sp.) dan Paitan (Tithonia diversifolia): Kemampuan Melarutkan Fosfat Dalam Media Pikovskaya Cair. Agrotekbis. 8(3): 483-491.
Nuryati L, Waryanto B, Widaningsih R. 2016. Komoditas Pertanian Sub Sektor Hortikultura. Pusat Data dan Sistem Informasi Pertanian: Jakarta.
Oksana, Irfan M, Fianiray AR, Zam SI. 2020. Isolasi dan Identifikasi Bakteri Pelarut Fosfat pada Tanah Ultisol di Kecamatan Rumbai, Pekanbaru. Agrotechnology Research Journal. 4(1): 22-25.
Pagiu S. 2013. Eksplorasi dan Skrining Bakteri Pelarut Fosfat dari Kawasan Taman Nasional
Lore Lindu. Jurnal Agroland. 19(3): 159164.
Rahmawati ID, Purwani KI, Muhibuddin A. 2018. Pengaruh Konsentrasi Pupuk P Terhadap Tinggi dan Panjang Akar Tagetes erecta L. (Marigold) Terinfeksi Mikoriza yang Ditanam Secara Hidroponik. Jurnal Sains dan Seni. 7(2): 42-46.
Restu M, Mappangaja B. 2005. Produksi Polong dan Biji Tanaman Gamal (Glirisidia sepium) dari Berbagai Provenansi Dengan Pemupukan NPK. Jurnal Perennial. 2(1): 21-24.
Rizki A, Oktiawan W, Wardhana IW. 2015. Pengolahan Limbah Rumah Pemotongan Hewan (RPH) Menjadi Pupuk Cair yang Diperkaya Dengan Unsur Magnesium (Mg) yang Berasal dari Limbah Garam (Bittern). Jurnal Teknik Lingkungan. 4(3): 1-10.
Roekhan A, Dayanti AI, Oktaviani R, Dewi FS, Anastasya NA. 2020. Kemampuan Multifungsi Bakteri Kitinolitik UB Forest pada Budidaya Kedelai. Fakultas Pertanian Universitas Brawjiaya: Malang.
Sari E, Noli ZA, Suwirmen. 2018. Pengaruh Pupuk N dan Cekaman Kekeringan Terhadap Pertumbuhan dan Kandungan Artemisinin Tanaman Artemisia vulgaris L.. Jurnal Biologi Universitas Andalas. 6(2): 71-78.
Sharon JA, Hathwaik LT, Glenn GM, Imam SH, Lee CC. 2016. Isolation of Efficient Phosphate Solubilizing Bacteria Capable of Enhancing Tomato Plant Growth. Journal of Soil Science and Plant Nutrition. 16(2): 525536.
Suartini NLPE, Darmayasa IBG, Ardhana IPG. 2013. Uji Keberadaan dan Karakterisasi Mikroba Pelarut Fosfat pada Berbagai Merek Pupuk Organik. Jurnal Biologi. 16(1): 42-46.
Wijayanti P, Hastuti ED, Haryanti S. 2019. Pengaruh Masa Inkubasi Pupuk dari Air Cucian Beras Terhadap Pertumbuhan Tanaman Sawi Hijau (Brassica juncea L.). Buletin Anatomi dan Fisiologi. 4(1): 21-28.
44
Discussion and feedback