Effect of Eucheuma cottoni seewead extract on malondialdehid level and spermatozoa of white rat (Rattus norvegicus L.) that induced by natrium nitrite
on
JURNAL BIOLOGI UDAYANA 26(1): 93-107
P ISSN: 1410-5292 E ISSN: 2599-2856
Pengaruh ekstrak rumput laut (Eucheuma cottoni) terhadap kadar malondialdehid dan spermatozoa tikus (Rattus norvegicus L.) yang diinduksi natrium nitrit
Effect of Eucheuma cottoni seewead extract on malondialdehid level and spermatozoa of white rat (Rattus norvegicus L.) that induced by natrium nitrite
Dessy Sukma Wirastuti, A A S A Sukmaningsih*, Sang Ketut Sudirga
Program Studi Ilmu Biologi, Fakultas MIPA ,Universitas Udayana, Jalan Kampus Bukit Jimbaran, Badung Bali
*Email: sukmaningsih@unud.ac.id
Diterima 4 Juni 2021 Disetujui 23 April 2022
INTISARI
Produk daging olahan adalah salah satu jenis pangan yang mudah mengalami kerusakan. Kerusakan pada produk daging olahan diakibatkan karena adanya pertumbuhan mikroorganisme. Menanggulangi hal tersebut, perusahaan pengolahan daging banyak menambahkan bahan tambahan pangan (BTP) yaitu natrium nitrit (NaNO2). Akumulasi nitrit yang berlebih dalam tubuh dapat menimbulkan efek yang merugikan pada sistem reproduksi. Penelitian oleh Pavlova et al. (2017) menemukan terjadi penurunan berat epididimis dan pengurangan jumlah spermatoa tikus yang diberi paparan NaNO2 tinggi. Rumput laut Eucheuma cottoni mengandung antioksidan yang dapat menetralkan sifat oksidatif yang ditimbulkan oleh NaNO2. Penelitian ini dilakukan untuk mengetahui pengaruh ekstrak rumput laut Eucheuma cottoni terhadap kadar Malondialdehid (MDA) dan spermatozoa pada tikus putih (Rattus norvegicus L.) jantan yang diinduksi NaNO2. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) yang terdiri dari kontrol negatif (K-), kontrol positif (K+), perlakuan dosis 1 (P1), perlakuan dosis 2 (P2) dan perlakuan 3 (P3). Kontrol negatif (K-) diberikan aquades sedangkan kontrol positif diberikan natrium nitrit dosis 22,5 mg/kg BB. Perlakuan dosis 1,2 dan 3 diberikan metode kombinasi natrium nitrit dan ekstrak rumput laut dosis 150 mg/kgBB/hari (P1), 300 mg/kgBB/hari (P2), dan 450 mg/kgBB/hari (P3). Pemberian perlakuan dilakukan selama 45 hari. Adapun variabel penelitian terdiri dari kadar MDA (Malondialdehid) pada serum dan kualitas spermatozoa meliputi integritas membran, viabilitas, motilitas dan morfologi spermatozoa dari tikus putih jantan. Analisis data dilakukan melalui uji statistik One Way Anova dan dilanjutkan dengan uji Duncan. . Hasil penelitian menunjukkan ekstrak rumput laut dosis 150 mg/kgBB mampu menurunkan kadar MDA (Malondialdehid), meningkatkan motilitas, viabilitas, integritas membran dan morfologi spermatozoa secara signifikan.
Kata kunci: NaNO2, Eucheuma cottoni, reproduksi
ABSTRACT
Processed meat products are types of food that are easily damaged. Damaged to meat products due to the presence of microorganisms grew. To overcome this, meat processing companies have added a lot of food additives (BTP), namely sodium nitrite (NaNO2). Excess nitrite accumulation in the body can have an effect on the reproductive system. Research conducted by Pavlova et al. (2017) found that there was a decrease in epididymal weight and a reduction in the sperm count of rats exposed to high NaNO2. Eucheuma cottoni
seaweed contains antioxidants that can neutralize the oxidative properties caused by NaNO2. The purpose of this study is know the effect of Eucheuma Cottoni seewead extract on Malondialdehid Level and Spermatozoa of White Rat (Rattus Norvegicus L.) that induced by NaNO2. The design used was a completely randomized design (CRD) consisting of negatif control treatment (K-), positive control treatment (+), dose treatment 1 (P1), dose treatment 2 (P2) and dose treatment 3 (P3). The negative control treatment (K-) was given distilled water while the positive control treatment was given sodium nitrite at a dose of 22.5 mg / kg BW. Treatment doses 1,2 and 3 were given a combination method of sodium nitrite and seaweed extract at a dose of 150 mg / kgBB / day (P1), 300 mg / kgBB / day (P2), and 450 mg / kgBB / day (P3). Observations were made by observing the levels of MDA (Malondialdehyde) in serum and sperm quality namely integrity of the membrane, viability, motility and morphology of spermatozoa male white rats. Data analysis was carried out through the One Way Anova statistical test and continued with the Duncan test. The results showed that seaweed extract dose of 150 mg/kgBW significantly could decrease MDA (Malondialdehyde) levels, increased viability, motility integrity of the membrane and morphology of spermatozoa.
Keywords: NaNO2, Eucheuma cottoni, reproduction
PENDAHULUAN
Seiring perkembangan jaman yang semakin modern menyebabkan masyarakat cendrung mengonsumsi makanan serba instan (fast food) yaitu produk daging olahan (Lubis, 2017). Menurut Buckle (2007), produk daging olahan termasuk kategori pangan cepat rusak (perishable food) yang disebabkan oleh kontaminasi bakteri saat proses pengolahan. Permasalahan tersebut membuat perusahaan produk olahan daging menambahkan produknya dengan bahan tambahan pangan (BTP) (Saputro et al., 2016). Natrium nitrit digunakan sebagai bahan tambahan pangan untuk pengawet produk daging olahan. Peraturan yang dikeluarkan oleh BPOM RI No. 36 tahun 2013 menyatakan bahwa penggunaan natrium nitrit pada produk daging olahan tidak melebihi batas ambang yang diperbolehkan yaitu 30 mg/kg BB (BPOM, 2013).
Konsumsi natrium nitrit yang berlebihan menyebabkan efek buruk terhadap tubuh yaitu berubahnya hemoglobin menjadi methemoglobin. Terbentuknya methemoglobin akan mengakibatkan penurunan distribusi oksigen ke seluruh jaringan tubuh manusia sehingga terjadi hipoksia jaringan bahkan sampai menyebabkan apoptosis atau kematian sel pada jaringan (Sianturi et al. 2013).
Penelitian oleh Ansari et al. (2017) menyebutkan bahwa natrium nitrit dosis 20, 40,
60 dan 75 mg/kgBB meningkatkan stres oksidatif pada tikus yang ditandai dengan terjadinya peroksidasi lipid. Hasil akhir peroksidasi lipid adalah Malondialdehid (MDA) yang mempunyai sifat toksik pada sel (Henkel, 2011). Penelitian lainnya oleh Pavlova et al. (2013) melaporkan bahwa pemberian dosis 50 mg/kg BB pada tikus jantan menyebabkan gangguan pada sistem reproduksi dimana terjadi penurunan berat epididimis dan pengurangan jumlah spermatozoa tikus.
Stress oksidatif pada tubuh dapat ditanggulangi dengan sumber antioksidan. Sumber antioksidan selain berasal dari dalam tubuh (endogen) dapat diperoleh pula tambahan antioksidan eksogen yang berasal dari luar tubuh (Parwata, 2015). Salah satu tanaman yang dapat dimanfaatkan sebagai sumber antioksidan adalah rumput laut Eucheuma cottonii. Rumput laut banyak digunakan untuk industri makanan, kosmetik dan farmasi (Abdan et al, 2013). Sudjarwo & Nuraini (2018) menyebutkan bahwa antioksidan dari ekstrak E. cottonii berpotensi sebagai neuroprotektor yang ditandai dengan terjadinya penurunan kadar MDA pada ginjal tikus jantan yang diinduksi timbal (Pb) jika dibandingkan kontrol.
Pengaruh E. cottonii pada kadar MDA dan spermatozoa tikus jantan yang diinduksi NaNO2 belum ada yang meneliti. Berdasarkan hal
tersebut perlu dilakukan penelitian dalam mengetahui pengaruh ekstrak E. cottonii dalam mengurangi efek negatif yang ditimbulkan natrium nitrit terhadap kadar MDA serum dan kualitas spermatozoa tikus jantan.
BAHAN DAN METODE
Bahan
Rumput laut E. cottonii diperoleh di daerah Pantai Geger Nusa Dua Badung Bali. Penelitian ini menggunakan 30 tikus putih dewasa galur Wistar dengan umur 2-3 bulan dengan berat badan rata-rata 200gr. Pada masing-masing kelompok perlakuan menggunakan 6 ekor tikus. Penelitian ini sebelumnya sudah memperoleh ijin dari Fakultas Kedokteran Hewan Universitas Udayana bagian Kode Etik Hewan dengan nomor sertifikat sebagai berikut :
6/UN14.2.9/PT.01.04/2020
Metode
Pembuatan Ekstrak Rumput Laut Eucheuma cottonii
Eucheuma cottonii yang telah diperoleh kemudian dibersihkan dengan air mengalir. Rumput laut dikeringkan dengan metode kering angin selama 30 hari. Rumput laut kemudian dihaluskan dengan menggunakan mesin penggiling hingga diperoleh serbuk dan di maserasi dengan pelarut etanol 96 % selama 72 jam. Langkah selanjutnya yaitu maserat disaring dengan kain kasa sehingga diperoleh filtrat. Filtrat dievaporasi menggunakan vacuum rotary evaporator dengan suhu 40oC sehingga diperoleh ekstrak kental (Wardani et al., 2017). Pembuatan dosis dosis 150, 300, dan 450 mg/kg BB, ekstrak kental E.cottonii dilarutkan dengan pelarut CMC Na 0,5%.
Analisis senyawa aktif pada ekstrak rumput laut Eucheuma cottonii
Proses identifikasi senyawa aktif pada ekstrak diawali proses fraksinasi menggunakan kromatografi kolom. Silika sebanyak 180 g yang dilarutkan pelarut n-heksan 350 mL. Sebanyak 3 g ekstrak kental dilarutkan dengan pelarut etanol
(yang digunakan saat maserasi) selanjutnya secara perlahan dimasukkan ke dalam kolom pada bagian atas. Kemudian bagian bawah keran diletakan gelas ukur untuk menampung pelarut.
Prinsip fraksinasi ini adalah like dissolves like (larut berdasarkan kemiripan sifat). Pemisahan ekstrak dilakukan menggunakan eluen atau pelarut bertingkat (bergradien) dari yang eluen non polar hingga eluen polar. Urutan eluen/ pelarut yang digunakan sebagai berikut:
-
1. Heksan; :200 ml
-
2. Heksan : diklorometan (1 : 1) :200 mL
-
3. Diklorometan :200 mL 4. Diklorometan : etil asetat (1 : 1) :200 mL 5. Etil asetat :200 mL 6. Etil asetat : aseton (1 : 1) :200 mL 7. Aseton :200 mL 8. Aseton : metanol (1 : 1) :200 mL 9. Metanol :200 mL
Pelarut dimasukkan ke kromatografi secara perlahan-lahan dengan menggunakan pipet tetes. Setelah dimasukkan pelarut pertama (heksan), keran kolom dibuka secara perlahan dan dibiarkan pelarutnya mengalir ke gelas ukur di bawah kran, tetapi diperhatikan jangan sampai pelarutnya habis. Eluen yang melewati kolom ditampung sebanyak 50 mL pertabung. Tampungan pertama disebut fraksi satu, dua dan seterusnya. Fraksi yang telah diperoleh dianalisis menggunakan GC-MS (gas chromatography -mass spectrometry) (Purwaningsi, 2019).
Pemberian Perlakuan pada Hewan Coba
Pemberian perlakuan natrium nitrit dan ekstrak rumput laut E. cottonii dilakukan dengan metode gavage. Pemberian ekstrak dan natrium nitrit (NaNO2) diberikan dengan metode kombinasi bersilang selama 45 hari. Adapun pemberian perlakuan dijelaskan seperti Tabel 1.
Pengukuran Kadar MDA (Malondialdehid)
Pengambilan darah dilakukan pada hari ke-46. Darah diambil melalui jantung sebanyak 2 mL menggunakan pipet kapiler. Darah yang telah diambil selanjutnya dimasukan ke dalam tabung ependorf dan disentrifugasi selama 20 menit agar diperoleh serum. Serum kemudian dibawa ke
Laboratorium Imunologi Fakultas Kedokteran enzyme-linked immunosorbent assay (ELISA) Hewan Universitas Udayana untuk dilakukan kit. Pengukuran kadar MDA dilakukan analisis kadar MDA. Serum hasil koleksi menggunakan alat spektrofotometri UV-Vis dianalisis menggunakan Rat malondialchehyche, dengan panjang gelombang 450 nm.
Tabel 1. Pemberian Perlakuan
|
Perlakuan |
Keterangan |
|
K+ Kontrol Positif |
Tikus diberikan NaNO2 selama 15 hari pertama. Pada hari ke-16 sampai hari ke-35 diberikan kombinasi perlakuan yaitu pagi hari diberikan NaNO2 dan sore hari diberikan pelarut ekstrak CMC 0,5%. Hari ke- 36 sampai 45 diberikan hanya pelarut ekstrak CMC 0,5% |
|
K- Kontrol Negatif |
Tikus hanya diberikan aquades selama 15 hari pertama. Pada hari ke-16 sampai ke- 35 diberikan kombinasi perlakuan yaitu pagi hari diberikan aquades dan sore hari diberikan pelarut ekstrak CMC 0,5 %. Hari ke-36 sampai hari ke-45 hanya diberikan pelarut ekstrak CMC 0,5%. |
|
P1 Perlakuan 1 |
Hari ke- 1 sampai dengan Hari ke-15 Tikus diberikan NaNO2 kemudian Hari ke-16 sampai dengan Hari ke-35 diberikan NaNO2 pagi hari dan ekstrak rumput laut Eucheuma cottonii dengan dosis 150 mg/kgBB/hari pada sore hari. Hari ke- 36- Hari ke- 45 hanya diberikan ekstrak ekstrak rumput laut E.cottonii saja |
|
P2 Perlakuan 2 |
Hari ke- 1 sampai dengan Hari ke-15 Tikus diberikan NaNO2 kemudian Hari ke-16 sampai dengan Hari ke-35 diberikan NaNO2 pagi hari dan ekstrak rumput laut Eucheuma cottoni dengan dosis 300mg/kgBB/hari pada sore hari. Hari ke- 36- Hari ke- 45 hanya diberikan ekstrak ekstrak rumput laut E. cottonii saja |
|
P3 Perlakuan 3 |
Hari ke- 1 sampai dengan Hari ke-15 Tikus diberikan NaNO2 kemudian Hari ke-16 sampai dengan Hari ke-35 diberikan NaNO2 pagi hari dan ekstrak rumput laut Eucheuma cottonii dengan dosis 450 mg/kgBB/hari pada sore hari. Hari ke- 36- Hari ke- 45 hanya diberikan ekstrak ekstrak rumput laut E. cottonii saja |
Pengamatan Kualitas Spermatozoa
Pengamatan sperma diawali dengan bagian epididimis diambil hari ke-46 kemudian diletakkan dalam kaca arloji yang berisi NaCl 0,9 %. Epididimis dicacah agar spermatozoa yang ada pada epididimis keluar, kemudian spermatozoa diaduk secara perlahan dengan pipet tetes agar homogen (Unitly et al., 2014).
-
a. Integritas Membran Spermatozoa
Evaluasi terhadap integritas dan keutuhan membran spermatozoa diuji menggunakan tes hypoosmotic swelling (HOS) (Rizal 2002). Adapun tahapan uji integritas spermatozoa dilakukan dengan melarutkan suspensi spermatozoa sebanyak 0,1 mL ke dalam larutan 9,9 mL
hypoosmotic (0,735 g sodium sitrat dihydrat (Na3C6H5O7,2H2O) dan 1,351 g fruktosa dalam 100 mL aquades). Larutan HOS ini sebelumnya telah diinkubasi pada suhu 37°C selama 30 menit. Pengamatan dilakukan dengan menggunakan mikroskop pembesaran 400X pada sepuluh lapang pandang.
Keutuhan membran plasma spermatozoa ditandai dengan ekor spermatozoa yang melingkar dan membran plasma spermatozoa yang tidak utuh menunjukkan ekor spermatozoa yang lurus (Hardyana & Arifiantini 2012). Perhitungan persentase keutuhan membran spermatozoa dengan dengan rumus (Septiyani, 2012):
Presentase Membran Utuh=
Jumlah spermatozoa membran utuh Jumlah total spermatozoa yang dihitung
x 100%
-
b. Motilitas Spermatozoa
Presentase Spermatozoa motil dihitung dengan cara merekam pergerakan
spermatozoa dibawah mikroskop. Spermatozoa dihitung motil jika bisa bergerak dengan progresif. Spermatozoa
yang tidak bergerak atau hanya bergerak berputar ditempat dihitung sebagai spermatozoa yang mati (non progresif) (Tabel 2.). Perhitungan pergerakan (motilitas spermatozoa) dilakukan dengan
cara mengamati 10 lapang pandang. Dihitung hanya sperma dengan katagori progresif. Adapun perhitungan motilitas menggunakan rumus berikut (Mumu, 2009).
Tabel 2. Katagori motilitas spermatozoa
Kelompok Katagori Ciri Katagori
A Katagori Progresif Spermatozoa yang memiliki gerakan maju lurus dan
cepat
B Katagori Non Progresif a. Spermatozoa yang memiliki gerakan sulit maju
dan Immotil lurus/lambat (nonprogresif)
b. Spermatozoa diam atau tidak tampak bergerak (immotil).
Motilitas_Spermatozoa dengan Katagori A (Motil Progresif)^ ∖qqo∕ Jumlah sperma yang diamati
c. Viabilitas Spermatozoa
Viabilitas spermatozoa dihitung dengan cara membuat preparat ulas dari campuran spermatozoa dengan pewarna Eosin. Tahapan dimulai dengan diambil sebanyak 10 µL semen kemudian diletakkan pada gelas objek. Ditambah pewarna Eosin 50 µL, dihomogenkan dan dibuat preparat serta dikeringkan. Pengamatan dilakukan dengan
menggunakan mikroskop menggunakan perbesaran 400x, spermatozoa yang hidup menujukkan kepala sperma berwarna transparant dan spermatozoa yang mati menujukkan kepala sperma berwarna merah. Pengamatan dilakukan dalam 10 lapangan pandang. Persentase viabilitas spermatozoa dapat diketahui dengan menggunakan persamaan sebagai berikut (Septiyani, 2012):
N
Presentase hidup (Viabilitas) = ^^~^χ 100 %
Keterangan:
N= Spermatoza hidup yang terhitung
M= Spermatozoa mati yang terhitung
d. Morfologi Spermatozoa
Sediaan apusan spermatozoa untuk pengamatan morfologi dibuat dengan menggunakan pewarna Eosin 2%. Pewarnaan dilakukan dengan pemberian suspensi spermatozoa menggunakan pewarna Eosin 2% dengan perbandingan 1:1. Pengamatan dilakukan dengan menggunakan mikroskop perbesaran 400x. Pengamatan spermatozoa yang abnormal dikatagorikan dalam dua
kelompok yaitu spermatozoa dengan kelainan kepala (sperma tanpa kepala, sperma kepala ganda, sperma kepala pipih, sperma kepala runcing) dan spermatozoa dengan kelainan ekor (sperma tidak berekor, sperma ekor ganda, sperma ekor bengkok, sperma ekor melingkar dan sperma leher bengkok) (Demirci & Sahin, 2019). Perhitungan persentase sperma abnormal sebagai berikut (Fatmawati et al, 2016):
A
Presentase Spermatozoa Abnormal = J^x 100 %
Keterangan:
A= Jumlah total spermatozoa yang memiliki morfologi normal
B= Jumlah total spermatozoa yang memiliki morfologi abnormal
Analisa Data
Analisis data dilakukan dengan menggunakan uji statistik One Way Anova program SPSS 23 for windows. Dilanjutkan dengan uji Duncan Multiple Range Test bila terdapat perbedaan signifikan dengan taraf P<0,05 pada semua kelompok
HASIL
Gas Chromatography Mass Spectrometry (GCMS) ekstrak rumput laut (Eucheuma cottonii)
Analisis menggunakan Gas Chromatography Mass Spectrometry (GCMS) diperoleh data berupa Kromatogram yang terdiri dari 12 puncak (Gambar 1). Hasil kromatogram kemudian dianalisis dan disajikan seperti pada Tabel 2.
Berdasarkan hasil analisis senyawa aktif dengan menggunakan GC-MS, ekstrak rumput laut Eucheuma cottoni mengandung berbagai jenis senyawa (Tabel 2).Hasil analisis menunjukkan yang memiliki persentase area tertinggi sebesar 28,90% adalah senyawa Methanethioamide, N.N-dimethyl. Nilai tertinggi kedua dengan persentase area sebesar 18,40% adalah senyawa Benzene, 1,2-dimethyl. Persentase tertinggi ketiga dengan area 13,43%
adalah 3-Penten-2-one,4-methyl. Nilai tertinggi keempat dan kelima dengan persentase area 9,67% dan 7,31 % adalah senyawa p-Xylene dan Acetic acid, butyl ester. Adapun kromatogram dapat terlihat pada Gambar 1.
Kadar Malondialdehid (MDA)
Pemberian natrium nitrit dosis 22,5 mg/kg BB selama 35 hari tanpa pemberian ekstrak rumput laut E. cottonii (K+) menunjukkan hasil kadar MDA tertinggi yaitu sebesar 1,33 nmol/mL (Gambar 2).
Hasil uji statistik menunjukan bahwa kadar malondialdehid (MDA) berbeda nyata (P>0,05) antara kelompok hewan (K+) yang diberikan natrium nitrit dengan kelompok hewan (K-) yang diberikan akuades. Jika dibandingkan dengan perlakuan, maka diperoleh kadar MDA kelompok hewan perlakuan dosis 1 (P1) yang diberikan ekstrak rumput laut E. cottonii dosis 150 kg/BB paling rendah dan yang paling mendekati kelompok hewan (K-).
Kualitas Spermatozoa
Hasil pengamatan kualitas spermatozoa disajikan pada table 3. Pada table 3 tampak bahwa terjadi penurunan motilitas, viabilitas, morfologi spermatozoa maupun integritas membran spermatozoa yang utuh pada K+.
Tabel 2. Senyawa aktif ekstrak rumput laut E. cottonii dari hasil analisis GCMS
|
No |
Puncak/ Peak |
Berat Molekul/ Molecular Weight |
Rumus Molekul/ Molecular Formulas |
Menit/ Retention Time |
Area (%) |
Struktur 2D/ Structure 2D |
Pubcem CID |
Senyawa aktif berdasarkan data base GC-MS/ Active compound based on GC-MS database |
|
1 |
Puncak 1 |
89.16 |
C3H7NS |
2,115 |
28,9 0 |
"Y^ |
69794 |
Methanethioamide, N.N-dimethyl |
|
2 |
Puncak 2 |
104.15 |
2,406 |
4,49 |
25298 |
Ethane,1-ethoxy-1-methoxy | ||
|
3 |
Puncak 3 |
92.14 |
C8H12 |
2,900 |
5,22 |
1140 |
Toluene | |
|
4 |
Puncak 4 |
98.14 |
C6H10O |
3,187 |
13,4 3 |
12964 |
3-Penten-2-one,4-methyl | |
|
5 |
Puncak 5 |
116.19 |
C6H12O2 |
3,347 |
7,31 |
31272 |
Acetic acid, butyl ester | |
|
6 |
Puncak 6 |
116.19 |
C6H12O2 |
3,746 |
6,77 |
31256 |
2-Pentanone, 4-hydroxy-4-methyl |
|
7 Puncak 7 |
106.16 C8H10 4,111 18,4 7237 Benzene, 1,20 dimethyl- |
|
8 Puncak 8 |
106.16 C8H10 4,230 9,67 1 7809 p-Xylene £ ∣l |
|
9 Puncak 9 |
106.16 C8H10 4,624 3,35 7237 Benzene,1,2- dimethyl- |
|
10 Puncak 10 11 Puncak 11 12 Puncak 12 |
100.16 C6H12O 5,577 0,45 22500 Oxirane, 2methyl-3- propyl-,cis 257.99 C7H14Br2 16,514 1,11 78309 Heptane,1,7-dibromo 390.56 C24H38O4 24,197 0,88 8343 Bis(2-ethylhexyl) phthalate |

Gambar 1. Kromatogram Hasil Analisis GC-MS ekstrak rumput laut (E. cottonii)
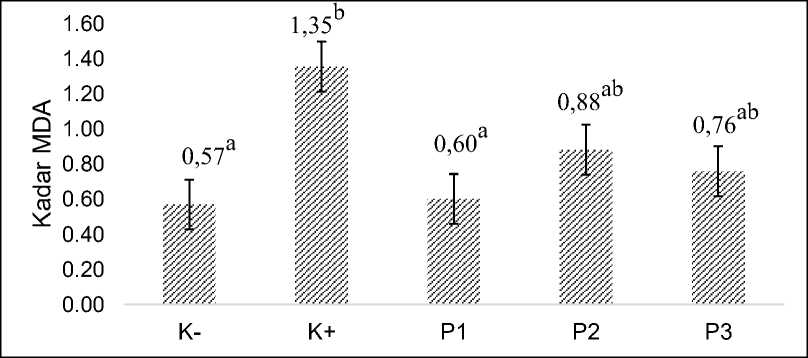
Gambar 2. Kadar malondialdehid (MDA) setelah pemberian ekstrak E. cottoni pada tikus (Rattus norvegicus) yang diinduksi ntrium nitrit.
Keterangan: Huruf yang sama menunjukkan tidak berbeda nyata (P<0,05). Satuan kadar MDA dalam nmol/mL
Tabel 3. Kualitas Spermatozoa setelah pemberian ekstrak rumput laut E. cottoni pada tikus (R. norvegicus) yang di induksi NaNO2
|
Parameter |
Kelompok Perlakuan | ||||
|
K- |
K+ |
P1 |
P2 |
P3 | |
|
Motilitas A (%) |
58,78 ±9,83 a |
36,69±12,21 b |
52,15±11,29 a |
53,98±11,29 a |
47,68±11,29 ab |
|
Motilitas B (%) |
41,21 ±9,83 a |
63,31±12,21 b |
47,84±11,29 a |
46,01±11,29 a |
53,30±11,29 ab |
|
Viabilitas (%) |
52,20±5.92 a |
32,77±6,12c |
54,21±2,09 a |
51,87±2,06 ab |
43,02±8,92 b |
|
Non viabilitas (%) |
48,12±5.92 a |
67,22±6,12c |
45,78±2,09 a |
48,12±2,06 ab |
56,97±8,92 b |
|
Morfologi normal (%) |
95,16±0,62 a |
89,43±4,75 b |
93,95±0,91 a |
91,75±4,87 ab |
91,07±2,98 b |
|
Morfologi abnormal (%) |
4,83±0,62 a |
10,57±4,75 b |
6,04±0,91 a |
8,25±4,87 ab |
8,93±2,98 b |
|
Integritas membran utuh (%) |
49,69±16,47 a |
36,73±5,62 a |
39,80±11,21 ab |
34,61±18,15 a |
34,43±12,33 a |
|
Integritas membran tidak utuh (%) |
50,31±16,47 a |
63,27±5,62 a |
60,20±11,21 ab |
65,39±18,15 a |
65,57±12,33 a |
Keterangan: Huruf yang sama pada baris yg sama pada kolom vertikal menunjukkan tidak berbeda nyata (P<0,05)
PEMBAHASAN
Gas Chromatography Mass Spectrometry (GCMS) ekstrak rumput laut (Eucheuma cottonii)
Persentase luas area pada hasil GCMS berhubungan dengan intensitas dari senyawa. Semakin tinggi persentase luas area, maka semakin tinggi kandungan senyawa kimia yang terdapat dalam ekstrak (Sipahelut, 2019). Dari hasil penelitian menunjukkan senyawa kimia methanethioamide, N.N-dimethyl memiliki persentase luas area tertinggi sebesar 28,90% methanethioamide, N.N-dimethyl atau yang memiliki nama lain tiazolidin adalah senyawa organik heterosiklik. Menurut Lucie et al. (2016) senyawa methanethioamide, N.N-dimethyl
termasuk glukosinolat. Glukosinolat merupakan metabolit sekunder tanaman yang pada konsentrasi rendah memiliki aktivitas antioksidan. Jeffery & Arraya (2009) menyebutkan bahwa senyawa glukosinolat mempunyai aktivitas dalam mempertahankan antioksidan endogen dalam sel sehingga berpotensi dalam mencegah stress oksidatif.
Kadar Malondialdehid (MDA)
Malondialdehid (MDA) dikatakan sebagai penanda adanya radikal bebas dalam tubuh.
Pembentukan MDA melalui proses peroksidasi lipid pada PUFA (asam lemak tak jenuh). Peroksidasi lipid yang terjadi karena interaksi antara radikal bebas dengan asam lemak tidak jenuh pada membran sel (Lavenia, 2010). Semakin tinggi kadar MDA yang terbentuk menunjukkan semakin tinggi kadar dari radikal bebas yang ada pada tubuh (Zaetun et al., 2018). Tingginya kadar MDA pada kelompok hewan (K+) diakibatkan karena pengaruh natrium nitrit. Penelitian Gihan et al. (2014) menunjukkan hasil yang sesuai bahwa pemberian natrium nitrit dosis 1 g/L dan 2 g/L menyebabkan peningkatan kadar MDA pada tikus putih jika dibandingkan dengan kelompok kontrol. Penelitian Alyoussef & Gayyar (2016) menyebutkan pemberian secara oral 80 mg/kg natrium nitrit selama dua belas minggu pada tikus jantan dapat meningkatkan kadar MDA dua kali lipat jika dibandingkan dengan kontrol.
Menurut Ambarwati (2012), natrium nitrit membentuk radikal bebas. Aktivitas radikal bebas ini terjadi akibat adanya ikatan nitrit dengan hemoglobin yang menginduksi terbentuknya ROS (Reactive Oxygen Spesies). Ketidakseimbangan antara ROS dengan antioksidan dalam tubuh akan menyebabkan stres oksidatif. Keadaan stress oksidatif akan memicu terjadinya peroksidasi lipid.
Tahapan terjadinya peroksidasi lipid adalah iniasi yang membentuk radikal lipid dan propagasi yang membentuk radikal peroksi lipid. Radikal peroksi lipid akan berikatan dengan PUFA lain selama proses propagasi sehingga membentuk lipid peroksida. Lipid peroksida ini akan mengalami degradasi membentuk malondialdehid (MDA). MDA bersifat mutagenik dan toksik di dalam sel (Henkel, 2011). Jika dibandingkan dengan seluruh kelompok perlakuan dosis ekstrak, pemberian ekstrak rumput laut E. cottonii dosis 150 mg/kgBB menunjukkan dosis yang paling efektif menurunkan kadar MDA. Hal ini dapat diakibatkan karena ekstrak rumput laut E. cottonii mengandung senyawa fitokimia yang memiliki aktivitas antioksidan. Rumput laut E. cottonii mengandung senyawa triterpenoid, alkaloid dan flavonoid (Andriani et al., 2015). Senyawa golongan flavonoid merupakan polihidroksil yaitu memiliki satu atau lebih gugus hidroksil (Setiawan & Amalia, 2017). Gugus hidroksil bebas pada flavonoid akan mendonasikan atom hidrogennya ke molekul radikal bebas sehingga menjadi stabil (Banjarnahor & Artanti, 2014).
Pemberian perlakuan ekstrak kacang merah yang mengandung flavonoid sebesar 1.188,29 mg/100g QE pada tikus yang diberikan aktivitas fisik berlebih dapat menurunkan kadar MDA (Septivani et al., 2019). Flavonoid merupakan senyawa yang memiliki aktivitas sebagai antioksidan karena memiliki sifat sebagai akseptor dari radikal bebas (Sudarmato & Suhartati., 2015). Mekanisme lainnya dalam aktivitasnya sebagai antioksidan dari senyawa flavonoid juga terjadi melalui pengaktifan nuclear factor erythroid 2 related factor 2 (Nrf2). Nfr2 merupakan faktor transkripsi dari gen yang berperan dalam sintsesis enzim antioksidan endogen dalam tubuh antara lain GPx (Glutathion peroksidase), SOD (superoxide dismutase) dan CAT (Catalase). Dengan adanya aktivasi dari Nrf2 oleh flavonoid, pembentukan MDA menurun karena tidak terjadinya peroksidasi lipid (Akhlaghi & Brian, 2009).
Hasil GCMS juga memperlihatkan senyawa glukosinolat yang memiliki aktivitas antioksidan.
Hasil penelitian Sharma & Sangha (2016) menyebutkan bahwa pemberian ekstrak brokoli yang mengandung glukosinolat menyebabkan penurunan stress oksidatif pada tikus yang diberi paparan toksisitas triazophos. Hasil penelitian tersebut menujukkan pemberian ekstrak brokoli sebanyak 20 µmol dan 30 µmol dapat menurunkan kadar MDA tikus putih betina secara signifikan dibandingkan dengan tikus yang diberi perlakuan triazophos. Mekanisme glukosinolat dalam aktivitasnya sebagai antioksidan terjadi melalui induksi protein sitoprotektif pada jalur Keap1 / Nrf2 / ARE (antioxidan respon elemen) pada tubuh. Aktivasi ARE menyebabkan terbentuknya enzim antioksidan. Enzim antioksidan umumnya bekerja dalam meredam radikal bebas melalui pengurangan satu dan dua elektron, sehingga berkontribusi untuk pengurangan stres oksidatif (Becker & Juvik 2016).
Kualitas Spermatozoa
Berdasarkan analisis kualitas spermatozoa, pada spermatozoa progresif, spermatozoa yang hidup, spermatozoa morfologi normal dan spermatozoa dengan integritas utuh seperti terlihat hasil seperti pada (Tabel 3). Kelompok hewan (K+) yang hanya diberikan natrium nitrit memiliki nilai rerata lebih rendah dibandingkan kelompok hewan (K-). Hasil uji statistik menunjukkan perbedaan nyata (P>0,05) antara kelompok hewan (K+) dan kelompok (K-).
Berdasarkan hasil analisis kelompok hewan (P1) yang diberikan ekstrak E. cottonii 150 mg/kg BB adalah dosis yang efektif dalam menurunkan kerusakan yang ditimbulkan oleh natrium nitrit. Nilai dari masing-masing parameter kualitas spermatozoa menunjukkan P1 memiliki nilai yang paling mendekati kelompok hewan (K-). Peningkatan pemberian ekstrak E. cottonii menyebabkan menurunnya kualitas spermatozoa. Pada integritas membran spermatozoa antara kelompok hewan perlakuan dosis 2 (P2) yang diberikan ekstrak rumput laut 300 mg/kg BB dan kelompok hewan perlakuan dosis 3 (P3) diberikan rumput laut dosis ekstrak rumput laut dosis 450 mg/kg BB menunjukkan penurunan integritas membran utuh pada spermatozoa. Uji statistik
menunjukkan perbedaan nyata (P>0,05) antara P2 dan P3 dengan kelompok kontrol hewan (K-).
Keutuhan membran spermatozoa menunjukkan terjaganya fungsi penting dari membran untuk kontrol terhadap sistem transport, motilitas dan viabilitas dari spermatozoa (Esteves, 2000). Integritas membran spermatozoa yang masih utuh akan memperlihatkan ekor yang melingkar sedangkan spermatozoa dengan integritas rusak ekor sperma akan terlihat lurus (Gambar 3).
Penurunan integritas membran pada kelompok hewan (K+) disebabkan karena adanya radikal bebas akibat pemberian natrium nitrit. Natrium nitrit yang masuk ke dalam tubuh akan meningkatkan produksi radikal bebas. Ambarwati (2012) menyebutkan ikatan antara nitrit dan hemoglobin pada sel darah merah akan menginduksi pembentukan ROS (Reactive Oxygen Spesies) yang akan menyebabkan stres oksidatif. Keadaan stres oksidatif dalam tubuh tentu berpengaruh pada sistem reproduksi.
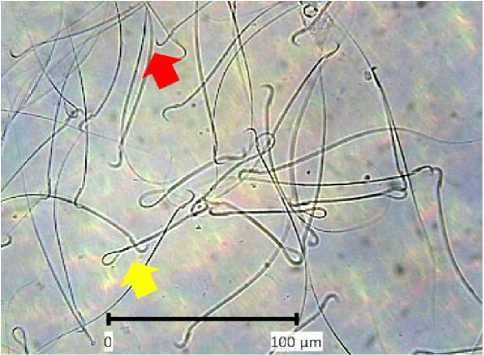
(A)

(B)
Gambar 3. Integritas membran spermatozoa (A) Perbesaran 400x Bar 100 µm (B) Perbesaran 1000x Bar 50 µm Keterangan:
Panah merah: Ekor lurus menunjukkan membran spermatozoa rusak
Panah kuning: Ekor melingkar menunjukkan spermatozoa utuh
Membran spermatozoa kaya akan PUFA yang rentan terhadap kehadiran radikal bebas. Menurut Sanocka et al. (2004), tingginya kadar radikal bebas dalam tubuh akan mengganggu komponen penting yang ada pada sel tubuh salah satunya lipid pada membran plasma spermatozoa. Lipid adalah komponen pada membran spermatozoa yang memiliki peran penting untuk menjaga stabilitas dan kelangsungan hidup dari spermatozoa. Bila terjadi kerusakan membran maka dapat mengakibatkan rusaknya organel yang terdapat di dalam sel. Hal ini karena membran plasma berfungsi sebagai pelindung organel di dalam sel (Said et al., 2005). Salah satu organel di dalam sel tersebut adalah mitokondria. Kerusakan mitokondria menyebabkan terganggunya proses metabolisme yang secara langsung mempengaruhi motilitas spermatozoa (Gaffari & Rostami, 2012).
Hasil penelitian menunjukkan terjadi penurunan motilitas spermatozoa setelah 35 hari pemberian natrium nitrit. (K+). Motilitas spermatozoa progresif sebesar 36,69 %. Motilitas spermatozoa berperan penting dalam proses fertilitasi. Malini (2013) menyebutkan bahwa spermatozoa dengan motilitas kurang dari 40% termasuk spermatozoa kualitas buruk dan masuk ke dalam katagori infertil. abilitas membran spermatozoa yang terganggu akibat rusaknya membran menyebabkan terhalangnya transpor nutrisi yang berpengaruh pada kerja mitokondria pada spermatozoa. Menurut Pesini et al. (1998) Seluruh produksi energi dari mitokondria akan berpengaruh pada motilitas spermatozoa.
Terganggunya permeabilitas secara tidak langsung akan menyebabkan terganggunya viabilitas dari spermatozoa.Viabilitas spermatozoa juga mengalami penurunan akibat induksi natrium nitrit. Paparan natrium nitrit
menyebabkan persentase kematian spermatozoa sebesar 67,22 %. Menurut Sanocka & Kurpisz (2004), ketidakseimbangan radikal bebas mengganggu kerja enzim ATP-ase yang terdapat di dalam membran plasma spermatozoa, yang berada pada bagian tengah ekor spermatozoa.
keseimbangan antara ion natrium dan kalium yang berperan penting terhadap kelangsungan hidup spermatozoa. Apabila enzim ini terganggu maka akan menyebabkan transpor ion natrium dan kalium juga akan terganggu sehingga menyebabkan kematian spermatozoa.
Enzim ini berfungsi
mempertahankan
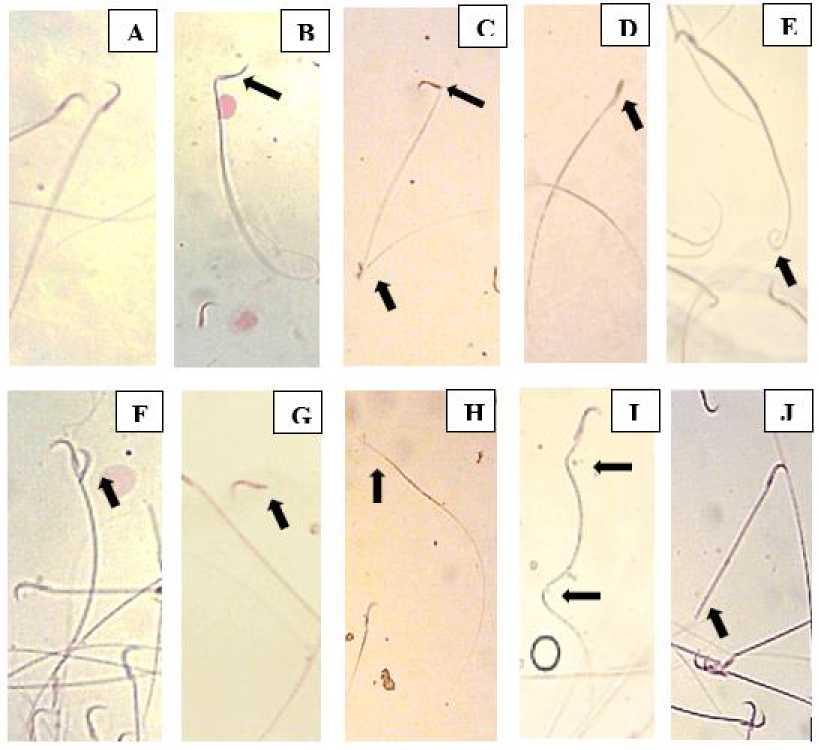
Gambar 4. Morfologi spermatozoa dengan pewarnaan eosin
Keterangan: (A) Sperma normal (B dan C) Leher dan ekor sperma bengkok (D) Kepala sperma runcing (E) Ekor sperma menggulung (F) Kepala sperma ganda (G) Kepala sperma putus (H) Sperma tanpa Kepala (I)Ekor sperma bagian tengah dan akhir bengkok (J) Ekor sperma putus
Radikal bebas merusak DNA dengan modifikasi basa, pemutusan rantai DNA, DNA cross-link dan perubahan kromosom. Pelepasan sitokrom c dari mitokondria akan menginduksi terjadinya kerusakan DNA. Kerusakan DNA yang mempercepat apoptosis/kematian sel spermatozoa (Soehadi, 1996). Apoptosis merupakan kematian sel secara terprogram yang terjadi melalui serangkaian perubahan struktural akibat adanya kerusakan DNA yang ireversible.
Penyebab terjadinya apoptosis karena berbagai faktor lingkungan atau stress fisiologis seperti radiasi sinar UV, radikal bebas, paparan senyawa toksik serta penurunan kadar hormon (Hassan & Djakaria, 2013; Ranawat & Bansal, 2009; Wang et al, 2008 ).
Radikal bebas pada sel Leydig akan menstimulasi sintesis testosteron tetapi stress oksidatif akan meningkatkan modifikasi oksidatif DNA ( Beattie dkk, 2013) dan penurunan sekresi
hormon testosteron (Al-Damegh, 2014). Hormon testosteron berperan penting terhadap kualitas spermatozoa. Penelitian oleh Alyoussef dan Gayyar (2016) menyebutkan bahwa pemberian natrium nitrit dosis 80 mg/kg BB menyebabkan penurunan sekresi kadar testosteron darah dan jumlah spermatozoa pada tikus. Hormon testosteron diperlukan pada saat awal proses meiosis pada tahap spermatogenesis dan maturasi spermatozoa (Elpiana, 2011). Terganggunya salah satu tahapan spermatogenesis tentu akan mempengaruhi kualitas spermatozoa.
Hasil penelitian menunjukkan adanya 9 kelainan bentuk spermatozoa (morfologi) seperti yang terlihat pada (Gambar 4). Hasil penelitian menunjukkan pada kelompok hewan (K+) memiliki nilai abnormalitas tertinggi dengan persentase sebesar 10,57 %. Peningkatan Radikal oxygen species (ROS) menyebabkan gangguan pada spermatogenesis sehingga menghasilkan morfologi spermatozoa yang abnormal Berbagai kelainan pada spermatozoa yang diakibatkan oleh radikal bebas merupakan salah salah satu faktor resiko infertilitas (Delfita, 2014).
Pemberian ekstrak rumput laut E. cottonii dosis 150 mg/kBB setelah pemberian NaNO2 (P1) berpotensi meningkatkan kualitas spermatozoa. Hal ini dapat dilihat dengan penurunan intergritas membran spermatozoa tidak utuh, penurunan morfologi spermatozoa abnormal, peningkatan motilitas dan viabilitas dari spermatozoa. Peningkatan ini dapat disebabkan karena kandungan senyawa yang bersifat antioksidan yaitu flavonoid. Kitagawa et al. (2004) melaporkan bahwa senyawa flavonoid melindungi sel dari kerusakan oksidatif membran dengan kemampuannya berikatan dengan membran sel. Senyawa flavonoid dapat menyumbangkan atom hidrogen kepada radikal bebas yang bersifat destruktif pada membran sel. Potensi senyawa flavonoid sebagai antioksidan dapat dimanfaatkan untuk meningkatkan kualitas spermatozoa dengan cara mencegah adanya kerusakan membran spermatozoa (Palupi, 2006).
Pemberian ekstrak rumput laut E. cottonii dosis 300 mg/kgBB/hari (P2); dan 450 mg/kgBB/hari
(P3) menyebabkan penurunan kualitas
spermatozoa. Peningkatan dosis ekstrak rumput laut E. Cottonii diduga memiliki kandungan saponin yang lebih tinggi dibandingkan dengan ekstrak rumput laut E. cottonii dosis 150 mg/kgBB/hari. Prabha et al., (2013) menyatakan bahwa rumput laut E. Cottonii mengandung senyawa saponin. Menurut Shah et al. (2008) saponin memiliki kemampuan berikatan dengan lipid serta lipoprotein pada membran spermatozoa yang menyebabkan kerusakan permeabilitas membran. Kerusakan membran akan mengakibatkan kerusakan organel sel seperti mitokondria dan lisosom. Hal ini akan mengganggu proses metabolisme yang akan berpengaruh terhadap pergerakan spermatozoa. Kerusakan lisosom mengakibatkan enzim di dalam spermatozoa akan mengalami lisis (Chari and Colagar, 2011) yang menyebabkan terjadinya kematian spermatozoa.
SIMPULAN
Ekstrak rumput laut E. cottonii dosis 150 mg/kgBB menurunkan kadar MDA dan
meningkatkan kualitas spermatozoa pada tikus putih yang diinduksi natrium nitrit (NaNO2) tetapi Ekstrak rumput laut E. cottonii dosis 300 mg/kgBB dan 450 mg/kgBB menyebabkan penurunan kualitas spermatozoa.
DAFTAR PUSTAKA
Abdan RA, Ruslaini. 2013. Pengaruh Jarak Tanam Terhadap Pertumbuhan dan Kandungan Karagenan Rumput Laut (Eucheuma spinosum) Menggunakan Metode Long Line. Jurnal Mina Laut Indonesia. 3 : 113-123.
Akhlaghi M, Brian B. 2009. Mechanisms of Flavonoid Protection Against Myocardial Ischemia–Reperfusion Injury. Journal of Molecular and Cellular Cardiology. 46:309– 17.
Alyoussef A, Gayyar MMHA. 2016.
Thymoquinone Ameliorated Elevated Inflammatory Cytokines in Testicular Tissue and Sex Hormones Imbalance Induced by
Oral Chronic Toxicity With Sodium Nitrite. Elsevier 83 : 64-74
Ambarwati R. 2012. Effect of Sodium Nitrite (NaNO2) to Erithrocyte and Hemoglobin Profile in White Rat (Rattus norvegicus). Folia Medica Indonesiana. 48(1):1-5
Andriani Z, Fasya GA, Hanapi A. 2015. Antibacterial Activity of the Red Algae Eucheuma cottonii Extract from Tanjung Coast, Sumenep Madura. Alchemi 4(2):93-100
Ansari F A, Ali SN, Mahmood R. 2015. Sodium Nitrite-Induced Oxidative Stress Causes Membrane Damage, Protein Oxidation, Lipid Peroxidation and Alters Major Metabolic Pathways In Human Erythrocytes. Toxicologi in Vitro 29(7):1878-1886
Badan Pengawas Obat dan Makanan. 2013. Peraturan Kepala Badan Pengawas Obat Dan Makanan Nomor 36 Tentang Batas Maksimum Penggunaan Bahan Tambahan Pangan Pengawet. Jakarta
Banjarnahor, SDS, Artanti N. 2014. Antioxidant properties of flavonoids. Med J Indones 23(4). 239-244
Beattie M C H, Chen H, Fan J, Papadoupoulos V, Milleer P, Zirkin B R. 2013. Aging and Luteinizing Hormone Effect On Reactive OXYGEN Species Production and DNA damage In Rat Leydig Cells. Biology Of Reproduction 88 (4) : 1 - 7
Becker TM , Juvik JA. 2016. The Role of Glucosinolate Hydrolysis Products from Brassica Vegetable Consumption in Inducing Antioxidant Activity and Reducing Cancer Incidence. Diseases 4 (22) : 1-33
Buckle KA, Edwards RA, Fleet GH, Wootton M. 2007. Ilmu Pangan. Terjemahan Purnomo dan Adiono. Universitas Indonesia Press :Jakarta.
Chari M G, Colagar A H. 2011. Seminal Plasma Lipid Peroxidation, total antioxidant capacity, and cigarette smoking in asthenoteratospermic men. Journal of Men’s Health 8 (1) : 43 - 49
Delfita R. 2014. Potensi Antifertilitas Ekstrak Teh Hitam Pada Mencit (Mus musculus L.) Jantan. Jurnal Sainstek 6 (2) : 181-18
Esteves SC, Sharma RK., Thomas AJ, Agarwal A. 2000. Improvement in Motion Characteristics and Acrosome Status in
Cryopreserved Human Spermatozoa by Swim-up Processing Before Freezing. Hum Reprod 15: 2173-2179.
Elpiana. 2011. Pengaruh Monosodium
Glutamatterhadap Kadar Hormon
Testosteron Danberat Testis Pada Tikus Putih Jantan (Rattus Norvegicus). Tesis. Padang. Universitas Andalas
Fatmawati DI, Isradji, Yusuf I, Suparmi. 2016. Kualitas Spermatozoa Mencit Balb/C Jantan Setelah Pemberian Ekstrak Buah Kepel (Stelechocarpus Burahol). MKB. 48 (3): 155159.
Ghaffari M.A, Rostami M. 2012. Lipid Peroxidation and Nitric Oxide Levels in Male Smokers Spermatozoa and their Relation with Sperm Motility. J Reprod Infertil 13(2):81-87
Gihan M, Hammoud, Nivin S, Khaled, Elsawy M., Adel, Rahman S A E, Mervat S H, Youssef, Masoud MS. 2014. Protective Effect Of Grape Seeds Extract Against Sodium Nitriteinduced Toxicity and Oxidative Stress in Albino Rats. Az. J. Pharm Sci.49 : 1-34.
Hardyana RD, Arifiantini RI. 2012. Penentuan Waktu Optimal Pengujian Keutuhan Membran Plasma Spermatozoa Semen Beku Sapi Menggunakan Hypoosmotic Swelling Test (HOS) Test. Prosiding Seminar Nasional Asosiasi Reproduksi Hewan Indonesia: 105-109.
Hasan I, Djakaria HM. 2013. Kematian Sel Akibat Radiasi. Journal of the Indonesian Radiation Oncology Society.
Henkel RR. 2011. Leukocytes and Oxidative Stress: Dilemma for Sperm Function and Male Fertility. Asian Journal of Andrology 13 : 43–52
Jeffery EH,Ararya M. 2009. Physiological Effects of Broccoli Consumption. Phytochem Rev 8: 283-298.
Kitagawa S, Sakamoto H, Tano H. 2004. Inhibitory Effect of Flavonoids on Free Radical-Induced Hemolysis and Their Oxidative Effect on Hemoglobin. Chemical and Pharmaceutical Bulletin. 52(8):999-
1001.
Lavenia A. 2010. Penghambatan Peroksidasi Lipid oleh Ekstrak Kulit Batang Mahoni (Swietenia Macrophylla King) Pada Tikus
Hiperurisemia. Skripsi. Departemen
Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
Lubis AZ. 2017. Analisis Kadar Nitrit pada Daging Nugget Sapi dengan Metode Spektrofotometri Uv-Vis. Skripsi.
Departemen Matematika Fakultas
Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara Medan.
Lucie BT, Patricia WS, Ephrem KK, Salomon N, Florent BOS, Beranger, LDP. Silla S, Diane YO, Laurent SMJ, Seck D, Mbacke S. 2016. The Effective Insecticidal Activity of the two Extracts Ethyl Acetate and Hexan of Trichilia gilgiana against Sitophilus zeamaïs. International Journal of Biology 8(2) : 23-31
Malini DM. 2013. Pengaruh Ekstrak Etanol dan Spinasterol Daun Senggugu (Clerodendron serratum L.) Terhadap Kualitas Sperma Mencit (Mus musculus L.). IJAS 3 (3) : 49-54
Mumu IM. 2009. Viabilitas Semen Sapi Simental Yang Dibekukan Menggunakan
Krioprotektan Gliserol. J. Agroland 16 (2) : 172 – 179.
Palupi HD. 2006. Pengaruh Pemberian Jus Buah Tomat Terhadap Viabilitas Spermatozoa Mencit Jantan Yang Diberi Paparan Asap Rokok. Skripsi. Universitas Diponegoro: Semarang.
Parwata DDI. 2015. Bahan Ajar Uji Bioaktivitas Antioksidan. Kimia Terapan Program Pascasarjana Universitas Udayana
Pavlova E, Dimova D, Petrova E, Gluhcheva Y, Atanassova N. 2013. Changes in Rat Testis and Sperm Count After Acute Treatment With Sodium Nitrite. J. Agric. Sci 2(19): 186–189
Pesini ER, Diez D, Lapena AC, Martos AP, Montoya.J, Alvarez E, Arenas J, Perez MJL. 1998. Correlation of Sperm Motility With Mitochondrial Enzymatic Activities. Clinical Chemistry 44 (8) : 1616- 1620.
Prabha V, Prakash DJ. Sudhra PN. 2013. Analysis of Bioactive Compounds and Antimicrobial Activity of Marine Algae Kappaphycus alvarezii Using Three Solvent Extracts, International Journal of Pharmaceutical Sciences and Research 4(1):306-310.
Purwaningsi PP. 2019. Daya Hambat Ekstrak Etanol Daun Ketapang (Terminale catappa
Linn) Terhadap Staphycocus aureus. Tesis. Program Studi Ilmu Biologi Universitas Udayana.
Ranawat P, Bansal MP. 2009. Apoptosis Induced by Modulation in Selenium Status Involves p38 MAPK and ROS Implications in Spermatogenesis. Molecular and Cellular Biochemistry 330(2):83-95
Rizal M. 2002. Fertilitas Spermatozoa Ejakulat Epididimis Domba Garut Hasil Kriopreservasi Menggunakan Modifikasi Pengencer Tris Dengan Berbagai Krioprotektan dan Antioksidan. Disertasi. Program Studi Pascasarjana Institut Pertanian Bogor.
Said S, Gunawan M., Kaiin EM, Tappa B. 2005. Daya Tahan Sperma Cair Sapi Simental yang Disimpan dalam Straw pada temperatura 5°C. Pusat penelitian Bioteknologi. LIPI. Buletin Peternakan 16 : 58-73.
Sanocka D, Kurpisz M. 2004. Reactive oxygen species and sperm cells. Reproductive Biology and Endocrinology 2(12): 1–7.
Sanocka D M, Fraczek, P Jedrzejczak. 2004. Male Genital Tract Infection : An Influence of Leukocytes and Bacteria on Semen. J Reprod Immunol. 62 : 111-124
Saputro E, Bintoro VP, Pramono YB. 2016. Agen Kyuring Alami Pengganti Natrium Nitrit Sintetis pada Kyuring Daging Sapi. Jurnal Ilmu Pertanian 12(1): 65-75
Satriyasa BK, Pangkahila WI. 2010. Fraksi Heksan dan Fraksi Metanol Ekstrak Biji Pepaya Muda Menghambat Spermatogonia Mencit (Mus musculus) Jantan. Jurnal Veteriner 1(11):36-40.
Septivani G, Pangkahila W, Pinatih I. 2019. Pemberian Ekstrak Kacang Merah (Phaseolus vulgaris L) Menurunkan Kadar Malondialdehid (MDA) Darah Tikus Putih (Rattus norvegicus) Jantan dengan Aktivitas Fisik Berlebih. Metamorfosa: Journal of Biological Sciences 6(2): 262-267
Septiyani R. 2012. Hubungan Antara Viabilitas, Motilitas, Dan Keutuhan Membran Plasma Spermatozoa Semen Beku Sapi Limousin dan Frisien Holstein Menggunakan Hypo-osmotic Swelling (HOS) Test. Skripsi. Program Studi Sarjana Institut Pertanian Bogor.
Setiadi MA, Agik S, Yulnawati. 2006. Viabilitas dan Integritas Membran Plasma Spermatozoa Epididymis Anjing Selama Penyimpanan pada Pengencer yang Berbeda. Media Kedokteran Hewan. 22(2):118-123
Setiawan NCE, Amalia H. 2017. Aktivitas Antioksidan Ekstrak Biji Buah Areca
vestiaria Giseke dan Fraksinya dengan Metode DPPH (2,2-diphenyl-1-
picrylhydrazyl). Journal Cis-Trans (JC-T) 1 (2) : 9-13.
Shah HC, Tatke, Singh KK. 2008. Spermicidal agents. Drug Discov Ther 2(4): 200-210.
Sharma D, Sangha GK. 2016. Effects of Glucosinolates Rich Broccoli extract against Triazophos induced Toxicity in Wistar Rats. Journal of Biomedical Sciences 5 (4) : 1-9
Sianturi S, Tanjung M, Sabri E. 2013. Pengaruh Buah Terong Belanda (Solanum Betaceum Cav.) Terhadap Jumlah Eritrosit dan Kadar Hemoglobin Mencit Jantan (Mus Musculus L.) Anemia Strain melalui Induksi Natrium Nitrit (Nano2). Saintia Biologi 1(2):49-54
Sipahelut, SG. 2019. Perbandingan Komponen Aktif Minyak Atsiri dari Daging Buah Pala Kering Cabinet Dryer Melalui Metode Distilasi Air dan Air-Uap. Agritekno, Jurnal Teknologi Pertanian 8 (1) : 8-13
Soehadi K. 1996. Diabetes Mellitus Pria: Profil Spermiogram, Hormon Reproduksi dan Potensi Seks. Airlangga University Press: Surabaya.
Sudarmanto I, Suhartati T. 2015. Aktivitas Antioksidan Senyawa Flavonoid Pada Kulit
Akar Tanaman Ara (Ficus racemosa, L). Jurnal Kesehatan 6 (2) : 137-141
Sudjarwo GW, Nuraini F. 2018. Efektifitas Nephroprotektor Ekstrak Rumput Laut Merah (Eucheuma Cottoniii) Pada Mencit yang Diinduksi dengan Logam Berat Timbal. Journal of Pharmacy Science and Technolog 1(1): 59-65.
Sutama IK, 2000. Uji Kualitas Semen Beku Kambing Peranakan Etawa dan Kambing Boer. Balai Penelitian Ternak. Bogor.
Unitly AJA, Kusumorini N, Agungpriyono S, Satyaningtijas AS. 2014. Perubahan Kualitas Spermatozoa Dan Jumlah Sel-Sel Spermatogenik Tikus Yang Terpapar Asap Rokok. Jurnal Kedokteran Hewan. Vol.8(2): 116- 119.
Wardani G, Farida N, Andayani R, Kundiri M, Sudjarwo SA. 2017. The Potency of Red Seaweed (Eucheuma cottonii) Extracts as Hepatoprotector on Lead Acetate-induced Hepatotoxicity in Mice. Pharmacognosy Research 9(3) : 282 - 286
Wang LS., Huang YW, Liu S, Yan P, Lin YC. 2008. Conjugated Linoleic Acid Induces Apoptosis Through Estrogen Receptor Alpha in Human Breast Tissue. BMC Cancer 8: 208
Zaetun S, Dewi LBK, Wiadnya IBR. 2018. Profil Kadar MDA (Malondialdehide) Sebagai Penanda Kerusakan Seluler Akibat Radikal Bebas Pada Tikus Yang Diberikan Air Beroksigen. Jurnal Analis Medika Bio Sains 5(1): 79-84.
107
Discussion and feedback