Potential Rhizopus spp. in control the growth of Aspergillus flavus FNCC6109 in broiler chicken concentrate feed
on
JURNAL BIOLOGI UDAYANA 25(2): 147-156
P ISSN: 1410-5292 E ISSN: 2599-2856
Potensi Rhizopus spp. dalam mengendalikan pertumbuhan Aspergillus flavus FNCC6109 pada pakan konsentrat ayam broiler
Potential Rhizopus spp. in control the growth of Aspergillus flavus FNCC6109 in broiler chicken concentrate feed
Lalu Muhammad Sakti Surya Jagat*, Ida Bagus Gede Darmayasa, I Made Sara Wijana
Program Studi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana, Jimbaran, Kuta Selatan, Badung, Bali 80361 – Indonesia
*Email: jagatzsurya@gmail.com
Diterima 7 April 2021 Disetujui 26 Agustus 2021
INTISARI
Kontaminasi Aspergillus flavus pada pakan ternak di Indonesia dapat mempengaruhi kesehatan dan produktivitas ternak. Beberapa faktor yang mendukung terjadinya kontaminasi pada pakan adalah suhu dan kelembapan. Penelitian ini bertujuan untuk mengetahui potensi kultur filtrat Rhizopus spp. dalam menghambat A. flavus FNCC6109 pada pakan konsentrat ayam broiler. Metode yang digunakan yaitu metode dual culture dan uji daya hambat kultur filtrat Rhizopus spp. yang diinkubasi selama 3, 4, dan 5 hari secara in vitro. Uji in vivo dilakukan pada model pakan konsentrat ayam broiler yang ditambahkan kultur filtrat Rhizopus spp. dengan konsentrasi 10% (v/v), 20% (v/v), 30% (v/v), 40% (v/v), dan 50% (v/v). Hasil penelitian menunjukkan bahwa kultur filtrat Rhizopus spp. secara signifikan (P≤0,05) mampu menghambat pertumbuhan A. flavus FNCC6109 baik in vitro dan in vivo. Persentase daya hambat kultur filtrat Rhizopus spp. yang diinkubasi selama 5 hari yaitu sebesar 67,47±2,10% relatif lebih baik dibandingkan 3 dan 4 hari, sehingga digunakan secara in vivo. Perlakuan kultur filtrat Rhizopus spp. sebesar 50% (v/v) pada pakan konsentrat ayam broiler berhasil secara signifikan menurunkan populasi A. flavus FNCC6109 sebesar 82% setelah diinkubasi selama 15 hari dibandingkan perlakuan kontrol negatif (pakan konsentrat tanpa penambahan kultur filtrat Rhizopus spp. dan A. flavus FNCC6109).
Kata kunci: Rhizopus spp., Aspergillus flavus FNCC6109, pakan konsentrat
ABSTRACT
Aspergillus flavus contamination of agriculture in Indonesia can cause problems to animal health and productivity. Some factors can support the appearance of contamination in feed, especially temperature and humidity. The main objective of this research was to investigate potency of Rhizopus spp. on inhibit A. flavus FNCC6109 in broiler chicken concentrate feed. The experiments were conducted dual culture method and the inhibition test of the Rhizopus spp. filtrate culture was incubated for 3, 4 and 5 days on in vitro. The in vivo test was directly applied in broiler chicken concentrate feed which added Rhizopus spp. filtrate culture concentration at 10% (v/v), 20% (v/v), 30% (v/v), 40% (v/v), dan 50% (v/v). The results showed that the Rhizopus spp. filtrate culture significantly (P≤0,05) to inhibit the growth of A. flavus FNCC6109 both in vitro and in vivo. The percentage inhibition of Rhizopus spp. filtrate culture incubated for 5 days showed 67,47±2,10% relatively better results than 3 and 4 days, and therefore was used in the in vivo. Application of 50% (v/v) Rhizopus spp. filtrate culture to the broiler chicken concentrate feed
significantly reduced 82% population of A. flavus FNCC6109 after 15 days incubated relative to that of negative control (concentrate feed without addition Rhizopus spp. filtrate culture and A. flavus FNCC6109).
Keywords: Rhizopus spp., Aspergillus flavus FNCC6109, concentrate feed
PENDAHULUAN
Industri peternakan di Indonesia memiliki peranan penting sebagai sumber penghasil protein hewani yang dibutuhkan oleh masyarakat (Sekretariat Ditjen PKH, 2017). Produktivitas hewan ternak sangat dipengaruhi oleh kualitas dan kuantitas pakan yang diberikan (Nurwahidah et al., 2016). Kualitas pakan yang baik mempunyai kandungan gizi yang diperlukan ternak, viabilitas tinggi, mudah dicerna, dan tidak mengandung cemaran mikroba patogen (Akhadiarto, 2010).
Penyediaan pakan secara berkelanjutan menjadi salah satu kendala bagi para peternak, karena selama proses penyimpanan pakan atau bahan pakan terjadi penurunan kualitas sehingga produktivitas ternak menjadi menurun (Yulien, 2012). Hal ini disebabkan karena Indonesia memiliki curah hujan yang tinggi sehingga kelembapan pakan meningkat (Fadilah & Polana, 2011). Kadar air yang tinggi pada pakan dapat mendukung pertumbuhan jamur genus Aspergillus (Bidura, 2017).
Menurut Hasanah (2017), Aspergillus flavus berkembang biak dengan pembentukan hifa dan menghasilkan konidiofor untuk pembentuk spora. Spora A. flavus dapat ditemukan pada udara terbuka dan air. Jamur ini memiliki ciri-ciri morfologi kuning kehijauan dan dapat tumbuh pada suhu 12–48oC dengan aw minimal 0,8 (Vujanovic et al., 2001). Aspergillus flavus merupakan salah satu jamur penghasil toksin yang berbahaya. Toksin yang dihasilkan jamur pencemar ini dikenal dengan aflatoksin yang umumnya ditemukan pada pakan ternak (Didwania & Joshi, 2013).
Aflatoksin merupakan senyawa metabolit sekunder yang bersifat karsinogenik, mutagenik, dan teratogenik pada manusia dan hewan
(Ghiasian & Maghsood, 2011). Ada enam jenis senyawa aflatoksin yaitu B1, B2, G1, G2, M1 dan M2 (Hackbart et al., 2014). Berdasarkan jenis senyawa aflatoksin tersebut, Aflatoksin B1 (AFB1) dan B2 (AFB2) dihasilkan oleh A. flavus (Yogendrarajah et al., 2015). AFB1 merupakan jenis senyawa yang paling toksik diantara jenis lainnya (Safika et al., 2015). Frekuensi cemaran aflatoksin B1 tertinggi terdapat pada berbagai hasil pertanian seperti kacang-kacangan, gandum, dan biji-bijian yang umumnya digunakan sebagai bahan baku pakan ternak (Utami et al., 2012).
Upaya pengendalian cemaran aflatoksin pada pakan ternak perlu dilakukan agar kandungan aflatoksin pada pakan tidak melebihi batas maksimum yang telah ditetapkan. Pengendalian secara fisik maupun kimia telah diusahakan, namun masih memiliki kelemahan disamping tidak efektif dan efisien tetapi juga menyisakan residu bahan kimia yang dapat membahayakan kesehatan. Selain itu, biaya yang dikeluarkan untuk membeli bahan-bahan kimia terbilang cukup mahal, sehingga perlu dilakukan teknik pengendalian lain yang tidak memerlukan biaya yang mahal serta lebih efektif dan efisien (Roosita, 2002). Pengendalian tersebut dapat dilakukan secara biologi dengan menggunakan mikroba antagonis yang berpotensi menghambat pertumbuhan A. flavus, salah satunya yaitu Rhizopus spp.. Beberapa penelitian terdahulu, seperti yang dilakukan oleh Kusumaningtyas dan Masrianti (2019) menunjukkan bahwa Rhizopus oligosporus mampu menghambat pertumbuhan A. flavus.
Berdasarkan uraian di atas, maka perlu dilakukan penelitian untuk menggali potensi Rhizopus spp. dalam menghambat pertumbuhan Aspergillus flavus FNCC6109 yang diaplikasikan pada pakan konsentrat ayam broiler sebagai upaya meningkatkan produktivitas hasil ternak
MATERI DAN METODE
Isolasi Rhizopus spp. dari Bahan Pakan Konsentrat Ayam Broiler
Isolasi Rhizopus spp. dilakukan dengan menggunakan metode pengenceran sampel (Plating method) yaitu, seri pengenceran 10-1 sampai pengenceran 10-3 (Ilyas et al., 2006). Sampel yang digunakan berasal dari bahan-bahan pakan konsentrat antara lain kedelai, jagung, dedak padi, dan bungkil kelapa. Suspensi pengenceran 10-1 sampai 10-3 masing-masing diambil sebanyak 1 mL kemudian suspensi dimasukkan ke dalam cawan Petri steril dan ditambahkan 15 mL media Potato Dextrosa Agar (PDA) serta kloramfenikol, lalu diinkubasi pada suhu 280C selama 3-4 hari. Koloni jamur yang tumbuh pada cawan Petri dicatat dan diamati secara makroskopis dengan berpedoman pada buku identifikasi Pitt and Hocking (1997).
Identifikasi kultur Rhizopus spp.
Identifikasi kultur Rhizopus spp. dilakukan secara makroskopis dan mikroskopis. Pengamatan secara makroskopis dilakukan dengan menggunakan kaca pembesar (loop) yang meliputi bentuk koloni, warna permukaan koloni, dan warna sebalik koloni. Sedangkan pengamatan secara mikroskopis dilakukan dengan menggunakan mikroskop yang meliputi rhizoid, sporangiofor, sporangium, spora, stolon, hifa, dan ada tidaknya sekat pada hifa (Pitt & Hocking, 1997).
Reisolasi Aspergillus flavus FNCC6109
Kultur A. flavus FNCC6109 diperoleh dari stok kultur Laboratorium Mikrobiologi, Program Studi Biologi, FMIPA, Universitas Udayana. Langkah pertama yang dilakukan yaitu stok kultur A. flavus diambil 1 ose kemudian diinokulasikan tepat di tengah cawan Petri yang berisi media Potato Dextrose Agar (PDA), lalu diinkubasi pada suhu 280C selama 4 hari. Koloni A. flavus FNCC6109 yang tumbuh pada media PDA dilakukan reidentifikasi secara makroskopis dan mikroskopis. Pengamatan secara makroskopis dilakukan dengan menggunakan
kaca pembesar (loop) yang meliputi tekstur koloni, warna permukaan koloni, dan warna sebalik koloni. Sedangkan pengamatan secara mikroskopis dengan menggunakan mikroskop yang meliputi foot sel, konidiofor, konidia, sterigma, miselia, hifa, dan ada tidaknya sekat pada hifa.
Uji Daya Hambat Rhizopus spp. terhadap Aspergillus flavus FNCC6109
Uji daya hambat Rhizopus spp. terhadap A. flavus FNCC6109 dilakukan secara in vitro menggunakan metode dual culture dengan ulangan sebanyak 4 kali.
Menurut Singh & Vijay (2011), persentase hambatan Rhizopus spp. terhadap A. flavus FNCC6109 dapat dihitung melalui PIRG (Percentage Inhibition of Radial Growth) dengan rumus:
PIRG (%) = ^1 ^2 × 100%.................(1)
«1
Keterangan:
PIRG : Percentage Inhibition of Radial Growth R1 : Diameter koloni A. flavus FNCC6109
tanpa antagonis (kontrol)
R2 : Diameter koloni A. flavus FNCC6109
dengan antagonis (dual culture)
Uji Daya Hambat kultur filtrat Rhizopus spp. terhadap Aspergillus flavus FNCC6109
Biakan Rhizopus spp. yang memiliki potensi paling besar dalam menghambat pertumbuhan A. flavus pada uji daya hambat secara in vitro selanjutnya diinokulasikan ke dalam botol yang berisi 100 mL media PDB (Potato Dextrosa Broth) lalu diinkubasi pada suhu 280C selama 3, 4, dan 5 hari. Kultur filtrat Rhizopus spp. yang telah dibuat dilakukan uji daya hambat secara in vitro sesuai dengan masa inkubasi yang telah ditentukan dengan pengulangan 4 kali. Hasil uji daya hambat kultur filtrat Rhizopus spp. terhadap A. flavus FNCC6109 dapat dihitung menggunakan rumus yang telah ditetapkan menurut Singh & Vijay (2011).
Pembuatan Model Pakan Konsentrat Ayam Ras Pedaging
Bahan baku pakan yang telah diformulasi dibuat dalam bentuk pellet sesuai dengan kebutuhan ransum ternak. Menurut Darmayasa (2015), komposisi bahan baku untuk pembuatan model pakan konsentrat antara lain, tepung jagung, tepung kedelai, dedak padi, bungkil kelapa, tepung ikan, tepung daun turi, garam dapur, dan mineral B12 (Tabel 1).
Tabel 1. Komposisi Model Pakan Konsentrat Ayam Ras Pedaging
|
No |
Jenis Bahan |
Berat (g) |
|
1 |
Tepung Jagung |
400 |
|
2 |
Dedak Padi |
210 |
|
3 |
Tepung Kedelai |
130 |
|
4 |
Bungkil Kelapa |
90 |
|
5 |
Tepung Ikan |
100 |
|
6 |
Tepung Daun Turi |
55 |
|
7 |
Garam Dapur |
7 |
|
8 |
Mineral B12 |
8 |
Sumber: Darmayasa (2015)
Pembuatan Suspensi Spora Aspergillus flavus FNCC6109
Pembuatan suspensi spora A. flavus FNCC6109 dilakukan dengan menginokulasikan koloni A. flavus FNCC6109 tepat di tengah media PDA padat dengan diameter 5 mm lalu diinkubasi pada suhu 28°C selama 4 hari. Koloni yang tumbuh pada media PDA ditetesi air steril sebanyak 5 mL pada permukaan koloni lalu diusapkan dengan spatula. Diambil cairan yang telah berisi spora menggunakan pipet Pasteur lalu dipindahkan ke tabung reaksi.
Uji kultur filtrat Rhizopus spp. terhadap Jumlah Koloni Aspergillus flavus FNCC6109 pada Pakan Konsentrat Ayam Ras Broiler
Uji ini dilakukan menggunakan 7 botol plastik yang masing-masing diisi dengan 10 g pakan konsentrat. Botol plastik pertama hanya diisi dengan 10 g pakan konsentrat yang digunakan sebagai kontrol negatif. Selanjutnya botol plastik kedua diisi dengan 10 g pakan konsentrat
ditambahkan 5 mL spora A. flavus FNCC6109 sebagai kontrol positif. Botol plastik ketiga sampai ketujuh, ditambahkan pakan ternak dan 5 mL spora A. flavus FNCC6109, kemudian ditambahkan kultur filtrat Rhizopus spp. dengan konsentrasi 10%, 20%, 30%, 40%, dan 50%. Semua perlakuan dan kontrol diinkubasi selama 15 hari pada suhu 28°C dan dilakukan perhitungan jumlah koloni A. flavus FNCC6109 menggunakan plating method.
HASIL
Isolasi dan Identifikasi Rhizopus spp. Secara Makroskopis dan Mikroskopis
Hasil isolasi Rhizopus spp. yang dilakukan pada bahan-bahan pakan konsentrat diperoleh satu isolat Rhizopus spp yang berhasil diisolasi dari kedelai. Hasil pengamatan isolat Rhizopus spp. secara makroskopis yang diinkubasi selama 4 hari rata-rata diameter koloninya 9 cm. Ciri-ciri koloni tersebut memiliki warna putih keabuan dengan tekstur koloni menyerupai kapas, growing zone, tidak terdapat zonasi, dan tidak memiliki garis radial (Gambar 1. A). Hasil pengamatan secara mikroskopis dengan perbesaran 400x menunjukkan bahwa Rhizopus spp. memiliki sporangium berbentuk oval, hifa tidak bersekat, memiliki rhizoid dan stolon (Gambar 1. B). Karakteristik isolat Rhizopus spp. yang diinkubasi selama 4 hari pada media PDA ditampilkan pada Tabel 2.
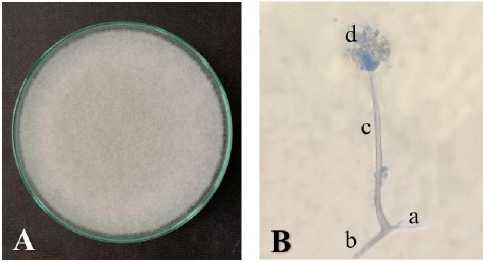
Gambar 1. Morfologi Rhizopus spp. (A) Koloni Rhizopus spp. pada media PDA; dan (B) Struktur Rhizopus spp. secara mikroskopis dengan perbesaran 400x, Keterangan a: rhizoid; b: stolon; c: sporangiofor; d: sporangium
Tabel 2. Hasil pengamatan makroskopis dan mikroskopis isolat Rhizopus spp. masa inkubasi 4 hari
|
Karakter Morfologi |
Keterangan | |
|
Makroskopik | ||
|
a |
Warna koloni |
Putih keabuan |
|
b |
Warna sebalik koloni |
Putih |
|
c |
Tekstur koloni |
Cattony |
|
d |
Growing zone |
Ada |
|
e |
Zonasi |
Tidak ada |
|
Mikroskopik | ||
|
a |
Jenis hifa |
Tidak bersepta |
|
b |
Sporangium |
Oval |
|
c |
Stolon |
Ada |
|
d |
Rhizoid |
Ada |
|
e |
Sporangiofor |
Tunggal |
Tabel 3. Hasil pengamatan makroskopis dan mikroskopis isolat A. flavus FNCC6109 masa inkubasi 4 hari
|
Karakter Morfologi |
Keterangan | |
|
Makroskopik | ||
|
a |
Warna koloni |
Hijau kekuningan |
|
b |
Warna sebalik koloni |
Kuning |
|
c |
Tekstur koloni |
Granular |
|
d |
Growing zone |
Ada |
|
e |
Zonasi |
Ada |
|
Mikroskopik | ||
|
a |
Jenis hifa |
Bersepta |
|
b |
Bentuk Vesikel |
Bulat |
|
c |
Konidiofor |
Ada |
|
d |
Konidia |
Ada |
|
e |
Sterigma |
Ganda |
Reidentifikasi Aspergillus flavus FNCC6109 Secara Makroskopis dan Mikroskopis
Hasil reidentifikasi A. flavus FNCC6109 yang diperoleh dari stok kultur Laboratorium Mikrobiologi, Program Studi Biologi Universitas Udayana. Hasil pengamatan A. flavus FNCC6109 secara makroskopis yang diinkubasi selama 4 hari rata-rata diameter koloninya 6,5 cm. Ciri-ciri koloni tersebut memiliki warna hijau kekuningan dengan tepi koloni berwarna putih, terdapat growing zone, koloni bertekstur granural, terdapat zonasi, dan tidak memiliki garis radial (Gambar 2. A). Hasil pengamatan secara mikroskopis dengan perbesaran 400x menunjukkan bahwa A. flavus FNCC6109 memiliki konidia yang berbentuk bulat, konidiofor berwarna bening, vesikel berbentuk bulat, dan sterigma yang menempel pada bagian vesikel (Gambar 2. B).
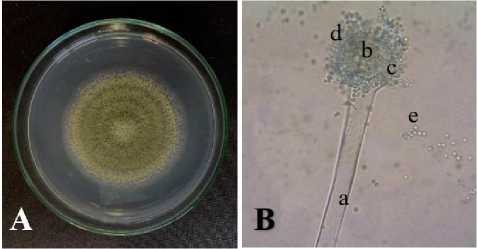
Gambar 2. Morfologi Aspergillus flavus FNCC6109 (A) Koloni A. flavus FNCC6109 pada media PDA; dan (B) Struktur A. flavus FNCC6109 secara mikroskopis dengan perbesaran 400x, Keterangan a: konidiofor; b: vesikel; c:
sterigma; d: konidia; e. konidium.
Uji Daya Hambat Rhizopus spp. terhadap Aspergillus flavus FNCC6109 secara In Vitro
Uji daya hambat Rhizopus spp. terhadap A. flavus FNCC6109 secara in vitro dengan menggunakan metode dual culture diperoleh hasil rata-rata persentase daya hambat sebesar 61,40±0,54% dengan masa inkubasi selama 4 hari. Rata-rata diameter koloni A. flavus FNCC6109 tanpa Rhizopus spp. dengan masa inkubasi 4 hari sebesar 6,37±0,22 cm. Sedangkan rata-rata diameter koloni A. flavus FNCC6109 dengan perlakuan yang diinkubasi selama 4 hari sebesar 2,46±0,09 cm (Tabel 4 dan Gambar 3).
|
Tabel 4. Hasil uji daya hambat Rhizopus spp. terhadap A. flavus FNCC6109 | ||||||
|
RgjMm |
Diameter ⅛J⅛9J⅛A∕Z^ FNCC6109 setelah inkubasi (cm) |
Jnnifek |
Rata- rata | |||
|
Ul |
m |
U3 |
U4 | |||
|
Ksisfcal |
6.5 |
6.1 |
6,3 |
6.6 |
25,5 |
6.37±0,22 |
|
Rhizopiis ^PP∙ |
2,55 |
2.37 |
2.40 |
2,52 |
9.84 |
2,46±0,09 |
|
JfewisUii (%) |
60.76 |
61.14 |
61,90 |
61.81 |
245.61 |
61.40±0,54 |
Keterangan: Nilai-nilai pada tabel 8 merupakan nilai dengan empat kali ulangan dan rata-rata ± standar deviasi; U = Ulangan
Uji Daya Hambat Kultur Filtrat Rhizopus spp. terhadap Aspergillus flavus FNCC6109 Secara In Vitro
Hasil persentase daya hambat kultur filtrat Rhizopus spp. yang diinkubasi selama 3, 4, dan 5 hari masing-masing sebesar 59,23±2,50%; 62,64±1,28%; dan 67,47±2,10%. Rata-rata diameter koloni A. flavus FNCC6109 tanpa perlakuan kultur filtrat Rhizopus spp. adalah sebesar 6,35±0,26 cm dengan masa inkubasi 4 hari. Sedangkan rata-rata diameter koloni A. flavus FNCC6109 yang diberikan perlakuan kultur filtrat Rhizopus spp. sebesar 2,33 cm dengan masa inkubasi 4 hari (Gambar 4).
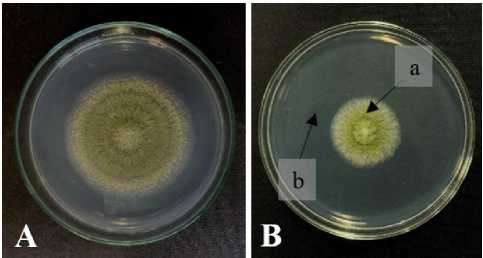
Gambar 4. Uji daya hambat kultur filtrat Rhizopus spp. terhadap A. flavus FNCC6109 pada media PDA; (A) Kontrol: A. flavus FNCC6109; (B) Perlakuan: a. A. flavus FNCC6109; b. Kultur filtrat Rhizopus spp.
Tabel 5. Hasil uji daya hambat kultur filtrat Rhizopus spp. terhadap A. flavus FNCC6109
|
RsrMuaii |
Diameter koloni.4. flavus FNCC6109 (cm) |
Rataiata (cm) |
Daja hambat (%) | |||
|
Ul |
U2 |
U3 |
U4 | |||
|
KsBtesJl |
6,3 |
6.5 |
6.0 |
6.6 |
6,35±0,26* |
0=0.0 |
|
Rhizopus spp. ⅛kufeaai 3 Im |
2,5 |
2.49 |
2,65 |
2,7 |
2.58±0.10b |
59,23±2,50 |
|
Rhizopus spp. Wkufeaai4Imi |
2.44 |
2.35 |
2.29 |
2,4 |
2,37±0.06b |
62.64±1,28 |
|
Rhizopus spp. Wkufeaai 5 Imi |
2,2 |
1.95 |
2,0 |
2,1 |
2.06±0.11b |
67,47±2.10 |
Keterangan: Nilai-nilai pada tabel yang diikuti notasi huruf yang sama menunjukkan hasil yang tidak berbeda nyata (P≤0,05) berdasarkan uji Duncan setelah dilakukan analisis sidik ragam (ANOVA).
Uji Kultur Filtrat Rhizopus spp. terhadap Jumlah Koloni Aspergillus flavus FNCC6109 Secara In Vivo
Hasil pengujian kultur filtrat Rhizopus spp. dalam menghambat pertumbuhan A. flavus FNCC6109 pada model pakan konsentrat ayam
ras broiler yang disimpan selama 15 hari menunjukkan hasil positif bahwa kultur filtrat yang diinkubasi selama 5 hari memiliki kemampuan dalam menghambat pertumbuhan A. flavus FNCC6109 pada pakan konsentrat (Tabel 6).
Tabel 6. Jumlah koloni A. flavus FNCC6109 pada model pakan konsentrat ayam ras broiler yang ditambahkan kultur filtrat Rhizopus spp.
|
Perlakuan |
Jumlah koloni A.flavus FNCC6109 (CFUZ8) |
Penurunan A.flavus FNCC6109 W | |
|
Koloni sebelum inkubasi (To) |
Koloni sesudah inkubasi (Tis) | ||
|
A |
(0,00) |
(0,00>0,008 |
0 |
|
B |
27,5xl04 |
51×104±0.355a |
0 |
|
C |
27.5xl04 |
25.5×104±0.316b |
8 |
|
D |
27.5xl04 |
22,7× 10⅛0.330bc |
18 |
|
E |
27,5xl04 |
19.7×10⅛0.29Scd |
28 |
|
F |
27,5xl04 |
8×104±0.182e |
71 |
|
G |
27.5xl04 |
5×10⅛0.182f |
82 |
Keterangan: Nilai rata-rata empat kali ulangan pada T15 dengan notasi huruf yang berbeda pada kolom yang sama menunjukkan nilai rata-rata yang berbeda nyata (P≤0,05) berdasarkan uji Duncan setelah dilakukan analisis sidik ragam (ANOVA). (A): Konsentrat tanpa A. flavus FNCC6109 dan tanpa kultur filtrat Rhizopus spp.; (B): Konsentrat + A. flavus FNCC6109; (C): Konsentrat + A. flavus FNCC6109 + 10% Rhizopus spp.; (D): Konsentrat + A. flavus FNCC6109 + 20% Rhizopus spp.; (E): Konsentrat + A. flavus FNCC6109 + 30% Rhizopus spp.; (F): Konsentrat + A. flavus FNCC6109 + 40% Rhizopus spp.; (G): Konsentrat + A. flavus FNCC6109 + 50% Rhizopus spp
PEMBAHASAN
Isolat Rhizopus spp. berhasil diisolasi dari kedelai sebagai salah satu bahan pakan konsentrat setelah ditumbuhkan dan dimurnikan pada media PDA yang diinkubasi selama 4 hari. Rhizopus spp. merupakan jamur kosmopolitan yang sering ditemukan di tanah, berbagai substrat organik seperti buah dan sayuran serta produk hasil fermentasi (Endrawati & Kusumaningtyas, 2017). Kemudian Park et al. (2016) menyatakan faktor yang menyebabkan jamur ini dapat mudah ditemukan keberadaannya adalah karena dalam pertumbuhannya tidak memerlukan nutrisi yang spesifik, namun di penelitian ini Rhizopus spp.
hanya ditemukan pada kedelai dari beberapa bahan pakan konsentrat yang telah diisolasi. Hal ini diduga disebabkan oleh tidak adanya kontaminasi pada bahan pakan yang lain dan atau faktor kelembapan pada bahan pakan konsentrat tersebut. Jamur tingkat rendah seperti Rhizopus spp. umumnya memerlukan lingkungan dengan tingkat kelembapan relatif yang tinggi yaitu (Rh) ≥ 90% untuk dapat tumbuh. Bahan pakan konsentrat yang disimpan pada lingkungan dengan tingkat kelembapan relatif di bawah 90% tidak dapat dicemari oleh jamur tingkat rendah, tetapi jamur tingkat tinggi seperti Aspergillus spp. dan Penicillium spp. dapat tumbuh dengan tingkat kelembapan relatif ≥ 80% (Gandjar et al., 1999).
Berdasarkan hasil identifikasi yang dilakukan secara makroskopis dan mikroskopis, isolat yang ditumbuhkan pada media PDA dengan masa inkubasi 4 hari menunjukkan karakteristik Rhizopus spp. (Tabel 2). Hasil pengamatan secara makroskopis Rhizopus spp. yang diinkubasi selama 4 hari pada media PDA dengan rata-rata diameter koloni 9 cm tergolong memiliki pertumbuhan yang sangat cepat. Morfologi Rhizopus spp. secara mikroskopis yang membedakannya dengan jamur lainnya adalah hifa yang tidak bersekat (senositik), memiliki rhizoid, serta sporangium yang berbentuk bulat, elip, dan silinder. Menurut Sine & Endang (2018), Rhizopus spp. memiliki rhizoid berwarna kecoklatan, bercabang, berlawanan arah dengan sporangiofor, memiliki stolon berdinding halus, serta sporangiofor dapat tumbuh tanpa adanya rhizoid.
Berdasarkan hasil reidentifikasi yang dilakukan secara makroskopis dan mikroskopis, isolat yang ditumbuhkan pada media PDA dengan masa inkubasi 4 hari menunjukkan karakteristik A. flavus FNCC6109 (Tabel 3). Ciri-ciri koloni tersebut memiliki warna hijau kekuningan dengan tepi koloni berwarna putih (Gambar 2. A). Bertambahnya waktu inkubasi menyebabkan terjadinya penambahan diameter dan perubahan warna pada koloni A. flavus FNCC6109 dari hijau tua sampai kuning. Hal ini sesuai dengan penelitian yang dilakukan oleh Samson et al.
(2011), bahwa secara makroskopis A. flavus yang ditumbuhkan pada media MEA selama 5-7 hari pada suhu 28°C memiliki koloni berwarna hijau kekuningan dengan misellium putih pada tepi koloni, memiliki zonasi, konidia bergranural, dan warna sebalik koloni kuning. Koloni yang berwarna putih kemudian akan berubah warna menjadi hijau kekuningan dengan membentuk struktur konidia pada hari ke-5 masa inkubasi (Safika et al., 2015). Pengamatan secara mikroskopis terlihat struktur A. flavus FNCC6109 yang terdiri dari konidium, konidia, vesikel, sterigma dan konidiofor (Gambar 2. B). Struktur mikroskopis pada hasil pengamatan tampak seperti struktur mikroskopis A. flavus secara umum yang memiliki konidiofor dengan panjang berkisar ± 1mm, konidia berdiameter antara 3,54,5 µm, konidiofor tunggal, vesikel yang berdiameter 10-65 µm, hifa bersepta, dan terdapat fialid (Hedayati et al., 2007; Samson et al., 2011).
Uji daya hambat Rhizopus spp. terhadap Aspergillus flavus FNCC6109 secara in vitro dengan menggunakan metode dual culture yang diinkubasi selama 4 hari menunjukkan adanya aktifitas penghambatan yang dilakukan oleh Rhizopus spp. (Gambar 3. B). Rhizopus spp. sebagai antagonis mampu menghambat pertumbuhan A. flavus FNCC6109 dikarenakan pertumbuhan Rhizopus spp. lebih cepat dibandingkan dengan A. flavus FNCC6109. Menurut Widi et al. (2015), kecepatan pertumbuhan pada jamur antagonis merupakan salah satu indikator mekanisme kompetisi ruang dan nutrisi dengan jamur patogen, semakin cepat pertumbuhan jamur antagonis maka semakin efektif dalam menghambat pertumbuhan jamur patogen. Kemampuan Rhizopus spp. dalam menghambat mikroorganisme lain pernah dilaporkan oleh Virgianti (2015) bahwa Rhizopus spp. yang diisolasi dari tempe mampu menghasilkan senyawa bioaktif antimikroba. Meskipun belum diketahui senyawa bioaktif yang dihasilkan tetapi telah mampu menghasilkan zona hambat dalam rentang susceptible terhadap bakteri patogen enterik Escherichia coli ATCC 25922, Salmonella typhimurium ATTC 14028, dan Shigella flexneri ATTC 12022. Perlu
dilakukan penelitian selanjutnya untuk mengetahui senyawa antibakteri maupun senyawa aktif lainnya yang dapat dihasilkan oleh Rhizopus spp.
Kultur filtrat Rhizopus spp. dengan masa inkubasi 3 hari, 4 hari, dan 5 hari menunjukkan daya hambat berbeda terhadap pertumbuhan Aspergillus flavus FNCC6109 secara in vitro (Tabel 5 dan Gambar 4). Kemampuan daya hambat yang dihasilkan kultur filtrat Rhizopus spp. diduga disebabkan karena pengaruh enzim dan metabolit-metabolit yang dieksresikan oleh Rhizopus spp. sehingga mampu menekan pertumbuhan A. flavus FNCC6109. Salah satu enzim yang dihasilkan oleh Rhizopus spp. adalah enzim β-glukanase (Celestino et al., 2006). Kemudian Celestino et al. (2006) menyatakan bahwa, enzim β-glukanase disintetis secara ekstraseluler oleh Rhizopus spp. untuk menghidrolisis karbohidrat golongan β-glukan. Menurut Hjeljord et al. (1998) enzim β-glukanase yang disintetis secara ekstraseluler bekerja dengan cara menghidrolisis struktur glukan yang terdapat pada dinding sel jamur patogen. Struktur glukan umumnya terdapat pada ujung hifa, sehingga enzim β-glukanase mampu mempengaruhi pertumbuhan hifa dan menyebabkan pembengkakan pada hifa serta nekrosis (Budiarti & Widyastuti, 2011). Menurut Deacon (1997) menyatakan bahwa, struktur glukan juga terdapat pada komponen utama penyusun dinding sel A. flavus. Komponen tersebut yaitu polisakarida yang terdiri dari protein dan lipid, dimana komponen fibrilnya berupa kitin dengan rantai panjang β-(1,4) N-acetylglucosamine dan β-(1,3)- β-(1,6) glukan. Jadi, enzim β-glukanase yang dihasilkan oleh Rhizopus spp. dapat menghidrolisis karbohidrat golongan glukan yang akan memperkaya nutrisi sehingga mempercepat pertumbuhan dan disisi lain enzim β-glukanase dapat menghidrolisis struktur glukan dinding sel hifa jamur patogen. Berdasarkan penelitian yang telah dilakukan sebelumnya, belum diketahui secara pasti enzim spesifik dari kultur filtrat Rhizopus spp. yang mampu menghambat pertumbuhan A. flavus sehingga perlu diketahui lebih lanjut untuk
mekanisme kerja dan enzim-enzim spesifik serta metabolit yang terkandung di dalam filtrat Rhizopus spp (Kobayasi, 1992).
Pemberian kultur filtrat Rhizopus spp. terhadap jumlah koloni Aspergillus flavus FNCC6109 pada pakan konsentrat ayam ras broiler yang diinkubasi selama 15 hari menunjukkan hasil positif bahwa kultur filtrat mampu menghambat pertumbuhan A. flavus FNCC6109 (Tabel 6). Jumlah koloni A. flavus FNCC6109 terendah ditemukan pada model pakan konsentrat dengan penambahan konsentrasi sebesar 50% kultur filtrat Rhizopus spp. yaitu sebesar 5×104±0,182 CFU/g sesudah penyimpanan selama 15 hari (T15) dengan persentase penurunan sebesar 82%. Hasil yang ditunjukkan pada Tabel 6 memiliki signifikasi bahwa semakin tinggi konsentrasi kultur filtrat yang diberikan pada model pakan konsentrat, maka pertumbuhan jumlah koloni A. flavus FNCC6109 akan semakin rendah. Hasil tersebut didukung oleh penelitian yang dilakukan oleh Darmayasa (2015) yang menyatakan bahwa pemberian kultur filtrat Trichoderma asperellum TKD dengan konsentrasi 9/100g mampu menghambat pertumbuhan A. flavus FNCC6109 pada model pakan konsentrat sebesar 74,93% dengan masa penyimpanan selama 30 hari. Sedangkan penurunan hambatan koloni A. flavus FNCC6109 terendah yaitu pada konsentrasi 10%. Hal ini sesuai dengan penelitian yang dilakukan Rabinal & Bhat (2017) bahwa, aktivitas antijamur yang dihasilkan dari metabolit akan menurun bersamaan dengan penurunan konsentrasi dari metabolit tersebut.
SIMPULAN
Adapun simpulan yang dapat diambil dari penelitian ini yaitu Rhizopus spp. mampu menghambat pertumbuhan Aspergillus flavus FNCC6109 secara in vitro pada masa inkubasi 4 hari dengan persentase hambatan tertinggi yaitu 61,90% dan terendah sebesar 60,76%. Kultur filtrat Rhizopus spp. yang diinkubasi selama 3, 4, dan 5 hari mampu menghambat pertumbuhan A. flavus FNCC6109 masing-masing sebesar 59,23±2,50%; 62,64±1,28%; dan 67,47±2,10%.
Kultur filtrat Rhizopus spp. secara nyata mampu mempengaruhi jumlah koloni A. flavus FNCC6109 pada model pakan konsentrat ayam broiler. Kultur filtrat Rhizopus spp. dengan konsentrasi 50% mampu menurunkan jumlah koloni A. flavus FNCC6109 sebesar 82% setelah pakan konsentrat ayam broiler disimpan selama 15 hari.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada Kepala laboratorium Mikrobiologi Prodi Biologi FMIPA Universitas Udayana atas semua fasilitas selama riset. Kepada Dr. Dra. Meitini Wahyuni Proborini, M.Sc., St., Dra. Inna Narayani, M.Sc., dan Drs. Deny Suhernawan Yusup, M.Sc. atas waktu saran, dan masukannya.
KEPUSTAKAAN
Akhadiarto S. 2010. Pengaruh Pemanfaatan Limbah Kulit Singkong dalam Pembuatan Pellet Ransum Unggas. J. Tek. Ling. 11(1): 127-138.
Bidura IGNG. 2017. Buku Ajar Teknologi dalam Industri Pakan. Denpasar: Udayana
University Press.
Budiarti SW, Widyastuti SM. 2011. Aktivitas Antifungal ∕7-1,3-Glukanase Trichoderma
reesei pada Fungi Akar Ganoderma philipii. Jurnal Widyariset 14(2):455-460.
Celestino KRS, Cunha RB, Felix CR. 2006. Characterization of a β-glucanase Produced by Rhizopus microspores var. microspores, and its Potensial for Application in The Brewing Industry. Journal BMC Biochemistry 7(23):1-9.
Darmayasa IBG. 2015. Potensi Trichoderma asperellum TKD Dalam Menghambat Pertumbuhan Aspergillus flavus FNCC6109 Sebagai Upaya Mengurangi Cemaran Afkatoksin B1 Pada Model Konsentrat. Doctoral Disertasi. Universitas Udayana.
Deacon JW. 1997. Modern Mycology. 3rd ed. Oxford: Balckwell Science Ltd.
Didwania N, Joshi M. 2013. Mycotoxins: A Critical Review on Occurrence and Significance. Int J Pharm. Pharm Sci. 5: 1014-1019.
Endrawati D, Kusumaningtyas E. 2017. Beberapa Fungsi Rhizopus sp. dalam Meningkatkan Nilai Nutrisi Bahan Pakan. WARTAZOA 27(2): 81-88
Fadilah R, Polana A. 2011. Mengatasi 71 Penyakit Pada Ayam. Jakarta: Agromedia Pustaka.
Gandjar I, Samson RA, Vermeulen KVDT, Oetari A, Santoso I. 1999. Pengenalan Kapang Tropik Umum. Jakarta: Yayasan Obor
Indonesia.
Ghiasian SA, Maghsood AH. 2011. Occurrence of Aflatoxigenic Fungi in Cow Feeds During the Summer and Winter Season in Hamadan, Iran. African Journal of Microbiology Research 5(5): 516-521.
Hackbart HCS, Machado AR, Christ-Ribeiro A, Prietto L, Badiale-Furlong E. 2014. Reduction of Aflatoxins by Rhizopus oryzae and Trichoderma reesei. Mycotoxin Res. 30: 141-149.
Hasanah U. 2017. Mengenal Aspergillosis, Infeksi Jamur Genus Aspergillus. Jurnal Keluarga Sehat Sejahtera 15(30): 76-86.
Hedayati MT, Pasqualloto AC, Warn PA, Bowyer P, Denning DW. 2007. Aspergillus flavus: human pathogen, allergen and mycotoxin producer. Journal of Microbial 153(1): 16771692.
Hjeljord L, Tronsmo A. 1998. Trichoderma and Gliocladium in Biological Control: an overview. In G.E. Harman and C.P. Kubicek (Eds.), Trichoderma and Gliocladium Vol. 2. London: Taylor and Francis.
Ilyas M, Rahmansyah M, Kanti A. 2006. Seri Panduan: Teknik Isolasi Fungi. Jakarta: LIPI Press.
Kobayasi. S. Y., N. Okazaki, dan T. Koseki. 1992. Purification and Characterization of an Antibiotic Substance Producred from Rhizopus oligosporus IFO 8631. Journal Biosci. Biotech, Biochem. 56(1):94-98.
Kusumaningtyas E, Masrianti FF. 2019. Rhizopus oligosporus Activity in Crude Extract and Powder Form to Reduce Aspergillus flavus and Aflatoxin Contamination in Corn. JITV. 24(4):173-181.
Nurwahidah J, Tolleng AL, Hidayat MN. 2016. Pengaruh Pemberian Pakan Konsentrat Dan Urea Molases Blok (UMB) Terhadap
Pertambahan Berat Badan Sapi Potong. Jurnal Ilmu-Ilmu Peternakan 2(2): 111-115.
Park JH, Yun HM, Kim IH. 2016. The effect of feeding Rhizopus oligosporus on growth performance, nutrient digestibility blood profile, fecal microbiota and fecal score in weanling pigs. Turkish J Vet Anim Sci. 40:17.
Pitt JI, Hocking AD. 1997. Fungi and Food
Spoilage. Second Edition. Cambridge:
Printed in Great Britain at the University Press.
Rabinal CA, Bhat S. 2017. Profiling of Trichoderma koningii IAB1252’S secondary metabolites by thin layer chromatography and their antifungal activity. Bioscan. 12:163–168.
Roosita LB. 2002. Biokontrol terhadap Racun Jamur. Dimuat pada Harian Pikiran Rakyat Edisi 2002. Diakses Tanggal 1 Oktober 2019 dari http://www.aflatoksin.id.com.
Safika, Jamin F, Aisyah S. 2015. Deteksi Aflatoksin B1 pada Jenis Makanan Olahan Jagung Menggunakan Enzyme-Linked Immunosorbent Assay (ELISA). Jurnal Medika Veterinaria 9(1): 23-25.
Samson RA, Varga J, Frisvad JC. 2011. Taxonomic studies on the genus Aspergillus. Utrecht: CBS-KNAW Fungal Biodiversity Centre.
Sekretariat Ditjen PKH, 2017. Konsumsi Periode Tahun 2016. Newsletter Data Makro Edisi: 01/konsumsi/03/2017. Direktorat Jenderal Peternakan dan Kesehatan Hewan, Kementerian Pertanian. Diakses Tanggal 26 September 2019 dari
http://ditjenpkh.pertanian.go.id/pages/73/ko nsumsi.html
Sine Y, Endang SS. 2018. Isolasi dan Identifikasi Kapang Rhizopus pada tempe gude (Cajanus cajan L.) Savana Cendana 3(4):67-68.
Singh PK, Vijay K. 2011. Biological Control of Fusarium Wilt of Chrysanthemum with Trichoderma and Botanicals. J. Agric Tech. 7(6): 1603-1613.
Utami T, Hartanta FX, Nugroho A, Usmiati S, Marwati S, Rahayu ES. 2012. Penurunan Kadar Aflatoksin B1 pada Sari Kedelai oleh Sel Hidup dan Sel Mati Lactobacillus Acidophilus Snp-2. Jurnal Teknologi dan Industri Pangan 23(1): 58-63.
Virgianti DA. 2015. Uji Antagonis Jamur Tempe (Rhizopus sp.) terhadap Bakteri Patogen Enterik. Jurnal Biosfera 32(3):163-168.
Vujanovic V, Smoragiewics W, Krzysztyniak K. 2001. Airborne Fungal Ecological Niche Determination as one of the Possibilities for Indirect Mycotoxin Risk Assessment in Indoor air. Environ Toxicol. 16: 1-8.
Widi A, Rita H, dan Samsudin. 2015. Evaluasi jamur antagonis dalam menghambat pertumbuhan Rigidoporus microporus penyebab penyakit jamur akar putih pada tanaman karet. J. TIDP. 2(1):51- 60.
Yogendrarajah P, Devlieghere F, Ediage EN, Jacxsens L, De-Meulenaer B, De-Saeger S. 2015. Toxigenic Potentiality of Aspergillus flavus and Aspergillus parasiticus Strains Isolated from Black Pepper Assessed by an LCMS/MS Based Multi-mycotoxin Method. Food Microbiology. 52: 185-196.
Yulien TF. 2012. Analisis Pendapatan dan Persepsi Peternak Unggas Plasma Terhadap Kontrak Perjanjian Pola Kemitraan Ayam Pedaging di Provinsi Lampung. Jurnal Universitas Gadjah Mada. 36 (1): 1-6.
156
Discussion and feedback