EVALUATION OF PHOSPHATE SOLUBILIZING BACTERIA (PSB) POPULATION IN NON RHIZOSPHERE AND RHIZOSPHERE OF Gliricidia sepium, Leucaena leucochepala,AND Sesbania grandiflora PLANT ON DRY LAND IN THE RAINY SEASON
on

e--journal FAPET UNUD
e-Journal

Universitas Udayana
Peternakan Tropika
Journal of Tropical Animal Science
email: peternakantropika_ejournal@yahoo.com
email: jurnaltropika@unud.ac.id
Submitted Date: February 2, 2018 Editor-Reviewer Article;: I Made Mudita
Accepted Date: February 6, 2018
EVALUASI POPULASI BAKTERI PELARUT FOSFAT (BPF) PADA NON RHIZOSFIR DAN RHIZOSFIR TANAMAN GAMAL, LAMTORO DAN TURI DI LAHANKERING PADA MUSIM HUJAN
Widnyana, I G., I W. Suarna, dan S. A. Lindawati
PS. Peternakan, Fakultas Peternakan, Universitas Udayana, Jln. P.B. Sudirman, Denpasar e-mail: gwidnyana9@gmail.com. Hp. 083114780850
ABSTRAK
Penelitian ini bertujuan untuk mengetahui populasi bakteri pelarut fosfat (BPF) pada non rhizosfir dan rhizosfir tanaman di lahan kering pada musim hujan. Penelitian dilaksanakan selama 3 bulan meliputi pengambilan sampel di Farm STS/Tanaman pakan Fakultas Peternakan dan analisis tanah dilaksanakan di Laboratorium Teknologi Hasil Ternak dan Mikrobiologi Fakultas Peternakan dan Laboratorium Ilmu Tanah Fakultas Pertanian, Universitas Udayana. Penelitian mengikuti model linier aditif dengan asumsi perbedaan terjadi disebabkan oleh perbedaan jenis tanaman sedangkan faktor lain dikondisikan seragam (homogen). Pengambilan sampel dilakukan pada 4 lokasi yaitu: non rhizosfir (NR), rhizosfir gamal (RG), rhizosfir lamtoro (RL), dan rhizosfir turi (RT) dengan 4 ulangan. Hasil penelitian menunjukkan TPC tanah berkisar 0,57×108- 5,6×108cfu/g, berbeda tidak nyata pada semua perlakuan. Total bakteri pelarut fosfat (BPF) berkisar 0,35×107- 2,88×107cfu/g menunjukkan berbeda tidak nyata pada semua perlakuan. Unsur P (fosfor), pada perlakuan NR sama dengan perlakuan RT yaitu 10,27ppm berbeda nyata dengan perlakuan RG dan RL. Kadar air berkisar 9,25-9,84 % dengan hasil tertinggi terdapat pada perlakuan RG yang tidak nyata lebih tinggi dari perlakuan RT dan nyata lebih tinggi dari perlakuan NR dan RL. Berdasarkan hasil penelitian dapat disimpulkan bahwa populasi bakteri dan bakteri pelarut fosfat (BPF) pada non rhizosfir mengalami lebih rendah tidak berpengaruh pada RG, RL, dan RT di lahan kering pada musim hujan. Kandungan P (Fosfor) pada non rhizosfir sama dengan RT, lebih rendah pada RG dan RL. Kadar air pada non rhizosfir sama dengan RL tetapi lebih rendah dibandingkan dengan RG dan RT.
Kata kunci:bakteri pelarut fosfat, non rhizosfir, rhizosfir
EVALUATION OF PHOSPHATE SOLUBILIZING BACTERIA (PSB) POPULATION IN NON RHIZOSPHERE AND RHIZOSPHERE OF Gliricidia sepium, Leucaena leucochepala,AND Sesbania grandiflora PLANT ON DRY LAND IN THE RAINY SEASON
ABSTRACT
This experiment aims to determine the population of phosphate solubilizing bacteria (PSB) in non-rhizosphere and rhizosphere plants on dry land in the rainy season. The experiment was conducted for 3 months including sampling at three strata system farm of Faculty of Animal Husbandry at Bukit Jimbaran; analysis of soil at Laboratory of Animal Production Technology
and Microbiology Faculty of Animal Husbandry and at Soil Science Laboratory, Faculty of Agriculture, Udayana University. This experiment follows an additive linear model with the assumption that the difference only caused by the different types of plants while other factors are uniformly homogeneous. Sampling was done on four rhizosfere including; non-rhizosphere (NR), Gliricidia sepium rhizosphere (RG), Leucaena leucochepala rhizosphere (RL), and Sesbania grandiflora rhizosphere (RT) with four replications. The variables observed in this experiment including: Total PlateCount (TPC), Total phosphate solubilizing bacteria (PSB), P (phosphorus) element, and water content. The result showed that TPC soil in the range of 0,57×108-5,6×108cfu/g, showed no significant different to all treatment. Total phosphate solubilizing bacteria (PSB) in range of 0,35×107 - 2,88×107cfu/g showed no significant different to all treatments. P (phosphorus) elements, in tretment NR same withtreatment RT are range of 10,27ppm significant different with RG and RL. Water content ranged from 9,25 - 9,84 % With the result is highest in treatment RG was no significant higher than RT and markedly higher than the NR and RL. Based on the experiment it could be concluded that the population of phosphate solubilizing bacteria (PSB) in non-rhizosphere tend to is lower compared with RG, RL, and RT on dry land in the rainy season. The content of P (phosphorus) element in non-rhizosphere is same with RT but lower than RG and RL. Water content in non-rhizosphere same with RL but lower than RG and RT.
Keywords: phosphate solubilizing bacteria, non rhizosphere, rhizosphere
PENDAHULUAN
Hijauan pakan pada dasarnya untuk memenuhi kebutuhan ternak terhadap zat-zat gizi yang diperlukan untuk pertumbuhan, produksi, dan perkembang biakan ternak.Salah satu upaya untuk meningkatkan produksi ternak ruminansia adalah denganpemberian pakan yang bermutu, baik dari segi kualitas maupun segi kuantitas (Chen, 1990). Hal ini di sebabkan lahan yang disediakan untuk tanaman pakan ternak kurang produktif, karena itu tanaman pakan yang ditanam harus memiliki respon yang baik atau mampu tumbuh dilahan yang memiliki struktur tanah yang kurang produktif, sehingga mampu berproduksi dengan baik, seperti pengembangan tanaman jenis leguminosa (Stylosanthes, gamal, lamtoro, dan kaliandra) yang cocok untuk dikembangkan dilahan yang memiliki kesuburan yang rendah (Yunaningdyah, 2000). Produktivitas tanaman jenis leguminosa juga dipengaruhi oleh kemampuan mikroba yang ada di rhizosfir dalam menyediakan unsur hara mikro dan makro di dalam tanah.
Rhizosfir didefinisikan sebagian kecil volume tanah yang langsung dipengaruhi oleh pertumbuhan dan metabolisme akar tanaman. Tanaman dan mikroba berinteraksi dan saling menstimulasi yang disebabkan oleh eksudat akar (Schröder dan Hartmann, 2003), sedangkan eksudat akar mempengaruhi pertumbuhan dan aktivitas mikroorganisme di rhizosfir, rizoplan, dan sekitarnya (Schottendreier dan Falkengren-Greup, 1999). Pertumbuhan jenis tanaman yang
berbeda akan menyediakan unsur-unsur mikroba tanah yang berbeda, sehingga populasi mikroba rhizosfir akan berbeda dengan yang ditemukan di daerah dan di sekitarnya (Curl and Truelove, 1986; Lynchand Hobbie, 1988).
Hardjowigeno (2003) menyatakan bahwa, tanaman membutuhkan beberapa unsur hara untuk pertumbuhan dan perkembangan sel tanaman. Salah satu unsur nutrisi tersebut adalah unsur hara fosfor (P). Fosfor berfungsi untuk merangsang perkembangan akar muda, mempercepat proses pembuahan, mengontrol fotosintesis, respirasi, dan pembelahan sel. Hal ini juga didukung oleh pernyataan Hodges (2013) menyatakan bahwa, fungsi utama fosfor berkaitan dengan ketersediaan energi dalam pertumbuhan, sehingga kekurangan unsur fosfor dapat mempengaruhi pertumbuhan vegetatif suatu tanaman.
Glick (1995) melaporkan bahwa, fosfor tidak dapat digunakan secara langsung oleh tanaman akan tetapi memerlukan bantuan mikroorganisme yaitu bakteri pelarut fosfat. Bakteri pelarut fosfat merupakan bakteri tanah yang bersifat nonpatogenik dan termasuk dalam kategori bakteri pemacu pertumbuhan tanaman. Bakteri tersebut menghasilkan vitamin dan fitohormon yang dapat memperbaiki pertumbuhan akar tanaman dan meningkatkan serapan hara. Bakteri pelarut fosfat mampu mengubah fosfor tidak larut dengan cara mensekresikan asam organik seperti asam format, asetat, propionate, laktat, glikolat, fumarat, dan suksinat. Tanaman menyerap fosfor terlarut dalam bentuk ortofosfat primer (H2PO4) dan sebagian kecil dalam bentuk ortofosfat sekunder (HPO4) (Suliasih et al., 2010). Bakteri pelarut fosfat bukan merupakan satu-satunya kelompok bakteri yang dapat melarutkan fosfor yang teradsorpsi oleh permukaan oksida-oksida besi dan alumunium sebagai senyawa Fe-P dan Al-P (Hartono, 2000), akan tetapi ada beberapa kelompok Actinomycetes (Nitta et al., 2002) dan kelompok jamur (Aleksieva et al., 2003), dapat juga melarutkan Fe-P dan Al-P.
Berdasarkan potensi dari bakteri pelarut fosfat tersebut diatas maka perlu dilakukan penelitian tentang keberadaan populasi bakteri pelarut fosfat pada non rhizosfir dan rhizosfir tanaman gamal, lamtoro, dan turi di lahan kering pada musim hujan, karena pertumbuhan jenis tanaman yang berbeda akan menyediakan unsur-unsur mikroba tanah yang berbeda, sehingga populasi mikroba rhizosfir akan berbeda dengan yang ditemukan di daerah dan di sekitarnya.
MATERI DAN METODE
Tanah
Tanah yang digunakan berasal dari bagian non rhizosfir dan rhizosfir tanaman gamal (Gliricidia sepium), lamtoro(Leucaenaleucocephala), turi (Sesbania grandiflora).
Peralatan
Peralatan yang digunakan dalam pengambilan sampel tanah yaitu menggunakan bor tanah, sekop kecil, wadah sampel dan tremos. Kegiatan analisis Total Plate Count (TPC) dan analisis bakteri pelarut fosfat (BPF) menggunakan peralatan, seperti: cawan petri, botol media, tabung reaksi, timbangan analitik, kertas label, inkubator, rak tabung, erlenmeyer, beaker glass, kertas aluminium foil, kompor listrik, autoklaf, gelas kimia, lampu spiritus, pipet ukur 1 ml, pipet ukur 5 ml , pipet ukur 10 ml, batang pengaduk, gelas ukur, corong, vortex, sentrifuge,rotary shaker, penyaring Seitz dan vacum pump, oven, labu kimia dan tutupnya, desikator, dan saringan.Alat yang digunakan untuk menganalisis unsur P (Fosfor) antara lain: spektrofotometer, botol reaksi 30 ml, rak tabung reaksi, tabung reaksi 20 ml, labu ukur 1000 ml, labu ukur 500 ml, labu ukur 100 ml, labu ukur 50 ml, pipet volume 50 ml, pipet volume 20 ml, timbangan, shaker, kuvet 10 ml, desikator, kertas saring, botol aquadest, botol plastik bertutup.Kegiatan analisis kadar air tanah menggunakan peralatan seperti, cawan porselin dengan penutup, desikator, tang penjepit, oven pengering, timbangan analitik, kertas label.
Bahan kimia
Bahan kimia yang digunakan dalam penelitian ini sebagai berikut:Media Nutrient Agar (NA), Media Pikovskaya, Bacteriological Pepton Water 0,1%, larutan ekstrasi Bray-1 (0,025 M HCl dalam 0,03 M NH4F), aquadest.
Tempat dan waktu penelitian
Sampel (tanah) diambil di Farm STS/Tanaman Pakan Fakultas Peternakan Bukit Jimbaran, pada daerah non rhizosfir dan rhizosfir tanaman gamal, lamtoro, dan turi. Analisis Total Plate Count (TPC), populasi bakteri pelarut fosfat (BPF) dilaksanakan di Laboratorium Teknologi Hasil Ternak dan Mikrobiologi Fakultas Peternakan Universitas Udayana dan unsur P (Fosfor) serta kadar air dilakukan di Laboratorium Ilmu Tanah Fakultas Pertanian Universitas Udayana. Penelitian ini dilaksanakan dari bulan Februari sampai April 2017.
Rancangan penelitian
Penelitian ini diawali dengan metode survey lapangan di lahan Farm STS/Tanaman Pakan Fakultas Peternakan Bukit Jimbaran. Pengambilan sampel dilakukan mengikuti model linier aditif dengan asumsi bahwa perbedaan populasi bakteri pelarut fosfat (BPF) hanya disebabkan oleh perbedaan jenis tanaman sedangkan faktor lain seperti musim, lahan, dan tanah dikondisikan seragam (homogen). Pengambilan sampel dilakukan pada 4 rhizosfir yaitu; Non Rhizosfir (NR), Rhizosfir Gamal (RG), Rhizosfir Lamtoro (RL), dan Rhizosfir Turi (RT) dengan 4 ulangan. Adapun model matematisnya dapat dilihat dibawah ini
Model Matematis
-
Yij= µ+α¡+ ϵij
Keterangan
-
Yij= Total bakteri, µ= Rata – rata umum, α¡= Jenis leguminosa, ϵij= 1,2,3,4.
Persiapan penelitian
Persiapan alat
Alat-alat yang digunakan untuk analisis Total Plate Count (TPC) dan bakteri pelarut fosfat (BPF) dalam penelitian ini, yakni tabung erlenmeyer dan cawan petri, sebelum digunakan, terlebih dahulu disterilisasi di dalam oven dengan suhu 1600C selama 2 jam,selanjutnya tabung reaksi, botol media, pipet ukur disterilisasi dengan menggunakan autoklaf pada suhu 1210C selama ± 30 menit. Analisis unsur P (Fosfor) dalam penelitian ini menggunakan botol reaksi, tabung reaksi, pipet skala, gelas ukur, corong, sebelum digunakan, alat-alat tersebut dibersihkan dengan menggunakan alkohol 70%.Untuk analisis kadar air tanah digunakan cawan porselin yang sudahdiberi label dan selanjutnya ditimbang untuk mengetahui berat cawan kosong.
Persiapan bahan
Analisis Total Plate Count(TPC) menggunakan media NA,dengan cara menimbang media seberat 23 gram dan dilarutkan ke dalam 1 liter aquadest dalam tabung erlenmeyer yang sudah steril, kemudian media dipanaskan (tidak sampai mendidih), selanjutnya media disterilisasi dengan autoklaf pada suhu 1210C ± 15 menit.
Media yang digunakan untuk analisisBPF, yakni menggunakan media Pikovskaya, dibuat dengan cara menimbang 10 gram glukosa, 0,2 gram NaCl, 5 gram Ca3 (PO4)2, 0,5 gram (NH4)2 SO4, 0,2 gram KCl, 0.1 gram MgSO4 7H2O, 0,5 gramyeast extract dan dimasukkan ke dalam tabung erlenmeyer kemudian diisi dengan 1000 ml aquades dan dikocok hingga homogen,
kemudian dipanaskan (tidak sampai mendidih), sehingga semua bahan larut dan homogen, serta di autoklaf pada 1210C selama ± 15 menit.
Untuk analisis unsur P (Fosfor),digunakan larutan ekstrasi Bray -1 (0,025 M HCl dalam 0,03 MNH4F)dengan cara melarutkan11 gram reagen grade Amonium Florida (NH4F) ke dalam 9 liter aquadest, dan ditambahkan250 ml larutan standar 1 M HCl,selanjutnya ditambah aquadest sehingga volumemenjadi 10 liter.Larutan tersebut secara perlahan-lahan di tambahkan HCl 5 N sambil diaduk secaramerata sehingga diperolehpH 2,6.
Variabel yang diamati
Variabel yang diamati dalam penelitian ini adalah Total Plate Count (TPC), Total bakteri pelarut fosfat (BPF), Unsur P (Fosfor) dan kadar air.
Prosedur penelitian
Sampel diambil menggunakan metode purposive samplingpada area non rhizosfirdan rhizosfir tanaman gamal, lamtoro, dan turidengan cara, mengebor tanah dengan kedalaman 20 cm pada posisi bagian area kanopi tanaman dengan jarak ± 50 cm dari batang tanaman,sedangkan untuk non rhizosfir, dilakukan diluar area kanopi tanaman dengan cara yang sama. Pengeboran tanah dilakukan pada empat titik dari masing-masing non rhizosfir dan rhizosfir tanaman gamal, lamtoro, dan turi yang diulang empat kali (Gambar 1). Tanah yang sudah di bor dimasukkan ke dalam kantong plastik berlabel dan dimasukan kedalam termos untuk menjaga suhu tanah tetap, selanjutnya dibawa ke laboratorium untuk dianalisis (Saraswati et al., 2007).
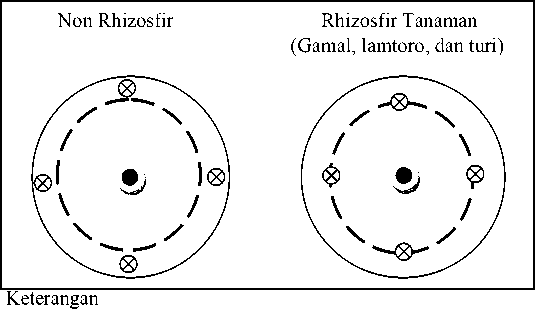
• ) Tanaman,- - - ), kanopi tanaman, 8) Titik pengambilan sampel
Gambar 1.Metode pengambilan tanah pada non rhizosfir dan rhizosfir Tanaman.
Analisis Total Plate Count (TPC)
Analisis TPC tanah untuk mengetahui pertumbuhan koloni bakteri secara keseluruhan, dilakukan dengan cara menimbang sebanyak 10 gr tanah, kemudian disuspensikan ke dalam 90 ml pepton dalam erlenmeyer dan di homogenkan dengan shakerpada kecepatan 150rpm selama 3 × 24 jam pada suhu kamar, diperoleh tingkat pengenceran 10-1. Dari tingkat pengenceran 10-1 diambil 1 ml dengan pipet dimasukkan kedalam tabung reaksi yang berisi 9 ml pepton sebagai tingkat pengenceran 10-2.Dari tingkat pengenceran 10-2 diambil 1 ml dengan pipet dimasukkan kedalam tabung reaksi yang berisi 9 ml pepton sebagai tingkat pengenceran 10-3.Demikian seterusnya sehingga diperoleh pengenceran 10-8.Dari tingkat pengenceran 10-1 sampai 10-8 dilakukan penanaman dengan cara metode tuang (Winarni, 1997).Masing-masing tingkat pengenceran diambil 1 ml dan dimasukan ke dalam cawan petri, kemudian dituangi dengan media NA sebanyak 20 ml, dan selanjutnya dihomogenkan dengan menggerakkan cawan sesuai angka 8. Setelah itu dibiarkan media memadat dan diinkubasi pada suhu 280C selama 2 × 24 jam dengan posisi cawan petri terbalik (Marista et al., 2013).
Analisis total bakteri pelarut fosfat (BPF)
Total bakteri pelarut fosfat (BPF) dianalisis untuk mengetahui pertumbuhan koloni BPF secara keseluruhan, dengan cara menimbang sebanyak 10 gr tanah, kemudian disuspensikan ke dalam 90 ml pepton dalam erlenmeyer dan di homogenkan dengan shakerpada kecepatan 150 rpm selama3 × 24 jam pada suhu kamar,diperoleh tingkat pengenceran 10-1.Dari tingkat pengenceran 10-1 diambil 1 ml dengan pipet dimasukkan kedalam tabung reaksi yang berisi 9 ml pepton sebagai tingkat pengenceran 10-2.Dari tingkat pengenceran 10-2 diambil 1 ml dengan pipet dimasukkan kedalam tabung reaksi yang berisi 9 ml pepton sebagai tingkat pengenceran 10-3.Demikian seterusnya sehingga diperoleh pengenceran 10-7.Dari tingkat pengenceran 10-1 sampai 10-7 dilakukan penanaman dengan cara metode tuang (Winarni, 1997), masing-masing tingkat pengenceran diambil 1 ml dan dimasukan ke dalam cawan petri, kemudian dituangi dengan media pikovskaya sebanyak20 ml, dan selanjutnya dihomogenkan dengan menggerakkan cawan sesuai angka 8.Setelah itu biarkan media memadat dan kemudian diinkubasikan selama 2 × 24 jam posisi cawan terbalik pada suhu 280C (Gaur, 1981).
Analisis unsur P (Fosfor)
Analisis unsur P (Fosfor) menggunakanmetode Bray-1 (Bray and Kurtz, 1945)dengan cara menimbang 2,5 gram tanah kemudian ditambah dengan pengekstrak Bray-1 sebanyak 25 ml, dan
dikocok menggunakan shaker selama30 menit (homogen), selanjutnya disaring. Apabila larutan masih keruh, disaring kembali seperti proses penyaringan semula (proses penyaringan maksimum5 menit). Dari hasil penyaringan, larutan dipipet 2 mlpada bagian jernihnya dan dimasukan ke dalam tabung reaksi dan deret standar. Dari masing-masing tabung reaksi dan deret standar ditambahkan dengan pereaksi pewarna fosfat sebanyak 10 ml,kemudian dikocok dan dibiarkan selama30 menit. Setelah itu diukur absorbansinya dengan spektrofotometer pada panjang gelombang 693 nm.
Analisis kadar air tanah
Analisis kadar air mengikuti metode Prijono dan Kusuma(2012) dengan cara menimbang berat cawan kosong (tanpa tanah) sehingga didapatkan berat cawan kosong dan diberi label, selanjutnya menimbang 2 gram tanah dan dimasukkan ke dalam cawan kemudian ditimbang cawan + tanah diperoleh berat basah cawan + tanah sebelum dioven, kemudian cawan + tanah dioven pada suhu 1100C selama 24 jam, setelah itu cawan + tanah dimasukkan ke dalam desikator sampai dingin, selanjutnya cawan + tanah ditimbang sehingga diperoleh berat kering cawan + tanah.
Rumus Kadar Air
^^(%) =
bb (tanah + cawan)– bk ( tanah + cawan) bb (tanah + cawan)
× 100%
Keterangan
KA = kadar air contoh tanah (%), bb = berat basah (g), bk = berat kering (g)
Analisis Data
Data yang diperoleh dianalisis dengan sidik ragam dan apabila perlakuan menunjukan perbedaan yang nyata (P<0,05) dilanjutkan dengan uji jarak berganda dari Duncan (Steel dan Torrie, 1995). Untuk data mikroba sebelum dianalisa ditransformasi terlebih dahulu ke dalam bentuk logx.
HASIL DAN PEMBAHASAN
TPC tanah
Hasil penelitian menunjukkan bahwa TPC tanah pada NR lebih rendah 82,46%, 89,82%, dan 83,71%tidak nyata (P>0,05) masing-masing dibandingkan RG, RL dan RT. RG lebih rendah 41,96% dan 7,14% tidak nyata (P>0,05) dibanding RL dan RT, akan tetapi RL lebih tinggi 37,5%
tidak nyata (P>0,05) dibanding dengan RT.Walaupun secara statistik pada semua perlakuan tidak nyata (P>0,05), namun jika dilihat dari data pada Tabel 1, diperoleh bahwa TPC tanah non rhizosfir cenderung terendah dari rhizosfir tanaman.
Hal ini disebabkan, pada non rhizosfir tidak terdapat naungan tanaman sehingga populasi bakteri yang terdapat di dalam tanah rendah, sedangkan pada rhizosfir gamal, lamtoro, dan turi mengeluarkan eksudat akar yang dapat dimanfaatkan oleh mikroba sebagai sumber makanan serta kelangsungan perkembang biakan mikroba yang berada di sekitar akar tanaman.
Tabel 1 Total Plate Count (TPC), total bakteri pelarut fosfat (BPF), unsur P (Fosfor), dan kadar air pada non rhizosfir dan rhizosfir tanaman gamal, lamtoro, dan turi di lahan kering pada musim hujan.
|
Variabel |
Perlakuan1) |
SEM2) | |||
|
NR |
RG |
RL |
RT | ||
|
TPC Tanah (cfu/g) |
5,70 ×107a |
3,25 × 108a |
5,60 × 108a |
3,50 × 108a |
0,23 |
|
Total Bakteri Pelarut Fosfat (BPF) (cfu/g) |
3,50 × 106a |
2,88 × 107a |
2,65 × 107a |
1,63 × 107a |
0,29 |
|
Unsur P (Fosfor) (ppm) |
10,27a3) |
4,14b |
2,40c |
10,27a |
0,13 |
|
Kadar Air (%) |
9,25b |
9,84a |
9,33b |
9,69a |
0,06 |
|
Keterangan:
| |||||
Nilai yang diikuti oleh huruf kecil superscript yang berbeda pada baris yang sama, berbeda nyata (P<0,05)
Pada rhizosfir gamal, lamtoro, dan turi memiliki populasi bakteri cenderung berbeda-beda, hal ini disebabkan oleh spesies tanaman dan tingkat pertumbuhan tanaman yang berbeda-beda, sehingga populasi bakteri pada rhizosfir gamal, lamtoro, dan turi diperoleh hasil yang bebeda. Hal ini didukung oleh Curl dan Truelove, (1986) yang menyatakan bahwa populasi bakteri akan berbeda pada lokasi yang berbeda. Komposisi akan berbeda pula pada jenis tanah yang berbeda, spesies tanaman yang berbeda, musim yang berbeda dan sangat dipengaruhi oleh kondisi iklim setempat. Pertumbuhan jenis tanaman yang berbeda akan menyediakan unsur-unsur mikroba tanah yang berbeda, sehingga populasi bakteri rhizosfir akan berbeda dengan yang ditemukan di daerah dan di sekitarnya. Populasi bakteri tertinggi diperoleh pada rhizosfir lamtoro, hal ini diduga disebabkan pada area rhizosfir lamtoro terdapat bahan organik yang mencukupi kebutuhan dari bakteri yang berada di dalam tanah sehingga merangsang pertumbuhan bakteri.Setiadi, (1989) hal ini disebabkan, di area rhizosfir terdapat bahan organik yang mencukupi dan merangsang pertumbuhan mikroba tanah pada permukaan akar sehingga jumlahnya akan mencapai 10-100 kali lebih banyak pada daerah rhizosfir dibandingkan dengan
daerah non rhizosfir. Secara fungsional bahan organik dan anorganik yang dilepas oleh tanaman ke dalam lingkungan, akan dimanfaatkan oleh mikroba tanah dan sebaliknya mikroba tanah berperan penting dalam mensintesis dan melepaskan kembali zat hara ke dalam bentuk bahan anorganik yang tersedia bagi tanaman.
Total bakteri pelarut fosfat (BPF)
Analisis statistik menunjukkan bahwa total BPF pada tanah NR lebih rendah 87,84%, 86,79%, dan 78,52% tidak nyata (P>0,05) dibandingkan dengan RG, RL, dan RT. RG lebih tinggi 7,98% dan 43,40% tidak nyata (P>0,05) dibanding RL dan RT, akan tetapi RL 38,49% lebih tinggi tidak nyata (P>0,05) dibandingkan dengan RT. Dilihat dari Tabel. 1 secara biologis, total BPF cenderung lebih rendah pada NR yaitu 0,35× 107, dan yang tertinggi dijumpai pada RG (2,88 × 107), kemudian diikuti RL (2,65 × 107) dan RT(1,63 × 107) cfu/g. Hal ini disebabkan, pada non rhizosfir tidak adanya penyebaran perakaran tanaman sehingga populasi bakteri cenderung sedikit. Sudarma (2011) yang menyatakan bahwa populasi mikroba dibagian rizosfer jauh lebih tinggi jika dibandingkan dengan bagian tanah yang lainnya, hal ini disebabkan perakaran tanaman mengeluarkan eksudat yang berguna bagi pertumbuhan mikroba.
Pada rhizosfir gamal, lamtoro, dan turi mengandung populasi BPF cenderung berbeda-beda, hal ini disebabkan oleh spesies dan tingkat pertumbuhan tanaman yang berbeda, sehingga populasi bakteri pada rhizosfir gamal, lamtoro, dan turi diperoleh hasil yang bebeda. Populasi tertinggi untuk BPF diperoleh pada rhizosfir gamal, hal ini disebabkan pada area rhizosfir gamal terdapat bahan organik yang mencukupi kebutuhan dari bakteri yang berada di dalam tanah sehingga merangsang pertumbuhan bakteri.Fosfor merupakan nutrient essensial yang diperlukan oleh tanaman dalam proses pertumbuhan dan perkembangannya. Fosfor sebenarnya terdapat dalam jumlah yang melimpah dalam tanah, namun sekitar 95-99% terdapat dalam bentuk fosfor tidak terlarut sehingga tidak dapat digunakan oleh tanaman (Vassileva et al., 1998). Menurut Purwantari (2008), bakteri pelarut fosfat berkembang baik pada tanah yang mengandung banyak bahan organik dan mineral tersedia sebagai karbon. Akar tanaman akan mengeluarkan senyawa metabolit (eksudat) ke dalam tanah, seperti senyawa-senyawa gula, asam amino, asam organik, glikosida, senyawa nukleotida, enzim, vitamin, dan senyawa indol yang dapat dimanfaatkan sebagai nutrisi untuk bakteri tanah sehingga dapat mempertahankan kelangsungan hidupnya. Widyati (2007) menyatakan bahwa, kemampuan isolat bakteri dalam melarutkan P (Fosfor) dan
menghasilkan asam-asam organik tergantung dari proses metabolisme isolat bakteri itu sendiri. Proses metabolisme bakteri dipengaruhi oleh aktivitas enzim. Hal ini mengindikasikan bahwa BPF belum optimal mensekresikan enzim sehingga asam-asam organik yang dapat meningkatkan ketersediaan P (Fosfor) menjadi kurang tersedia.
Unsur P (Fosfor)
Unsur P (Fosfor) pada penelitian ini diperoleh bahwapada perlakuan NR lebih tinggi 59,68% dan 76,63% nyata (P<0,05) dibandingkan dengan perlakuan RG dan RL, sedangkan terhadap perlakuan RT diperoleh hasil tidak nyata (P>0,05) (Tabel 1). Pada perlakuan RG,unsur P (Fosfor) lebih tinggi 59,68% nyata(P<0,05) dibandingkan dengan RL, sedangkan perlakuan RG lebih rendah 59,68% nyata (P<0,05) dibandingkan dengan RT (Tabel 1). RL lebih rendah76,63% nyata(P<0,05) dibandingkan dengan RT. Dilihat dari data pada Tabel 1, diperoleh bahwa unsur P (Fosfor) pada NR dan RT tertinggi, yaitu sekitar 10,27 ppm, kemudian diikuti RG sebesar 4,14 ppm dan RL 2,40 ppm. Hal ini disebabkan pada rhizosfir tanaman gamal dan lamtoro, terdapat sistem perakaran tanaman sehingga diduga terjadi proses penyerapan unsur P,pada RT diduga sedikit menyerap unsur P tanah dibandingkan dengan perlakuan RG dan RL, sehingga didapatkan kandungan unsur P paling tinggi. Pada NR lebih tinggi dibandingkan rhizosfir tanaman gamal dan lamtoro dikarenakan NR tidak terdapat akar tanaman, sehingga diduga bakteri pelarut fosfat pada NR yang mampu menambat P dan mengubah menjadi bentuk P tersedia, tidak terjadi proses penyerapan oleh akar tanaman, sedangkan pada rhizosfir tanaman (gamal dan lamtoro), diduga terjadi proses penyerapan P tersedia oleh akar tanaman.
Unsur P tersedia pada rhizosfir tanaman gamal, lamtoro dan turi diperoleh hasil yang berbeda. Pada RT diperoleh hasil unsur P yang tinggi (10,27ppm) di dalam tanah, disebabkan oleh minimnya proses penyerapan unsur P untuk pertumbuhan tanaman, karena diduga pada saat pengambilan sampel tanaman turi tidak ada proses pertumbuhan daun, cabang dan bunga, sedangkan pada RG dan RL diperoleh unsur P yang lebih rendah dari RT dikarenakan diduga penyerapan unsur P lebih tinggi oleh akar tanaman. Tingginya proses penyerapan ini untuk merangsang pertumbuhan vegetatif oleh tanaman, dapat terlihat adanya proses pertumbuhan daun muda. Hal ini didukung oleh Havlin et al. (2005) yang menyatakan bahwa, ketersediaan dan jumlah unsur P di dalam tanah menjadi perhatian utama dalam kaitannya dengan pertumbuhan dan produksi tanaman. Lebih lanjut dijelaskan bahwabentuk–bentuk P dalam tanah dikategorikan
menjadi: 1) P sebagai ion dan senyawa dalam larutan tanah, 2) P yang diserap pada permukaan komponen-komponen inorganik penyusun tanah, 3) mineral P yang kristalin maupun amorf, dan (4) P sebagai komponen bahan organik tanah. Hara P yang cukup berhubungan dengan meningkatnya pertumbuhan akar tanaman (Havlin et al., 1999). Selain itu bahan organik juga dapat memperbaiki struktur tanah (Hsieh, 1990; Chenu et al., 2000), sehingga perkembangan akar menjadi lebih baik dan penyerapan unsur hara lain untuk pertumbuhan tanaman.
Kadar air
Hasil kadar air pada perlakuan NR lebih rendah 5,99% dan 4,54% nyata (P<0,05) dibandingkan dengan perlakuan RGdan RT, sedangkan terhadap perlakuan RL diperoleh hasil tidak nyata (P>0,05) (Tabel 1). Kadar air pada RG 5,18% lebih tinggi nyata (P<0,05)dari RL, sedangkan terhadap perlakuan RT tidak nyata (P>0,05) 1,52%(Tabel 1). Perlakuan RL 3,71% lebih rendah nyata (P<0,05)dibandingkan dengan RT (Tabel 1). Dilihat dari data pada Tabel 1, diperoleh bahwa kadar air pada RG dan RTtertinggi, yaitu 9,84 dan 9,69% kemudian diikuti RL sebesar 9,33 dan NR 9,25%.Hal ini berarti kadar air dipengaruhi olehkadar bahan organik tanah mempunyai pori pori yang jauh lebih banyak dari pada partikel mineral tanah yang berarti luas permukaan penyerapan juga lebih banyak sehingga makin tinggi kadar bahan organik tanah makin tinggi kadar dan ketersediaan air tanah. Kedalaman Solum atau lapisan tanah menentukan volume simpan air tanah, semakin dalam maka ketersediaan kadar air juga akan semakin banyak. Iklim dan Tumbuhan mempunyai pengaruh yang penting bagi ketersediaan air yang dapat diabsorbsi dengan efisiensi oleh tumbuhan dalam tanah. Temperature dan perubahan udara merupakan perubahan iklim dan berpengaruh pada efisiensi penggunaan air tanah dan penentuan air yang dapat hilang melalui saluran evaporasi permukaan tanah (Indranada, 1994),
Hasil tertinggi diperoleh pada perlakuan RG, kadar air pada non rhizosfir paling rendah dibanding dengan rhizosfir tanaman (gamal, lamtoro dan turi) (Tabel 1). Hal ini diduga karena populasi mikroba kandungan bakteri (5,70 × 107) dan populasi BPF (3,50 × 106) pada NR rendah. Rendahnya populasi mikroba tanah dapat mempengaruhi kandungan bahan organik tanah, mempengaruhi kondisi tanah/agregat tanah, mengakibatkan kemampuan tanah untuk menyerap air rendah. Begitu pada sebaliknya pada rhizosfir tanaman (gamal, lamtoro dan turi) kadar air lebih tinggi, karena populasi bakteri dan populasi BPF lebih tinggi sehingga kemampuan menyerap air lebih tinggi. Hal ini sesuai dengan pendapat Hanafiah (2007) yang menyatakan bahwa, kadar air tanah dipengaruhi oleh kadar bahan organik tanah dan kedalaman solum, makin
tinggi kadar bahan organik tanah akan makin tinggi kadar air, serta makin dalam kedalaman solum tanah maka kadar air juga semakin tinggi. Tanah mampu menyediakan air yang cukup bagi tanaman, serta tanah mampu mengikat air dan meneruskan air yang diterima dipermukaan tanah, sehinggakadar air pada perlakuan rhizosfir tanaman diperoleh hasil paling tinggi. Pergerakan air maupun lajuperubahan kadar air dalam tanah sangatditentukan oleh karakteristik pori tanah yangmenyusun struktur tanah, seperti distribusi pori,kontinuitas pori, dan tortuositas pori (Hillel,1980). Hal ini didukung oleh Rahmat dan Soekarno (2006) yang menyatakan bahwa kadar air tanah berkaitan dengan penyediaan air bagi tanaman, jumlah air yang tersedia dan terkandung dalam tanah bergantung pada permeabilitas tanah atau kemampuan tanah dalam mengikat air dan meneruskan air yang diterima di permukaan tanah ke arah lateral maupun vertikal. Menurut Hardjowigeno (2003), kemampuan tanah dalam menahan air ini dipengaruhi oleh tekstur tanah, sedangkan jumlah air yang terkandung pada tanah dipengaruhi oleh curah hujan yang turun pada daerah tersebut.Disamping itu data ini diduga dipengaruhi juga oleh waktu pengambilan sampel dilakukan pada saat awal musim hujan.
SIMPULAN
Berdasarkan hasil penelitian dapat disimpulkan bahwa populasi bakteri dan bakteri pelarut fosfat (BPF) pada non rhizosfir cenderung lebih rendah dari rhizosfir gamal, lamtoro, dan turi di lahan kering pada musim hujan. Kandungan P (Fosfor) pada non rhizosfir sama dengan rhizosfir turi, lebih rendah pada rhizosfir gamal dan rhizosfir lamtoro. Kadar air pada non rhizosfir sama dengan rhizosfir lamtoro tetapi lebih rendah dibandingkan dengan rhizosfir gamal dan turi. Penelitian ini memberikan informasi bahwa tanah STS/Tanaman Pakan Fakultas Peternakan ditinjau dari populasi bakteri termasuk tanah subur.
UCAPAN TERIMAKASIH
Penulis mengucapkan terima kasih kepada Rektor Universitas Udayana Prof. Dr. dr. A. A. Raka Sudewi, Sp.S.(K) dan Dekan Fakultas Peternakan Universitas Udayana Dr. Ir. Ida Bagus Gaga Partama, MS yang telah memberikan kesempatan dan fasilitas yang diberikan. Ucapan yang sama juga disampaikan kepada Bapak/Ibu DosenFakultas Peternakan Universitas Udayana yang telah banyak memberikan saran dan masukan dalam penulisan jurnal.
DAFTAR PUSTAKA
Aleksieva, P. D., Spasova, and S. Radoevska. 2003. Acid phosphatase distribution and localization in the fungus humicola lutea. Z. Naturforsch. 58c:239-243.
Bray, R. H., and L. T. Kurtz. 1945. Determination of total, organic, and available forms of phosphorus in soils. Soil Sci. Vol 59:39–45.
Chen, C. P. 1990. Management of Forage For Animal Production Under Tree Crops. in: Proc. Integrated Tree Croping and Small Ruminant Production System. INIQUES L. C and M. D. SANCHEZ (Eds).SR-CRSP.Univ. California Davis, USA.Pp. 10 –23.
Chenu, C., Y. Le Bissonnais., and Arronays. 2000. Organic matter influence on clay wettability and soil aggregate stability. Soil Sci. Soc. Am. J. Vol 64:1479-1486.
Curl, E. A., and B. Truelove. 1986. The Rhizosphere, Springer-Verlag, Berlin Heidenberg.
Gaur, A. C. 1981.Phospho-microorganism and varians transformation. In: Compost Technology. Project field document. Vol 13:106-111.
Glick, B. R. 1995. The enhancement of plant growth by free living bacteria.Can. J. Microbiol. 41:109-117.
Hanafiah, K. A. 2007. Dasar-Dasar Ilmu Tanah, Jakarta, Rajawali Press.
Hardjowigeno, S. 2003. Ilmu Tanah. Akademika Pressindo. Jakarta.
Hartono, A. 2000.Pengaruh pupuk fosfor, bahan organik, dan kapur terhdap pertumbuhan jerapan P pada tanah masam latosol darmaga. J. Ilmiah pert. Gakuryoku VI(1):73-78.
Havlin, J. L., J. D. Beaton., and S. L. Nelson. 1999. Soil Fertility and Fertilizer. Sixth Ed. Prentice-Hall, Inc. New Jersey. Pp 499.
Havlin J. L., J. D. Beaton., S. L. Nelson., and W. L. Nelson. 2005. Soil Fertility and Fertilizers: An Introduction to Nutrient Management. New Jersey (US): Pearson PrenticeHall. Pp 528.
Hillel, D. 1980. Fundamentals of Soil Physics.Academic Press. New York.
Hodges, S. C. 2013. Soil Fertility Basics, Soil Science Extension North Carolina State University.
Hsieh, S. C., and C. F. Hsieh. 1990. The Use of Organic Matter In crop Production. Paper Presented at Seminar on “The Use of Organic Fertilizer in Crop Production” at Soweon, South Korea.
Indranada, H. 1994. Pengelolaan Kesuburan Tanah. Semarang : Bumi Aksara
Lynchand, J. M., and J. E. Hobbie. 1988. The Terrestrial Environment in: Lynch J. M., and J. E. Hobbie. (eds) Microorganisms in Action: Concepts and Application in Microbial Ecology. Blackwell Scientific Publications, Oxford, GB, Pp 103-131.
Marista, E., S. Khotimah., dan R. Linda. 2013. Bakteri pelarut fosfat hasil isolasi dari tiga jenis tanah rhizosfer tanaman pisah nipah (Musa paradisiacavar. Nipah) di Kota Singkawang. Probiont 2 (2): 93-101.
Nitta, M., M. Goro., N. Shibuya., and Y. Okawa. 2002. Protein with alkaline phosphatase and protease inhibitor activities in streptomyces hiroshimensis. Bull. Biol.Pharmacy. 25(7):833-836.
Prijono, S., dan Z. Kusuma. 2012. Instruksi Kerja Laboratorium Kimia Tanah. F. Pertanian, Brawijaya.
Purwantari, N. D. 2008. Penambat nitrogen secara biologis: Perspektif dan keterbatasannya. Wartazoa 18 (1): 9-17.
Rahmat, D., dan I. Soekarno. 2006. Formulasi efek sifat fisik tanah terhadap permeabilitas dan suction head tanah (Kajian Empirik Untuk Meningkatkan Laju Infiltrasi). Jurnal Bionatura, Vol. 8 (1): 60-80.
Saraswati, R., E. Husen., dan R. Simanungkalit. 2007. Metode Biologi Tanah. Balai Besar Litbang Sumber daya Lahan Pertanian, Bogor.
Schottendreier, M., and U. Falkengren-Greup. 1999. Plant induced alteration in the rhizosphere and the utilization of soil heterogenicity. Plant Soil 209: 297-309.
Schröder, P., and A. Hartmann. 2003. New developments in rhizosphere research. J Soils and Sediments 3 (4): 227.
Setiadi, Y. 1989. Pemanfaatan Mikroorganisme dalam Kehutanan. Bogor: Institut Pertanian Bogor.
Steel, C. J., dan J. H. Torrie. 1995. Prinsip dan Prosedur Statistik. PT Gramedia. Jakarta.
Sudarma, I. M. 2011. Keragaman Mikroba Tanah Pada Habitat Tanaman Pisang (Musa paradisiaca L.) Dengan dan Tanpa Gejala Layu Fusarium. Disertasi, Program Pascasarjana Universitas Udayana, Denpasar.
Suliasih, S., Widawati., dan A. Muharam. 2010. Aplikasi pupuk organik dan bakteri pelarut fosfat untuk meningkatkan pertumbuhan tanaman tomat dan aktivitas mikroba tanah. J. Hort. 20 (3):241-246.
Vassileva, M., N. Vassilev., and R. Azcon. 1998. Rock phosphate solubilization by Aspergillus niger on olive cake-based medium and its further application in a soil-plant system. World J Microbiol Biotechnol.14:281–284.
Widyati, E. 2007. Formulasi inokulum mikroba: MA, BPF dan rhizobium asal lahan bekas tambang batubara untuk bibit acacia crassicarpa cunn. Ex-Benth.JurnalBiodiversitas 8 (3) : 238 - 241.
Winarni, D. 1997. Diktat Teknik Fermentasi. Program Studi D3 Teknik Kimia FTI-ITS: Surabaya.
Yunaningdyah, Y. T. 2000. Kecernaan In Vitro Bahan Kering dan Bahan Organik Daun Gamal (Gliricidia sepium) yang Dipotong dengan Interval Berbeda pada Akhir Musim Kemarau. Skripsi Fakultas Peternakan, Universitas Udayana, Denpasar.
Widnyana et al, Peternakan Tropika Vol. 6 No. 1 Th. 2018: 22 – 36
Page 36
Discussion and feedback