EFEK YOGA TERHADAP KOMPONEN BIOMOLEKULAR PADA PROSES CELL AGING
on
Sport and Fitness Journal
Volume 8, No.2, Mei 2020: 15-31
E-ISSN: 2654-9182
EFEK YOGA TERHADAP KOMPONEN BIOMOLEKULAR PADA PROSES CELL AGING
Nila Wahyuni
Departemen Ilmu Faal Fakultas Kedokteran Universitas Udayana Jalan P.B.Sudirman, Denpasar, Bali, Indonesia
Kode pos/telp 80232/0361222510
Email:wahyuninila08@gmail.com
ABSTRAK
Pada dekade belakangan ini terjadi peningkatan yang signifikan pada prevalensi penyakit yang berhubungan dengan gaya hidup seperti depresi, diabetes mellitus, penyakit kardiovaskular, kanker, dan infertilitas. Penyakit ini sangat berhubungan dengan percepatan proses cell aging. Yoga dapat efektif dalam memperlambat proses cell aging dengan mengubah kadar berbagai biomarker yang berperan dalam proses cell aging Adapun metode penulisan yang digunakan adalah dengan studi literatur artikel mengenai efek yoga terhadap komponen biomolekuler dalam proses aging sel. Yoga dapat memperlambat proses seluler dan biological aging melalui penurunan produksi ROS, dan mempengaruhi stabilitas panjang telomer, mempengaruhi aksis hipotalamus-pituitari-adrenal (HPA aksis). Yoga efektif dalam mengubah kadar cardinal biomarker dan metabotrophic biomarker dalam darah terkait proses cell aging. Yoga juga efektif dalam menjaga kadar growth hormone dan dehydroepiandrosterone sulfate yang merupakan endocrine marker dari proses aging.
Kata kunci : yoga, cell aging, biomolekuler
ABSTRACT
In the past decade there has been a significant increase in the prevalence of lifestyle-related diseases such as depression, diabetes mellitus, cardiovascular disease, cancer, and infertility. This disease is closely related to the acceleration of the cell aging process. Yoga can be effective in slowing the cell aging process by changing the levels of various biomarkers that play a role in the cell aging process. The method used is literature study about the effects of yoga on biomolecular components in the cell aging process. Yoga can slow down cellular processes and biological aging through decreasing ROS production, and affecting the stability of telomere length, affecting the hypothalamus-pituitary-adrenal (HPA axis) axis. Yoga is effective in changing the levels of cardinal biomarkers and metabotropic biomarkers in the blood associated with cell aging. Yoga is also effective in maintaining levels of growth hormone and dehydroepiandrosterone sulfate which is an endocrine marker of the aging process.
Keywords: yoga, cell aging, biomolecular
PENDAHULUAN penyakit kardiovaskular, kanker, dan
infertilitas. Penyakit ini sangat berhubungan dengan percepatan proses cell aging1,2. Penyakit kardiovaskular merupakan salah satu penyakit yang terjadi akibat proses cell
Pada dekade belakangan ini terjadi peningkatan yang signifikan pada prevalensi penyakit yang berhubungan dengan gaya hidup seperti depresi, diabetes mellitus,
aging dan merupakan penyebab 37% dari kematian di Indonesia.
Diabetes mellitus juga merupakan penyakit terkait dengan gaya hidup yang didasari oleh proses cell aging dimana berdasarkan data WHO, diabetes mellitus di Indonesia adalah penyebab utama kematian ketiga dengan 6% kematian pada tahun 2012 yaitu 100.400 orang. Ada kecenderungan diabetes di Indonesia meningkat dengan bertambahnya usia dimana dan dari 1,1% pada populasi dengan usia 15-24 tahun menjadi 13,2% pada populasi dengan usia 65-74 tahun dan 75 tahun ke atas dan mencapai puncaknya pada populasi dengan usia 55-64 tahun3.
Harapan hidup rata-rata terus meningkat secara dramatis dan diperkirakan akan semakin meningkat. Memahami proses molekuler yang mendasari proses aging dan penurunan kesehatan dapat memberikan kontribusi dalam mencegah, menunda, mengurangi terjadinya penyakit yang berkaitan proses aging4.
Berbagai intervensi telah diteliti untuk mengetahui pengaruh intervensi tersebut terhadap pencegahan penyakit terkait gaya hidup yang terus meningkat5,6, namun tidak ada satu intervensi pun yang menjadi strategi pencegahan dan terapi yang efektif untuk pencegahan penyakit terkait gaya hidup. Oleh karena itu, diperlukan penelitian lebih lanjut untuk mendapatkan intervensi yang optimal untuk populasi yang berisiko terhadap penyakit terkait gaya hidup. Yoga adalah disiplin kesehatan integratif yang sedang berkembang, yang dapat meningkatkan kemampuan individu dan telah terbukti meningkatkan profil klinis pasien dengan berbagai kondisi patologis7. Berdasarkan penelitian oleh Tolahunase, M et al., pada tahun 2017 menunjukkan bahwa yoga dapat efektif dalam memperlambat proses cell aging dengan mengubah kadar berbagai biomarker yang berperan dalam proses cell aging8.
Berdasarkan latar belakang tersebut penulis tertarik untuk mengkaji lebih dalam mengenai efek yoga terhadap komponen biomolekuler pada proses cell aging.
Genetic pathway dan proses biomolekuler pada cell aging
Terdapat sembilan mekanisme yang mendasari proses cell aging adalah pemendekan telomer, instabilitas genom, perubahan epigenetik, hilangnya proteostasis, deregulasi nutrient sensing (IGF-1, mTOR, sirtuins, dan AMPK), disfungsi mitokondria, cellular senescence, stem cell exhaustion, perubahan komunikasi interseluler9. Telomer adalah struktur nukleoprotein yang terdapat di ujung kromosom eukariotik10. Telomer merupakan rantai DNA yang mengandung sequence AATGGG pada salah satu untai dan TTTACCC pada untai yang berlawanan. Sel-sel secara normal hanya dapat membelah sebanyak 50 sampai 70 kali, dimana telomer akan semakin memendek sebelum akhirnya sel mengalami penuaan dan mati. Panjang telomer merupakan biomarker dari proses aging.
Terdapat teori yang mampu menjelaskan mengenai proses aging sel yaitu hipotesis telomer. Teori ini menjelaskan seiring dengan pembelahan sel, sel tersebut akan kehilangan bagian telomernya sampai sel tersebut mengalami kematian11. Pemendekan telomer terjadi pada proses aging normal pada manusia dan mencit9. Hanya sel yang mampu mengaktifkan kembali telomerase yang dapat terus hidup. Sel yang tidak mampu mengaktifkan kembali telomerase akan mengalami penuaan dan akhirnya kematian11. Modifikasi genetik pada binatang telah menunjukkan hubungan antara pemendekan telomer, penuaan sel dan proses aging pada mikroorganisme. Hasil meta-analisis menunjukkan bahwa terdapat hubungan
yang kuat antara telomer yang pendek dengan mortality risk pada manusia12.
Faktor lain yang juga berperan dalam proses aging adalah instabilitas genom. Akumulasi kerusakan DNA di sepanjang kehidupan mendasari terjadinya proses aging13. Integritas dan stabilitas DNA selalu terancam oleh agen fisik, kimia dan biologis eksogen dan endogen seperti kesalahan replikasi DNA, reaksi hidrolitik spontan dan Reactive Oxygen Species (ROS)14. Instabilitas genom merupakan kecenderungan genom untuk mengalami perubahan informasi DNA melalui mutasi yang merupakan penanda dari aging. Beberapa hal yang menyebabkan terjadinya instabilitas genom adalah kerusakan DNA, perubahan kromosom, variasi struktur genom, dan mutasi substitusi basa. Kerusakan DNA merupakan perubahan fisik pada struktur asam nukleat, seperti depurinasi, depirimidinasi, crosslinks, modifikasi basa. Perubahan kromosom adalah abnormalitas kromosom yang terjadi akibat mutasi dimana terjadi perubahan pada jumlah kromosom atau perubahan struktur pada kromosom15.
Faktor yang juga berperan dalam proses aging adalah perubahan epigenetik. Berbagai perubahan epigenetik mempengaruhi semua sel dan jaringan di sepanjang hidup16. Perubahan epigenetik melibatkan perubahan pada pola metilasi DNA, modifikasi histone post-translasi, dan chromatin remodeling. Peningkatan asetilasi histone H4K16, trimetilasi H4K20, atau trimetilasi H3K4 dan juga penurunan metilasi H3K9 atau trimetilasi H3K2717,18. Mekanisme yang juga mendasari terjadinya proses aging adalah hilangnya proteostasis. Proses aging dan berbagai penyakit akibat proses aging berkaitan dengan gangguan homeostasis protein atau proteostasis19. Semua fungsi sistem dalam proteostasis memperbaiki polipeptida yang mengalami misfolded atau disingkirkan atau didegradasi secara sempurna untuk mencegah akumulasi
komponen yang telah rusak sehingga bisa dilakukan pembaharuan protein sel.
Beberapa studi menunjukkan terjadi perubahan pada proteostasis seiring dengan proses aging20. Ekspresi kronis dari protein yang mengalami unfolded, misfolded dan agregasi berperan dalam perkembangan berbagai penyakit terkait proses aging seperti Alzheimer’s diseases, Parkinson’s diseases dan katarak19. Deregulasi nutrient sensing juga merupakan penanda dari proses aging dimana sistem ini terdiri dari insulin dan IGF-1 signalling pathway (IIS). IGF-1 merupakan mediator sekunder yang dihasilkan sebagai respons terhadap GH. IIS pathway merupakan pathway yang mengatur proses aging dan beberapa targetnya yaitu faktor transkripsi FOXO (Forkhead Box Class O) family dan kompleks mTOR yang juga berperan dalam proses aging21,22,23. FOXO mengatur metabolisme, proliferasi sel, toleransi terhadap stres dan umur sel. Faktor transkripsi FOXO berperan dalam berbagai proses fisiologis dan patologis termasuk aging, kanker dan penyakit neurologis. FOXO juga berperan dalam bertambahnya umur dari suatu organisme dan memperlambat munculnya gejala penyakit terkait aging karena merupakan faktor yang berperan dalam mekanisme pengontrolan kualitas dan fungsi sel24. GH, IGF-1 menurun selama proses aging normal dan juga menyebabkan proses aging premature pada eksperimen pada tikus25.
Penurunan IIS pathway merupakan karakteristik yang umum terjadi pada proses aging fisiologis dan percepatan proses aging sedangkan penurunan IIS dapat memperpanjang usia. Hal tersebut menunjukkan penemuan yang kontroversial dimana penurunan modulasi IIS menggambarkan respons perlawanan untuk meminimalkan pertumbuhan dan metabolisme sel dalam konteks kerusakan sistemik26. Organisme dengan IIS yang lebih rendah dapat bertahan lebih lama karena memiliki kecepatan pertumbuhan dan
metabolisme yang lebih rendah sehingga kecepatan kerusakan sel lebih rendah27. Mutasi yang menyebabkan penurunan signaling pada aksis GH/IGF-1 berhubungan dengan peningkatan usia dan kesehatan suatu organisme. Penemuan berdasarkan studi kohort juga menunjukkan bahwa mutasi fungsional pada aksis somatotropik menyebabkan perlindungan terhadap penyakit terkait usia28. Sistem nutrientsensing lainnya yaitu mTOR yang berfungsi dalam sensing konsentrasi asam amino yang tinggi, AMPK yang berperan dalam sensing kondisi energi yang rendah dengan mendeteksi konsentrasi AMP yang tinggi, dan sirtuin yang berperan dalam sensing kondisi energi rendah dengan mendeteksi konsentrasi kadar NAD yang tinggi29.
Mechanistic target of rapamycin (mTOR) merupakan komponen kunci dalam metabolisme sel yang mengintegrasikan nutrient sensing dan proses dalam sel yang menyuplai energi untuk pertumbuhan dan proliferasi sel30. mTOR kinase adalah bagian dari kompleks protein mTORC1 dan mTORC2 yang mengatur semua aspek metabolisme anabolik31. Stimulus melalui IIS pathway maupun mTORC1 pathway merupakan faktor utama yang mempercepat proses aging32. Sirtuin adalah famili dari NAD+-dependent protein deacetylases yang berperan dalam berbagai fungsi sel melalui interaksi dengan, dan deasetilasi berbagai molekul signaling, faktor transkripsi, histone, dan enzim33. Family sirtuin terdiri dari 7 komponen yaitu SIRT 1 (Silent information regulator T1)sampai SIRT 7 (Silent information regulator T7) yang terletak di lokasi dalam sel yang berbeda-beda. SIRT6 dan SIRT7 terletak di nucleus, SIRT 3,4, dan 5 terletak di dalam mitokondria34, SIRT1 dan SIRT2 terletak di antara sitoplasma dan nucleus. Ekspresi dan transkripsi SIRT1 semakin menurun seiring dengan proses aging pada jaringan hewan maupun manusia seperti pada jaringan paru, jantung, lemak dan darah35. SIRT1
meningkatkan fungsi mitokondria, dan mengurangi produksi ROS melalui pengaturan kerja pengatur biogenesis mitokondria seperti PGC-1α, eNOS dan nitric-oxide dependent pathway36. SIRT1 pathway berperan dalam pengaturan cell senescence dan kolaborasi antara SIRT1 dan LKB1/AMPK (AMP-activated protein kinase) signaling merupakan 2 pathway yang berperan dalam pengaturan longevity dan stress resistance.
Sirtuins menjadi topik yang menarik karena perannya dalam pengaturan longevity dan memiliki potensi terapeutik untuk pencegahan atau pengobatan komplikasi medis terkait aging khususnya pada penyakit kardiovaskular, diabetes dan penyakit neurodegeneratif37. Proses biomolekuler yang juga mendasari proses aging adalah disfungsi mitokondria. Seiring dengan bertambahnya usia sel dan organisme, efektivitas rantai respirasi semakin menurun sehingga terjadi peningkatan pelepasan elektron dan penurunan produksi ATP38.
Terdapat 2 hal yang mendasari disfungsi mitokondria terkait dengan proses aging yaitu produksi reactive oxygen species (ROS) dan biogenesis dan integritas mitokondria. Teori radikal bebas mitokondria pada proses aging menunjukkan bahwa disfungsi mitokondria yang terjadi seiring dengan proses aging menyebabkan peningkatan produksi ROS yang menyebabkan kerusakan mitokondria dan kerusakan secara global39. Manipulasi genetik pada tikus yang dapat meningkatkan produksi ROS mitokondria dan kerusakan oksidatif tidak mempercepat proses aging40, percobaan pada tikus dengan peningkatan antioksidan tidak memperpanjang usia41. Efek merusak dari ROS menyebabkan akumulasi signaling intraseluler sehingga ROS berperan dalam menstimulasi proliferasi dan mekanisme “survival” sel sebagai respons terhadap sinyal fisiologi dan kondisi stres42. Disfungsi mitokondria terkait integritas mitokondria dikaitkan dengan
genomic instability yaitu terjadinya defisiensi DNA polymerase. Defisiensi mitokondria mempengaruhi signaling apoptosis43, menstimulasi reaksi inflamasi44 dan mempengaruhi signaling seluler45.
Berkurangnya biogenesis mitokondria sebagai akibat pemendekan telomer pada percobaan pada tikus yang mengalami defisiensi telomerase dimediasi oleh penurunan PGC-1α dan PGC-1β46. Selular senescence juga merupakan salah satu proses biomolekuler yang mendasari proses aging. Selular senescence dapat didefinisikan sebagai suatu kondisi dimana sel berada dalam keadaan “diam” yang stabil dan disertai dengan terjadinya perubahan fenotipe pada sel tersebut47. Seluler senescence disebabkan oleh pemendekan telomer dan terdapat stimulus lain terkait aging yang menyebabkan terjadinya seluler senescence yaitu kerusakan DNA non telomer dan derepression dari lokus INK4/ARF yang terjadi secara progresif pada proses aging kronologis yang juga dapat menginduksi terjadinya selular senescence48.
Berkurangnya kemampuan jaringan untuk melakukan regenerasi adalah salah satu karakteristik utama dari proses aging. Studi pada tikus menunjukkan bahwa terjadi penurunan aktivitas siklus stem sel hematopoietik dimana stem sel yang lebih tua menunjukkan pembelahan sel yang lebih sedikit daripada stem sel yang lebih muda49. Hal tersebut dikaitkan dengan akumulasi kerusakan DNA dan over ekspresi cell-cycle inhibitory proteins seperti p16INK4a.50
Perubahan komunikasi interseluler juga mendasari terjadinya proses aging menyebabkan perubahan pada sel tetapi juga terlibat dalam perubahan komunikasi interseluler yaitu endokrin neuroendokrin atau neuronal51. Neurohormonal signaling seperti renin-angiotensin, adrenergik, insulin-IGF-1 mengalami deregulasi yang menyebabkan peningkatan reaksi inflamasi, penurunan immunosurveilance sel terhadap
patogen dan sel pre malignant serta perubahan lingkungan peri dan ekstra seluler39. Selain inflamasi, perubahan yang terjadi pada satu jaringan akibat proses aging dapat menyebabkan terjadinya proses aging pada jaringan lain melalui koordinasi inter-organ52.
Yoga dapat memperlambat proses seluler dan biological aging melalui penurunan produksi ROS, dan mempengaruhi stabilitas panjang telomer
Proses aging berkaitan dengan pemendekan telomer yang disebabkan oleh berbagai sebab salah satunya adalah stres oksidatif. Telomer DNA merupakan target primer dari kerusakan oksidatif. Percepatan telomere loss berpotensi untuk dicegah atau diperlambat dengan antioksidan53. Pemendekan telomer dihambat oleh aktivitas enzim telomerase54. Telomerase menambahkan sekuens telomer secara berulang pada ujung DNA kromosom, tidak hanya menjaga panjang telomer tetapi juga menjaga fungsi sel dan fungsi imun jangka panjang55. Pemendekan panjang telomer dan berkurangnya aktivitas telomerase dikaitkan dengan premature mortality56.
Terapi alternatif dan komplementer dalam dunia medis semakin sering diterapkan sebagai tambahan terapi medis dan kemungkinan dapat memperlambat proses aging. Berdasarkan hasil studi oleh Kumar, S.B et al tahun 2014 menunjukkan bahwa efek yoga dalam memperlambat proses aging disebabkan karena yoga dapat menurunkan stres oksidatif , termasuk kerusakan oksidatif pada DNA57. Sejalan dengan penelitian oleh Kumar, S.B., et al tahun 2015 menunjukkan bahwa yoga efektif dalam meningkatkan aktivitas telomerase dan kadar β endorfin serta dapat menurunkan beberapa marker stres oksidatif seperti ROS, kortisol plasma, dan 8-hydroxy-2’-deoxyguanosine (8-OH2dG)58.
Beberapa studi fokus pada stabilitas telomer yaitu keseimbangan antara berbagai pathway yang mengontrol panjang telomere59. Pada kondisi fisiologis, telomer yang tidak stabil dihubungkan dengan penyakit terkait aging dan paparan terhadap stres seperti diabetes mellitus, obesitas, heart diseases, PPOK, asma, kanker, penyakit psikiatri seperti depresi, ansietas, post-traumatic stress disorder, penyakit bipolar dan schizophrenia60,61,62,63,64,65.
Asana dan pranayama adalah pernapasan diafragma yang berupa nafas dalam melalui paru-paru dengan lebih melenturkan diafragma daripada rongga dada66. Metode dasar respirasi yang digunakan dalam yoga adalah pernafasan yang perlahan, halus dan lebih dominan menggunakan diafragma daripada otot pernafasan66. Berdasarkan literatur, latihan pernafasan diafragma dapat mengurangi produksi ROS atau meningkatkan stimulasi kerja enzim untuk mempercepat pemecahan ROS atau melalui kedua mekanisme tersebut. Penelitian pada yeast, peningkatan konsumsi oksigen menyebabkan penurunan produksi ROS67.
Asana merupakan pernafasan diafragma yang dapat meningkatkan pertukaran gas alveolar, distribusi ventilasi dan memperbaiki konsumsi oksigen sub-maksimal dan maksimal68. Pranayama dapat mengubah respons mental dan persepsi terhadap stimulus eksternal dan internal, memperlambat reaktivitas dan mengurangi produksi ROS. Anion superoxide O2 adalah ROS utama yang dihasilkan di dalam sel, kemudian enzim superoxide dismutase (SOD) mengubah anion superoxide menjadi hidrogen peroksida dan kemudian dieliminasi oleh enzim glutation peroksidase atau katalase. Latihan pernafasan pada yoga dapat meningkatkan kadar SOD dan menurunkan produksi radikal bebas69. Sejalan dengan hal tersebut, penelitian oleh Martarelli, D., et al menemukan bahwa
latihan pernafasan diafragma dapat meningkatkan kadar antioksidan66.
ROS dihasilkan melalui berbagai reaksi enzimatik dan atau aut0-oksidasi beberapa komponen seperti katekolamin dan hidrokuinon. Stimulus eksogen seperti radiasi ionisasi, sinar ultraviolet, asap rokok, toksin, infeksi patogen dan paparan terhadap pestisida juga merupakan sumber produksi ROS in vivo70. Lipid adalah target primer oksidasi oleh ROS. Di antara berbagai produk primer dari peroksidasi lipis, Malondialdehid (MDA) adalah biomarker peroksidasi lipid omega -3 dan omega-6 yang paling sering digunakan71. Studi menunjukkan bahwa terdapat korelasi negatif antara panjang telomer dengan kadar MDA pada kelompok yoga.
Berdasarkan studi oleh Ingole, et al tahun 2015, vipassana yang merupakan salah satu bentuk meditasi menunjukkan bahwa terjadi penurunan kadar MDA yang signifikan pada responden72. Berdasarkan penelitian oleh Khrisna, B.H., et al tahun 2015 dimana leucocyte telomer length lebih pendek pada kelompok kontrol dibandingkan dengan kelompok yoga, total antioksidan lebih tinggi pada kelompok yoga dibandingkan kelompok kontrol. Kadar MDA dan homosistein lebih tinggi pada kelompok kontrol dibandingkan dengan kelompok yoga. Penelitian ini juga menyimpulkan bahwa terdapat hubungan positif yang signifikan antara leucocyte telomer length dengan total antioksidan, dan terdapat hubungan negatif yang signifikan antara leucocyte telomer length dengan kadar MDA dan homosistein73.
Asana dalam yoga melibatkan peregangan otot yang perlahan, postur yang nyaman dan mudah dilakukan, sehingga beberapa otot dan sendi teregang secara halus tanpa adanya tahanan. Peregangan statis pada otot dan ligamen dapat menstimulasi sirkulasi jaringan dan organ sekitar. Hal tersebut juga mempermudah pembuangan produk sisa metabolisme yang
dihasilkan oleh tubuh74. Asana dapat mengurangi stres oksidatif dan mencegah penumpukan metabolit di dalam tubuh sehingga dapat mengurangi kerusakan molekuler di dalam sel75.
Yoga mempengaruhi aksis hipotalamus-pituitari-adrenal (HPA aksis)
Stres kronis dapat menyebabkan peningkatan hormon kortisol dan insulin serta penekanan produksi hormon-hormon anabolik. Stres metabolik ini menyebabkan abdominal adiposity. Respons stres dan akumulasi lemak visceral inflamasi sistemik dan stres oksidatif sehingga lingkungan biokimia menjadi kondusif untuk terjadinya berbagai mekanisme cell aging yaitu pemendekan telomer, aktivitas telomerase dan cel senescence77.
Efek sistemik dan seluler karena stres kronis terkait cell aging dapat dilihat pada gambar 1 di bawah ini.
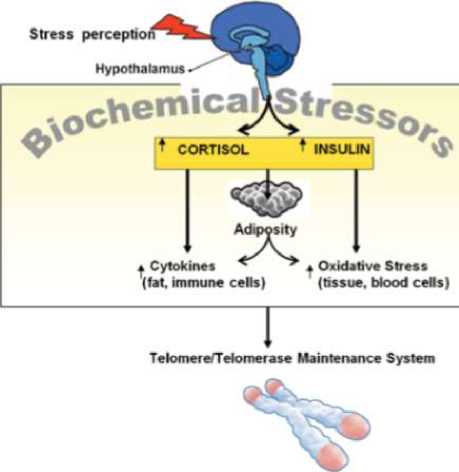
Gambar 1. Efek sistemik dan seluler karena stres kronis77
Yoga exercise membantu dalam manajemen stres dan penyakit akibat stres melalui downregulation respons hyphotalamic-pituitary-adrenal (HPA)
terhadap stres dan melalui pengaturan sistem saraf simpatis76. Yoga dapat menghambat aktivitas nuclei paraventrikular hipotalamus sehingga mempengaruhi hipofisis anterior untuk menguangi produksi ACTH. Penurunan produksi ACTH menurunkan sintesis kortisol di kelenjar adrenal78. Berdasarkan penelitian oleh Thirtalli, J et al tahun 2013 menemukan bahwa terjadi penurunan kadar kortisol pada pasien depresi setelah diberi intervensi yoga, dimana kelompok yang diberi intervensi obat anti depresan dan dikombinasi dengan pelatihan yoga menunjukkan perbedaan yang signifikan dalam penurunan kadar hormon kortisol dibandingkan dengan kelompok yang hanya diberikan intervensi berupa anti depresan79. Penurunan tingkat stres dikaitkan dengan penurunan kadar hormon kortisol. Efek yoga dalam menurunkan hormon kortisol disebabkan oleh karena yoga dapat mengurangi stres. Penelitian menunjukkan terdapat peran hormon kortisol dan stres terhadap BDNF otak80. Penurunan kadar hormon kortisol dapat memfasilitasi neurotropisme.
Peningkatan BDNF berkaitan dengan penurunan hormon kortisol. Peningkatan kadar BDNF terkait dengan obat anti depresan telah diinterpretasikan sebagai mekanisme neuroplastik untuk mengurangi gejala depresi. Telah diketahui bahwa efek “de-stressing” dari beberapa intervensi termasuk yoga dapat mengurangi kadar hormon kortisol. Efek kortisol pada reseptor steroid pada beberapa area di otak (hippocampus) menyebabkan gejala depresi, dan mekanisme tersebut bisa digagalkan oleh pelatihan yoga. Penemuan ini dihubungkan dengan kerja anti depresan tingkat molekul yaitu blokade pada reseptor steroid/kortisol79.
Mekanisme lain yang mendasari yoga dapat mengurangi kadar hormon kortisol adalah melalui peningkatan parasympathetic tone. Peningkatan aktivitas parasimpatis dapat mengurangi stimulus pada nucleus
paragigantoceluler dari medulla ke locus ceruleus. Penurunan stimulus ke locus ceruleus dapat menurunkan pelepasan norepinefrin menyebabkan relaksasi, ketenangan, dan menurunkan laju respirasi dan heart rate. Penurunan norepinefrin ke nucleus paraventrikular hipotalamus dapat menjelaskan terjadinya penurunan corticothropin-releasing hormone dan kortisol81.
Peningkatan stimulus parasimpatis menyebabkan penurunan tekanan darah dapat merelaksasikan baroreseptor arteri sehingga menyebabkan penurunan inhibisi γ-aminobutyric acid-ergic pada nucleus supraoptic hipotalamus kemudian menyebabkan pelepasan arginine vasopressin (AVP). AVP diketahui memiliki pengaruh yang positif82. Yoga dapat menyebabkan aktivasi korteks area pre frontal dan meningkatkan transmisi glutamat pada nucleus arcuatus dari hipotalamus medial yang menyebabkan pelepasan beta-endorfin83, kemudian menyebabkan anxiolysis84 sehingga menyebabkan penurunan kadar hormon79 kortisol.
Yoga efektif dalam mengubah kadar cardinal biomarker dan metabotrophic biomarker dalam darah terkait proses cell aging
Biomarker utama dalam seluler aging adalah kerusakan DNA, pemendekan telomer dan stres oksidatif85. Kerusakan DNA menyebabkan instabilitas genom sehingga terjadi disfungsi sel dalam patogenesis penyakit-penyakit terkait gaya hidup86. Beberapa biomarker utama dalam darah yang berperan dalam proses cell aging antara lain biomarker kerusakan DNA yaitu 8-hydroxy-2’-deoxyguanosine (8OH2dG), biomarker stres oksidatif yaitu Reactive Oxygen Species (ROS), dan Total Antioxidant Capacity (TAC), dan biomarker metabotrophic dalam darah yang
berhubungan dengan seluler aging yaitu kortisol, β-endorfin, BDNF dan sirtuin-1.
Berdasarkan penelitian oleh
Tolahunase, M., et al tahun 2017, bahwa terjadi perbaikan kadar biomarker cardinal dan metabotrophic terkait seluler aging dibandingkan dengan baseline value. Kadar 8-OH2dG, ROS, kortisol, dan IL-6 lebih rendah secara signifikan dan kadar TAC, aktivitas telomerase, β-endorfin, BDNF dan sirtuin-1 meningkat secara signifikan setelah yoga dan meditasi selama 12 minggu, sehingga dapat disimpulkan yoga dan meditasi dapat memperlambat proses seluler aging pada populasi sehat8. Perbaikan
respons stres dan inflamasi dimediasi oleh perubahan kadar kortisol, β-endorfin, Il-6, dan faktor-faktor lainnya melalui perubahan pada aksis hyphotalamus pituitary adrenal (HPA). Respons tersebut melibatkan pengaturan jalur adaptasi yaitu integrated stress response (ISR)87, yang mengaktivasi eukaryotic translation initiation factor 2 alpha (eIF2a) yang meningkatkan cellular recovery sehingga meningkatkan sinyal untuk cell survival dan longevity sel88. Fosforilasi eIF2α menyebabkan
berkurangnya sintesis protein secara global sehingga memungkinkan translasi gen-gen tertentu salah satunya adalah activating transcription factor (ATF4) yang berperan 89 dalam cell survival dan recovery89
Respons terhadap yoga dan meditasi juga kemungkinan mengarah pada stres oksidatif dan mekanisme yang berlawanan terhadap senescence-associated secretory phenotype termasuk sel di otak, sel lemak, endotel dan gonad. Perubahan secretory phenotype yang terjadi yaitu penurunan kadar IL-688, peningkatan BDNF, dan sirtuin-190. Faktor-faktor pengatur ini berperan dalam keseimbangan stres oksidatif dan cellular longevity dan berkontribusi dalam revival jaringan dalam tubuh dari neuroplastisitas dalam sistem saraf pusat terhadap gonad, pembuluh darah dan otot. Secretory phenotype dari sel somatik memberikan
umpan balik ke otak91, yang melengkapi siklus pengaturan antara pikiran dan tubuh. Peningkatan BDNF, sirtuin-1 dan β-endorfin dan penurunan kadar kortisol menurunkan seluler aging di otak, menurunkan neurodegenerasi dan meningkatkan neuroplastisitas92.
Peningkatan cellular longevity dan neuroplastisitas kemungkinan merupakan mekanisme perubahan pada volume substansia grisea pada beberapa area yang berbeda di korteks cerebri93, peningkatan perhatian94, dan proses kompleks lainnya melibatkan pengurangan stres dan depresi setelah yoga dan meditasi8.
Yoga dapat memperbaiki cardiac vagal tone, aktivasi sistem saraf parasimpatis dan mengurangi aktivasi HPA aksis yang mengalami hiperaktivasi selama kondisi stres. Hal tersebut menyebabkan terjadinya modulasi sistem imun dan homeostasis memperbaiki parameter terkait metabolisme dan psikologis sehingga mengurangi persepsi terhadap stres96,97. Yoga dapat meningkatkan konsentrasi, ketenangan, perhatian, kesadaran, dan memperbaiki suasana hati98. Yoga dapat meningkatkan gelombang alpha dan theta di otak99. Berdasarkan penelitian oleh Ganpat,T.S., et al bahwa yoga efektif dalam meningkatkan gelombang alpha dan delta di otak yang dikaitkan dengan peningkatan mental performance100. Penurunan IL-6 dan peningkatan BDNF mengaktivasi TOR (Target of Rapamycin) dan kemudian memediasi mekanisme neuroprotektif dan plastisitas sinaptik101. Sirtuin-1 (histone deacetylase) terletak di dalam inti sel yang berperan dalam nutritional and energy sensing pathway. Sirtuin-1 membentuk suatu mekanisme feedback auto-regulasi dan mengatur kadar ROS dan kemudian meningkatkan celluler longevity102.
Yoga efektif dalam menjaga kadar growth hormone dan
dehydroepiandrosterone sulfate yang merupakan endocrine marker dari proses aging
Growth hormone disekresikan dari hipofisis anterior dan memiliki peran dalam pertumbuhan semua jenis sel, metabolisme, dan perubahan komposisi tubuh103.
Dehydroepiandrosteronesulfate(DHEAS) disekresikan oleh korteks adrenal yang berperan sebagai neurosteroid,
kardioprotektif, anti diabetes, dan anti obesitas104. Kadar GH dan DHEA basal menurun seiring dengan bertambahnya usia dan kedua hormon ini disebut sebagai hormon anti aging. Terapi replacement non farmakologi seperti yoga kemungkinan dapat memperlambat proses aging105. Penurunan kadar GH dan DHEA lebih lambat pada individu yang aktif dibandingkan dengan yang tidak aktif106. Berdasarkan penelitian oleh Chatterje, S., et al tahun 2014 bahwa yoga exercise selama 12 minggu dapat meningkatkan kadar GH dan DHEA secara signifikan dibandingkan dengan data baseline. Dapat disimpulkan bahwa yoga exercise bermanfaat untuk menjaga kadar basal dari hormon GH dan DHEA pada manusia sehingga dapat tercapai healthy aging.
Yoga merupakan bentuk pelatihan yang memadukan antara tubuh dan pikiran. Kriya, Suryanamaskara, dan Asana (tingkat fisik), Pranayama (tingkat psikofisiologi), dan meditasi (tingkat psikoneurologi) mengintegrasikan dan mengharmonisasikan antara pikiran dan penyesuaian dalam individu dan dapat secara positif menstimulasi pola sekresi GH dan DHEAS pada individu usia pertengahan107. Kriya atau proses pembersihan (Kapalbhati, Agnisara, Uddiyan Jalaneti, Sutraneti, dan Vamandhauti) memberikan efek
pengendalian sistem saraf otonom108. Hal tersebut menyebabkan adanya umpan balik
positif ke HPA aksis sehingga mempengaruhi produksi GH basal. Kapalbhati, Agnisara, dan Uddiyan melibatkan pergerakan di area abdomen dan memberikan efek masase pada abdomen. Hal tersebut memberikan efek positif pada fungsi kelenjar adrenal sehingga dapat meningkatkan produksi DHEA107.
Dua jenis hormon yang berespons terhadap stres adalah kortisol dan DHEA. Molekul signaling untuk sekresi kedua hormon tersebut dilepaskan melalui HPA aksis108. Kadar DHEA dan rasio kortisol dengan DHEA akan meningkat pada kondisi stress109.
Yoga exercise membantu dalam manajemen stres dan penyakit akibat stres melalui downregulation respons hyphotalamic-pituitary-adrenal (HPA) terhadap stres dan melalui pengaturan sistem saraf simpatis76. Yoga dapat menghambat aktivitas nuclei paraventrikular hipotalamus sehingga mempengaruhi hipofisis anterior untuk menguangi produksi ACTH. Penurunan produksi ACTH menurunkan sintesis kortisol di kelenjar adrenal78. Perubahan kadar DHEA tergantung pada kadar kortisol dimana hubungan tersebut telah diuji pada penelitian oleh Boudarene, M., et al. Kortisol dan DHEA memiliki mekanisme kerja yang berlawanan, sehingga DHEA disebut merupakan antagonis dari kortisol. Sifat antagonis antara kedua hormon ini dikaitkan dengan kompetisi keduanya dalam sintesis dan sekresi oleh kelenjar yang sama yaitu kelenjar adrenal. Tingkat kecemasan yang tinggi akan meningkatkan kadar hormon kortisol sedangkan tingkat kecemasan yang rendah akan meningkatkan kadar DHEA110.
RINGKASAN
Yoga dapat efektif dalam memperlambat proses cell aging dengan mengubah kadar berbagai biomarker yang berperan dalam proses cell aging. Yoga dapat
memperlambat proses seluler dan biological aging melalui penurunan produksi ROS, dan mempengaruhi stabilitas panjang telomer, mempengaruhi aksis hypothalamus-pituitari-adrenal (HPA aksis). Yoga efektif dalam mengubah kadar cardinal biomarker dan metabotrophic biomarker dalam darah terkait proses cell aging. Yoga juga efektif dalam menjaga kadar growth hormone dan dehydroepiandrosterone sulfate yang merupakan endocrine marker dari proses aging.
DAFTAR PUSTAKA
-
1. Jackson, A.S., Sui, X., H´ebert, J.R., Church, T.S., Blair, S.SN. 2009. “Role of lifestyle and aging on the longitudinal change in cardiorespiratory fitness. Archives of Internal
Medicine,vol.169(19), pp.1781–1787.
-
2. Boccardi, V., Paolisso, G., and Mecocci, P. 2016. Nutrition and lifestyle in healthy aging:thetelomerase challenge. Aging,vol.8(1) pp.12–15
-
3. World Health Organization (WHO). Indonesia: WHO statistical profile.
2015. Available from:
http://who.int/gho/mortality_burden_dis ease/en/.
-
4. J. R. Aunan1,2, M. M. Watson1,2, H. R. Hagland1,3 and K. Søreide1,2,4. 2016. Molecular and biological hallmarks of ageing. BJS; 103: e29–e46
-
5. B.K.Kennedy,S. L.Berger,A.Brunetetal., “Aging : a common driver of chronic diseases and a target for novel interventions,”
Cell,vol.159,no.4,pp.709–713,2014.
-
6. V.D.Longo,A.Antebi,A.Bartkeetal.,“Int erventions to slow aging in humans: are we ready?” Aging Cell, vol. 14, no. 4, pp. 497–510,2015
-
7. A. B¨ussing, A. Michalsen, S. B. S. Khalsa, S. Telles, and K. J. Sherman.
2012. “Effects of yoga on mental and physical health: a short summary of reviews,”Evidence-Based
Complementary and Alternative Medicine,vol.2012,Article ID 165410,7 pages,2012.
-
8. Tolahunase, M., Sagar, R., Dada, R.. 2017. Impact of Yoga and Meditation on Cellular Aging in Apparently Healthy Individuals: A Prospective, Open-Label Single-Arm Exploratory Study. Oxidative Medicine and Cellular Longevity.
https://doi.org/10.1155/2017/7928981
-
9. Lopez-Otin, C., Blasco, M.A., Patridge, L., Serrano, M., Kroemer, G. 2013. The Hallmark of Aging. Cell, Vol. 153. pp. 1194-1217.
-
10. Bekaert, S., Meyer, T.D., and
Oostveldt, P.V. 2005. Telomer Attrition as Ageing Biomarker. Anticamcer
research 25: 3011-3022.
-
11. Asirvatham, S., Yadav, R., Chaube.,H. 2015. Role of telomeres and telomerase in aging. World Journal of Pharmaceutical Research. Volume 4, Issue 5, 697-708.
-
12. Boonekamp, J.J., Simons, M.J., Hemerik, L., Verhulst, S. 2013. Telomer length behaves as biomarker of somatic redundancy rather than biological age. Aging Cell Vol 12, pp. 330-332.
-
13. Moskalev, A.A., Shaphosnikov, M.V., Plyusnina, E.N., Zhavoronkov, A, Budovsky, A., Yanai, H., Fraifeld, V.E. 2012. The role of DNA damage and repair in aging trough the prism of Koch-like criteri. Ageing. Res. Rev. http://dx.doi.org/10.1016/j.arr.2012.02.0 01.
-
14. Hoeijmakers, J.H. 2009. DNA damage, aging and cancer. N.Engl.J.med. 361. Pp. 1475-1485.
-
15. Vijg, J., Montagna. C. 2017. Genome instability and aging: Cause or effect?. Translational medicine of aging. Vol.1, pp. 5-11.
-
16. Talens, R.P., Christensen, K., Putter, H, Willemsen, G., Christiansen, L.,
Kremer, D., Suchirman, H.E., Slagboom, P.E., Boomsma, D.I., Heijmans, B.T. 2012. Epigenetic
variations during the adult lifespan; cross-sectional and longitudinal data on monozygotic twin pairs. Aging Cell Vol.11. pp. 694-703.
-
17. Fraga, M.F., Esteller, M. 2007. Epigenetic and aging; the target and the marks.Trends Genet. Vol. , pp. 413-418.
-
18. Han, S, Brunnet, A. 2012. Histone methylation makes its mark on longevity. Trends Cell Biol. Vol. 22, pp.42-49.
-
19. Powers, E.T., Morimoto, R.I., Dillin, A., Kelly, J.W., Balch, W.E. 2009. Biological and nad chemical approaches to diseases of proteasis deficiency. Annu. Rev. Biochem. 78, 9595-991.
-
20. Koga, H., Kaushik, S., Cuervo, A.M. 2011. Protein homeostasis and aging: The importance of exquisite quality control. Ageing. Res. Rev.10, 205-215.
-
21. Barzilai, N., Huffman, D.M., Muzumdar, R.H., Bartke, A. 2012. The critical role of metabolic pathways in aging. Diabetes 61, 1315-1322.
-
22. Fontana, L., Patridge, L., Longo, V.D. 2010. Extending healthy life span-from yeast to humans. Sciences 328, 321-328.
-
23. Kenyon, C.J. 2010. The genetic of ageing. Nature 464, 504-512.
-
24. Webb, A.E., Brunet, A. FOXO transcription factors: key regulators of cellular quality control. 2014. Trends Biochem Sci. 2014; 39(4): 159–169.
doi:10.1016/j.tibs.2014.02.003.
-
25. Schumacher, B., van der Pluijm, I., Moorhouse, M.J., Kosteas, T., Robinson, A.R., Suh, Y., Bret, T.M., van Steeg, H., Niedernhofer, L.J., van Ijcken, W. 2008. Delayed and accelerated aging share common longevity assurance mechanism. PLoS Genet.4. e1000161.
-
26. Garinis, G.A., van der Horst, G.T., Vijg, J., Hoeijmakers, J.H. 2008. DNA damaged and ageing: new-age ideas for an age-old problem. Nat.Cell.Biol. 10, 1241-1247.
-
27. Renner, O, Carnero, A. 2009. Mouse models to decipher the PI3K signaling networkin human cancer. Curr. Mol.Med. 9, 612-625.
-
28. Milman, S., Huffman, D.M., Barzilai, N. 2016. The Somatotropic Axis in Human Aging: Framework for the Current State of Knowledge and Future Research. Cell Metabolism. 23, 980989.
-
29. Houtkooper, R.H., Williams, R.W., Auwerx, J. 2010. Metabolic networks of longevity. Cell 142, 9-14.
-
30. Papadopoli, D., Boula, K., Kazak, L., Pollak, M., Mallette, F.A., Topisirovic, I., Hulea, L. 2019. mTOR as a central regulator of lifespan and aging. F1000 Faculty Rev:998
(https://doi.org/10.12688/f1000research. 17196.1).
-
31. Laplante, M., Sabatini, D.M. 2012. mTOR signaling in growth control and disease. Cell 149. 274-293.
-
32. Wilkinson, J.E., Burmeister, L., Brooks, S.V., Chan, C.C., Friedline, S., Harisson, D.E., Hejtmancik, J.F., Nadon, N., Strong, R., Wood, L.K., et al. 2012. Rapamycins slows aging in mice. Aging Cell 11, 675-682.
-
33. Donmez, G., Guarente, L. 2010. Agiing and diseas: connections to sirtuins. Aging Cell 9, 285-290.
-
34. Finkel, T., Deng, C.X., Mostoslavsky, R. 2009. Recent progress in the biology and physiology of sirtuins. Nature 460, 587-591.
-
35. Han, L., Zhou, R., Niu, J., McNutt, M.A., Wang, P., Tong, T. 2010. SIRT1is regulated by a PPAR (gamma)-SIRT1 negative feedback loop associated with senescence. Nucleic Acid Res. 38, 7458-7471.
-
36. Guarente, L. 2007. Sirtuins in agingand disease. Cold Spring Harb.
Symp.Quant. Biol.72, 483-488.
-
37. Wang, Y., Liang, Y., Vanhoutte, P.M. 2011. SIRT1 and AMPK in regulating mammalian senescence : A critical review and a working model. FEBS Letters 585, 986-994.
-
38. Green, D.R., Galluzzi, L., Kroemer, G. 2011. Mithocondria and autophagy-inflamation-cell death axis in organismal aging. Science 333,11091112.
-
39. Lopez-otin, C., Blasco, M.A., Patrdige,L., Serrano, M., Kroemer, G. 2013. The hallmarks of aging. Cell 153. 1194-1217.
-
40. Zhang, Y., Ikeno, Y., Qi, W., Chaudhuri, A., Li, Y., Bokov, A., Thorpe, S.R., Baynes, J.W., Eipstein, C., Richardson, A., Van Remmen, H. 2009. Mice deficient in both Mn superoxide dismutase and glutathione peroxidase-1have increased oxidative damage and a greater incidence of apology but no reduction in longevity. J.Gerontol. A Biol.Sci.Med.Sci. 64, 1212-1220.
-
41. Perez, V.I., Van Remmen, H., Bokov, A., Eipstein, C.J., Vijg, J., Richardson,
A. 2009. The overexpression of major antioxidant enzyme does not extend the lifespan of mice. Aging Cell 8, 73-75.
-
42. Sena, L.A., Chandel, N.S. 2012.
Physiological role of mithocondrial reactive oxygen speciesMol.Cell 48, 158-167.
-
43. Kroemer, G., Galluzzi, L., Brenner, C.2007. Mithocondrial membrane permeabilization in cell death. Physiol.Rev.87, 99-163.
-
44. Green, D.R., Galluzzi, L., Kroemer, G. 2011. Mithocondria and autophagy-inflamation-cell death axis in organismal aging. Science 333,11091112.
-
45. Raffaello, A., and Rizzuto, R.2011. Mithocondrial longevity
pathways.Biochim.Biophys.Acta 1813, 260-268.
-
46. Sahin, E., DePinho, R.A. 2012.Axis of ageing : telomeres, p53and
mithocondriaNat. Rev. Mol.Cell
Biol.13, 397-404.
-
47. Kuilman, T., Michaloglou, C., Mooi, W.J., Peeper, D.S. 2010. The essecence of senescence. Genes Dev. 24, 24632479.
-
48. Collado, M., Blasco, M.A., Serrano, M. 2007. Cellular senescence in cancer and aging. Cell 130, 223-233. et al 2007.
-
49. Rossi, D.J., Bryder, D., Seita, J.,
Nussenzweig, A., Hoeijmakers, J.,
Weissman, I.L. 2007. Deficiencies in DNA damage repair limit the function of haematopoietic stem cells with age. Natur 447, 725-729.
-
50. Janzen, V., Forkert, R., Fleming, H.E., Saito, Y., Waring, M.T., Dombkowski, D.M., Cheng, T., DePinho, R.A., Sharpless, N.E., Scadden, D.T. 2006. Stem-cell ageing modified by the
cyclin-dependent kinase inhibitor p16INK4a. Nature 443, 421-426.2006.
-
51. Zhang, G., Li, J., Purkayastha, S., Tang, Y, Zhang, H., Yin, Y., Li, B., Liu, G., cai, D. 2013. Hypothalamic programming of systemic ageing involving IKK-β, NF-κB and GnRH. Nature 497, 211-216.
-
52. Nelson, G., Wordsworth, J., Wang, C., Jurk, D., Lawless, C., Martin-Ruiz, C., Von Zglinicki, T. 2012. A Senescent cell bystander effect : senescence induced senescence. Aging Cell11, 345349.
-
53. von Zglinicki T. Oxidative stress shortens telomeres. Trends Biochem Sci Volume 2002;27:339–344.
-
54. Ornish D, Lin J, Daubenmier J, et al. Increased telomerase activity and comprehensive lifestyle changes: a pilot study. Lancet Oncol 2008;9:1048–1057.
-
55. Blackburn EH. Telomer states and cell fates. Nature 2000; 408:53–56
-
56. Epel ES, Blackburn EH, Lin J, et al. Accelerated telomer shortening in response to life stress. Proc Natl Acad Sci U S A 2004;101:17312–17315.
-
57. Kumar SB, Yadav R, Kumar Yadav R, et al. Impact of life style interventions on markers of cellular aging. Andrology 2014;2(Suppl 1):73.
-
58. Kumar, S.B., Yadav, R., Yadav, R.K., Tolahunase, M., Dada, R. 2015. Telomerase Activity and Cellular Aging Might Be Positively Modified by a Yoga-Based Lifestyle Intervention. The journal of alternative and
complementary medicine. Volume 21, Number 6, pp. 370–372.
-
59. Rivera T, Haggblom C, Cosconati S, Karlseder J. A balance between elongation and trimming regulates
telomer stability in stem cells. Nat Struct Mol Biol. 2017;24:30–9.
-
60. Ridout KK, Ridout SJ, Goonan K, Tyrka AR, Price LH. Stress: Neuroendocrinology and Neurobiology Handbook of Stress Series. Vol. 2. Victoria, Australia: Academic Press; 2017. Telomeres and early life stress; pp. 185–93. [Google Scholar]
-
61. Zhan Y, Karlsson IK, Karlsson R, Tillander A, Reynolds CA, Pedersen NL, et al. Exploring the causal pathway from telomer length to coronary heart disease: A Network Mendelian
Randomization Study. Circ
Res. 2017;121:214–
-
62. Ping F, Li ZY, Lv K, Zhou MC, Dong YX, Sun Q, et al. Deoxyribonucleic acid telomer length shortening can predict the incidence of non-alcoholic fatty liver disease in patients with type 2 diabetes mellitus. J Diabetes
Investig. 2017;8:174–80.
-
63. Martínez P, Blasco MA. Telomere-driven diseases and telomere-targeting therapies. J Cell Biol. 2017;216:875–87.
-
64. Barbé-Tuana FM, Parisi MM, Panizzutti BS, Fries GR, Grun LK, Guma FT, et al. Shortened telomer length in bipolar disorder: A comparison of the early and late stages of disease. Rev Bras Psiquiatr. 2016;38:281–6.
-
65. Ivancich M, Schrank Z, Wojdyla L, Leviskas B, Kuckovic A, Sanjali A, et al. Treating cancer by targeting telomeres and telomerase. Antioxidants (Basel) 2017;6:pii: E15.
-
66. Martarelli D, Cocchioni M, Scuri S, Pompei P. Diaphragmatic breathing reduces exercise-induced oxidative stress. Evid Based Complement Alternat Med. 2011;2011:932430.
-
67. Barros MH, Bandy B, Tahara EB, Kowaltowski AJ. Higher respiratory activity decreases mitochondrial reactive oxygen release and increases life span in saccharomyces cerevisiae. J Biol Chem. 2004;279:49883–8.
-
68. Shaw I, Shaw BS, Brown GA. Role of diaphragmatic breathing and aerobic exercise in improving pulmonary function and maximal oxygen consumption in asthmatics. Sci Sports. 2010;25:139–45
-
69. Bhattacharya S, Pandey US, Verma NS. Improvement in oxidative status with yogic breathing in young healthy males. Indian J Physiol Pharmacol. 2002;46:349–54.
-
70. Ayala A, Muñoz MF, Argüelles S. Lipid peroxidation: Production, metabolism, and signaling mechanisms of malondialdehyde and 4-hydroxy-2-nonenal. Oxid Med Cell Longev. 2014;2014:360438.
-
71. Esterbauer H, Cheeseman KH. Determination of aldehydic lipid peroxidation products: Malondialdehyde and 4-hydroxynonenal. Methods Enzymol. 1990;186:407–21.
-
72. Ingole A, Bahattare V, Chaware S. Reducing oxidative stress through Vipassana meditation. Medpulse Int Med J. 2015;2:189–91.
-
73. Krishna BH, Keerthi GS, Kumar CK, Reddy NM. Association of leukocyte telomer length with oxidative stress in yoga practitioners. J Clin Diagn Res. 2015;9:CC01–3.
-
74. McCall T. Yoga as Medicine: The Yogic Prescriptions for Health and Living. 1st ed. New York: Bantam Publishers; 2007.
-
75. Mrithunjay Rathore and Jessy Abraham. 2018. Implication of Asana, Pranayama
and Meditation on Telomer Stability. Int.J.Yoga. 11(3), 186-193.
-
76. Kirkwood G, Rampes H, Tuffrey V, Richardson J, Pilkington K. Yoga for anxiety: A systematic review of the research evidence. Br J Sports Med. 2005;39:884–91.
-
77. Epel, E.S. 2009. Psychological and metabolic stress: A recipe for
accelerated cellular aging?. Hormones, 8(1):7-22
-
78. Kamei T, Toriumi Y, Kimura H, Ohno S, Kumano H, Kimura K. Decrease in serum cortisol during yoga exercise is correlated with alpha wave activation. Percept Mot Skills. 2000;90:1027–32.
-
79. Thirthalli, J., Naveen, G.H., Gangadhar, B.N. Cortisol and antidepressant effects of yoga. Indian journal of phsyciatry, 55(30), pp.S405-S408
-
80. Bravo, J.A., Díaz-Veliz, G., Mora, S., Ulloa, J.L., Berthoud, V.M., Morales, P., et al. 2009. Desipramine prevents stress-induced changes in depressive-like behavior and hippocampal markers of neuroprotection. Behav
Pharmacol;20:273–85.
-
81. Mohandas E. Neurobiology of spirituality. Mens Sana Monogr. 2008;6:63–80.
-
82. Pietrowsky, R., Braun, D., Fehm, H.L., Pauschinger, P., Born, J. 1991. Vasopressin and oxytocin do not influence early sensory processing but affect mood and activation in man. Peptides;12:1385–91.
-
83. Yadid, G., Zangen, A., Herzberg, U., Nakash, R., Sagen, J. 2000. Alterations in endogenous brain beta-endorphin release by adrenal medullary transplants in the spinal cord.
Neuropsychopharmacology;23:709–16.
-
84. Janal, M.N., Colt, E.W., Clark, W.C., Glusman, M. 1984. Pain sensitivity, mood and plasma endocrine levels in man following long-distance running: Effects of naloxone. Pain;19:13–25.
-
85. Correia-Melo, C., Hewitt, G., Passos., J.F. 2014. “Telomeres, oxidative stress and inflammatory factors: partners in cellular
senescence?”Longevity&Healthspan,vol .3,no.1.
-
86. Dada,S., Kumar, B., Tolahunase,M., Mishra, K., Mohanty, T., Mukesh. 2015. “Yoga and meditation as a therapeutic intervention in oxidative stress and oxidative DNA damage to paternal genome,”Journal of Yoga&Physical Therapy,vol.5,no.4.
-
87. K.Pakos-Zebrucka, I., Koryga,K., Mnich, M., Ljujic,A., Samali., Gorman, A.M. “The integrated stress response,” EMBO Reports,vol.17,no.10,pp.1374– 1395,2016.
-
88. Miller, A.H., Raison, C.L. 2016. “The role of inflammation in
depression:fromevolutionaryimperativet omoderntreatment target,” Nature Reviews Immunology, vol. 16, no. 1, pp. 22–34.
-
89. Lu, P.D., Harding, H.P., Ron, D. 2004. Translation reinitiation at alternative open reading frames regulates gene expression in an integrated stress response. J Cell Biol 167: 27–33.
-
90. S.-W. Min, P. D. Sohn, S.-H. Cho, R. A. Swanson, and L. Gan. 2013. “Sirtuins in neurodegenerative diseases : an update on potential mechanisms,”Frontiersin Aging Neuroscience,vol.5,article no. 53.
-
91. T. Tchkonia, Y. Zhu, J. Van Deursen, J. Campisi, and J. L. Kirkland, “Cellular senescence and the senescent secretory phenotype : therapeutic
opportunities,”Journal of Clinical Investigation,vol.123,no.3,pp.966– 972,2013.
-
92. Shaffer, J. 2016. Neuroplasticity and clinical practice : building brain power for health. Frontiers in
Psychology,vol.7, article no.1118.
-
93. Villemure, C., ˇCeko, M., Cotton, V.A., Catherine, M., Bushnell. 2015.
Neuroprotective effects of yoga practice:age-,experience, and frequencydependent plasticity,” Frontiers in Human Neuroscience,vol.9,article
00281.
-
94. Dobkin, P.L., Zhao, Q. 2011. Increased mindfulness—the active component of the mindfulness-based stress reduction program?”Complementary Therapies in Clinical Practice,vol.17,no. 1,pp.22– 27,2011.
-
95. Yadav, R.K., Magan, D., Mehta, N., Sharma, R,., Mahapatra, S.C. 2012. Efficacy of a
-
96. short-term yoga-based lifestyle
intervention in reducing stress and inflammation: preliminary results. The journal of alternative and
complementary medicine;18 (7):662–7.
-
97. Singh, V.P., Khandelwal, B., Sherpa, N.T. 2015. Psycho-neuro-endocrine-immune mechanisms of action of yoga in type II diabetes. Ancient science of life;35 (1):12
-
98. Froeliger, B., Garland, E.L., Modlin, L.A., McClernon, F.J. 2012. Neurocognitive correlates of the effects of yoga meditation practice on emotion and cognition: a pilot study. Frontiers in integrative neuroscience;6:48.
-
99. Desai, R., Tailor, A., Bhatt, T. 2015. Effects of yoga on brain waves and structural activation: A review.
Complementary therapies in clinical practice;21 (2):112–8.
-
100. Ganpat, T.S., Nagendra,H.R., Selvi, V. 2013. Efficacy of yoga for mental performance in university students. Indian journal psychiatry. 55(4). pp 349-352.
-
101. Chen, A., Xiong-L.J., Tong, Y., Mao, M. Neuroptotective effect of barin derived neurotrophic factor mediated by autophagy through the PI3K/Akt/mTOR pathway. Molecular medicine repors. 2013;8(4):1011-6.
-
102. Michan,S., Sinclair, D., Sirtuins in mammals: insights into their biological function. Biochemical journal.
2007;404(1):1-13.
-
103. Stokes, K.A., Nevill, M.E., Cherry, P.W., Lakomy, H.K.A., Hall, G.M. 2004. “Effect of 6 weeks of sprint training on growth hormone responses to
sprinting,”European Journal of Applied Physiology, vol.92,no.1-2,pp.26–32.
-
104. Kostka, T. 2001. Aging and so called “youth hormones. Potential influence of exercise training,”Przeglad
Lekarski,vol.58,no.1, pp.25–27.
-
105. Heutlingand, D., Lehnert, H. 2008. Hormonetherapyandanti-aging: is there an indication?” Internist, vol. 49, no. 5, pp. 570–580.
-
106. Kostka, T. 2001. Aging and so called “youth hormones. Potential influence of exercise training,”Przeglad
Lekarski,vol.58,no.1, pp.25–27.
-
107. Chatterjee, S., Mondal, S. Effect of Regular Yogic Training on Growth Hormone and Dehydroepiandrosterone Sulfate as an Endocrine Marker of Aging. Evidence-Based Complementary
and Alternative Medicine.
http://dx.doi.org/10.1155/2014/240581.
-
108. McEwen, B.S., 2003. Mood disorders and allostatic load. Biol. Psychiatry 54:200–207.
http://dx.doi.org/10.1016/S0006-3223(03)00177-X.
-
109. Lennartsson, A.-K., Sjörs, A., Jonsdottir, I.H., 2015. Indication of
attenuated DHEA-s response during acute psychosocial stress in patients with clinical burnout. J. Psychosom. Res. 79:107–111.
http://dx.doi.org/10.1016/j.jpsychores.2 015.05.011.
-
110. Boudarene, M., Legros, J.J., Timsit-Berthier, M. Study of the stress response: role of anxiety, cortisol and DHEAs. Encephale. 28(2); 139-46.
31
Discussion and feedback