Trichoderma spp. AS BIOCONTROL Sclerotium rolfsii Sacc. ON SOYBEAN PLANTS (Glycine max L.)
on
SIMBIOSIS X (2): 199-210 http://ojs.unud.ac.id/index.php/simbiosis
Program Studi Biologi FMIPA UNUD
eISSN: 2656-7784
September 2022
PEMANFAATAN Trichoderma spp. SEBAGAI BIOKONTROL Sclerotium rolfsii Sacc. PADA TANAMAN KEDELAI (Glycine max L.)
Trichoderma spp. AS BIOCONTROL Sclerotium rolfsii Sacc. ON SOYBEAN PLANTS (Glycine max L.)
Putu Candra Dewi Oktaviawati*, Sang Ketut Sudirga, Junita Hardini
Program xStudi xBiologi xFakultas xMatematika xdan xIlmu xPengetahuan xAlam xUniversitas xUdayana, xBukit xJimbaran, xBali, xIndonesia - x80361 *Email korespodensi: coktaviawati@gmail.com
ABSTRAK
Sclerotium rolfsii Sacc. merupakan jamur penyebab penyakit pada tanaman kedelai (Glycine max L.) yang menyebabkan penurunan produksi kedelai. xSalah xsatu xupaya xuntuk xmeningkatkan ketahanan xtanaman kedelai terhadap S. rolfsii adalah dengan menggunakan agen hayati Trichoderma spp. Tujuan dari penelitian inixuntuk menekan infeksi jamur S. rolfsii xpada xtanaman xkedelai menggunakan Trichoderma spp. Metode ppenelitian xmenggunakan xRancangan xAcak xLengkap (xRAL), xdengan 5 xperlakuan xyaitu xa) media tumbuh xtanpa perlakuan (kontrol); xb) media tumbuh + x10 g Trichoderma spp., dan tanpa S. rolfsii; c) media tumbuh tanpa Trichoderma spp., + 5 g S. rolfsii; d) media tumbuh + 15 g Trichoderma spp., dan 5 g S. rolfsii; e) media tumbuh + 20 g Trichoderma spp., dan 5 g S. rolfsii. xPerlakuan xdiulang xsebanyak x5 xkali dan xdiperoleh kombinasi perlakuan sebanyak 25 unit. Data xdianalisis xmenggunakan Analysis xof xVariance (xANOVA), didapatkan xhasil xyang xberbeda xnyata α<0,05 xdilanjutkan xdengan analisis Post Hoc xDuncan Test. Hasil penelitian secara In Vitro menunjukkan Trichoderma spp. dapat menghambat S. rolfsii sebesar 55,56%, secara In Vivo Trichoderma spp. dapat menghambat S. rolfsii sebesar 40%, dosis optimal Trichoderma spp. sebesar 20 g berdasarkan tingginya rerata berat polong yang dihasilkan, rerata tinggi tanaman tertinggi yaitu 64,4 cm, rerata berat kering tajuk tertinggi sebesar 5,1 g, rerata berat kering akar tertinggi sebesar 0,5 g, dan rerata berat polong tertinggi sebesar 17,0 g.
Kata kunci: Gejala penyakit, Intensitas serangan, Ketahanan, Persentase, Produksi kedelai.
ABSTRACT
Sclerotium rolfsii Sacc. on soybeans was one of the diseases in the cultivation that caused a decrease in soybeans (Glycine max L.) production. One of the efforts in increasing the growth and the resistance of the soybean was by using the biological agent named Trichoderma spp. This study aimed to control the intensity of the Sclerotium rolfsii that can cause disease in soybeans. this research was conducted from July 2021 to September 2021 at the Biochemical laboratory and at the Green House owned by the Biology Department FMIPA, Udayana University. The research used an completely randomized design (CRD) with five treatments; a) growing media without the treatment (control); b) growing media + 10 g Trichoderma spp., and without S. rolfsii; c) growing media without Trichoderma spp., + 5 g S. rolfsii; d) growing media + 15 g Trichoderma spp., and 5 g S. rolfsii; e) growing media + 20 g Trichoderma spp., and 5 g S. rolfsii. In this research, the treatment was repeated 5 times and 25 combinations of treatments were obtained. Analysis of Variance (ANOVA) was used in this study to analyze the data, it was found that there was a different result <0,05, then it was continued by using the analysis of Post Hoc Duncan Test. According to the research, it was found that there were two different results. Based on in vitro method, it can be concluded that Trichoderma spp. can inhibit S. rolfsii by about 55,56%. Meanwhile, based on in vivo
method, it can be concluded that Trichoderma spp. can inhibit S. rolfsii about 40% which the optimal dose of Trichoderma spp. was about 20 g, the highest plant height was 64.4 cm, the highest average dry weight of shoots was 5.1 g, the highest average dry weight of roots was 0.5 g, and the highest average pod weight was 17.0 g.
Keywords: Attack intensity, Disease symptoms, Percentage, Resistance, Soybean production.
PENDAHULUAN
Kedelai (Glycine max L.) termasuk dalam famili Fabaceae merupakan xsalah xsatu xkomoditas xpangan utama xdi xIndonesia selain xpadi xdan xjagung. Selain itu, kedelai merupakan xsumber utama xprotein dan minyak xnabati utama dunia (Aldillah, 2015) juga mengandung vitamin B, E, K, kalsium, fosfor, magnesium dan zinc (Agung dkk., 2016). Produksi kedelai di Provinsi Bali pada tahun 2019 hingga 2020 mengalami penurunan sebanyak 741 ton (Dinas Pertanian dan Ketahanan Pangan Provinsi Bali, 2021).
Salah satu faktor yang menyebabkan produktivitas kedelai rendah yaitu adanyaxpenyakit xbusuk pangkal xbatang. xPenyakit xbusuk xpangkal xbatang pada kedelai xdisebabkan xoleh xSclerotium xrolfsii (Semangun, 2007). xMenurut xSastrahidayat xet xal. (x2007), xpenyakit xbusuk xbatang xyang xdisebabkan xoleh xS. xrolfsii ialah xpenyakit krusial xpada tumbuhan xkedelai di xIndonesia xdan xpenyakit xini xdapat xmenyebabkan penurunan produksi 75 – 100%.
Upaya pengendalian alternatif untuk mengurangi dampak negatif dari penggunaan fungisida sintetik dan lebih efektif dalam menghambat pertumbuhan jamur S. rolfsii adalah dengan mikroorganisme antagonis.
xSalah xsatu xmikroorganisme xantagonis xyang dapat dimanfaatkan sebagai xpengendali xhayati atau agen biokontrol xadalah xjamur xTrichoderma xspp. Menurut Chamzurni dkk. (2011) aplikasi dosis Trichoderma spp. sebanyak 75 g dapat menghambat perkembangan jamur S. rolfsii melalui mekanisme antagonis. Hasari dkk. (2018) melaporkan bahwa, pemberian Trichoderma pada tanaman stroberi menghasilkan persentase penekanan penyakit layu fusarium sebesar 20%.
Berdasarkan hal tersebut, perlu dilakukan penelitian pemanfaatan Trichoderma spp. sebagai biokontrol terhadap S. xrolfsii xpenyebab xpenyakit xbusuk xpangkal xbatang xpada xtanaman kedelai.
MATERI DAN METODE
xWaktu xdan xTempat Penelitian
Penelitian xdilaksanakan xpada xbulan Juli 2021 - xSeptember 2021. Penelitian dilaksanakan xdi xLaboratorium Biokimia xdan xGreen House Program Studi xBiologi, xFakultas MIPA xUniversitas Udayana.
Rancangan Penelitian
Penelitian menggunakan RAL dengan 5 perlakuan (termasuk kontrol, Trichoderma 10 g, Trichoderma 15 g + S. rolfsii 5 g, Trichoderma 20 g + S. rolfsii 5 g, dan S. rolfsii 10 g). xSetiap xperlakuan
diulang xsebanyak x5 xkali xsehingga
diperoleh 25 unit percobaan.
Prosedur Penelitian
Reisolasi Jamur
Isolat masing-masing jamur diambil 1 loof Ose, lalu diinokulasikan ke xcawan xPetri berbeda xyang xsudah xberisi xmedia Potato Dextrose Agar (PDA), dan xdiinkubasi xselama x7 hari dalam xsuhu xruang.
xUji xAntagonis xSecara xIn xVitro
Uji antagonis menggunakan metode biakan ganda. Isolat masing-masing xjamur diambil menggunakan cork borer, lalu diletakkan xdalam xsatu xcawan xPetri xyang xberisi media xPDA xdengan xjarak x3 cm. xCawan xPetri xyang berbeda diinokulasikan isolat S. rolfsii tanpa antagonis sebagai kontrol. Masing-masing cawan Petri diinkubasi selama 7 hari dalam suhu ruang dan dihitung diameter koloninya. Pengukuran dilakukan menggunakan mistar, dan perhitungan daya hambat menurut Singh and Vijay (2011), dengan xrumus:
PIGR (%) = X 100%
v 7 Rl
Keterangan:
-
- PIGR = xPercentage xInhibition xof xRadial xGrowth (% daya xhambat)
-
- R1 = xDiameter xpatogen xtanpa xantagonis (cm)
-
- R2 = xDiameter xpatogen xdengan xantagonis (cm)
Penyemaian Benih Kedelai
Benih kedelai varietas Wilis direndam dalam air hangat selama 1 menit, dan disemai dalam tray semai. Benih disemai selama 2 minggu hingga 2-3 helai daun.
Persiapan Media Tanam
Tanah sebanyak 3,6 kg diayak hingga tidak ada gumpalan, kemudian disterilisasi dengan dikukus selama 3 jam dengan suhu 100℃. Tanah yang sudah steril dicampur dengan pupuk kandang 0,5 kg dan arang sekam 0,5 kg, setelah tanah tercampur kemudian dimasukkan ke dalam polybag dan didiamkan selama 7 hari.
Inokulasi Trichoderma dalam Dedak
Dedak direndam dalam air hangat selama 15 menit, dedak disaring kemudian dikukus selama 30 menit dan disterilisasi dengan autoklaf selama 40 menit. Selanjutnya dedak ditimbang sesuai berat perlakuan (10, 15, 20 g) dan dimasukkan ke dalam cawan Petri. Isolat Trichoderma xdiinokulasikan xke xdalam xmedia dedak, xdan xdiinkubasi xdalam xsuhu ruang hingga jamur tumbuh memenuhi cawan Petri. Dedak yang sudah ditumbuhi jamur, diinokulasikan xke xdalam xmedia tanam xdan xdiinkubasi xselama x7 xhari.
Pindah Semai
Bibit yang sudah tumbuh x2-3 xhelai xdaun xselanjutnya xdipindahkan xke xdalam xpolybag xyang xtelah diinokulasikan Trichoderma. Selanjutnya tanaman didiamkan hingga 7 hari.
Inokulasi Sclerotium rolfsii dalam Bubur Kentang
Kentang yang telah dipotong, ditimbang sebanyak 200 g, lalu direbus dalam 1 L air. Kentang dihancurkan hingga seperti bubur, ditambahkan agar 14 g dan dextrose 20 g dan diaduk hingga homogen. Bubur kentang dimasukkan ke dalam Erlenmeyer dan disterilisasi dengan
autoklaf selama 15 menit. Bubur kentang ditimbang sesuai berat perlakuan (5 g dan x10 g) dan xdimasukkan xke xdalam xcawan xPetri. Isolat S. roflsii diinokulasikan xke xdalam xmedia bubur kentang dan xdiinkubasi xselama x7 xhari dalam suhu ruang. Bubur kentang yang ditumbuhi jamur, diinokulasikan ke tanaman dan diamati gejalanya.
Parameter Pengamatan
xParameter xyang xdiamati yaituxtinggi xtanaman (cm), xberat xkering tajuk (g), xberat xkering xakar (g), xberat polong (g) diukur 6 minggu setelah tanam.
Keparahan penyakit diamati setiap minggu dan diukur pada akhir penelitian.
Perhitungan xkeparahan xpenyakit xdengan xrumus (Nurzannah dkk., 2014):
KeP = x 100%
NxZ
xKeterangan:
-
- KeP = xkeparahan xpenyakit
-
- n = xjumlah xtanaman xterinfeksi xpada xsetiap xkategori xserangan
-
- v = xnilai xskala xdari xmasing-
xmasing xkategori xserangan
-
- Z = xnilai xskala xkategori xtertinggi
-
- N = xjumlah xtanaman xyang xdiamati
xNilai xskala xuntuk xsetiap xkategori xserangan xpada xsetiap xtanaman xditentukan xberdasarkan xgejala
xserangan xpada xtanaman dapat dilihat pada xTabel 1.
Tabel 1. Skala serangan patogen Sclerotium rolfsii.
|
xSkala |
Gejala serangan |
|
0 |
xTanpa xserangan, tanaman sehat |
|
1 |
Lesi berwarna abu-abu yang basah terdapat pada pangkal batang, tetapi pertumbuhan jamur tidak terlihat |
|
2 |
Pertumbuhan jamur terlihat pada pangkal batang, ditandai dengan miselia warna putih seperti sutra dan atau sklerotia yang menjadi gelap |
|
3 |
Tanaman layu sebagian, daun muda mulai layu dan batang mulai mengerut |
|
4 |
Tanaman layu total, pengeringan dan pencoklatan pada daun dan batang; tanaman roboh dan busuk |
|
5 |
Tanaman mati |
Analisis Data
xData kuantitatif berupa tinggi tanaman, berat kering tajuk, berat kering akar, dan berat polong xyang xdiperoleh xdianalisis xmenggunakan xANOVA xdan hasil berbeda nyata α<0,05 dilanjutkan xdengan analisis Post Hoc Duncan Test.
HASIL DAN PEMBAHASAN
Hasil
Hasil uji in vitro antagonisme Trichoderma spp. dengan Sclerotium rolfsii secara makroskopis disajikan pada Gambar 1. menunjukkan bahwa jamur Trichoderma spp. memiliki diameter koloni 5 cm dan jamur S. rolfsii memiliki diameter koloni 4 cm.
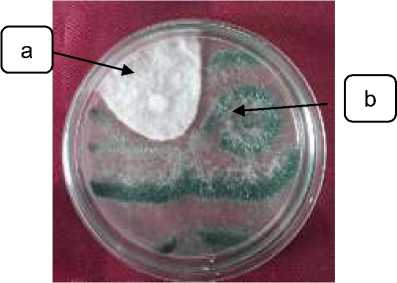
Gambar 12. Uji Antagonisme Trichoderma spp. dengan Sclerotium rolfsii setelah inkubasi 7 hari dalam suhu ruang
Keterangan: a) koloni S. rolfsii; b) koloni Trichoderma spp.
Besarnya daya hambat dilihat dari luas diameter masing-masing koloni jamur. Diameter koloni Trichoderma spp. lebih luas dibanding koloni S. rolfsii menandakan bahwa Trichoderma spp. dapat menghambat pertumbuhan patogen dengan mekanisme antagonisnya yaitu kompetisi.
Perhitungan kerapatan konidia Trichoderma spp. pada xpengenceran 10-1, 10-2, 10-3 disajikan xpada xTabel 2.
Tabel 2. Hasil perhitungan kerapatan konidia dengan hemasitometer

Gambar 2. Tanaman kedelai setelah diinokulasi S. rolfsii
Keterangan: (1) gejala pada hari ketiga setelah diinokulasi; (2) gejala pada hari ke-7 setelah diinokulasi
S. rolfsii membentuk miselia dan menginfeksi pangkal batang pada hari ketiga setelah inokulasi, dan gejala serangan yaitu pangkal batang berwarna coklat yang terjadi pada 1 minggu setelah inokulasi.
Pengamatan pada minggu ke-2 keparahan penyakit pada pangkal batang kedelai (Gambar 3) yang ditandai dengan adanya lesi. Hal tersebut menandakan bahwa S. rolfsii telah menginfeksi pangkal batang xtanaman xkedelai.
|
Pengenceran |
Kerapatan konidia spora/mL |
|
10-1 |
7,5 x 106 |
|
10-2 |
5 x 106 |
|
10-3 |
1 x 106 |
A
B
Gambar 3.
D
E
Hasil pengamatan xkeparahan penyakit pada xpangkal xbatang tanaman xkedelai xdisajikan xpada Gambar x2.
kedelai
Keterangan: (a) perlakuan kontrol; (b) perlakuan Trichoderma 10 g; (c) perlakuan Sclerotium rolfsii 10 g; (d) perlakuan Trichoderma 15 g + S. rolfsii 5 g; (e) perlakuan Trichoderma 20 g + S. rolfsii 5 g.
xBerdasarkan hasil pengamatan dan perhitungan xkeparahan xpenyakit xpada pangkal batang tanaman kedelai secara makroskopis, diperoleh hasil persentase keparahan penyakit xyang xdapat xdilihat xpada xTabel 3.
xTabel x3. xPersentase keparahan penyakit.
Tabel 3 menunjukkan bahwa persentase keparahan penyakit tanaman kedelai berkisar 40-80%. Perlakuan C menghasilkan persentase keparahan penyakit tertinggi yaitu sebesar 80% sedangkan perlakuan D dan E menghasilkan persentase keparahan penyakit yaitu sebesar 40%.
Hasil ANOVA xmenunjukkan xbahwa xpemberian xTrichoderma xspp. xberpengaruh xnyata xterhadap xtinggi tanaman kedelai disajikan pada Tabel 4.
xPerlakuan pemberian Trichoderma spp. 10 g, menghasilkan rerata tanaman tertinggi, sedangkan perlakuan C Sclerotium rolfsii 10 g menghasilkan rerata tinggi tanaman terendah (Tabel 4).
Rerata xberat xkering xtajuk disajikan pada Tabel x5.
|
Tabel 5. xRerata berat kering tajuk pada tanaman kedelai xpada 6 MST. | |
|
Perlakuan |
Berat (g) |
|
A |
4,6±0,5ab |
|
B |
5,1±1,0b |
|
C |
3,5±0,7a |
|
D |
3,7±0,9a |
|
E |
3,9±0,5a |
|
Perlakuan Persentase Keparahan Penyakit (%) | |
|
A |
0 |
|
B |
0 |
|
C |
80 |
|
D |
40 |
|
E |
40 |
Keterangan: xAngka xyang xdiikuti notasi xyang berbeda xpada xkolom xyang xsama, xmenunjukkan xberbeda xnyata berdasarkan xuji xDMRT 5%. A= kontrol, B= Trichoderma spp. 10 g, C= S. rolfsii 10 g, D= Trichoderma spp. 15 g + S. rolfsii 5 g, E= Trichoderma spp. 20 g + S. rolfsii 5 g.
Perlakuan B menghasilkan rerata berat kering tajuk tertinggi yaitu sebesar 5,1 g, sedangkan perlakuan C menghasilkan rerata berat kering tajuk terendah yaitu sebesar 3,5 g.
Tabel 4. Tinggi tanaman (cm) kedelai per-minggu
|
Perlakuan |
Minggu | |||||
|
1 |
2 |
3 |
4 |
5 |
6 | |
|
A |
17,3±0,5b |
22,7±0,9b |
32,1±5,2ab |
35,9±7,7a |
41,1±10,9a |
47,2±13,2a |
|
B |
16,7±1,0ab |
21,7±1,7ab |
37,3±8,9b |
46,7±14,6a |
55,4±14,9b |
64,4±14,7c |
|
C |
17,1±0,4b |
22,7±0,7b |
28,0±3,3a |
34,5±5,1a |
39,4±5,5a |
43,9±2,9ab |
|
D |
15,7±0,6a |
20,2±0,6a |
32,3±2,9ab |
40,4±3,1a |
49,6±3,9ab |
57,9±4,0bc |
|
E |
16,6±1,5ab |
21,7±1,6ab |
35,1±5,9ab |
40,6±8,9a |
49,2±6,2ab |
57,6±6,2bc |
Keterangan: xAngka xyang xdiikuti notasi xyang berbeda xpada xkolom xyang xsama, xmenunjukkan xberbeda xnyata berdasarkan xuji xDMRT 5%. A= kontrol, B= Trichoderma spp. 10 g, C= S. rolfsii 10 g, D= Trichoderma spp. 15 g + S. rolfsii 5 g, E= Trichoderma spp. 20 g + S. rolfsii 5 g.
|
Hasil ANOVA rerata berat kering akar xdisajikan xpada xTabel x6. xTabel x6. xRerata xberat kering akar pada xtanaman kedelai pada 6 MST. | |
|
Perlakuan |
Berat (g) |
|
A |
0,4±0,9ab |
|
B |
0,5±0,9b |
|
C |
0,2±0,4a |
|
D |
0,5±0,3b |
|
E |
0,3±0,8ab |
Keterangan: xAngka xyang xdiikuti notasi xyang berbeda xpada xkolom xyang xsama, xmenunjukkan xberbeda xnyata berdasarkan xuji xDMRT 5%. A= kontrol, B= Trichoderma spp. 10 g, C= S. rolfsii 10 g, D= Trichoderma spp. 15 g + S. rolfsii 5 g, E= Trichoderma spp. 20 g + S. rolfsii 5 g.
Pengaruh pemberian Trichoderma spp., menghasilkan berat kering akar yang berbeda nyata, perlakuan B menghasilkan xrerata xberat xkering xakar tertinggi yaitu xsebesar 0,5 g. xPerlakuan C xmenghasilkan rerata xberat xkering xakar terendah xyaitu sebesar 0,2 g.
Hasil ANOVA xmenunjukkan xbahwa faktor xpemberian xTrichoderma spp., xberpengaruh xnyata xterhadap berat polong kedelai yang dihasilkan. Rerata berat polong xdisajikan xpada xTabel x7.
|
Tabel x7. xRerata xberat xpolong kedelai pada 6 MST. | |
|
Perlakuan |
Berat (g) |
|
A |
15,4±3,6b |
|
B |
13,8±2,7b |
|
C |
10,4±2,0a |
|
D |
14,6±1,5b |
|
E |
17,0±1,5b |
Keterangan: xAngka xyang xdiikuti notasi xyang berbeda xpada xkolom xyang xsama, xmenunjukkan xberbeda xnyata berdasarkan xuji xDMRT 5%. A= kontrol, B= Trichoderma spp. 10 g, C= S. rolfsii 10 g, D= Trichoderma spp. 15 g +
S. rolfsii 5 g, E= Trichoderma spp. 20 g + S. rolfsii 5 g.
Pengaruh pemberian Trichoderma spp., menghasilkan berat polong yang berbeda nyata, perlakuan E menghasilkan rerata berat polong tertinggi sebesar 17 g. Perlakuan C menghasilkan rerata berat polong terendah yaitu sebesar 10 g.
PEMBAHASAN
Hasil uji antagonisme (pada Gambar 1) xmenunjukkan xbahwa xTrichoderma xspp. dapat menghambat xpertumbuhan xSclerotium xrolfsii sebesar 55,56%. Hal ini dikarenakan Trichoderma spp. memiliki sifat sebagai mikoparasit dan hiperparasitisme yaitu kemampuan Trichoderma spp. menghambat pertumbuhan jamur S. rolfsii. Dengan cara hifanya xmenghimpit xdan xmembelit xhifa patogen xdengan xmembentuk xstruktur xseperti xkait (xhook-like xstructure) (Syahnen dkk., 2014).
S. rolfsii tidak membentuk sklerotia, hal ini terjadi karena sifat antagonis Trichoderma spp. yang mampu melisiskan dan mendegradasi miselia (Mulyani et al., 2011). Standar kerapatan konidia untuk agen biokontrol atau agen pengendali hayati Trichoderma spp., xharus xmemiliki xnilai xlebih xbesar xatau xsama xdengan 1 x 106 xspora/mL (xPusat xPenelitian dan xPengembangan xPerkebunan, 2014).
xKerapatan konidia tersebut xmenunjukkan xbahwa konidia xyang xdihasilkan xoleh xTrichoderma spp. xdalam xuji xini xmemenuhi xpersyaratan xmutu agen xpengendali xhayati. Kerapatan konidia xyang xtinggi xatau xmemenuhi xstandar xakan xmenjadi xindikator xkemampuan agen pengendali
hayati xdalam xmenekan xinfeksi xpatogen (Syahnen dkk., 2014).
Tingkat keparahan penyakit tertinggi terdapat pada tanaman kedelai perlakuan C yang hanya diberi patogen S. rolfsii dengan nilai skala 2 dan persentase keparahan penyakitnya sebesar 80%. Pangkal batang tanaman kedelai perlakuan C lebih gelap daripada pangkal batang tanaman perlakuan lainnya, hal ini menunjukkan bahwa patogen menginfeksi tanaman tersebut. Pangkal batang tanaman perlakuan C pada minggu ke-2 setelah diinokulasikan patogen, tidak menunjukkan pembusukan atau kelayuan (gejala sekunder).
Menurut Notarianto dan Lerdi (2017), bahwa xciri xgejala xadanya xinfeksi xatau xserangan S. xrolfsii xyaitu xadanya miselia xberwarna xputih xyang xdisertai xdengan xbercak xwarna xcoklat xpada xpangkal xbatang xyang xmerupakan xgejala xprimer xsuatu xpenyakit xyang xtimbul xsetelah xterjadi xinfeksi pada xjaringan. Jaringan yang rusak pada xpangkal xbatang xdan xakar xakan xmenimbulkan xlayu xpada xdaun, xkelayuan xini xdisebut xgejala xsekunder.
Patogen kemungkinan tidak dapat tumbuh dan menginfeksi tanaman lebih dalam sehingga tidak ada peningkatan gejala serangan maupun gejala sekunder pada tanaman. Pada saat penelitian dari bulan Agustus sampai September berlangsung musim kemarau (suhu tinggi dan kelembaban rendah), menyebabkan gejala sekunder tidak terjadi. Notarianto dan Lerdi (2017) menyatakan bahwa Miselia cendawan patogen yang berada dalam kondisi xtersebut xakan xmengalami xhambatan xdalam
xpertumbuhan xdan xperkembangan sehingga xberpengaruh xterhadap xlambatnya xproses xpenetrasi xdan xinfeksi xpada xjaringan xtanaman.
Tanaman dapat menghambat pertumbuhan dan perkembangan patogen karena adanya rintangan mekanik dan memiliki kemampuan lignifikasi. Selain karakter morfologi, ketahanan biokimia juga menentukan ketahanan suatu tanaman, misalnya tanaman mengeluarkan senyawa fenolik. Penekanan perkembangan patogen dapat dilakukan senyawa fenolik dalam meningkatkan ketahanan tanaman (Vagiri et al., 2017).
Tingkat keparahan penyakit pada tanaman perlakuan D dan E diperoleh persentase keparahan penyakit sebesar 40%. Pangkal batang pada perlakuan D dan E (pada Gambar 3) tidak menunjukkan peningkatan gejala serangan primer dan sekunder setelah 2 minggu diinokulasi patogen, pangkal batang tanaman hanya terdapat lesi tetapi tidak menyebabkan perubahan warna pada pangkal batang serta pembusukan atau kelayuan pada tanaman.
Menurut Amiroh dkk. (2020) Trichoderma spp. xsecara xtidak xlangsung xmampu xmeningkatkan xpertumbuhan xtanaman xyaitu xdengan xmenekan laju pertumbuhan xpatogen, sehingga patogen tidak dapat menginfeksi tanaman kedelai dan menyebabkan penyakit. Mekanisme antagonisnya yaitu Trichoderma akan mengkolonisasi xdaerah xrizosfer, xselanjutnya xmenginvasi xlapisan pangkal xkorteks xakar, xruang xbagi xpatogen xberkurang xsehingga xserapan xunsur xhara xtidak xterganggu
xdan xpertumbuhan xtanaman xmenjadi xbaik.
Hasil uji ANOVA menunjukkan bahwa tanaman yang diberikan xTrichoderma xspp. xmemberikan xpengaruh xyang nyata xterhadap xtinggi xtanaman (Tabel 4). Hal ini dikarenakan xTrichoderma xspp. xmengeluarkan xhormon pertumbuhan auksin xyang xdapat xdidifusikan xke xdalam xjaringan xtanaman xyang xmemacu xpertumbuhan xtinggi xtanaman (Sudantha, 2010).
xTanaman xyang xdiberi xTrichoderma xspp. xdan S. rolfsii xmenghasilkan xtinggi xtanaman xyang sama xdengan xtanaman xyang hanya xdiberi xTrichoderma xspp. xHal xini xdikarenakan Trichoderma spp. xadalah xkompetitor xruang xtumbuh S. rolfsii xyang xsangat xbaik, xpertumbuhannya xyang xcepat xdapat xmengkolonisasi xdan xtumbuh xberasosiasi xdengan xbaik xpada xperakaran xtanaman, xserta xsecara xsignifikan xmeningkatkan xpertumbuhan xdan xperkembangan xtanaman (Castro et al., 2009).
Tanaman yang hanya diberi S. rolfsii menunjukkan rerata tinggi tanaman kedelai terendah. Tanaman kedelai dapat tumbuh karena mendapatkan nutrisi dari unsur hara pupuk kandang dan adanya xbakteri xRhizobium. Rhizobium xmerupakan xmikroba xyang xmampu xmengikat xnitrogen xbebas xyang xberada xdi xudara xmenjadi senyawa nitrogen xyang diperlukan xtanaman xuntuk xtumbuh xdan xberkembang (xSari dan xPrayudyaningsih, 2015). Sedangkan pupuk kandang merupakan sumber bahan organik P2O5, N, dan K2O, juga
mengandung Zn, Cu, Mo, C, B, Mn, Cl, Mg, dan S (xHakim et al., x1986).
xHasil uji xANOVA (Tabel 5) pemberian Trichoderma spp. (xperlakuan B) xtidak xberbeda xnyata xdengan xkontrol. Hal ini xdiduga xkarena xdipengaruhi xoleh xfaktor xeksternal,xsehingga xTrichoderma spp. xtidak optimal xmengeluarkan xzat xtertentu xyang xdapat xmeningkatkan xpertumbuhan xtanaman.
Menurut Herlina dan Dewi (2010), Trichoderma spp. dapat merangsang tanaman untuk memproduksi hormon auksin sehingga dapat xmenunjang pertumbuhan xtanaman xsengon dan menstimulasi terbentuknya xakar xlateral. Unsur hara, air, dan zat terlarut diserap oleh akar, xdan xditransfusikan ke bagian-bagian tanaman sehingga xmempengaruhi xbiomassa xtanaman.
Hasil uji ANOVA pada xperlakuan xC, xD dan xE xtidak xberbeda xnyata terhadap rerata berat kering tajuk. Perlakuan C (S. rolfsii 10 g) xtidak xberbeda xnyata xdengan xperlakuan xD dan xE (Tabel 5). Hal ini xdapat disebabkan karena infeksi Trichoderma spp. terhadap akar kurang optimal. Menurut xDendang xdan xHani (2014), bahwa pemberian xTrichoderma xspp. dapat meningkatkan kandungan N dan C dan dapat meningkatkan pH pupuk xsehingga berpengaruh terhadap xproduksi xberat xkering xpada xhasil xakhir xtanaman.
Pemberian S. rolfsii (perlakuan C) pada tanaman xmenghasilkan xberat xkering tajuk xterendah, xhal xini diduga karena kekurangan xhara Nitrogen (N) pada tanaman. Produktivitas optimal pada
tanaman kedelai membutuhkan hara N, P, dan K xdalam xjumlah xbanyak. Laju fotosintesis dipengaruhi oleh klorofil yang dibentuk oleh unsur N dalam tanah. Senyawa-senyawa organik hasil fotosintesis, ditranslokasikan ke seluruh bagian tanaman yang dapat meningkatkan berat kering pada tanaman (Lakitan, 2001).
Menurut Ulfa dkk. (2009), berlangsungnya metabolisme tanaman dengan baik dapat dilihat dari berat kering lebih besar yang dihasilkan oleh tanaman yang menunjukkan pertumbuhan dan perkembangan sel-sel jaringannya bertambah.
Hasil uji ANOVA pemberian Trichoderma dan S. rolfsii tidak xmemberikan xpengaruh xyang xberbeda xnyata dengan perlakuan kontrol xterhadap xberat xkering akar (Tabel 6). Hal ini kemungkinan dipengaruhi oleh faktor eksternal. Kelembaban udara yang relatif berfluktuasi, sumber makanan, ruang tumbuh untuk pertumbuhan Trichoderma spp. yang kurang menyebabkan aplikasi Trichoderma spp. kurang efisien sehingga berpengaruh terhadap tanaman (Baihaqi, 2013).
Sedangkan menurut Lestari dkk. (2007), pada xberbagai percobaan, Trichoderma spp. mampu menghasilkan tingginya pertumbuhan xperakaran dan xmelindungi tanaman xdari xpatogen xsoil xborne xmaupun xwater xborne.
Tanaman yang diberi S. rolfsii menghasilkan rerata berat kering akar terendah, hal ini dikarenakan kekurangan unsur N dan P (fosfat) dalam tanah. Menurut Lingga dan Marsono (2003) untuk dapat meningkatkan pertumbuhan tanaman khususnya batang dan daun,
diperlukan nitrogen dalam jumlah yang cukup untuk tanaman. Penyerapan unsur hara yang lebih baik merupakan peran dari akar, dimana unsur P sangat diperlukan tanaman untuk merangsang perakaran tanaman (Satria dkk., 2015).
Hasil uji ANOVA perlakuan Trichoderma spp. (perlakuan B, D, dan E) menghasilkan 64% rerata berat polong lebih tinggi xdibandingkan xdengan xperlakuan S. rolfsii, xtetapi xtidak xberbeda xnyata dengan xperlakuan kontrol (Tabel 7). xHal xini xdiduga xkarena Trichoderma spp. tidak dapat menginfeksi akar secara optimal, serta tanaman kedelai yang dipanen sebelum waktunya (85-90 hari) sehingga pembentukan polong dan biji belum sempurna dan mempengaruhi berat polong yang dihasilkan.
Menurut Amiroh dkk. (2020), bahwa pemberian Trichoderma spp. mampu membuat tanaman meningkatkan xproses xterbentuknya xbuah xtanaman xkedelai. Penyerapan nutrisi xyang baik mampu meningkatkan xproduksi xbuah xpada xtanaman xkedelai dan pada proses pematangan buah kelainan atau cacat dapat berkurang. Trichoderma spp. xyang diberikan dapat xmengkolonisasi rhizosfer xsehingga tingginya xbiomassa xakar dapat menghasilkan tingginya produksi tanaman (Sopialena, 2018).
Tanaman yang diberi S. rolfsii menghasilkan rerata berat polong terendah, hal ini dikarenakan tanaman kekurangan hara N. Selama fase pembungaan serta pembentukan polong, hara nitrogen sangat diperlukan tanaman kedelai agar dapat xmemperbaiki xpembentukan xbiji (xSorensen dan xPenas, 2001).
SIMPULAN DAN SARAN
Trichoderma spp. dapat
xmenghambat xpertumbuhan S. rolfsii xsecara xin xvitro xdengan xpersentase xdaya xhambat xsebesar 55,56%. Serta dapat xmenekan xpertumbuhan S. xrolfsii xsecara xin vivo pada tanaman kedelai dengan persentase tingkat kerusakan sebesar 40% pada perlakuan D (Trichoderma 15 g) dan E (Trichoderma 20 g). Dosis Trichoderma spp. 20 g
optimal menekan intensitas serangan penyakit pada tanaman kedelai dilihat dari tingginya rata-rata berat polong yang dihasilkan.
Saran yang dapat diberikan untuk penelitian selanjutnya adalah untuk melanjutkan penelitian ini sehingga memperoleh dosis Trichoderma yang optimal sebagai pengendali hayati dan juga mampu meningkatkan produksi tanaman kedelai.
DAFTAR PUSTAKA
Aldillah, R. 2015. Proyeksi Produksi dan Konsumsi Kedelai Indonesia. Pusat Analisis Sosial Ekonomi Dan Kebijakan Pertanian, Kementrian Pertanian Republik Indonesia ABSTRAK. 8(1) : 9
239–23.
Agung, IG.A. A., Sukerta, IM., Raka, D. N. dan Tariningsih, D. 2016. Kedelai Lokal Bali, Bahan Baku Tempe Tinggi Nutrisi, Antioksidan Dan Organoleptik Serta Berkhasiat Obat. Agrimeta. 6(12): 87–92.
Amiroh, A., Aminuddin, M. I. dan Ardiansah, R. 2020. Respon Pemberian Macam Dosis Dan
Interval Waktu Apliksasi
Trichoderma sp. Terhadap
Produksi Tanaman Kedelai
(Glycine max L.). AGRORADIX: Jurnal Ilmu Pertanian, 4(1): 6–14.
Baihaqi, A., Nawawi, M. dan Abadi, A.L.
2013. Teknik Aplikasi
Trichoderma sp. Terhadap Pertumbuhan dan Hasil Tanaman Kentang (Solanum tuberosum L.). Jurnal Produksi Tanaman. 1(3): 31-39.
Balai Penelitian Tanaman Aneka Kacang dan Umbi (BALITKABI). Penyakit Busuk Batang
Sclerotium rolfsii pada Tanaman Aneka Kacang.
http://balitkabi.litbang.pertanian.g o.id/infotek/penyakit-busuk-batang-sclerotium-rolfsii-pada-tanaman-aneka-kacang/. Diakses pada tanggal 28 Desember 2020.
Castro, O. R.H. A., Cornejo, C, L., Rodriguez, M., and J. Bucio. L. 2009. The Role Of Microbial Signals In Plant Growth Ang Development. Plant signaling and Behavior. 4(8): 701 – 712.
Chamzurni, T., Sriwati, R. dan Selian, R.D. 2011. Efektivitas Dosis Dan Waktu Aplikasi Trichoderma virens Terhadap Serangan Sclerotium rolfsii Pada Kedelai. J. Floratek. 6(1): 62-73.
Dendang, B., dan Hani, A. 2014. Efektivitas Trichoderma spp. dan Pupuk Kompos Terhadap Pertumbuhan Bibit Sengon (Falcataria mollucana). Jurnal Penelitian Agroforestry. 2(1): 13– 19.
Dinas Pertanian dan Ketahanan Pangan Provinsi Bali. 2021. Kinerja Produksi Kedelai Provinsi Bali 2016-2020.
https://distanpangan.baliprov.go.i d/kinerja-produksi-kedelai-provinsi-bali-2016-2020/. Diakses pada tanggal 31 Desember 2021.
Hakim, N., Nyapka, M. Y., Lubis, A.M., Nugroho, S. G., Diha, M.A., Hong, G.B. and Bailey, A.A. 1986. Dasar-dasar Ilmu Tanah. Universitas Lampung. Bandar Lampung. 488 hal.
Hasari, S.A., Temaja, IG.R.M. Sudiarta, IP. dan Wirya, G.N.A.S. 2018. Efektivitas Trichoderma sp. yang Ditambahkan pada Kompos Daun untuk Pengendalian Penyakit Layu Fusarium pada Tanaman Stroberi (Fragaria sp.) di Desa Pancasari Kabupaten Buleleng. E-jurnal Agroekoteknologi
Tropika.7(3): 437-446.
Herlina, L. dan Dewi. 2010. Penggunaan Kompos Aktif Trichoderma
Harzianum dalam Meningkatkan
Pertumbuhan Tanaman Cabai. Sainteknol: Jurnal Sains dan
Teknologi. 8(2): 11-25.
Lakitan, B. 2001. Dasar-dasar Fisiologi Tumbuhan. Rajawali Press. Jakarta.
Lestari, P., Susilowati, D.N. dan Riyanti, E.I. 2007. Pengaruh Hormon Asam Indol Asetat yang Dihasilkan oleh Azospirillum sp. Terhadap Perkembangan Akar Padi. Jurnal AgroBiogen. 3(2): 66 – 71.
Lingga, P. dan Marsono. 2003. Petunjuk Penggunaan Pupuk. Penebar Swadaya. Jakarta Timur.
Mulyani, R.B., Melhanah. dan Radityo. 2011. Aplikasi Trichoderma Isolat Plk-1 dan Waktu Inkubasi Pupuk Kandang Ayam di Tanah Gambut Untuk Pengendalian Penyakit Busuk Pangkal Batang Jagung Manis. Jurnal Agri Peat. 18 Juni 2011.
Nurzannah, S.E., Lisnawati. dan Bakti, D. 2014. Potensi Jamur Endofit Asal Cabai Sebagai Agens Hayati
untuk Mengendalikan Layu Fusarium (Fusarium oxysporum) pada Cabai dan Interaksinya. Jurnal Online Agroekoteknologi. 2(3): 1230-1238.
Notarianto, R dan Lerdi, L. 2017. Pengaruh Aplikasi Trichoderma sp. Terhadap Serangan Layu (Sclerotium rolfsii) pada Kacang Tanah (Arachis hypogen L.).
Jurnal Ilmiah Respati. 8(1).
Pusat Penelitian dan Pengembangan Perkebunan. 2014. Pengendalian Penyakit Jamur Akar Putih (JAP) pada Pembibitan Karet dengan Trichoderma sp.
http://Perkebunan.litbang.pertania n.go.id. Diakses pada tanggal 20 Oktober 2021.
Sari, R. dan Prayudyaningsih, R. 2015. Rhizobium: Pemanfaatannya
Sebagai Bakteri Penambat Nitrogen. Info Teknis EBONI. 12(1): 51-64.
Satria, N., Wardati. dan Khoiri, M.A. 2015. Pengaruh Pemberian Kompos Tandan Kosong Kelapa
Sawit dan Pupuk NPK Terhadap Pertumbuhan Bibit Tanaman Gaharu (Aquilaria malaccencis). JOM Faperta. 2(1).
Semangun, H. 2007. Penyakit-Penyakit Tanaman Hortikultura di Indonesia Edisi II. Gadjah Mada University Press. Yogyakarta.
Singh, P.K. and Kumar, V. 2011. Biological Control of Fusarium Wilt of Chrysanthemum with Trichoderma and Botanicals. Journal Agric Tech. 7(6): 16031613.
Sopialena. 2018. Pengaruh Pemberian Trichoderma sp. Pada Tanaman Tomat Terhadap Faktor-Faktor Produksi. Jurnal AGRIFOR. 17(2): 345-354.
Sorensen, R.C. and Penas, E.J. 2001. Nitrogen Fertilization of Soybean. Agr, Jour. 70: 213 – 216.
Sudantha, I. M. 2010. Pengujian Beberapa Jenis Jamur Endofit dan Saprofit Trichoderma spp. terhadap Penyakit Layu Fusarium pada Tanaman Kedelai. Jurnal Agroteksos. 20(2): 90-102.
Syahnen., Sirait, D.D.N., dan Pinem,S.E. 2014. Teknik Uji Mutu Agens Pengendali Hayati (ABK) di Laboratorium. Balai Besar
Perbenihan dan Proteksi Tanaman Perkebunan (BBPPTP) Medan.
Ulfa, M., Waluyo, E. A. dan Martin, E. 2009. Pengaruh Inokulasi Fungi Mikoriza Arbuskula Glomus clorum, Glomus etunicatum, dan Gigaspora sp. Terhadap Pertumbuhan Semai Mahoni dan Seru. Jurnal Penelitian Hutan Tanaman. 6(5): 273-280.
Vagiri, M., Johansson, E. and Rumpunen, K. 2017. Phenolic Compounds In Black Currant Leaves – An Interaction Between The Plant And Foliar Diseases. Journal of Plant Interaction. 1(12): 193-199.
DOI: https://doi.org/10.24843/JSIMBIOSIS.2022.v10.i02.p07
211
Discussion and feedback