EFFECT OF VITAMIN C ON THE BLOOD PROFILE OF MALE RATS (Rattus norvegicus) INDUCED BY SODIUM NITRITE (NaNO2)
on
SIMBIOSIS X (2): 186-198 http://ojs.unud.ac.id/index.php/simbiosis
Program Studi Biologi FMIPA UNUD
eISSN: 2656-7784
September 2022
PENGARUH VITAMIN C PADA PROFIL DARAH TIKUS (Rattus norvegicus) JANTAN YANG DIINDUKSI NATRIUM NITRIT (NaNO2)
EFFECT OF VITAMIN C ON THE BLOOD PROFILE OF MALE RATS (Rattus norvegicus) INDUCED BY SODIUM NITRITE (NaNO2)
Galih Anindita Kusumatjahja1, Inna Narayani1, I Made Sara Wijana1 1Program Studi Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana, Bukit Jimbaran, Bali, Indonesia - 80361 Email korespodensi: ganinditaktj@gmail.com
ABSTRAK
Natrium nitrit (NaNO2) merupakan bahan kimia yang sering digunakan dalam industri pangan. NaNO2 banyak digunakan untuk pengawet bahan makanan, umumnya pada produk-produk olahan daging. Namun, NaNO2 dapat menyebabkan kondisi anemia dengan menganggu proses pengangkutan oksigen (O2) dalam darah. Efek NaNO2 dapat ditanggulangi dengan penggunaan vitamin C. Penelitian ini bertujuan untuk mengetahui pengaruh vitamin C terhadap profil darah tikus yang diinduksi natrium nitrit, serta dosis yang efektif untuk memperbaiki profil darah tikus. Penelitian menggunakan Rancangan Acak Lengkap (RAL) yang terdiri dari empat perlakuan yaitu K- (Aquades); K+ (NaNO2 37,5mg/kgBB); C1 (NaNO2 37,5mg/kgBB + vitamin C 1,8mg/ekor/hari); C2 (NaNO2 37,5mg/gBB + vitamin C 3,6mg/ekor/hari). Sampel yang digunakan pada setiap kelompok perlakuan sebanyak 6 ekor, sehingga total sampel yang digunakan berjumlah 24 ekor tikus putih (Rattus norvegicus) jantan galur Wistar. Larutan NaNO2 dan vitamin C diberikan secara oral dengan metode gavage. Larutan NaNO2 diberikan hingga hari ke-35, kemudian larutan vitamin C diberikan pada hari ke-22 hingga hari ke-35. Sampel darah tikus diambil tiga kali, yaitu sehari sebelum pemberian NaNO2, pada hari ke-21 setelah pemberian perlakuan NaNO2 dan pada hari ke-36, untuk selanjutnya dilakukan analisis darah menggunakan haematology analyzer dan pembuatan apusan darah menggunakan pewarnaan Giemsa. Analisis statistik dengan ANOVA dan uji Duncan. Hasil penelitian menunjukkan bahwa vitamin C dapat memperbaiki profil darah, dengan kadar vitamin C paling efektif adalah 1,8 mg/ekor/hari.
Kata Kunci: natrium nitrit, profil darah, vitamin C
ABSTRACT
Sodium nitrite (NaNO2) is a chemical compound that is often used in food industry. NaNO2 widely used for food preservatives, mainly in processed meat products. However, NaNO2 could cause anemia by interfering with the process of transporting oxygen in the blood. The effects of NaNO2 could be repaired with the use of vitamin C. This study was aimed to determine the effect of vitamin C on the blood profile of rats induced by NaNO2, and the effective dose to improve the blood profile of rats. The study used a completely randomized design (CRD) with 4 groups, namely K- (Aquades); K+ (NaNO2 37,5mg/kgBW); C1 (NaNO2 37,5 mg/kgBW + vitamin C 1,8 mg/animal/day); C2 (NaNO2 37,5 mg/kgBW + vitamin C 3,6 mg/animal/day). The samples used in each treatment group were 6 rats, therefore the total sample used was 24 male white rats (Rattus norvegicus) strain Wistar. NaNO2 and vitamin C solutions were administered orally by the gavage method. NaNO2 solution was given until 35th day, then vitamin C solution was given on 22nd to 35th day. Blood samples were taken three times, the day before the administration of NaNO2, on the 21st day, and on the 36th day, further analysis of blood used a haematology analyzer and blood smears preparations Giemsa staining. Data were statistical analyzed by ANOVA and
continued with Duncan's test. The results showed that Vitamin C can improve the blood profile, with the most effective dose of vitamin C is 1,8 mg/animal/day.
Keyword: sodium nitrite, blood profile, vitamin C
PENDAHULUAN
NaNO2 merupakan bahan yang sering digunakan dalam makanan olahan. Namun, penggunaan NaNO2 dapat menimbulkan bahaya pada tubuh. Lemahnya pengawasan serta ketidaktahuan masyarakat akan bahaya tersebut kerap dimanfaatkan oleh produsen. Natrium nitrit banyak digunakan dalam industri makanan sebagai pengawet dan fiksatif warna produk ikan dan daging. Natrium nitrit juga berfungsi sebagai bahan pengawet antara lain karena mampu mencegah oksidasi lemak, juga menghambat pertumbuhan mikroorganisme penyebab botulisme yaitu Clostridium botulinum (Ansari et al., 2017). Batasan maksimal yang ditetapkan Badan Pengawasan Obat dan Makanan RI (2019) untuk penambahan natrium nitrit pada olahan daging adalah 30 mg/kg.
Terserapnya nitrit ke dalam tubuh dapat mempengaruhi pengangkutan oksigen oleh eritrosit, yang akan menimbulkan sakit kepala, sulit bernapas, radang ginjal, muntah, hingga anemia (Widyastuti, 2013). Paparan akut nitrit dapat menyebabkan kematian, terutama karena methemoglobinemia. Paparan kronis nitrit dapat menyebabkan kelainan saat lahir, penyakit saluran pernapasan, kerusakan sistem saraf dan kelumpuhan. Paparan nitrit yang berlangsung dalam waktu lama juga dapat menyebabkan karsinogenisitas dan mutagenisitas (Gui et al., 2016; Zhou et al., 2016). Keracunan natrium nitrit yang sering terjadi yaitu menurunnya kemampuan hemoglobin (Hb) dalam mengikat oksigen dan meningkatnya pembentukan reactive oxygen species
(ROS) yang dapat mengubah jumlah eritrosit dan kadar Hb (Ansari et al., 2017). Antioksidan yang memiliki potensi menanggulangi efek natrium nitrit adalah asam askorbat/vitamin C. Asam askorbat dapat menurunkan methemoglobin secara langsung dan terbukti dapat mengobati sianosis secara efektif (Qasim, 2020).
Oleh sebab itu, perlu dilakukan penelitian mengenai efektivitas vitamin C pada hematologi tikus yang diinduksi NaNO2 dengan mengamati kadar hemoglobin, jumlah eritrosit, jumlah leukosit, serta diferensial leukosit.
MATERI DAN METODE
Penelitian dilaksanakan dari bulan Juli hingga Agustus 2021. Pemeliharaan dan pemberian perlakuan hewan coba dilakukan di ruang pemeliharaan hewan coba Program Studi Biologi FMIPA. Pembedahan dan pengambilan sampel darah tikus dilakukan di Laboratorium Struktur Hewan Program Studi Biologi FMIPA Universitas Udayana. Analisis darah tikus dilakukan di Laboratorium Hematologi Balai Besar Veteriner Denpasar.
Hewan coba yang digunakan adalah tikus (Rattus norvegicus) jantan galur Wistar seberat 200 gram. Tikus dibagi secara acak dan dimasukkan ke dalam empat buah kandang berupa bak plastik yang ditutup dengan anyaman kawat. Tikus diberi pakan berupa pelet ayam BRS3 593 dan diberi air ledeng secara ad libitum sebagai air minum.
Rancangan Penelitian
Penelitian ini adalah penelitian eksperimental dengan Rancangan Acak
Lengkap (RAL). Penelitian terdiri atas empat perlakuan, yaitu diinduksi natrium nitrit (NaNO2) dengan dosis 37,5 mg/kgBB (kontrol positif/ K+), hanya diberi aquades (kontrol negatif/ K-), dan dua perlakuan yang diinduksi natrium nitrit (NaNO2) dosis 37,5 mg/kgBB serta diberikan vitamin C. Dosis vitamin C yang diberikan pada perlakuan pertama (C1) sebesar 100 mg/ekor/hari dan perlakuan kedua (C2) sebesar 200 mg/ekor/hari.
Pembuatan larutan natrium nitrit (NaNO2)
Serbuk natrium nitrit (NaNO2) dilarutkan dengan akuades. Larutan stok natrium nitrit dibuat baru setiap harinya dengan cara 150 mg serbuk NaNO2 dilarutkan dalam 20 mL akuades.
Pembuatan larutan vitamin C
Larutan vitamin C berbentuk serbuk asam askorbat dilarutkan dalam akuades. Dosis vitamin C yang digunakan adalah 100mg/hari dan 200mg/hari (Paunović et al., 2016; Hassan et al., 2018), yang kemudian dikalikan dengan faktor konversi dari manusia seberat 70 kg ke tikus seberat 200g yaitu 0,018 (Laurence dan Bacharach, 1964). Larutan vitamin C dibuat setiap hari dengan dosis untuk tikus setelah konversi masing-masing adalah sebesar 0,018 x 100 mg = 1,8 mg/hari dan 0,018 x 200 mg = 3,6 mg/hari.
Perlakuan pada hewan coba
Tikus diaklimatisasi selama 7 hari terlebih dahulu. Larutan NaNO2 dan vitamin C diberikan sebanyak 1 mL/ekor. Larutan NaNO2 dan vitamin C diberikan secara oral dengan metode gavage. Larutan NaNO2 diberikan pada kelompok perlakuan K+, C1, dan C2 hingga hari ke-35 setelah pengambilan darah pertama (PD I), pengambilan sampel darah kedua (PD II)
diambil pada hari ke-21. Larutan vitamin C diberikan pada kelompok perlakuan C1 dan C2 pada hari ke-22 (setelah pengambilan darah kedua (PD II)) hingga hari ke-35. Sampel darah dilakukan dengan cara tikus dibius terlebih dahulu dengan ketamin dosis 40 mg/kgBB dan xylazine dosis 5 mg/kgBB. Koleksi sampel darah diambil melalui sinus orbitalis. Sampel darah kemudian dimasukkan ke dalam tabung EDTA serta diberi label untuk identifikasi sampel dan selanjutnya dilakukan analisis darah.
Pemeriksaan hematologi
Pemeriksaan hematologi dilakukan menggunakan hematology analyzer Rayto RT-7600®. Darah dihitung dan diukur dengan variasi impedansi dalam aliran listrik atau sinar ke sel yang lewat oleh hematology analyzer dengan prinsip kerja flow cytometer. Setiap sampel dibuatkan ID pada hematology analyzer. Tabung EDTA kemudian ditempatkan di bawah kolom untuk meletakkan tabung EDTA. Tombol ‘open’ kemudian ditekan sehingga jarum penghisap keluar dan darah dalam tabung EDTA dihisap jarum untuk dibawa masuk ke dalam alat. Tombol ‘aspirate’ ditekan dan ditunggu hingga hasil keluar. Langkah-langkah tersebut diulang pada setiap tabung EDTA berisi sampel darah.
Pemeriksaan diferensial leukosit
Darah diambil dari tabung EDTA dan diteteskan pada kaca objek, kemudian diulas sepanjang permukaan kaca objek. Apusan darah selanjutnya dikeringkan. Preparat yang telah kering difiksasi dengan metanol selama 3 menit, lalu dikeringkan. Preparat direndam selama 30 menit dalam pewarna Giemsa. Setelah pewarnaan, preparat dibilas dengan air mengalir dan dikeringkan dalam posisi berdiri pada salah satu ujungnya di atas papan pengering.
Preparat apusan darah diamati dengan mikroskop yang terhubung dengan optilab. Pengamatan dilakukan pada lima bidang pandang. Dihitung jumlah diferensial leukosit yang ditemukan.
Metode Pengolahan Data
Data kualitatif apusan darah disajikan berbentuk gambar dan deskripsi. Data kuantitatif dianalisis menggunakan software SPSS versi 23 dengan derajat kesalahan (α) sebesar 5%. Data terdistribusi normal dianalisis dengan One way ANOVA dan dilanjutkan dengan uji post-hoc Duncan jika berbeda nyata (P < 0,05).
HASIL
Kadar hemoglobin
Hasil kadar hemoglobin pada tiga kali pengambilan darah menunjukkan bahwa pada pengambilan darah pertama sebelum induksi NaNO2 (PD I) dan pengambilan darah kedua setelah induksi NaNO2 (PD II) tidak ada perbedaan nyata antara perlakuan kontrol negatif (K-) dengan kontrol positif (K+), C1, dan C2 (P>0,05), sedangkan pada pengambilan darah ketiga setelah pemberian vitamin C (PD III) menunjukkan adanya perbedaan nyata antara perlakuan K+ dengan K-, C1, dan C2 (P<0,05). Hasil uji Duncan pada kadar hemoglobin PD III menunjukkan adanya perbedaan nyata K+ dengan K-, C1, dan C2 (Tabel 1).
|
Tabel 1. Rerata kadar hemoglobin tikus | |
|
Perlakuan |
Kadar Hemoglobin (g/dL) PD I PD II PD III |
|
K-K+ C1 C2 |
10,76 ± 0,83 a 11,36 ± 0,86 a 11,7 ± 1,16 b 10,60 ± 1,54 a 9,83 ± 2,19 a 9,41 ± 0,85 a 10,96 ± 0,60 a 10,60 ± 0,52 a 11,15 ± 0,80 b 11,43 ± 0,75 a 10,01 ± 1,80 a 11,48 ± 0,27 b |
Keterangan: huruf yang berbeda pada kolom yang sama menunjukkan adanya perbedaan yang nyata pada uji Duncan (P<0,05); PD I= Pengambilan darah pertama; PD II= pengambilan darah kedua; PD III= pengambilan darah ketiga
Jumlah total eritrosit
Hasil uji statistik menggunakan ANOVA terhadap jumlah eritrosit pada tiga kali pengambilan darah menunjukkan bahwa pada pengambilan darah I tidak ada perbedaan nyata di seluruh perlakuan (K+, K-, C1, C2) (P>0,05), sedangkan pada pengambilan darah (PD) II dan III
menunjukkan adanya perbedaan nyata antara perlakuan K+ dengan perlakuan K-, C1, dan C2 (P<0,05). Hasil uji Duncan jumlah total eritrosit pada PD II dan III menunjukkan perbedaan nyata antara perlakuan K+ dan C2 dengan perlakuan K-dan C1 (Tabel 2).
|
Tabel 2. Rerata jumlah total eritrosit tikus | ||
|
Perlakuan |
Jumlah Eritrosit (x106/mm3) | |
|
PD I PD II |
PD III | |
|
K- |
5,26 ± 0,28 a 5,30 ± 0,43 ab |
5,81 ± 0,71 ab |
|
K+ |
5,15 ± 0,88 a 5,06 ± 0,65 a |
4,90 ± 0,49 a |
|
C1 |
5,28 ± 0,73 a 6,28 ± 1,45 b |
6,74 ± 1,65 b |
|
C2 |
5,45 ± 0,36 a 4,57 ± 0,97 a |
5,37 ± 0,18 a |
Keterangan: huruf yang berbeda pada kolom yang sama menunjukkan adanya perbedaan yang nyata pada uji Duncan (P<0,05); PD I= Pengambilan darah pertama; PD II= pengambilan darah kedua; PD III= pengambilan darah ketiga.
Jumlah leukosit
Hasil uji statistik menggunakan ANOVA terhadap jumlah leukosit pada tiga kali pengambilan darah menunjukkan bahwa pada pengambilan darah I tidak ada perbedaan nyata di seluruh perlakuan (K+, K-, C1, C2) (P>0,05). Hasil uji ANOVA pada pengambilan darah (PD) II dan III menunjukkan berbeda nyata antara perlakuan C2 dengan seluruh perlakuan dan
antara perlakuan K+ dengan seluruh perlakuan (P<0,05). Hasil uji Duncan pada PD II menunjukkan adanya berbeda nyata antara perlakuan C2 dengan perlakuan lainnya (K+, K-, C1). Hasil uji Duncan pada PD III menunjukkan bahwa ada perbedaan nyata antara perlakuan K+ dengan perlakuan lainnya (K-, C1, C2) (Tabel 3).
|
Tabel 3. Rerata jumlah total leukosit tikus | ||
|
Perlakuan |
Jumlah Leukosit (x103/mm3) | |
|
PD I PD II |
PD III | |
|
K- |
10,12 ± 1,38 a 9,77 ± 2,36 b |
9,70 ± 1,81 b |
|
K+ |
8,88 ± 5,73 a 9,13 ± 2,32 b |
6,42 ± 1,18 a |
|
C1 |
7,95 ± 2,13 a 8,18 ± 1,40 b |
9,72 ± 2,82 b |
|
C2 |
8,92 ± 3,17 a 5,48 ± 2,39 a |
9,87 ± 2,82 b |
Keterangan: huruf yang berbeda pada kolom yang sama menunjukkan adanya perbedaan yang nyata pada uji Duncan (P<0,05); PD I= Pengambilan darah pertama; PD II= pengambilan darah kedua; PD III= pengambilan darah ketiga
Tabel 4. Total diferensial leukosit tikus
|
Diferensial Leukosit |
Perlakuan |
Pengambilan Darah (%) | ||
|
I |
II |
III | ||
|
K- |
22,00 ± 7,32 c |
13,67 ± 3,27 a |
12,83 ± 2,14 a | |
|
Monosit |
K+ |
16,50 ± 6,12 bc |
14,17 ± 5,64 a |
18,33 ± 5,35 a |
|
C1 |
7,83 ± 3,13 a |
14,50 ± 3,39 a |
16,00 ± 5,69 a | |
|
C2 |
13,83 ± 5,78 ab |
11,50 ± 4,32 a |
16,17 ± 4,40 a | |
|
K- |
64,50 ± 6,22 c |
58,17 ± 3,49 b |
54,17 ± 6,76 b | |
|
Limfosit |
K+ |
44,17 ± 6,91 a |
36,50 ± 21,33 a |
41,50 ± 7,20 a |
|
C1 |
58,33 ± 15,67 bc |
51,17 ± 12,33 ab |
44,50 ± 12,05 ab | |
|
C2 |
50,17 ± 7,33 ab |
46,17 ± 6,37 ab |
53,50 ± 6,31 b | |
|
K- |
14,67 ± 2,66 a |
25,33 ± 4,46 a |
28,67 ± 6,56 a | |
|
Neutrofil |
K+ |
36,17 ± 8,45 b |
38,83 ± 11,18 b |
36,83 ± 10,74 a |
|
C1 |
28,83 ± 14,29 b |
29,83 ± 8,54 ab |
35,33 ± 14,26 a | |
|
C2 |
32,00 ± 12,82 b |
39,67 ± 7,55 b |
25,50 ± 7,89 a | |
|
K- |
4,67 ± 6,22 a |
2,83 ± 2,32 a |
4,33 ± 4,03 a | |
|
Eosinofil |
K+ |
3,17 ± 3,31 a |
4,50 ± 2,17 a |
5,00 ± 3,35 a |
|
C1 |
5,00 ± 4,60 a |
4,50 ± 4,93 a |
4,17 ± 2,23 a | |
|
C2 |
4,00 ± 1,67 a |
2,67 ± 1,37 a |
4,83 ± 3,97 a | |
Keterangan: huruf yang berbeda pada kolom yang sama menunjukkan adanya perbedaan yang nyata pada uji Duncan (P<0,05)
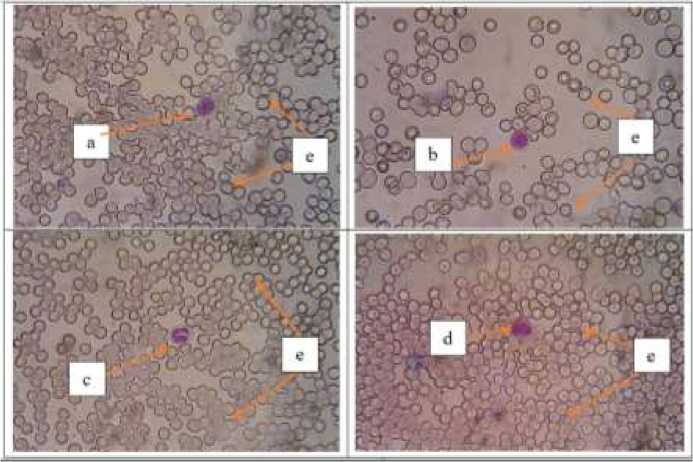
Gambar 1. Gambaran ulas darah tikus masing-masing perlakuan (Giemsa, 400X). Keterangan: (a) monosit; (b) limfosit, (c) neutrofil, (d) eosinofil, (e) eritrosit
Persentase total monosit
Hasil uji statistik menggunakan ANOVA terhadap persentase total monosit pada tiga kali pengambilan darah menunjukkan bahwa pada pengambilan darah (PD) I terdapat perbedaan yang nyata antara C1 dengan perlakuan lain (K-, K+, C2) (P<0,05), sedangkan pada PD II dan III tidak ada perbedaan nyata antar seluruh perlakuan (K-, K+, C1, C2) (P>0,05). Hasil uji Duncan yang dilakukan pada persentase total monosit pada PD I menunjukkan bahwa terdapat perbedaan nyata antara C1 dengan perlakuan C2 dan K+, serta C1 dengan perlakuan K- (Tabel 4).
Persentase total limfosit
Hasil uji statistik menggunakan ANOVA terhadap persentase total limfosit pada tiga kali pengambilan darah menunjukkan bahwa pada pengambilan darah (PD) I, II, dan III terdapat perbedaan yang nyata antara K+ dengan perlakuan lain (K-, C1, C2) (P<0,05). Hasil uji lanjut Duncan yang dilakukan pada persentase total limfosit pada PD I dan II menunjukkan bahwa terdapat perbedaan nyata antara perlakuan K+ dengan C2 dan
C1, serta K+ dengan K-. Hasil uji Duncan yang dilakukan pada persentase total limfosit pada PD III menunjukkan perbedaan nyata antara perlakuan K+ dengan C1, serta K+ dengan K- dan C2 (Tabel 4).
Persentase total neutrofil
Hasil uji statistik menggunakan ANOVA terhadap persentase total neutrofil pada tiga kali pengambilan darah menunjukkan bahwa pada pengambilan darah (PD) I dan II terdapat perbedaan nyata antara perlakuan K- dengan perlakuan lainnya (K+, C1, C2), sedangkan pada PD III menunjukkan tidak adanya perbedaan nyata antar seluruh perlakuan (K-, K+, C1, C2) (P>0,05). Hasil uji lanjut Duncan yang dilakukan pada persentase total neutrofil pada PD I menunjukkan bahwa adanya perbedaan yang nyata antara perlakuan K- dengan perlakuan lainnya (K+, C1, C2). Hasil uji lanjut Duncan yang dilakukan pada persentase total neutrofil pada PD II menunjukkan adanya perbedaan yang nyata antara perlakuan K- dengan C1, serta K- dengan K+ dan C2 (Tabel 4).
Persentase total eosinofil
Hasil uji statistik menggunakan ANOVA terhadap persentase total eosinofil pada tiga kali pengambilan darah menunjukkan bahwa pada pengambilan darah (PD) I, II, dan III tidak adanya perbedaan yang nyata antar seluruh
PEMBAHASAN
Hasil parameter hematologis tikus sebelum induksi NaNO2 menunjukkan bahwa tikus telah mengalami anemia sebelum induksi NaNO2 dan setelah diinduksi NaNO2 kadar hemoglobin menunjukkan adanya tren penurunan (Tabel 1). NaNO2 dapat merangsang terjadinya oksidasi ion Fe2+ menjadi Fe3+, yang berperan dalam pembentukan methemoglobin serta berbagai ROS (Reactive Oxygen Spesies) (Fouad et al., 2017). Badar et al. (2019), bahwa hilangnya elektron akibat oksidasi menyebabkan methemoglobin tidak dapat berikatan dengan oksigen, sehingga tidak mampu mengangkut oksigen ke jaringan tubuh.
Menurut Aiba dkk. (2016), kadar hemoglobin normal pada tikus berkisar antara 11,6-16,1 g/dL, maka rerata kadar hemoglobin dari pengambilan darah pertama sebelum induksi NaNO2 (PD I) berada sedikit di bawah kadar normal hemoglobin yang mengindikasi bahwa tikus berada dalam kondisi anemia (Tabel 1). Kondisi tersebut dapat disebabkan karena beberapa faktor dapat mempengaruhi kondisi fisiologis tikus, seperti kurangnya asupan protein. Salah satu peran protein adalah sebagai media transportasi vitamin dan mineral (Sari dkk., 2016).
Kadar hemoglobin setelah induksi NaNO2 (PD II) menunjukkan terdapat tren penurunan dibandingkan PD I dan semakin
perlakuan (K-, K+, C1, C2) (P>0,05). Hasil uji Duncan yang dilakukan pada persentase total eosinofil pada PD I, II, maupun III menunjukkan tidak adanya perbedaan yang nyata antar seluruh perlakuan (K-, K+, C1, C2) (Tabel 4).
di bawah batas normal (Tabel 1). Hasil tersebut menunjukkan bahwa induksi NaNO2 pada penilitian ini belum menurunkan kadar hemoglobin secara signifikan yang dijelaskan Suudah dkk. (2015), bahwa NaNO2 membutuhkan waktu relatif lama untuk menunjukkan efeknya.
Hasil yang ditunjukkan pada pengambilan darah ketiga (PD III) menunjukkan perbedaan nyata antara perlakuan K+ serta adanya tren peningkatan kadar hemoglobin meskipun belum mencapai batas normal (Tabel 1). Hal ini menunjukkan bahwa vitamin C dapat meningkatkan kadar hemoglobin, dengan cara melindungi pembentukan hemoglobin yang baru, setelah rusak akibat induksi NaNO2. Sultana et al. (2016) menyatakan bahwa vitamin C mempertahankan besi (Fe) dalam bentuk besi yang dibutuhkan untuk penggabungan ke dalam bagian heme.
Jumlah eritrosit total (RBC) tikus normal berkisar antara 7,2x106-9,6x106/mm3 (Widyastuti, 2013). Jumlah total eritrosit PD I berada di bawah jumlah normal (Tabel 2). Kondisi ini dapat disebabkan karena pada penelitian ini, populasi tikus diambil dari tempat yang berbeda. Menurut Ihedioha et al. (2012), nilai hematologis dapat dipengaruhi oleh letak geografis, meliputi suhu, kelembapan, iklim, serta pencahayaan.
Hasil analisis darah PD II menunjukkan terjadi tren penurunan jumlah total eritrosit
dan berada di bawah batas normal (Tabel 2). Hal ini menunjukkan bahwa jumlah eritrosit semakin menurun setelah induksi NaNO2. Penurunan jumlah eritrosit disebabkan karena terbentuknya radikal bebas akibat oksidasi ion besi (Fe2+) oleh NaNO2 yang membentuk methemoglobin dan reactive oxygen species (ROS). ROS menyebabkan membran eritrosit mengalami stres oksidatif (Ambarwati, 2012). Stres oksidatif kemudian menyebabkan lisisnya membran eritrosit, yang merupakan hasil antara reaksi lipid peroksida dengan gugus sulfhidril yang berasal dari lemak dan protein membran eritrosit (Suparmi et al., 2016).
Tren peningkatan jumlah eritrosit total terjadi pada PD III (Tabel 2). Hal ini menunjukkan bahwa vitamin C mencegah eritrosit dari paparan NaNO2 serta mencegah kerusakan pada eritrosit yang baru. Muslim dkk. (2019) menjelaskan, vitamin C sebagai antioksidan bekerja menurunkan fragilitas membran eritrosit dengan cara mendonorkan elektron pada senyawa radikal bebas, sehingga menghadang peroksidasi dengan membran eritrosit. Penelitian oleh Maulidiyah (2018) menunjukkan bahwa vitamin C dapat mencegah penurunan aktivitas enzim katalase, yang berperan sebagai antioksidan endogen (alami). Sementara peningkatan jumlah eritrosit perlakuan C1 (PD II) dan K- (PD II dan III) dapat disebabkan karena proses eritropoesis (Gluhchevaa et al., 2012), serta faktor ketersediaan protein (Lin et al., 2013).
Jumlah leukosit normal pada tikus berkisar antara 8x103–11,8x103/mm3 (Lindstrom et al., 2015). Rerata jumlah leukosit total (WBC) untuk seluruh perlakuan berada pada batas normal. Hal ini menunjukkan bahwa tidak adanya infeksi dalam tubuh tikus setelah induksi
NaNO2 dan setelah pemberian vitamin C (Tabel 4). Menurut van Gerven et al. (2021), jumlah total leukosit merupakan parameter indikasi adanya infeksi.
Jumlah leukosit total pada PD II menunjukkan adanya tren peningkatan pada perlakuan K+ dan C1 dibandingkan dengan perlakuan K-, meskipun masih berada dalam kisaran normal (Tabel 3). Maka, pada penelitian ini, peningkatan leukosit terjadi karena adanya usaha tubuh terhadap induksi NaNO2 dengan mengaktifkan fungsi leukosit sebagai sistem imun tubuh. Menurut Abdel-Baky (2019), bahwa peningkatan jumlah leukosit berhubungan dengan aktifnya sistem imun tubuh. Gluhcheva a et al. (2012) menambahkan, bahwa kondisi peningkatan jumlah leukosit yang kurang signifikan dapat disebabkan kurang lamanya periode perlakuan sehingga tubuh masih bisa mentoleransi akumulasi NaNO2, yang ditunjukkan pada penelitian ini bahwa 20 hari pemberian NaNO2 belum cukup lama untuk meningkatkan jumlah leukosit sebagai tanda terganggunya sistem imun tubuh.
Setelah diberikan vitamin C (PD III), perlakuan C1 dan C2 menunjukkan tren peningkatan, meskipun masih berada pada batas normal (Tabel 3). Menurut Mitmesser et al. (2016), fungsi utama vitamin C dalam sistem imun (termasuk fagositosis leukosit) adalah untuk melindungi dari stres oksidatif selama proses infeksi, hingga kembali normal. Hal ini mengindikasikan bahwa vitamin C dapat melindungi leukosit dari stres oksidatif sehingga dapat menjalankan fungsinya sebagai sistem imun tubuh seperti menghancurkan sel-sel yang rusak akibat NaNO2.
Aiba dkk. (2016) menyatakan, bahwa persentase total monosit normal pada tikus berkisar antara 1-6%, sehingga hasil
persentase total monosit penelitian ini berada di atas batas normal. Hasil analisis persentase total monosit PD II maupun PD III tidak menunjukkan perbedaan yang signifikan antar kelompok perlakuan, namun menunjukkan tren peningkatan setelah pemberian vitamin C (Tabel 4). Peningkatan persentase monosit hingga berada di atas batas normal menunjukkan aktifnya sistem imun tubuh, didukung oleh pernyataan Setyawati (2016), bahwa peningkatan persentase total monosit dapat terjadi sebagai bentuk perlindungan sistem imun dari radikal bebas dan menghindari terjadinya stres oksidatif. Tangkas dkk. (2021) menyebutkan, sel-sel mati ataupun benda asing yang bersifat patogen akan ditelan serta dihancurkan oleh monosit yang memiliki peran sebagai makrofag, sehingga persentase monosit yang berada di atas normal dapat disebabkan karena monosit berperan sebagai makrofag yang membersihkan sel-sel yang telah rusak akibat induksi NaNO2.
Aiba dkk. (2016) menyatakan bahwa persentase total limfosit normal pada tikus berkisar antara 60-70%. Hal ini mengindikasikan bahwa selama periode penelitian ini hasil analisis persentase total limfosit mengalami tren penurunan hingga di bawah nilai normal. Hasil juga menunjukkan bahwa setelah diinduksi NaNO2 (Tabel 4). Widyastuti (2013) menyatakan, bahwa penurunan limfosit dapat terjadi karena migrasi
limfosit yang berada dalam sistem sirkulasi menuju ke jaringan.
Setelah pemberian vitamin C (PD III), perlakuan K+ dan C2 menunjukkan tren peningkatan persentase total limfosit (Tabel 4). Menurut Aiba dkk. (2016), limfosit bertugas untuk membentuk antibodi guna melindungi tubuh dari infeksi. Menurut Nugroho (2014), vitamin C berperan dalam
eISSN: 2656-7784 September 2022 menstimulasi aktivitas antibodi dalam kinerja sistem imun.
Persentase total neutrofil pada PD II menunjukkan perbedaan nyata dengan perlakuan K-, serta menunjukkan adanya tren peningkatan persentase neutrofil, meskipun masih berada dalam rentang normal (Tabel 4), sesuai dengan pernyataan Lindstrom et al. (2015), bahwa rentang persentase total neutrofil normal tikus berkisar antara 6,2-42,6%. Peningkatan neutrofil disebabkan karena aktifnya respon imun akibat akumulasi NaNO2 (Widyastuti, 2013). Susanti (2017) menyatakan, neutrofil merupakan respon imun yang pertama muncul bahkan saat peradangan sehingga sering digunakan sebagai penanda dimulainya inflamasi. Maka, dari penelitian ini menunjukkan NaNO2 menyebabkan inflamasi sehingga terjadi peningkatan neutrofil.
Setelah pemberian vitamin C (PD II), persentase total neutrofil tidak menunjukkan perbedaan nyata antar kelompok, namun menunjukkan adanya tren peningkatan dibanding PD II (Tabel 4). Bozonet et al. (2015) menyatakan vitamin C dapat melindungi neutrofil dari stres oksidatif, sementara Ariami dkk. (2018) menambahkan, konsentrasi vitamin C 1040 kali lebih tinggi dalam sel granulosit, yang menunjukkan keaktifan transport vitamin C ke dalam sel.
Persentase total eosinofil menunjukkan bahwa antar kelompok perlakuan tidak ada perbedaan yang nyata, dan masih berada dalam rentang normal (Tabel 4), sejalan dengan pernyataan Aiba dkk. (2016) bahwa kisaran persentase eosinofil berada di antara 1-4%. Menurut Purnomo dkk. (2015), eosinofil berfungsi merespon terhadap reaksi alergi dan parasitik. Maka, rerata persentase yang eosinofil yang masih dalam batas normal pada penelitian ini
mengindikasikan bahwa tidak ada reaksi alergi maupun parasitik.
Persentase total eosinofil setelah diberikan vitamin C dosis 1,8 mg/ekor/hari (C1) menunjukkan tren penurunan meskipun tidak signifikan. Menurut Septiyan dkk. (2019), vitamin C mampu menghambat pelepasan histamin selama reaksi hipersensitivitas terhadap alergi. Suriansyah dkk. (2016), menambahkan, persentase total eosinofil bergantung dari hipersensitivitas respon imun terhadap parasit, alergi, dan tingkat peradangan. Tidak adanya reaksi alergi diperkuat dengan tidak ditemukannya basofil pada penelitian ini, berkaitan dengan fungsi basofil terhadap reaksi hipersensitivitas dan alergi (Soma dkk., 2013). Menurut Lindstrom et al. (2015), nilai normal basofil pada tikus jantan berkisar antara 00,6%.
SIMPULAN
Vitamin C dapat memperbaiki profil darah tikus yang meliputi: peningkatan kadar hemoglobin dan peningkatan jumlah total eritrosit, dan menormalkan jumlah leukosit akibat pemberian NaNO2. Dosis vitamin C yang paling efektif untuk memperbaiki profil darah pada tikus adalah dosis 1,8 mg/ekor/hari.
DAFTAR PUSTAKA
Abdel-Baky, E. S. 2019. Efficiency of Lepidium Sativum Seeds in Modulation The Alterations in Hematological Parameters Induced by Sodium Nitrite in Rats. The Egyptian Journal of Hospital Medicine. 74(2): 396-402.
Aiba, S., W. Manalu, A. Suprayogi, dan H. Maheshwari. 2016. Gambaran Nilai Hematologi Tikus Putih Betina Dara pada Pemberian Tombong
Kelapa. Acta VETERINARIA Indonesiana. 4(2): 74-81.
Ambarwati, R. 2012. Effect of Sodium Nitrite (NaNO2) to Erithrocyte and Hemoglobin Profile in White Rat (Rattus norvegicus). Folia Medica Indonesiana. 8(1): 1-5.
Ansari, F. A., S. N. Ali, H. Arif, and A. A. Khan. 2017. Acute Oral Dose of Sodium Nitrite Induces Redox Imbalance, DNA Damage,
Metabolic and Histological Changes in Rat Intestine. PLoS ONE. 12(4): 1-22.
Ariami, P., H. Suliastiningsih, dan Diarti, M. W. 2018. Profil Leukosit Tikus Putih yang Diberi Air Seduhan Kelopak Bunga Rosela Merah (Hibiscus sabdariffa). Jurnal Kesehatan Prima. 9(2): 1534-1545.
Badan Pengawas Obat dan Makanan Republik Indonesia. 2019.
Peraturan Badan Pengawas Obat dan Makanan Nomor 11 Tahun 2019 Tentang Bahan Tambahan Pangan. BPOM. Jakarta.
Badar, A., A. O. Bamosa, M. Salahuddin, and Meheithif, A. A. 2019. Effect of Zamzam Water On Blood Methemoglobin Level In Young Rats. Journal of family & community medicine. 26(1): 30.
Bozonet, S. M., A. C. Carr, J. M. Pullar, and M. Vissers. 2015. Enhanced Human Neutrophil Vitamin C Status, Chemotaxis and Oxidant Generation Following Dietary Supplementation with Vitamin C-Rich Sungold Kiwifruit. Nutrients. 7(4): 2574-2588.
Fouad, S. S., M. M. Mohi-Eldin., M. A. Haridy and A. M., Khalil. 2017. Ameliorative Effects of Ascorbic Acid (Vit. C) Against Sodium
Nitrite Toxicity in Albino Rats: Hematological, Biochemical and Histopathological Studies.
American-Eurasian Journal of Toxicological Sciences. 9(1): 1-6.
Gluhchevaa, Y., I. Ivanovb, E. Petrovaa, E. Pavlovaa, and I. Vladovaa. 2012. Sodium Nitrite-Induced
Hematological and
Hemorheological Changes in Rats. Series on Biomechanic. 27: 53-58.
Gui, G., S. Meng, L. Li, B. Liu, H. Liang, and C. Huangfu. 2016. Sodium Nitrite Enhanced The Potentials of Migration and Invasion of Human Hepatocellular Carcinoma SMMC-7721 Cells Through Induction of Mitophagy. Yao Xue Xue Bao. 51: 59-67.
Hassan, S. M., N. F. Zaglool, and S. A. El-shamy. 2018. Comparative Studies on Turmeric and Vitamin C on Sodium Nitrite treated Rats. Alexandria Journal for Veterinary Sciences. 56(1): 56-68.
Ihedioha, J. I., J. I. Ugwuja, O. A. Noel-Uneke, I. J. Udeani and G. Daniel-Igwe. 2012. Reference Values for the Haematology Profile of Conventional Grade Outbred Albino Mice (Mus musculus) in Nsuka, Eastern Nigeria. ARI. 9(2): 1601-1612.
Laurence, D. R. and A. L. Bacharach. 1964. Evaluation of Drug Activities: Pharmacometrics. Academic Press. London.
Lin C. Y., W. C. Hsiao, C.J. Huang, C. F. Kao, and G. S. Hsu. 2013. Heme Oxygenase-1 Induction by The ROS–JNK Pathway Plays A Role in Aluminum-Induced Anemia.
Journal Inorg Biochem. 1(128):
221-8.
Lindstrom, N. M., D. M. Moore, K., Zimmerman, and S. A. Smith. 2015. Hematologic Assessment in Pet Rats, Mice, Hamsters, and Gerbils: Blood Sample Collection and Blood Cell Identification. Clinics in laboratory Medicine. 355(3): 629640.
Maulidiyah, S. 2018. Pengaruh Ekstrak Kunyit Putih (Curcuma zedoaria) dan Vitamin C terhadap Kadar Katalase Tikus yang Diberikan MSG (Monosodium Glutamat). Skripsi. Fakultas Kedokteran. Universitas Islam Negeri Syarif Hidayatullah. Jakarta.
Mitmesser, S. H., Q. Ye, M. Evans, and M. Combs. 2016. Determination of Plasma and Leukocyte Vitamin C Concentrations in A Randomized, Double-Blind, Placebo-Controlled Trial With Ester-C®. SpringerPlus. 5(1): 1-11.
Muslim, Z., A. Prasetyo, dan S. S. Wahyudi. 2019. Pengaruh Vitamin C terhadap Fragilitas Osmotik Eritrosit pada Mahasiswa
Kedokteran Universitas Jember
yang Mengalami Stres Psikologis (Effect of Vitamin C on Osmotic Fragility of Erythrocytes in Medical Students of Jember University with Psychological Stress). Pustaka
Kesehatan. 7(1): 14-19.
Nugroho, E. J. 2014. Pengaruh Pemberian Vitamin C Terhadap Nilai Limfosit Pada Pasien Tuberculose Di Wilayah Kerja Puskesmas
Kradenan Kabupaten Grobogan. Disertasi. Universitas
Muhammadiyah Surakarta.
Surakarta.
Paunović, M. G., B. I. Ognjanović, M. M. Matić, A. S. Štajn, and Z. S. Saičić.
2016. Protective Effects of Quercetin and Vitamin C Against Nicotine-Induced Toxicity In The Blood of Wistar Rats. Archives of Industrial Hygiene and Toxicology. 67(4): 304-310.
Purnomo, D., S. Sugiharto, dan I. Isroli. 2015. Total leukosit dan Diferensial Leukosit Darah Ayam Broiler Akibat Penggunaan Tepung Onggok Fermentasi Rhizopus oryzae pada Ransum. Jurnal Ilmu-Ilmu Peternakan (Indonesian Journal of Animal Science). 25(3): 59-68.
Qasim, H. O. 2020. The Antagonism Effect of Sodium Nitrate by Ascorbic Acid (Vitamin C) On Neurobehavioral Of Mice. Iraqi Journal of Veterinary Sciences. 34(2): 241-245.
Sari, H. P., E. Dardjito, dan D. Anandari. 2016. Anemia Gizi Besi di Wilayah Kabupaten Banyumas. Jurnal Kesehatan Masyarakat. 8(1): 16-31.
Septiyan, F. S., I. B. K. Ardana, dan A. A.
S. Kendran. 2019. Pemberian Susu Afkir dalam Pakan terhadap Total dan Diferensial Leukosit pada Anak Babi Crossbreed Jantan Lepas Sapih. Indonesian Medicus
Veterninus. 8(6): 774-782.
Setyawati, A. 2016. Potensi Tepung Tempe Terhadap Persentase Sel Darah Putih Diferensial Limfosit dan Monosit (Study Pada Tikus Sprague Dawley Betina yang Diinduksi DMBA Sebagai Karsinogenik Kanker Payudara). Skripsi. Fakultas Keperwatan dan Kesehatan Universitas Muhamadiyah
Semarang. Semarang.
Soma I. G., I.N. Wandalia, I. G. Putra, dan R. Silta R. 2013. Profil Darah Monyet Ekor Panjang (Macaca
fascicularis) Liar Di Habitat Alami. Jurnal Ilmu dan Kesehatan Hewan. 1(1): 22-28.
Sultana, T., M. V. DeVita, and M. F. Michelis. 2016. Oral Vitamin C Supplementation Reduces
Erythropoietin Requirement in Hemodialysis Patients With
Functional Iron Deficiency. International Urology And
Nephrology. 48(9): 1519-1524.
Suparmi, S., S. Sampurna, N. Anna, A. M. Ednisari, G. D. Urfani, I. Laila, and H. R. Saintika. 2016. Anti-Anemia Effect of Chlorophyll from Katuk (Sauropus androgynus) Leaves on Female Mice Induced Sodium Nitrite. Pharmacognosy Journal. 8(4): 375-379.
Suriansyah, I. B. K. Ardana, M.S. Anthara, dan L. D. Anggreni. 2016. Leukosit Ayam Pedaging Setelah Diberikan Paracetamol. Indonesia Medicus Veterinus. 5(2): 165-174.
Susanti, G. 2017. Efek Anti Inflamasi Ekstrak Daun Binahong (Anredera cordifolia (Ten.) Steenis) Topikal Terhadap Jumlah PMN Neutrofil Pada Tikus Jantan Sprague Dawley. J. Kesehatan. 8(3): 351-357.
Suudah E. N., C. S. Yusriana, dan T. N. Dewi. 2015. Uji Efektivitas Ketepatan Waktu Pemberian Kombinasi Natrium Tiosulfat dan Natrium Nitrit Sebagai Antidotum Ketoksikan Akut Kalium Sianida Pada Mencit (Mus musculus).
Jurnal Permata Indonesia. 6(1): 2128.
Tangkas, P. J. W., I. N. Suarsana, dan I. W. Gunawan. 2021. Profil Hematologi Tikus Putih yang Diberi Latihan Intensif dan Ekstrak Kulit Pisang
Kepok. Buletin Veteriner Udayana. 13(2): 206-216.
van Gerven, C., K. Eid, T. Krüger, M. Fell, D. Kendoff, M. Friedrich, and C. N. Kraft. 2021. Serum C-Reactive Protein and WBC Count in Conservatively and Operatively Managed Bacterial
Spondylodiscitis. J. Orthop Surg. 29(1): 1-8.
Widyastuti, D. A. 2013. Profil Darah Tikus Putih Wistar pada Kondisi Subkronis Pemberian Natrium Nitrit. Jurnal Sain Veteriner. 31(2): 201-215.
Zhou, L., M. Zahid, M. M. Anwar, K. L. Pennington, S. M. Cohen, and J. L. Wisecarver. 2016. Suggestive Evidence for the Induction of Colonic Aberrant Crypts in Mice Fed Sodium Nitrite. Nutr Cancer. 68: 105-112.
DOI: https://doi.org/10.24843/JSIMBIOSIS.2022.v10.i02.p06
198
Discussion and feedback