ISOLASI DAN OPTIMALISASI PERTUMBUHAN BAKTERI PELARUT FOSFAT (BPF) PADA LIMBAH TAHU CAIR DENGAN MENGGUNAKAN KONSENTRASI KARBON (C) YANG BERBEDA
on
JURNAL SIMBIOSIS III (1): 326- 329
Jurusan Biologi FMIPA Universitas Udayana
ISSN: 2337-7224
Semtember 2015
ISOLASI DAN OPTIMALISASI PERTUMBUHAN BAKTERI PELARUT FOSFAT (BPF) PADA LIMBAH TAHU CAIR DENGAN MENGGUNAKAN KONSENTRASI KARBON (C) YANG BERBEDA
ISOLATION AND OPTIMIZATION OF SOLVENT PHOSPHATE BACTERIA GROWTH OF TO TOFU LIQUID WASTE BY GIVING CARBON (C) AT DIFFERENT CONCENTRATIONS
Siti Didah Alawiah1, Ida Bagus Gede Darmayasa2, I Ketut Sundra3
Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana, Kampus Bukit Jimbaran
Email : sitididah.alawiah@yahoo.co.id
INTISARI
Penelitian yang bertujuan untuk mengetahui pemberian konsentrasi Karbon (C) yang tepat pada limbah tahu cair sebagai media pertumbuhan Bakteri Pelarut Fosfat (BPF) dilakukan di Laboratorium Mikrobiologi, Universitas Udayana. Metode penelitian eksperimen dengan menambahkan konsentrasi Dextrosa yang berbeda-beda pada limbah tahu cair yang telah diberikan isolat bakteri pelarut fosfat yaitu konsentrasi 0 gr (sebagai kontrol), 0,54 gr, 0,77 gr dan 1,00 gr Dextrosa. Hasil penelitian menunjukkan pertumbuhan Bakteri Pelarut Fosfat (BPF) E. gergoviae tidak adanya perbedaan nyata (P<0,05) antara kontrol dengan perlakuan 0,54 gr dan 1,00 gr, sedangkan perlakuan 0,77 gr menunjukkan perbedaan nyata (P>0,05) ditandai dengan paling banyaknya total jumlah koloni bakteri E. gergoviae yaitu sebanyak 2,45 CFU/mL.
Kata Kunci : Limbah tahu cair, Bakteri Pelarut Fosfat (BPF) E. gergoviae, Dextrosa.
ABSTRACT
This research aimed to determine the concentration giving Carbon (C) the right to know the waste liquid as solvent Bacterial growth media Phosphate (BPF) performed in the Laboratory of Microbiology, University of Udayana. Experimental research method by adding Dextrosa concentrations varying the liquid waste that has been given out bacterial isolates phosphate solvent the concentration of 0 g (as a control), 0,54 g, 0,77 g and 1,00 g Dextrosa. The results showed the growth of bacteria Solvent Phosphate (BPF) E. gergoviae no significant differences (P <0.05) between the control and treatment of 0,54 g and 1,00 g, 0,77 g where as treatment showed significant differences (P> 0.05) are marked with the number of total number of bacterial colonies of E. gergoviae as many as 2,45 CFU / mL.
Keywords : Tofu Liquid Waste, Bacteria Solvent Phosphate (BPF) E. gergoviae, Dextrosa.
PENDAHULUAN
Limbah adalah sisa atau bahan yang dihasilkan dari proses pengolahan dan pembuatan suatu produk industri yang memiliki nilai guna rendah. Industri penghasil produk seringkali membuang limbah begitu saja di sekitar lingkungan tanpa memperhatikan dampak negatifnya terhadap lingkungan. Dampak negatif pencemaran lingkungan yang berasal dari pembuangan limbah dapat dikurangi apabila diketahui berbagai cara pemanfaatan limbah (Hastuti dan Handajani, 2001).
Menurut Suliasih dan Rahmat (2007) hasil produksi satu ton tahu dapat menghasilkan 3.000–5.000 Liter limbah cair. Kandungan nutrien yang terdapat di dalam limbah tahu cair memiliki prospek untuk dimanfaatkan sebagai media pertumbuhan berbagai bakteri potensial. Menurut Hastuti dan Handajani (2001) limbah cair yang dihasilkan oleh industri tahu merupakan limbah organik yang mudah diuraikan oleh mikroorganisme secara alamiah. Unsur hara P yang terkandung dalam limbah tahu cair merupakan unsur pertumbuhan utama yang diperlukan bakteri pelarut fosfat, hal ini memungkinkan limbah tahu cair dapat digunakan sebagai media untuk pertumbuhan bakteri pelarut fosfat.
Adanya penambahan unsur Karbon (C) dalam limbah tahu cair sangat berperan penting sebagai syarat untuk pertumbuhan suatu mikroba. Sumber Karbon (C) akan dirombak dan digunakan untuk membangun massa sel. Dextrosa merupakan sumber Karbon (C) yang paling sering digunakan dalam media untuk pertumbuhan bakteri karena dapat menjadi sumber asam glukoronat, hyaluronat dan kondroitin sulfat dan dapat dikonversi menjadi pentosa yang digunakan dalam pembentukan asam nukleat (Lakhsmi dkk., 2009).
Berdasarkan latar belakang di atas, perlu dilakukan penelitian dengan menggunakan limbah tahu cair sebagai medium untuk pertumbuhan Bakteri Pelarut Fosfat (BPF) dengan penambahan sumber Karbon (C) berupa Dextrosa,
sehingga nantinya dapat diaplikasikan sebagai pupuk cair pada tanaman.
MATERI DAN METODE
Lokasi dan Tempat Penelitian
Penelitian dilakukan di Laboratorium Mikrobiologi, Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana dan UPT. Laboratorium Analitik, Universitas Udayana serta Laboratorium Mikrobiologi Klinik Fakultas Kedokteran, Universitas Udayana dari bulan November 2013 sampai dengan Maret 2014.
Teknik Pengambilan Sampel Limbah Tahu Cair
Limbah tahu cair diambil dari pabrik tahu yang terletak di Jln. Kepawon, Denpasar, Bali. Sampel limbah tahu cair diambil menggunakan Erlenmeyer yang telah disterilisasi sebanyak 400 mL.
Analisis Proksimat Kandungan Limbah Tahu Sebelum Diberikan Perlakuan
Limbah tahu cair yang telah diambil sampelnya kemudian dianalisis terlebih dahulu di UPT. Laboratorium Analitik, Universitas Udayana untuk mengetahui kandungan nutrien yang terdapat di dalamnya. Analisis yang dilakukan berupa analisis proksimat, meliputi analisis kandungan karbohidrat, protein, lemak, kadar air, kadar abu, dan serat kasar.
Pengambilan Sampel Pupuk Organik
Sampel pupuk organik yang digunakan dalam penelitian ini sebanyak 5 sampel, dimana 3 merk pupuk diambil dari tempat penjualan pupuk di daerah Sanur, Denpasar yaitu Pubotan Tanah Subur, Pukora Agung, Pupuk Kompos Media, dan 2 merk pupuk diambil dari koleksi pupuk di Laboratorium Mikrobiologi yaitu pupuk cair Aloevera A, dan B. Masing-masing sampel pupuk
pada penelitian dilakukan pengulangan sebanyak 3 kali, dengan periode pengulangannya setiap dua minggu sekali.
Isolasi Bakteri Pelarut Fosfat dari Sampel Pupuk Organik
Isolasi bakteri pelarut fosfat dari sampel pupuk organik dilakukan dengan menggunakan metode pengenceran yaitu Platting Method (Pelczar dan Chan, 2006). Masing-masing sampel pupuk diambil dan ditimbang sebanyak 10 gram. Sampel hasil timbangan kemudian dimasukkan ke dalam botol sampel yang telah berisi air steril sebanyak 90 mL sehingga didapatkan pangkat pengenceran 10-1. Sampel di dalam botol dikocok hingga homogen dan secara aseptik sebanyak 1 mL diambil dengan menggunakan pipet mikro. Selanjutnya dimasukkan ke dalam tabung reaksi yang telah berisi air steril sebanyak 9 mL dan dikocok hingga homogen menggunakan vortex, sehingga faktor pengenceran menjadi 100 kali (10-2). Hasil pengenceran 10-2 kemudian diambil secara aseptik sebanyak satu mL dan dimasukkan kedalam 9 mL air steril dalam tabung reaksi, dikocok hingga homogen dengan menggunakan vortex, sehingga faktor pengenceran menjadi 1.000 kali (10-3). Dilakukan teknik yang sama sampai diperoleh pengenceran 10-6 dan dilakukan pada masing-masing sampel. Penanaman dilakukan pada masing-masing sampel pupuk organik yang telah dibuat seri pengenceran tersebut. Sampel dengan faktor pengenceran 10-4, 10-5 dan 10-6 masing-masing diambil sebanyak satu mL dan dimasukkan ke dalam 3 buah cawan Petri menggunakan metode tuang atau metode Pour Plate (Hadioetomo, 1990).
Metode Pour Plate yaitu, masing-masing faktor pengenceran yang telah diperoleh dengan teknik Platting Method dari faktor pengenceran (10-4, 10-5, 10-6), diambil secara aseptik sebanyak satu mL dan dituangkan kedalam cawan Petri steril yang kosong, selanjutnya media pikovskaya dituangkan kedalam cawan Petri yang telah berisi sampel tersebut. Cawan Petri yang sudah berisi sampel dan media pikovskaya tersebut digoyangkan sampai homogen. Setelah dingin dan membeku cawan Petri yang telah berisi sampel dan media tersebut diinkubasi pada inkubator dengan suhu 370C selama 24 jam (Kawuri dkk., 2007).
disterilisasi dan diinkubasi pada suhu 370C selama 48 jam di dalam inkubator.
Optimalisasi Pertumbuhan Pelarut Fosfat (BPF)
Pembuatan media pertumbuhan bakteri pelarut fosfat pada medium limbah tahu cair dengan pemberian konsentrasi sumber Karbon (C) berupa Dextrosa dilakukan dengan cara yaitu, limbah tahu cair dimasukkan ke dalam 4 Erlenmeyer masing-masing sebanyak 100 mL, kemudian masing-masing diberi label I, II, III dan IV. Dimasukkan sumber Karbon (C) yang diambil dari Dextrosa dengan berbagai konsentrasi, yaitu 0 gr (sebagai kontrol), 0,54 gr, 0,77 gr dan 1,00 gr ke dalam masing-masing Erlenmeyer yang telah berisi limbah tahu cair sebanyak 100 mL, label I ditambahkan sumber Karbon sebanyak 0 gr, label II ditambahkan sumber Karbon sebanyak 0,54 gr, label III ditambahkan sumber Karbon sebanyak 0,77 gr, label IV sebanyak 1,00 gr dan disterilisasi menggunakan autoclave dengan suhu sebesar 1210 C dan tekanan 15 lbs selama 15 menit. Label I yang berisi limbah tahu cair yang telah disterilisasi disuspensikan dengan 10 mL Bakteri Pelarut Fosfat (BPF) yang telah dikultur murni dari media Nutrient Broth dengan konsentrasi sumber Karbon 0 gr, selanjutnya diinkubasi pada inkubator dengan suhu 370C serta diamati pertumbuhannya setiap 2 jam selama 24 jam dengan penanaman menggunakan metode tuang atau Pour Plate diambil secara aseptik sebanyak satu mL dan dituangkan kedalam cawan Petri steril yang kosong, selanjutnya media pikovskaya dituangkan kedalam cawan Petri yang telah berisi sampel tersebut. Cawan Petri yang sudah berisi sampel dan media pikovskaya tersebut digoyangkan sampai homogen dan diinkubasi pada suhu 370C selama 24 jam (Kawuri dkk., 2007). Dilakukan prosedur atau metode yang sama untuk Erlenmeyer label II, III dan IV yang berisi limbah tahu cair sebanyak 100 mL dan konsentrasi Karbon masing-masing sebanyak 0,54 gr, 0,77 gr, dan 1,00 gr yang telah disterilisasi. Hasil pengamatan setiap dua jam selama 24 jam dicatat dan dilakukan analisis data pertumbuhan bakteri.
Rancangan Percobaan
Penelitian ini menggunakan metode penelitian
eksperimen penambahan konsentrasi Karbon (C) yang
mengacu pada komposisi medium pikovskaya untuk
pertumbuhan Bakteri Pelarut Fosfat (BPF), maka diperoleh
perhitungan dalam menambahkan sumber Karbon yaitu
Identifikasi Bakteri Bakteri Pelarut Fosfat (BPF)
Secara makroskopis pengamatan koloni Bakteri Pelarut Fosfat (BPF) yang tumbuh pada media pikovskaya dilakukan dengan mengamati zona bening yang terdapat disekitar koloni. Diamati ciri-ciri koloni tersebut yang meliputi bentuk koloni, warna, dan ukuran koloni dengan acuan buku Manual for the Identification of Medical Bacteria (Cowan and Steel’s, 2003). Secara mikroskopis pengamatan Bakteri Pelarut Fosfat (BPF) dapat dilakukan dengan metode pewarnaan Gram. Secara Biokimia isolat diidentifikasi menggunakan Kit MicrogentTM GN-ID A+B Panel di Laboratorium Mikrobiologi Klinik Fakultas Kedokteran, Universitas Udayana.
Pembuatan Suspensi Bakteri Pelarut Fosfat (BPF) pada Media Nutrient Broth (NB)
Isolat Bakteri Pelarut Fosfat (BPF) yang telah dikultur murni pada media pikovskaya miring di ambil dengan menggunakan jarum ose selanjutnya disuspensikan ke dalam 40 ml media Nutrient Broth (NB) yang sudah
1.000 mL
10 gr
-~m~, hal ini menunjukkan dalam 100 mL
medium pikovskaya dibutuhkan 1 gr sumber Karbon (C), sedangkan dari hasil analisis proksimat menunjukkan pada sampel limbah tahu cair hanya mengandung karbohidrat sebesar 0,23%. Berdasarkan hal tersebut, maka untuk
memperoleh komposisi sumber Karbon (C) menjadi 1 gr diperlukan penambahan sumber Karbon (C) sebanyak 0,77 gr (1,00 gr – 0,23 gr = 0,77 gr) pada 100 mL limbah tahu cair. Berdasarkan hasil perhitungan komposisi medium pikovskaya dan hasil analisis proksimat sampel limbah tahu cair tersebut, maka digunakanlah perlakuan penambahan sumber Karbon (C) berupa Dextrosa yaitu sebesar 0,54 gr merupakan perlakuan kurang dari 0,77 gr, 0,77 gr merupakan perlakuan normal, 1,00 gr merupakan perlakuan lebih dari 0,77 gr, dan kontrol. Rancangan yang digunakan yaitu Rancangan Acak Lengkap Faktorial (RALF) dengan ulangan sebanyak 3 kali pada masing-masing perlakuan.
Analisis data
Data yang diperoleh dalam penelitian dianalisis secara statistik dengan SPSS 22 menggunakan analysis of varians (ANOVA). Apabila terdapat perbedaan yang nyata pada pengaruh perlakuan dilanjutkan dengan uji jarak berganda dari Duncan P < 0,05.
HASIL
Analisis proksimat sampel limbah tahu cair sebelum diberikan perlakuan penambahan sumber Karbon dan isolat Bakteri Pelarut Fosfat (BPF) tersaji pada Tabel 1.
Tabel 1. Kandungan nutrisi limbah tahu cair sebelum diberikan perlakuan
|
Parameter |
Hasil Analisis (%) |
|
Karbohidrat |
0,23 |
|
Protein |
0,36 |
|
Lemak |
0,57 |
|
Kadar Air |
96,65 |
|
Kadar abu |
0,18 |
|
Serat Kasar |
0,001 |
Terdapat 4 isolat Bakteri Pelarut Fosfat (BPF) yang berhasil diisolasi dan diidentifikasi, dimana keempat isolat tersebut ditemukan dari sampel pupuk Aloevera A dan B. Data selengkapnya dapat dilihat pada Tabel 2.
Tabel 2. Jenis Bakteri Pelarut Fosfat (BPF) pada sampel pupuk
|
Sampel Pupuk |
Jenis Pupuk |
Isolat |
Jenis Bakteri Pelarut Fosfat |
|
Pubotan Tanah Subur |
Pupuk Padat |
- |
- |
|
Pukora Agung |
Pupuk Padat |
- |
- |
|
Pupuk Kompos Media |
Pupuk Padat |
- |
- |
|
Pupuk Aloevera A |
Pupuk Cair |
Isolat 1 |
Proteus sp. |
|
Isolat 2 |
Acinetobacter sp. | ||
|
Isolat 3 |
Enterobacter gergoviae | ||
|
Pupuk Aloevera B |
Pupuk Cair |
Isolat 4 |
Acinetobacter sp. |
Keterangan : Tanda negatif (-) menunjukkan tidak ditemukannya isolat Bakteri Pelarut Fosfat (BPF) pada sampel pupuk.
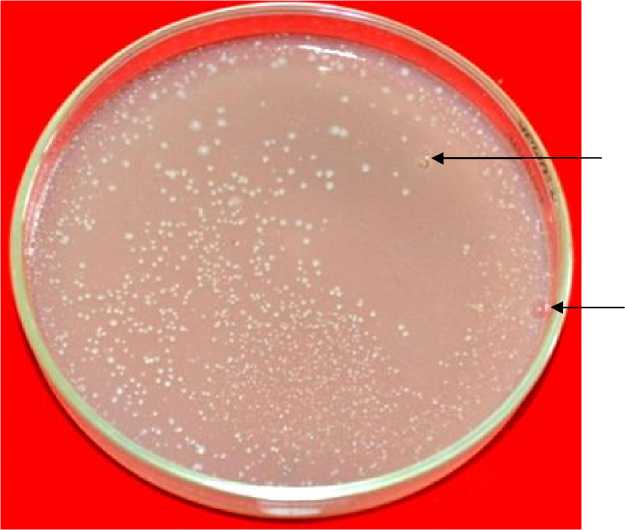
Gambar 1. Bakteri Pelarut Fosfat hasil isolasi dari sampel pupuk Aloevera A membentuk zona bening pada media pikovskaya ditandai dengan tanda panah (←).
Pertumbuhan Bakteri Pelarut Fosfat (BPF) E. gergoviae hasil isolasi dari sampel pupuk Aloevera A pada limbah tahu cair dengan penambahan konsentrasi Dextrosa
sebagai sumber Karbon (C) yang berbeda yaitu 0 gr (kontrol), 0,54 gr, 0,77 gr, dan 1,00 gr dapat dilihat selengkapnya pada Tabel 3.
Tabel 3. Pertumbuhan Bakteri Pelarut Fosfat (BPF) E.
gergoviae pada Limbah Tahu Cair
|
Jam |
Kontrol (log 10) |
P 1 (log 10) |
P 2 (log 10) |
P 3 (log 10) |
Notasi |
|
0 |
2,33 ±0,01 |
2,32 ±0,01 |
2,37 ±0,01 |
2,32 ±0,01 |
a |
|
1 |
2,37 ±0,03 |
2,35 ±0,00 |
2,40 ±0,01 |
2,37 ±0,02 |
b |
|
2 |
2,39 ±0,04 |
2,38 ±0,00 |
2,41 ±0,00 |
2,40 ±0,01 |
c |
|
3 |
2,39 ±0,03 |
2,39 ±0,01 |
2,42 ±0,00 |
2,41 ±0,00 |
cd |
|
4 |
2,40 ±0,03 |
2,39 ±0,01 |
2,44 ±0,01 |
2,41 ±0,01 |
de |
|
5 |
2,41 ±0,02 |
2,41 ±0,01 |
2,44 ±0,00 |
2,42 ±0,00 |
ef |
|
6 |
2,42 ±0,02 |
2,42 ±0,01 |
2,46 ±0,00 |
2,44 ±0,00 |
fg |
|
7 |
2,43 ±0,01 |
2,44 ±0,01 |
2,46 ±0,00 |
2,45 ±0,01 |
gh |
|
8 |
2,43 ±0,00 |
2,45 ±0,01 |
2,47 ±0,01 |
2,45 ±0,00 |
h |
|
9 |
2,45 ±0,00 |
2,48 ±0,03 |
2,48 ±0,00 |
2,46 ±0,00 |
i |
|
10 |
2,46 ±0,01 |
2,48 ±0,03 |
2,48 ±0,00 |
2,47 ±0,01 |
i |
|
11 |
2,48 ±0,00 |
2,50 ±0,02 |
2,49 ±0,00 |
2,47 ±0,00 |
j |
|
12 |
2,49 ±0,00 |
2,52 ±0,01 |
2,51 ±0,01 |
2,43 ±0,05 |
j |
|
Nota |
a |
a |
b |
a | |
|
si |
Keterangan : Nilai adalah rata-rata 3 ulangan, angka yang diikuti dengan huruf
yang sama pada kolom menunjukkan tidak berbeda nyata (P<0,05) pada hasil pengamatan setiap jam, sedangkan angka yang diikuti dengan huruf yang sama pada baris yang sama menunjukkan tidak berbeda nyata (P<0,05) pada setiap perlakuan.
Analisis proksimat sampel limbah tahu cair sesudah diberikan perlakuan penambahan konsentrasi sumber Karbon (C) berupa Dextrosa dan isolat Bakteri Pelarut Fosfat (BPF) E. gergoviae tersaji pada Tabel 4.
Tabel 4. Kandungan nutrisi limbah tahu cair sesudah diberikan perlakuan penambahan Dextrosa (Sumber Karbon) dan isolat bakteri E. gergoviae Parameter Hasil Analisis (%)
|
Karbohidrat |
0,30 |
|
Protein |
0,35 |
|
Lemak |
0,02 |
|
Kadar Air |
99,12 |
|
Kadar Abu |
0,19 |
|
Serat Kasar |
0,001 |
PEMBAHASAN
Analisis proksimat sampel limbah tahu cair sebelum diberikan perlakuan penambahan konsentrasi Dextrosa (sumber Karbon) yang berbeda ditunjukkan oleh Tabel 1 adalah sebagai berikut : 0,23% karbohidrat, 0,36% protein, 0,57% lemak, 96,65% kadar air, 0,18% kadar abu, 0,001% serat kasar. Hasil ini menunjukkan bahwa limbah tahu cair sudah memenuhi persyaratan nutrisi yang dibutuhkan sebagai medium untuk pertumbuhan Bakteri Pelarut Fosfat (BPF) dalam melakukan proses metabolisme, meskipun nutrisi yang terdapat dalam sampel limbah tahu cair masing-masing dalam jumlah persentase yang kecil.
Tabel 2 menunjukkan pada sampel pupuk Aloevera A ditemukan 3 isolat Bakteri Pelarut Fosfat (BPF) yaitu isolat 1, 2, dan 3 serta sampel pupuk Aloevera B ditemukan 1 isolat yaitu isolat 4, adanya isolat Bakteri Pelarut Fosfat (BPF) pada kedua sampel pupuk tersebut dikarenakan kedua sampel pupuk merupakan jenis sampel pupuk cair dalam botol yang tidak mudah terkontaminasi oleh spora jamur. Ketiga merk pupuk yang tidak terdapat Bakteri Pelarut Fosfat (BPF) hanya menunjukkan banyaknya koloni jamur yang tumbuh pada media. Simanungkalit, dkk. (2006) menyatakan hal tersebut dapat terjadi karena ketiga merk pupuk tersebut adalah jenis pupuk kompos padat yang mudah ditumbuhi jamur dalam kondisi lembab.
Selain itu, pupuk organik yang sudah terlalu lama disimpan akan menyebabkan pupuk kadaluarsa sehingga bakteri yang terdapat di dalamnya akan mati dan hanya koloni jamur saja yang dapat berkembangbiak.
Tabel 3 menunjukkan tidak adanya perbedaan nyata (P<0,05) antara kontrol dengan perlakuan pemberian Dextrosa (sumber Karbon) 0,54 gr dan 1,00 gr, sedangkan pada perlakuan 0,77 gr pemberian Dextrosa menunjukkan perbedaan nyata (P>0,05). Hal tersebut ditandai dengan paling banyaknya total jumlah koloni bakteri E. gergoviae pada perlakuan 0,77 gr Dextrosa.
Pemberian 0,77 gr Dextrosa sesuai dengan komposisi sumber Karbon pada media sintetik pikovskaya, dimana menurut Purwaningsih (2003) Bakteri Pelarut Fosfat (BPF) dapat tumbuh optimum pada media selektif ini. Konsentrasi pemberian sumber Karbon di dalam media pertumbuhan harus dipertimbangkan dengan seksama. Stanbury and Whitaker (1984) menyatakan konsentrasi glukosa melebihi 50 gr/L pada kultur bakteri akan menurunkan pertumbuhan karena terjadi dehidrasi sel. Umumnya larutan hipertonis dengan kadar gula atau kadar garam yang tinggi menghambat pertumbuhan bakteri karena menyebabkan terjadinya plasmolisis pada sel bakteri.
Terjadinya peningkatan jumlah koloni bakteri E. gergoviae dari jam pengamatan 0 sampai jam pengamatan 12, dimana total koloni bakteri E. gergoviae pada jam pengamatan 0 yaitu 2,3375 CFU/mL menjadi 2,5025 CFU/mL. Hasil tersebut menunjukkan perbedaan nyata (P>0,05) artinya bakteri E. gergoviae mampu hidup pada limbah tahu cair yang telah diberikan konsentrasi Dextrosa (sumber Karbon) yang berbeda-beda. Menurut Siagian (2012) peningkatan jumlah sel dan massa sel menandai adanya pertumbuhan mikroorganisme dimana semakin tinggi kecepatan pertumbuhan semakin banyak jumlah massa sel. Penelitian yang dilakukan oleh Buntan (1992) melaporkan bahwa pemberian inokulasi E. gergoviae pada tanaman jagung menunjukkan adanya peningkatan berat kering tanaman jagung sebesar 29% karena tersedianya unsur P yang cukup bagi tanaman jagung.
Adanya hasil tidak berbeda nyata (P<0,05) dari jam pengamatan kedua setiap dua jam pengamatan berikutnya yang ditunjukkan pada Tabel 3, dapat disebabkan karena waktu pengamatan yang saling berdekatan yaitu setiap dua jam, sehingga koloni bakteri masih mendekati jumlah yang sama. Selain itu, adanya populasi bakteri yang tinggi pada kontrol menurut Li (2007) dapat disebabkan karena Bakteri Pelarut Fosfat E. gergoviae telah mampu beradaptasi dengan baik pada medium cair limbah tahu dengan tipe pertumbuhannya menyerupai suspensi larut. Hal tersebut dipertegas dengan pernyataan Nur dan Maya (2012) yang menyatakan bahwa bakteri dalam keadaan tersuspensi akan tumbuh merata pada semua bagian medium, baik di permukaan, di kolom, bahkan di dasar medium.
Hasil analisis proksimat kedua pada Tabel 4 menunjukkan kandungan kadar protein, lemak, air, dan abu yang tidak jauh berbeda dari hasil analisis sebelum diberikan perlakuan, akan tetapi terjadi peningkatan kadar karbohidrat yaitu dari 0,23% menjadi sebesar 0,30%. Peningkatan kadar karbohidrat yang terdapat di dalam limbah tahu cair yang telah diberikan perlakuan ini
dikarenakan adanya penambahan sumber Karbon (C) pada limbah tahu cair yaitu berupa Dextrosa. Terjadinya penurunan kadar lemak dan protein disebabkan tidak adanya penambahan konsentrasi sumber lemak dan protein, sehingga substrat tersebut berkurang persentasenya karena telah digunakan oleh bakteri E. gergoviae untuk melakukan proses metabolisme. Hasil analisis juga menunjukkan persentase kadar serat yang sama dari limbah tahu cair sebelum dan sesudah perlakuan yaitu sebesar 0,001 %. Hal tersebut kemungkinan dapat disebabkan karena jumlah sampel yang dianalisis sebelum dan sesudah perlakuan dalam jumlah yang sama dan berasal dari pabrik pembuatan tahu yang sama. Menurut Sudarmadji dan Slamet (2006) serat kasar adalah senyawa yang tidak dapat dihidrolisa oleh asam atau alkali.
SIMPULAN
Bakteri Pelarut Fosfat (BPF) E. gergoviae tumbuh paling optimum pada perlakuan pemberian Dextrosa (sumber Karbon) sebanyak 0,77 gr.
PUSTAKA
Buntan, A. 1992. Efektifitas Bakteri Pelarut Fosfat dalam Kompos Peningkatan Serapan P dan Efisiensi pemupukan P pada Tanaman Jagung. Tesis. Program Pascasarjana IPB. Bogor.
Hastuti, DS., dan Handajani, H. 2001. Budidaya Pakan Alami. Fakultas Peternakan-Perikanan UMM.
Malang.
Lakhsmi, A., Hidayat, R., Puspitawati, R., Boy M. Bahtiar. 2009. Efek Penambahan Glukosa Pada Sabouraud Dextrosa Broth Terhadap Pertumbuhan Candida albicans (Uji in vitro). Indonesian Jurnal of Dentistry 16 (1) : 58- 63.
Li C, Fang HHP. 2007. Fermentative hydrogen production from waste water and solid wastes by mixed cultures. Journal Environment Science Technology. 37 (1) : 31-39.
Nur D, Maya S. 2012. Adaptasi isolat bakteri aerob penghasil gas hidrogen pada medium limbah organik. Jurnal Sains dan Seni ITS 1: 2301-928X.
Purwaningsih, S., 2003. Isolasi, Populasi dan Karakterisasi Bakteri Pelarut Fosfat pada Tanah dari Taman Nasional Bogani Nani Wartabone. Sulawesi Utara. Biologi 3 (1) : 22-31.
Siagian, E. Isolasi Bakteri Selulolitik Dari Daerah Aliran Sungai Siak Di Tandun Kabupaten Rokan Hulu. 2012. Skripsi S-1. Jurusan Kimia FMIPA UR, Pekanbaru.
Simanungkalit RDM, Suriadikarta DA, Sarawati R, Setyorini dan Hartatik. 2006. Pupuk organik dan pupuk hayati. Bogor : Balai Besar Penelitian dan Pengembangan Sumber Daya Lahan Pertanian.
Stanbury Peter F., Allan Whitaker. 1984. Principles of Fermentation Technology. Pergamon Press. New York.
Sudarmadji dan Slamet. 2006. Prosedur Analisis Untuk Bahan Makan Dan Pertanian. Liberty : Yogyakarta.
Suliasih, dan Rahmat. 2007. Aktivitas Fosfatase dan Pelarutan Kalsium Fosfat oleh Beberapa Bakteri Pelarut Fosfat. Biodiversitas 8 (1) : 23-26.
Yelti, SN., Zul, Delita., Fibriarti, BL. 2014. Formulasi Biofertilizer Cair Menggunakan Bakteri Pelarut Fosfat Indigenus Asal Tanah Gambut Riau. JOM FMIPA 1 : 656-658.
329
Discussion and feedback