STRATEGI UNTUK MENINGKATKAN KUALITAS OBAT BIOLOGI PADA SEL MAMALIA CHINESE HAMSTER OVARY (CHO) : SUATU KAJIAN PUSTAKA
on
SIMBIOSIS XI (1): 238-250 http://ojs.unud.ac.id/index.php/simbiosis
Program Studi Biologi FMIPA UNUD
eISSN: 2656-7784
September 2023
STRATEGI UNTUK MENINGKATKAN KUALITAS OBAT BIOLOGI PADA SEL MAMALIA CHINESE HAMSTER OVARY (CHO) : SUATU KAJIAN PUSTAKA
STRATEGIES TO IMPROVE THE QUALITY OF BIOPHARMACEUTICALS IN CHINESE HAMSTER OVARY (CHO) MAMMALIAN CELLS: A LITERATURE REVIEW
Alayna Lillahida Indri Himawan1, Adi Santoso2, Endah Puji Septisetyani2, Pekik Wiji Prasetyaningrum2, Nurul Maulida Rahma3, dan Inna Narayani1
-
1) Program Studi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana, Bali, Indonesia-80361
-
2)Pusat Riset Rekayasa Genetika, Badan Riset dan Inovasi Nasional, Jl. Raya Bogor KM. 46, Cibinong, Bogor, Jawa Barat, Indonesia-16911
3) Program Studi Biologi, Fakultas Biologi, Universitas Jenderal Soedirman, Purwokerto, Indonesia-53122
Email korespondensi: narayani@unud.ac.id
ABSTRAK
Sel Chinese Hamster Ovary (CHO) adalah sel yang sangat penting dalam produksi obat biologi, terutama glikoprotein. Meskipun demikian, untuk mendapatkan proses produksi yang efisien dan konsistensi terapi yang efektif, strategi yang tepat sangat dibutuhkan untuk meningkatkan kualitas produk obat biologi. Telah diketahui bahwa semua molekul kunci yang terlibat dalam respons imun adalah glikoprotein dan banyak protein terapeutik seperti vaksin, antibodi, dan enzim memerlukan glikan untuk memiliki aktivitas biologis yang tinggi. Pada review ini dibahas tentang strategi yang digunakan dalam sel CHO untuk memodulasi pola sialilasi melalui overekspresi pada enzim sialyltransferase, CMP-sialic acid transporter, UDP-GlcNAc 2-epimerase (GNE), ManNAc kinase (MNK) dan enzim terkait lainnya. Selain melakukan modulasi jalur biosintesis untuk meningkatkan kandungan asam sialat dengan teknik overekspresi gen, pembahasan pada review ini juga mencakup tentang teknik penyisipan situs glikosilasi dan manipulasi glikan untuk menghasilkan glikoform yang diinginkan. Untuk meningkatkan waktu paruh protein, pendekatan melalui teknik protein fusi dengan molekul Fc dari IgG manusia juga dibahas. Akhirnya, sebagai strategi untuk meningkatkan kualitas molekul obat biologi, pada review ini juga dibahas tentang pentingnya monoklonalisasi dalam rangka pengembangan lini sel yang benar-benar berasal dari satu klon. Hal ini sangat penting untuk menjamin konsistensi dalam proses produksi obat biologi.
Kata kunci: asam sialat, Fc Fusi, glikosilasi, monoklonalisasi, obat biologi
ABSTRACT
Chinese hamster ovary (CHO) cells are frequently used to produce biopharmaceutical molecules, especially glycoproteins. Nevertheless, the right approach needs to be considered to be taken carefully to improve the efficacy of biological medicine products in order to obtain an effective production process and therapeutic consistency. All of the essential components involved in the immune response are known to be glycoproteins, and many therapeutic proteins, such as antibodies, enzymes, and vaccines, need glycans to perform their biological activity. This review addresses how sialyltransferases, CMP-sialic acid transporter, UDP-GlcNAc 2-epimerase (GNE), ManNAc kinase (MNK), and other related enzymes are overexpressed in the CHO cells to modify the patterns of sialylation. In addition to modulating biosynthetic pathways to increase sialic acid content with gene overexpression techniques, this review
includes methods for inserting glycosylation sites and manipulating glycans to produce the desired glycoforms. An approach through protein fusion techniques with Fc molecules from human IgG is also discussed to increase the protein half-life. Finally, this review additionally discusses the significance of cell monoclonalization in generating a cell line that precisely derives from a single clone to enhance the quality of biopharmaceutical molecules. This is a very critical step to obtain batch-to-batch consistency during the production process of a biopharmaceutical molecule.
Keywords: Biopharmaceutical, Fc Fusion, Glycosylation, Monoclonalization, Sialic acid.
PENDAHULUAN
Obat biologi adalah obat yang berbasis pada protein yang diproduksi dengan menggunakan makhluk hidup, di antaranya vaksin, faktor pertumbuhan, modulator imun, antibodi monoklonal, serta produk yang berasal dari darah dan plasma manusia. Secara mendasar yang membedakan obat biologi dari jenis obat lainnya adalah bahwa obat biologi pada umumnya merupakan protein yang dimurnikan dari sistem kultur hidup atau dari darah, sedangkan obat-obatan lainnya dianggap sebagai 'molekul kecil' dan dibuat secara sintetis atau dimurnikan dari tumbuhan atau organisme lainnya (FDA, 2018).
Meningkatnya nilai ekonomi dan tingginya kebutuhan dunia terhadap obat biologi, menyebabkan produksi dan inovasi jenis obat ini mengalami peningkatan drastis. Peningkatan yang signifikan ini berkaitan dengan meningkatnya penderita penyakit kronis, usia populasi, dan juga perkembangan inovasi dan teknologi yang mendukung produksi obat-obatan biologi (Gupta and Shukla, 2016; Gupta and Shukla, 2017). Meskipun mengalami peningkatan yang signifikan, pemenuhan kebutuhan produk obat biologi ini tetap menjadi tantangan. Rumitnya sintesis obat biologi, dimana sekitar 70% obat biologi merupakan glikoprotein, membuat produksi obat ini menjadi sangat kompleks.
Obat biologi mempunyai beberapa karakteristik khusus terkait solubilitas, imunogenisitas, waktu paruh, agregasi dan efikasinya. Disamping itu, karena sebagian besar obat biologi diproduksi menggunakan sel mamalia maka biaya produksi obat ini sangat mahal sehingga produksinya harus dilakukan secara efisien. Proses produksi glikoprotein lebih rumit karena modifikasi glikan dapat menghasilkan beberapa tipe glikan termasuk tipe hybrid dan tipe kompleks, di mana pada glikan bertipe kompleks memiliki percabangan yang lebih banyak dengan jumlah asam sialat yang lebih banyak (Pierce and Parsons, 1981). Dalam hal ini, karena asam sialat berperan penting dalam meningkatkan waktu paruh glikoprotein, telah dilakukan rekayasa sel maupun modifikasi bioproses untuk meningkatkan kandungan asam sialat pada produk obat biologi (Kobata,H 1992). Sehubungan dengan hal tersebut, pada review ini dibahas tentang modulasi jalur biosintesis glikoprotein dengan teknik overekspresi gen, penyisipan situs glikosilasi, manipulasi glikan dan glikoform yang dihasilkan, serta penggunaan teknik protein fusi dengan molekul Fc dari IgG. Review ini juga membahas pentingnya pengembangan suatu lini sel yang benar-benar berasal dari satu klon untuk mendapatkan konsistensi dalam produksi protein obat.
MODULASI JALUR BIOSINTESIS ASAM SIALAT DENGAN OVEREKSPRESI GEN
Asam sialat berperan dalam memperpanjang waktu paruh dan bioaktivitas dari glikoprotein, maka kandungan asam sialat yang tinggi dalam suatu sel inang sangat esensial pada sintesis biofarmasetika yang berbasis pada glikoprotein (Fan, 2015; Goh and Ng, 2018; Hossler et al., 2009; Kwak et al., 2017). Pada sel mamalia, biosintesis asam sialat (Neu5Ac) terjadi pada sitosol, kemudian diproses pada inti sel untuk membentuk asam sialat aktif (CMP-Neu5Ac). Selanjutnya asam sialat ditransportasikan dari sitosol ke badan golgi untuk mendukung proses glikosilasi (Gambar 1). Biosintesis asam sialat berawal dari jalur heksosamin (hexosamine pathway). Pada sel eukaryota, dengan bantuan dua enzim, UDP-GlcNAc 2-epimerase (GNE) dan ManNAc kinase (MNK), uridin difosfat (UDP)-GlcNAc diubah menjadi ManNAc dan akhirnya menjadi ManNAc-6-fosfat. Kedua enzim ini (GNE dan MNK) adalah enzim yang unik karena menjadi satu enzim tetapi mempunyai 2 fungsi (bifungsional) (Hinderlich et al., 1997; Reinke et al., 2009; Son et al., 2011). Proses selanjutnya adalah perubahan struktur dari ManNAc-6-fosfat menjadi Neu5Ac-9P oleh enzyme N-AcetyIneuraminic Acid Synthase (NANS). Molekul Neu5Ac-9P kemudian diubah menjadi Neu5Ac oleh enzim N-AcetyIneuraminic Acid Phosphatase (NANP). Molekul Neu5Ac kemudian ditransfer ke dalam inti sel untuk penambahan CMP (cytidine monofosfat) pada molekul Neu5Ac menjadi CMP-Neu5Ac dengan bantuan enzim CMP-sialic acid synthetase. Selanjutnya, CMP-Neu5Ac ditransfer ke badan golgi melalui CMP-sialic acid transporter (CST) (Gambar 1 dan 2) (Enns et al., 2001; Ferreira et al., 1999).
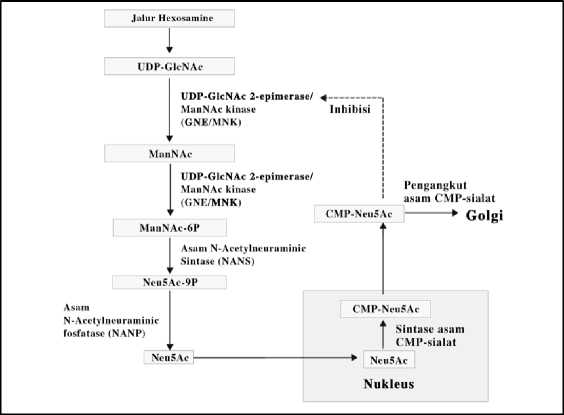
Gambar 1. Skema jalur biosintesis dan transpor asam sialat pada sel mamalia. Diadaptasi dari Wang dkk. 2017.
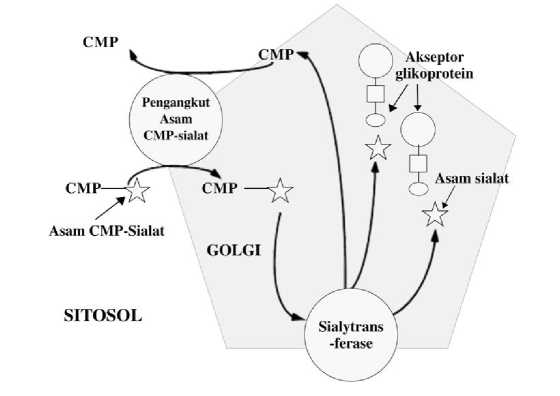
Gambar 2. Skema penambahan gugus asam sialat pada glikoprotein yang terjadi di badan golgi. Diadaptasi dari Wong dkk. 2006.
Di dalam badan Golgi, enzim sialyltransferase kemudian melepas CMP molekul untuk membentuk molekul asam sialat CMP-Neu5Ac kembali. CMP yang terlepas akan dikeluarkan dari badan golgi ke sitosol untuk digunakan lagi pada proses transpor asam sialat berikutnya, sedangkan asam sialat yang terbentuk di dalam badan golgi akan terintegrasi pada molekul glikoprotein (Gambar 2). Berdasarkan jalur biosintesis asam sialat, rekayasa genetik melalui overekspresi enzim sialyltransferase (ST) dan CST dapat menjadi alternatif untuk meningkatkan kandungan asam sialat suatu glikoprotein. (Santoso et al., 2022) melakukan overekspresi kedua enzim tersebut pada sel CHO-DG44 untuk sintesis darbepoetin-alfa (DPO). Dalam riset yang telah dilakukan oleh Santoso et al., (2022), terlihat bahwa DPO yang dihasilkan memiliki berat molekul yang lebih tinggi jika dibandingkan kontrol. Hal tersebut dipercaya berhubungan dengan peningkatan kandungan asam sialat. Hal ini menunjukan bahwa overekspresi gen-gen yang bertanggung jawab terhadap proses glikosilasi dapat dijadikan sebagai upaya untuk meningkatkan kandungan asam sialat pada glikoprotein yang diinginkan.
Riset terdahulu menunjukkan bahwa overekspresi enzim ST pada sel CHO berhasil meningkatkan kandungan asam sialat pada glikoprotein TNFR-IgG sebesar 33% (Fukuta dkk., 2000). Di samping itu, penelitian dari Wong et al., (2006) melaporkan bahwa overekspresi gen CST pada sel CHO mampu meningkatkan asam sialat sebesar 4–16% pada interferon gamma (IFN gamma). Di sisi lain, telah dibuktikan bahwa overekspresi gen alfa-2,6 ST dan GNE/MNK secara simultan dalam sel CHO-DG44 mampu meningkatkan kandungan asam sialat yang cukup besar, yaitu sekitar 42% (Thi Sam et al., 2018). Beberapa pendekatan di atas menunjukkan bahwa peningkatan kandungan asam sialat dalam protein terapeutik dapat diperoleh melalui modulasi jalur biosintesis asam sialat melalui overekspresi gen. Meskipun demikian, pendekatan ini sangat dipengaruhi oleh protein yang diminati, gen kunci glikosilasi, dan jenis lini sel.
PENYISIPAN SITUS GLIKOPROTEIN BARU
Peningkatan situs glikosilasi ini memungkinkan penambahan integrasi molekul asam sialat pada produk glikoprotein yang dihasilkan. Pendekatan alternatif ini telah terbukti dalam meningkatkan profil farmakokinetik suatu glikoprotein (Fares et al., 2007). Keberadaan karbohidrat terhadap protein memiliki berbagai macam peran biologis seperti menjaga kestabilan dari molekul, meningkatkan kemampuannya untuk larut dan juga dalam kegiatan in vivo. Secara khusus, komponen karbohidrat yang mengandung asam sialat memiliki kemampuan untuk menambah waktu paruh dan manfaat terapeutik dari protein tersebut (Sinclair and Elliott, 2005). Mikro dan makroheterogenitas adalah dua jenis umum heterogenitas yang terkait dengan struktur glikosilasi glikoprotein (Meuris et al., 2014; Yang et al., 2015). Selain memodifikasi struktur oligosakarida pada situs glikan tertentu (mikroheterogenitas), rekayasa glikoprotein juga dapat diterapkan untuk mengontrol penempatan situs glikan pada protein target (makroheterogenitas) dengan mengubah urutan konsensus N-glikan serta jumlah dan posisi situs glikosilasi pada rantai peptida melalui teknik mutagenesis terarah (Wang et al., 2017).
Setiap jenis mahluk hidup, seperti yeast (kapang), insekta (serangga), tanaman, dan mamalia selain manusia (Yehuda and Padler-Karavani, 2020) memiliki berbagai ragam pola glikosilasi. Glikosilasi-N dan glikosilasi-O adalah yang paling umum berada pada manusia. Glikosilasi-N terletak pada asam amino asparagin (N) dengan pola motif N-X-S/T, di mana X terdiri dari semua asam amino kecuali prolin, dan S dan T terdiri dari asam amino serin dan treonin. Glikosilasi-O, di sisi lain, tidak memiliki pola khusus dan terletak pada gugus asam amino serin atau treonin (Ohtsubo and Marth, 2006; Sjögren, 2015; Varki, 2011). Pada glikosilasi-N, asam amino prolin pada posisi X akan memblokir glikosilasi di situs tersebut, sedangkan glutamat, triptofan, aspartat, dan leusin menunjukkan glikosilasi yang tidak efisien (Fussenegger et al., 1999; Hu et al., 2013; Zhang et al., 1997). Selain itu, urutan Asn-X-Thr lebih cenderung mengalami glikosilasi daripada Asn-X-Ser. Dengan demikian, glikosilasi protein target akan lebih baik ketika treonin hadir sebagai pengganti serin pada posisi hidroksi N-glikan (Hu et al., 2013).
Egrie dan Browne (2001) telah melakukan studi penambahan situs glikosilasi pada human eritropoietin (EPO), molekul native hEPO adalah hormon glikoprotein yang memiliki pengaruh agar tubuh memproduksi lebih banyak eritrosit. Molekul ini memiliki 3 rantai N-linked, 1 rantai O-linked dan memiliki 14 molekul asam sialat (Gambar 3A). (Egrie dan Browne, 2001) melakukan rekayasa pada hEPO dengan cara menambahkan 2 situs glikosilasi-N, menjadikan hEPO memiliki glikosilasi 5 situs glikosilasi-N dan 1 glikosilasi-O dengan 22 molekul asam sialat (NESP, novel erythropoiesis stimulating protein yang kemudian diproduksi dengan nama DPO) (Gambar 3B). Hal ini menjadikan NESP memiliki berat molekul yang lebih tinggi dan muatan negatif yang lebih besar dibanding rhEPO. Selain itu, NESP memiliki waktu paruh serum sekitar 3 kali lipat lebih lama dan mempunyai potensi in vivo lebih besar daripada rhEPO sehingga molekul NESP dapat diberikan lebih jarang untuk mendapatkan respon biologis yang sama (Egrie dan Browne, 2001).
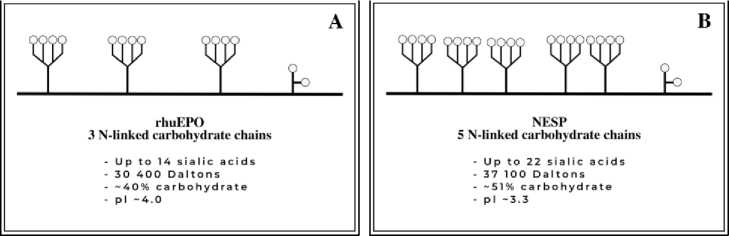
Gambar 3. Struktur glikosilasi rekombinan erythropoietin manusia (rhEPO) (A) dan analog rhEPO yang memiliki 5 N-linked rantai karbohidrat (NESP/DPO) (B). Diadaptasi dari: (Egrie and Browne, 2001)
FUSI PROTEIN DENGAN FRAGMEN ANTIBODI Fc
Molekul imunoglobulin pada umumnya (imunoglobulin G/IgG) terdiri dari empat polipeptida yang dihubungkan secara kovalen oleh ikatan disulfida, 2 rantai ringan dan 2 rantai berat. Dengan menggunakan reaksi proteolisis, secara umum, molekul IgG ini akan menghasilkan dua fragmen Fab dan satu fragmen Fc. IgG adalah salah satu protein yang banyak terdapat pada darah manusia dan membentuk sekitar 70 - 75% dari total imunoglobulin dalam serum manusia. IgG mempunyai waktu paruh terpanjang di antara lima jenis imunoglobulin dan dapat mencapai 21 hari (Schroeder dan Cavacini, 2010; Wang et al., 2017).
Kemajuan teknologi rekayasa protein telah memungkinkan peneliti untuk menggabungkan (fusi) protein, di antaranya fusi protein antara Fc dari IgG manusia dengan suatu protein yang memiliki potensi terapetik (Beck dan Reichert, 2011). Karena Fc mempunyai waktu paruh in vivo yang relatif panjang maka protein terapetik yang difusikan dengan molekul Fc protein akan memiliki waktu paruh yang panjang pula (Duivelshof et al., 2021). Teknik protein fusi dengan molekul Fc biasanya digunakan untuk menargetkan interaksi reseptor-ligan. Teknik ini dapat bekerja baik sebagai antagonis untuk memblokir pengikatan reseptor (misalnya etanercept, aflibercept, rilonacept, belatacept, abatacept) atau sebagai agonis untuk secara langsung merangsang fungsi reseptor untuk mengurangi (misal: alefacept) atau meningkatkan aktivitas kekebalan (misal: romiplostim) (Czajkowsky et al., 2012). Teknik bioteknologi modern telah berhasil diterapkan pada pembuatan protein fusi yang terdiri dari fragmen - fragmen protein terapeutik, seperti sitokin reseptor yang dapat larut dan fragmen Fc dari IgG manusia (Jones et al., 2004; Mitoma et al., 2018; Wang et al., 2017).
Salah satu obat yang cukup populer untuk penderita rheumatoid arthritis adalah Etanercept dengan nama dagang Enbrel. Obat ini adalah protein fusi antara molekul Fc dari IgG manusia dengan protein p75 TNF (tumor necrosis factor) (Mitoma et al., 2018). Selain Etanercept, molekul protein terapetik lainya yang difusikan dengan molekul IgG manusia adalah hEPO. Waktu paruh yang lebih tinggi pada protein dimer EPO (rHuEPO-Fc) ini mungkin disebabkan oleh peningkatan ukuran molekul EPO dan interaksi dengan reseptornya. Selain itu, domain molekul Fc juga dapat meningkatkan kelarutan dan stabilitas molekul protein yang berfusi (Wang et al., 2017).
KLON TUNGGAL DAN MONOKLONALISASI
Tahapan dalam pembuatan protein terapeutik pada sel mamalia secara umum terdiri dari 3 tahap, yaitu: konstruksi vektor untuk ekspresi protein rekombinan, pengembangan lini sel (cell line development) dan karakterisasi produk protein obatnya serta pengembangan proses produksinya (Tripathi and Shrivastava, 2019). Mengingat biaya produksi obat berbasis protein terapetik sangat mahal, maka proses produksi yang efisien harus digunakan untuk meningkatkan produktivitas protein target. Sampai saat ini titer produk meningkat lebih dari 100 kali lipat dalam 20 tahun sejak pertengahan tahun 1980-an (Wurm, 2004), dan saat ini tipikal titer produk pada sel CHO dapat mencapai sekitar 1–10 g/L media (Kunert and Reinhart, 2016). Peningkatan ini dapat dicapai melalui berbagai macam inovasi dan kemajuan dalam pengembangan lini sel dan pengembangan proses kultur sel.
Keberhasilan pengembangan lini sel dengan kemampuan tinggi untuk menghasilkan protein terapetik (high-producer cell lines) merupakan tahap pertama yang sangat penting untuk kesuksesan produksi industri biofarmasi yang akhirnya diharapkan dapat mencapai tahap komersial (pemasaran produk). Pengembangan lini sel dibentuk dengan mendesain vektor rekombinan dimana gen yang mengekspresikan protein rekombinan dan gen penanda untuk seleksi diintegrasikan, diikuti dengan transfeksi pada sel inang CHO. Mendapatkan sel dengan produktivitas dan stabilitas yang tinggi merupakan hal yang cukup sulit karena gen terintegrasi secara acak ke dalam genom sel CHO dari sel yang dihasilkan. Oleh karena, untuk mendapatkan sel klon dengan produktivitas dan stabilitas yang tinggi kita perlu untuk melakukan isolasi dalam jumlah besar dari populasi sel yang stabil. Untuk mendapatkan klon sel yang stabil, desain dari suatu vektor juga sangat berperan. Desain dari suatu vektor mencakup promotor (Deer and Allison, 2004), desain gene of interest (Girod et al., 2007; Takagi et al., 2017) penanda (marker) untuk seleksi (selection markers) (Kaufman and Sharp, 1982; Sanders and Wilson, 1984) telah banyak dipelajari.
CHO-DG44 merupakan jenis sel CHO yang bersertifikasi cGMP dan banyak digunakan dalam produksi protein rekombinan. Sel CHO-DG44 telah direkayasa sehingga kehilangan gen penyandi DHFR (Urlaub and Chasin, 1980). Salah satu cara untuk melakukan penyisipan gen asing yang stabil adalah dengan mendesain vektor ekspresi bisistronik yang mengandung gen penyandi protein obat yang diinginkan dan gen penyandi DHFR. Seleksi dapat dilakukan dengan memodifikasi media kultur sel sehingga sel yang tidak berhasil tertransfeksi tidak akan bertahan hidup (Omasa et al., 2010).
Menurut pengalaman penulis dalam melakukan penelitian ini, usaha dalam memperoleh klon sel dengan kemampuan produksi yang tinggi perlu dilakukan dengan target keberhasilan dalam mendapatkan klon sel yang benar-benar berasal dari klon tunggal, lalu dipastikan dan diikuti dengan proses skrining secara bertahap. Sel-sel yang berasal dari satu sel ini menjadi sangat spesifik dan kemungkinan besar identik secara genetik, yang memungkinkan untuk digunakan dalam produksi obat berbasis protein. Secara umum teknik untuk melakukan dan mendapatkan lini sel klon tunggal melibatkan 3 tahap: 1) Melakukan transfeksi pada sel inang untuk mendapatkan generasi populasi sel campuran (pool cells). Pada sel campuran ini berisi sel yang mengekspresikan dan tidak mengekspresikan protein yang diinginkan. Selain itu sel yang tertransfeksi juga memiliki karakteristik genotipe dan fenotipe yang heterogen dan mempengaruhi tingkat ekspresi tiap sel. Oleh sebab itu, mendapatkan klon
sel yang benar-benar diawali dari satu sel menjadi sangat penting. 2) Menyeleksi sub-populasi sel yang telah tertransfeksi. Seleksi ini dilakukan berdasarkan gen penanda yang digunakan yang diintegrasikan ke dalam vektor ekspresi. 3) Kloning sub-populasi sel atau sel dari klon tunggal untuk mendapatkan klon dengan kinerja terbaik. Proses ini cukup melelahkan dan mahal.
Monoklon adalah istilah yang menggambarkan lini sel yang berasal dari satu sel tunggal. Pengembangan suatu lini sel dan sel yang sudah terjamin merupakan sel monoklonal bahwa kultur sel tersebut benar-benar berasal dari satu sel merupakan tahapan penting dalam proses produksi suatu molekul biofarmasi. Suatu populasi sel dapat ditetapkan sebagai monoklon apabila populasi sel tersebut benar-benar berasal dari satu sel dan satu klon tunggal dan dapat mengekspresikan protein yang diinginkan dengan produktivitas yang tinggi. Oleh karena kloning sel tunggal merupakan langkah penting dalam produksi molekul biofarmasetik, telah dikembangkan instrumen terotomatisasi untuk mensorting dan mengisolasi sel tunggal (Molecular Devices, 2023).
Salah satu tonggak penting dalam proses monoklonalisasi adalah mendokumentasikan bukti klonalitas suatu lini sel untuk memastikan reproduktivitas genetik dari lini sel tersebut. Monoklonalitas suatu lini sel ini sangat penting karena di dalam peraturan pengembangan suatu lini sel, peneliti yang bersangkutan akan diminta untuk menunjukkan bukti bahwa klon sel tersebut benar-benar berasal dari suatu sel tunggal. Pentingnya pembuktian suatu klon sel telah mendorong kebutuhan akan teknologi dan metodologi yang lebih baik dalam produksi biofarmasetik.
KESIMPULAN
Sel mamalia CHO memiliki karakteristik yang sangat menguntungkan untuk dimanfaatkan dalam produksi obat biologis karena faktor keamanan, sistem produksi dan produktivitasnya dalam menghasilkan protein obat. Rekayasa sel CHO telah banyak dilakukan untuk meningkatkan kemudahan dalam pengembangan lini sel dan efisiensi produksi obat biologi. Rekayasa sel CHO terkait peningkatan kualitas glikoprotein dilakukan di antaranya dengan melakukan modulasi pada jalur biosintesis asam sialat, melakukan penyisipan situs glikosilasi serta melakukan fusi protein dengan molekul Fc dari IgG manusia. Selain itu, monoklonalisasi dan kloning sel tunggal juga perlu dilakukan untuk meningkatkan produktivitas dan kualitas protein terapetik yang diinginkan.
UCAPAN TERIMA KASIH
Terima kasih kami ucapkan kepada program Pusat Pengembangan Teknologi Informasi 2019 Kemenristek Dikti yang telah membiayai riset kami mengenai pengembangan produk biologi darbepoetin-alfa (DPO) yang berkaitan erat dalam mendukung penulisan review ini.
DAFTAR PUSTAKA
Beck, A., and Reichert, J. M. 2011. Therapeutic Fc-fusion Proteins and Peptides ss Successful Alternatives to Antibodies. in MAbs. Vol. 3: No. 5, pp. 415-416.
Bi, J. X., Shuttleworth, J., and Al‐Rubeai, M. 2004. Uncoupling of Cell Growth and Proliferation Results in Enhancement of Productivity in p21CIP1‐arrested CHO cells.
Biotechnology and bioengineering. 85(7): 741-749.
Costa, A. R., Rodrigues, M. E., Henriques, M., Oliveira, R., and Azeredo, J. 2011. Strategies for Adaptation of MAb-Producing CHO Cells to Serum-free Medium. In BMC proceedings. Vol. 5: No. 8, pp. 1-2.
Czajkowsky, D. M., Hu, J., Shao, Z., and Pleass, R. J. 2012. Fc‐fusion Proteins: New Developments and Future Perspectives. EMBO Molecular Medicine. 4(10): 1015-1028.
Davis, J. D., Deng, R., Boswell, C. A., Zhang, Y., Li, J., Fielder, P., and Kenkare-Mitra, S. 2013. Monoclonal Antibodies: from Structure to Therapeutic Application. Pharmaceutical Biotechnology: Fundamentals and Applications. 143-178.
Deer, J. R., and Allison, D. S. 2004. High‐level Expression of Proteins in Ammalian Cells using Transcription Regulatory Sequences from the Chinese Hamster EF‐1α gene. Biotechnology Progress. 20(3): 880-889.
Duivelshof, B. L., Murisier, A., Camperi, J., Fekete, S., Beck, A., Guillarme, D., and D'Atri, V. 2021. Therapeutic Fc‐fusion Proteins: Current Analytical Strategies. Journal of separation science. 44(1): 35-62.
Egrie, J. C., and Browne, J. K. 2001 Development and Characterization of Novel Erythropoiesis Stimulating Protein (NESP). British journal of cancer. 84(1): 3-10.
Enns, G. M., Seppala, R., Musci, T. J., Weisiger, K., Ferrell, L. D., Wenger, D. A., and Packman, S. 2001. Clinical Course and Biochemistry of Sialuria. Journal of Inherited Metabolic Disease. 24(3): 328-336.
Fan, Y., Andersen, M. R., and Weilguny, D. 2015. N-Glycosylation Optimization of Recombinant Antibodies in CHO Cell Through Process and Metabolic Engineering. Technical University of Denmark.
Fares, F., Ganem, S., Hajouj, T., and Agai, E. 2007. Development of a Long-Acting Erythropoietin by Fusing the Carboxyl-Terminal Peptide of Human Chorionic Gonadotropin Β-Subunit to The Coding Sequence of Human Erythropoietin. Endocrinology. 148(10): 5081-5087.
Ferreira, H., Seppala, R., Pinto, R., Huizing, M., Martins, E., Braga, A. C., and Gahl, W. A. 1999. Sialuria in a Portuguese Girl: Clinical, Biochemical, and Molecular Characteristics. Molecular Genetics and Metabolism. 67(2): 131-137.
Food and Drug Administration (FDA). 2018. Biological Product Definitions. https://www.fda.gov/files/drugs/published/Biological-Product-Definitions.pdf
Fukuta, K., Yokomatsu, T., Abe, R., Asanagi, M., and Makino, T. 2000. Genetic Engineering of CHO Cells Producing Human Interferon-γ by Transfection of Sialyltransferases. Glycoconjugate Journal. 17: 895-904.
Fussenegger, M., Bailey, J. E., Hauser, H., and Mueller, P. P. 1999. Genetic Optimization of Recombinant Glycoprotein Production by Mammalian Cells. Trends in Biotechnology. 17(1): 35-42.
Girod, P. A., Nguyen, D. Q., Calabrese, D., Puttini, S., Grandjean, M., Martinet, D., and Mermod, N. 2007. Genome-Wide Prediction of Matrix Attachment Regions that Increase Gene Expression in Mammalian Cells. Nature Methods. 4(9): 747-753.
Goh, J. B., and Ng, S. K. 2018. Impact of Host Cell Line Choice on Glycan Profile. Critical Reviews in Biotechnology. 38(6): 851-867.
Gupta, S. K., and Shukla, P. 2016. Advanced Technologies for Improved Expression of Recombinant Proteins in Bacteria: Perspectives and Applications. Critical Reviews in Biotechnology. 36(6): 1089-1098.
Gupta, S. K., and Shukla, P. 2017. Microbial Platform Technology For Recombinant Antibody Fragment Production: A Review. Critical Reviews in Microbiology. 43(1): 31-42.
Hossler, P., Khattak, S. F., and Li, Z. J. 2009. Optimal and Consistent Protein Glycosylation in Mammalian Cell Culture. Glycobiology. 19(9): 936-949.
Hinderlich, S., Stäsche, R., Zeitler, R., and Reutter, W. 1997. A Bifunctional Enzyme Catalyzes the First Two Steps in N-Acetylneuraminic Acid Biosynthesis of Rat Liver. Purification And Characterization of UDP-N-acetylglucosamine 2-epimerase/N-acetylmannosamine kinase. The Journal of Biological Chemistry, 272(39), 24313–24318.
https://doi.org/10.1074/JBC.272.39.24313
Hu, Z., Guo, D., Yip, S. S., Zhan, D., Misaghi, S., Joly, J. C., and Shen, A. Y. 2013. Chinese Hamster Ovary K1 Host Cell Enables Stable Cell Line Development for Antibody Molecules Which are Difficult to Express in DUXB11‐derived Dihydrofolate Reductase Deficient Host Cell. Biotechnology Progress. 29(4): 980-985.
Jaakkonen, A., Volkmann, G., and Iwaï, H. 2020. An Off-the-Shelf Approach for the Production of Fc Fusion Proteins By Protein Trans-Splicing Towards Generating a Lectibody in Vitro. International Journal of Molecular Sciences. 21(11): 4011.
Jayapal, K. P., Wlaschin, K. F., Hu, W. S., and Yap, M. G. 2007. Recombinant Protein Therapeutics from CHO cells-20 Years and Counting. Chemical Engineering Progress. 103(10): 40.
Jonathan, S., 2015. Bacterial Modulation of Host Glycosylation - in Infection, Biotechnology, and Therapy. Dissertation. Lund University, Sweden.
Jones, T. D., Hanlon, M., Smith, B. J., Heise, C. T., Nayee, P. D., Sanders, D. A., and Baker, M. P. 2004. The Development of a Modified Human IFN-α2b Linked to the Fc Portion of Human IgG1 as a Novel Potential Therapeutic for the Treatment of Hepatitis C Virus Infection. Journal of Interferon and Cytokine Research. 24(9): 560-572.
Kaufman, R. J., and Sharp, P. A. 1982. Amplification and Expression of Sequences Cotransfected with a Modular Dihydrofolate Reductase Complementary DNA Gene. Journal of Molecular Biology. 159(4): 601-621.
Kobata, A. 1992. Structures and Functions of The Sugar Chains of Glycoproteins. European Journal of Biochemistry. 209(2): 483-501.
Kunert, R., and Reinhart, D. 2016. Advances in Recombinant Antibody Manufacturing. Applied Microbiology and Biotechnology. 100: 3451-3461.
Kwak, C. Y., Park, S. Y., Lee, C. G., Okino, N., Ito, M., and Kim, J. H. 2017. Enhancing the Sialylation of Recombinant EPO Produced in CHO Cells via the Inhibition of Glycosphingolipid Biosynthesis. Scientific Reports. 7(1): 13059.
Langer, E. S. 2011. Trends in Perfusion Bioreactors: The Next Revolution in Bioprocessing. BioProcess Int. 9(10): 18-22.
Meuris, L., Santens, F., Elson, G., Festjens, N., Boone, M., Dos Santos, A., and Callewaert, N. 2014. GlycoDelete Engineering of Mammalian Cells Simplifies N-glycosylation of Recombinant Proteins. Nature Biotechnology. 32(5): 485-489.
Mitoma, H., Horiuchi, T., Tsukamoto, H., and Ueda, N. 2018. Molecular Mechanisms of Action of Anti-TNF-α Agents–Comparison Among Therapeutic TNF-α Antagonists. Cytokine. 101: 56-63.
Molecular Devices (2023). Monoclonality
https://www.moleculardevices.com/applications/monoclonality
Ohtsubo, K., and Marth, J. D. 2006. Glycosylation in Cellular Mechanisms of Health and Disease. Cell. 126(5): 855-867.
Omasa, T., Onitsuka, M., and Kim, W. D. 2010. Cell Engineering and Cultivation of Chinese Hamster Ovary (CHO) Cells. Current Pharmaceutical Biotechnology. 11(3): 233-240.
Pierce, J. G., and Parsons, T. F. 1981. Glycoprotein Hormones: Structure and Function. Annual Review of Biochemistry. 50(1): 465-495.
Qureshi, H. K., Veeresham, C., and Srinivas, C. 2021. Analytical Method Development and Validation of Etanercept by UV and RP-UFLC Methods. American Journal of Analytical Chemistry. 12(12): 493-505.
Reinke, S. O., Lehmer, G., Hinderlich, S., and Reutter, W. 2009. Regulation and Pathophysiological Implications of UDP-GlcNAc 2-epimerase/ManNAc kinase (GNE) as the Key Enzyme of Sialic Acid Biosynthesis.
Sanders, P. G., and Wilson, R. H. 1984. Amplification and Cloning of the Chinese Hamster Glutamine Synthetase Gene. The EMBO Journal. 3(1): 65-71.
Santoso, A., Septisetyani, E. P., Ramadani, R. D., Rubiyana, Y., Prasetyaningrum, P. W., Wisnuwardhani, P. H., and Nuraini, N. 2022. Glycoengineering of Darbepoetin-α in CHO-DG44 Cells through Overexpression of α-2, 3-sialyl-transferase and CMP-sialic Acid Transporter. HAYATI Journal of Biosciences. 29(2): 204-213.
Schroeder Jr, H. W., and Cavacini, L. 2010. Structure and Function of Immunoglobulins. Journal of Allergy and Clinical Immunology. 125(2): S41-S52.
Sinclair, A. M., and Elliott, S. 2005. Glycoengineering: the Effect of Glycosylation on the Properties Of Therapeutic Proteins. Journal of Pharmaceutical Sciences. 94(8): 16261635.
Son, Y. D., Jeong, Y. T., Park, S. Y., and Kim, J. H. 2011. Enhanced Sialylation of Recombinant Human Erythropoietin in Chinese Hamster Ovary Cells by Combinatorial Engineering of Selected Genes. Glycobiology. 21(8): 1019-1028.
Stäsche, R., Hinderlich, S., Weise, C., Effertz, K., Lucka, L., Moormann, P., and Reutter, W. 1997. A Bifunctional Enzyme Catalyzes the First Two Steps in N-Acetylneuraminic Acid Biosynthesis of Rat Liver. Journal of Biological Chemistry. 272(39): 24319-24324.
Takagi, Y., Yamazaki, T., Masuda, K., Nishii, S., Kawakami, B., and Omasa, T. 2017. Identification of Regulatory Motifs in the CHO Genome for Stable Monoclonal Antibody Production. Cytotechnology. 69: 451-460.
Thi Sam, N., Misaki, R., Ohashi, T., and Fujiyama, K. 2018. Enhancement of Glycosylation by Stable Co-Expression of Two Sialylation-Related Enzymes on Chinese Hamster Ovary Cells. Journal of Bioscience and Bioengineering. 126(1): 102–110.
https://doi.org/10.1016/J.JBIOSC.2018.01.010
Tripathi, N. K., and Shrivastava, A. 2019. Recent Developments in Bioprocessing of Recombinant Proteins: Expression Hosts and Process Development. Frontiers in Bioengineering and Biotechnology. 7: 420.
Urlaub, G., and Chasin, L. A. 1980. Isolation of Chinese Hamster Cell Mutants Deficient in Dihydrofolate Reductase Activity. Proceedings of the National Academy of Sciences. 77(7): 4216-4220.
Varki, A. 2011. Evolutionary Forces Shaping the Golgi Glycosylation Machinery: Why Cell Surface Glycans are Universal to Living Cells. Cold Spring Harbor Perspectives in Biology. 3(6): a005462.
Wang H, Du Y, Zhang R, Xu J, Liu L, United States Patent, Patent No : US 11,279,742 B2, Date of Patent 22 Maret 2022.
Wang, Q., Yin, B., Chung, C. Y., and Betenbaugh, M. J. 2017. Glycoengineering of CHO cells to improve product quality. Heterologous Protein Production in CHO Cells: Methods and Protocols. 25-44.
Wippermann, A., Rupp, O., Brinkrolf, K., Hoffrogge, R., and Noll, T. 2015. The DNA Methylation Landscape of Chinese Hamster Ovary (CHO) DP-12 cells. Journal of Biotechnology. 199: 38-46.
Wong, N. S., Yap, M. G., and Wang, D. I. 2006. Enhancing Recombinant Glycoprotein Sialylation Through CMP‐Sialic Acid Transporter Overexpression in Chinese Hamster Ovary Cells. Biotechnology and Bioengineering. 93(5): 1005-1016.
Yang, Z., Wang, S., Halim, A., Schulz, M. A., Frodin, M., Rahman, S. H., and Clausen, H. 2015. Engineered CHO cells for Production of Diverse, Homogeneous Glycoproteins. Nature Biotechnology. 33(8): 842-844.
Yehuda, S., and Padler-Karavani, V. 2020. Glycosylated Biotherapeutics: Immunological Effects of N-glycolylneuraminic Acid. Frontiers in Immunology. 11: 21.
Zhang, Y., Katakura, Y., Ohashi, H., and Shirahata, S. 1997. Efficient and Inducible Production of Human Interleukin 6 in Chinese Hamster Ovary Cells Using a Novel Expression System. Cytotechnology. 25(1-3): 53-60.
DOI: https://doi.org/10.24843/JSIMBIOSIS.2023.v11.i02.p11
249
Discussion and feedback