INDUKSI DAN MULTIPLIKASI TANAMAN PAKAN TERNAK LEUCAENA KX2 SECARA INVITRO
on
pastura Vol. 4 No. 2 : 83 - 87
ISSN : 2088-818X
INDUKSI DAN MULTIPLIKASI TANAMAN PAKAN TERNAK LEUCAENA KX2 SECARA INVITRO
Sajimin*, N.D. Purwantari* and D.Sukmadjaja**
*Indonesian Reserach Institute for Animal Production, P.O. Box 221, Bogor 16002 **Indonesian Center for Agriculture Biotechnology & Genetic Resources, Jl. Tentara Pelajar 3A Bogor 16114
ABSTRAK
Leucaena KX2 termasuk tanaman pakan ternak leguminosa pohon serbaguna dan toleran terhadap serangan hama kutu loncat. Pengembangan tanaman ini untuk budidaya ataupun untuk tujuan konservasi masih belum optimal karena terbatasnya bibit. Teknik kultur jaringan merupakan alternatif teknologi yang mampu menyediakan bibit secara massal, seragam dan relatif cepat. Tahap yang harus dilakukan dalam perbanyakan bibit melalui kultur jaringan adalah multiplikasi tunas yang menjadi kunci keberhasilan teknik perbanyakan ini. Penelitian dilakukan di laboratorium kultur jaringan BB-Biogen dan Ciawi untuk induksi tunas dan multiplikasi tunas. Penelitian dilakukan dalam dua tahap (1) induksi tunas (2) multiplikasi tunas secara invitro. Hasil penelitian menunjukkan bahwa media MS dan WPM + BA 0,5 mg/lt untuk induksi tunas lebih baik dibanding pada media MS (kontrol). Kemudian multiplikasi tunas diperoleh pada media MS + BA 0,5 mg/lt + TDZ 0,03 mg/lt dengan jumlah tunas rata-rata 4,0 tunas dan jumlah daun 7 helai lebih tinggi dibanding pada media MS + BA 0,05 +TDZ 0,01 mg/lt maupun penambahan TDZ 0,05 mg/lt rata-rata 4,2 tunas dengan 6 daun. Penggunaan media MS untuk induksi dan multiplikasi tunas diperoleh tunas lebih rendah dibanding pada media WPM.
Kata kunci : invitro, induksi tunas, Leucaena KX2, media, zat pengatur tumbuh
ABSTRACT
Leucaena KX2 hybrid is multipurpose forage leguminous tree, psyllids tolerant. Lack of the availability of this hybrid seed, it causes their development has not been optimal yet. Tissue culture technique is one of the alternative way to produce of L. leucocephala KX2 hybrid in large scale, quick and uniform. Shoot multiplication is key in producing plant by tissue culture technique. Experiment was conducted at BB-Biogen tissue culture laboratorium and at IRIAP Laboratorium in Ciawi. Two steps activities were done (1) bud induction (2) invitro shoot multiplication. Results shows that for shoot induction MS and WPM + BA 0,5 mg/lt media was perfomed better than MS media (control). Shoot multiplication MS + BA 0,5 mg/lt + TDZ 0,03 mg/lt media was produced average number of shoot 4,0 and 7 leaves. This was higher than on MS + BA 0,05 +TDZ 0,01 mg/lt media as well as with added TDZ 0,05 mg/lt which produced 4,2 shoot, 6 leaves. Application of MS media for bud induction and shoot multiplication produced lower shoot than WPM media.
Kata kunci : invitro, shoot induction, Leucaena KX2, media, plant growth regulator
PENDAHULUAN
Leucaena adalah jenis leguminosa pohon yang cepat tumbuh dan ,termasuk jenis pohon serbaguna (JPSG) yang tersebar luas didaerah tropis dan subtropics. Tanaman ini bisa tumbuh mencapai ketinggian 5 meter dan mempunyai daun majemuk.. Tanaman ini berguna untuk mencegah erosi, mempertahankan kesuburan tanah sumber kayu bakar dan makanan ternak. Di Indonesia, tanaman ini telah digunakan lebih dari 50 tahun sebagai peneduh tanaman kopi serta untuk mempertahankan kesuburan tanah. Lamtoro dapat menghasilkan hijauan dalam jumlah yang tinggi dan tanaman ini dapat bertahan terhadap pemangkasan berulang kali. Produksi hijauan dapat mencapai 20 ton bahan kering/ha/th dengan total protein kasar 3 ton/ha/tahun (Jones, 1979).
Sebagai hijauan pakan ternak lamtoro memiliki nilai gizi yang cukup baik sehingga daunnya sangat disukai ternak ruminansia. Di NTT lamtoro merupakan tanaman pakan sapi yang dimanfaatkan pada musim kering panjang dan menjadi pakan utama. Namun semenjak adanya serangan hama kutu loncat lamtoro tahun 1986 lamtoro banyak yang mati. Namun setelah dihasilkan Leucaena KX2 yang tahan serangan hama kutu loncat mulai dikembangkan lagi sebagai pakan ternak.
Jenis Leucaena KX2 merupakan tanaman hibrid yang menghasilkan biji setelah ditanam mengalami segregasi dan rentan terhadap serangan kutu loncat. Menurut Brewbaker (2008) Leucaena KX2 hibrid merupakan hasil persilangan L.leucocephala dan L.pallida yang tahan serangan hama kutu loncat lamtoro. Tanaman ini juga tahan kering dengan
produksi dan kualitas hijauan sama L.leucocephala. Austin et al (1995) melaporkan produksi Leucena KX2 per potong 6,4 t/ha sedangkan L. leucocephala 1,9 t/ ha pada interval potong 11 mg pada kondisi terserang kutu loncat. Kemudian Purwantari (2005) produksi bahan kering Leucaena KX2 mencapai 12,48 t/ha/th sedangkan L.leucocephala K28 1,43 t/ha/th dengan kandungan protein maupun P tidak berbeda dengan leucaena lainnya. Selanjutnya Shi dan Brewbaker (2006) Leucaena KX2 adalah tanaman pakan yang bermutu tapi steril sehingga perbanyakannya harus dengan cara vegetatif untuk pemenuhan kebutuhan bibit.
Perbanyakan tanaman secara konvensional memerlukan waktu lama untuk mendapatkan bibit dalam jumlah banyak. Teknologi kultur jaringan telah terbukti dapat menghasilkan bibit untuk untuk pemenuhan kebutuhan bibit dalam jumlah banyak. Menurut Ahloowalia et al (2004), Mariska (2002), dan Lestari (2008), perbanyakan tanaman dengan teknik ini memiliki kelebihan yaitu tanaman dapat diperbanyak setiap saat, daya multiplikasi tinggi dari bahan tanaman yang sedikit, dihasilkan bibit yang seragam bebas virus maupun penyakit. Teknik ini ditujukan untuk tanaman yang menghadapi masalah seperti daya kecambah rendah, tanaman hibrida yang tetua jantanya steril, tanaman langka dan tanaman yang selalu diperbanyak dengan vegetatif. Teknik kultur jaringan untuk mendapatkan tanaman bebas virus, pelestarian plasma nutfah berupa sel atau organorgan tumbuhan yang dapat diregenerasikan menjadi tanaman lengkap. Di Indonesia telah banyak dilakukan pada tanaman pangan. tanaman hias, tanaman keras. Sedangkan pada tanaman pakan ternak belum dilakukan, padahal bibit tanaman yang bermutu masih dibutuhkan terutama jenis-jenis tanaman serba guna yang tidak berbiji. Makalah ini mempelajari perbanyakan tanaman Leucaena KX2 secara invitro untuk perbanyakan tanaman yang mudah dan cepat.
MATERI DAN METODE
Percobaan dilakukan menggunakan tanaman leguminosa Leucaea KX2 yang dipelihara dirumah kaca sebagai sumber eksplan, pelaksanaan kegiatan dilakukan melalui beberapa tahapan .
Tahap 1. Induksi pertunasan Leucaena KX2 melalui kultur in vitro menggunakan eksplan mata tunas satu buku.
Bahan percobaan menggunakan mata tunas yang telah di sterilisasi dengan cara mencuci eksplan menggunakan deterjen sampai bersih. Selanjutnya eksplan disterilisasi menggunakan alkohol 70 % selama 10 menit, HgCl2 0,2 % 3 menit, kloroks 30 % selama 5 menit dan kloroks 20 % selama 7 menit, selanjutnya dicuci dengan aquades steril tiga kali dan dicelupkan pada betadin 1 menit. Kemudian di tanam pada media tanpa zat pengatur tumbuh untuk induksi tunas. Setelah diperoleh tunas steril dalam jumlah
banyak selanjutnya ditanam pada media multiplikasi tunas yaitu media dasar MS dan WPM dikombinasikan dengan 3 taraf BA (0, 0.5 dan 1,0) mg/l.
Tahap 2: Multiplikasi tunas Leucaena KX2
Kegiatan penelitian ini dilakukan dari hasil kegiatan induksi tunas yang diperoleh tahap satu pada formula media MS dan WPM yang terbaik dikombinasikan dengan TDZ (thidiazuron) dengan konsentrasi (0.0; 0.01; 0.03; 0.05 ) mg/l. Rancangan percobaan adalah acak lengkap pola factorial dengan perlakuan konsentrasi media diulang 10 kali.
Peubah yang diamati untuk organogenesis adalah jumlah tunas, tinggi tunas, jumlah daun serta visual biakan, sedangkan untuk embryogenesis somatik yang diamati jumlah kalus embriogenik, jumlah struktur embrioid dan visual kalus. Eksplan yang sudah di tanam diletakkan di dalam rak kultur dengan intensitas penyinaran 1000 luks lama penyinaran selama 16 jam sehari.
HASIL DAN PEMBAHASAN
Induksi tunas Leucaena KX2 menggunakan satu mata tunas
Penelitian ini diawali dengan memelihara tanaman Leucaena KX2 di rumah kaca sebagai sumber eksplan yang diintroduksikan ke Indonesia untuk menanggulangi serangan hama kutu loncat. Percobaan menggunakan eksplan berupa stek mikro satu buku disterilisasi dalam kondisi aseptik menggunakan Alkohol 70 %, HgCl 0,2%. Eksplan yang diperoleh dikulturkan pada media seperti yang tertera pada Tabel 1.
Tabel 1. Rataan tinggi, jumlah tunas dan daun eksplan Leucaena KX2 umur 6 minggu setelah tanam pada media MS.
|
Media |
Tinggi tunas (cm) |
Jumlah tunas (batang) |
Jumlah daun (helai) |
|
MS + BA 0,0 mg/lt |
2,49 a |
1.14 a |
4,00 a |
|
MS + BA 0,5 mg/lt |
4,32 b |
4,20 b |
7,00 b |
|
MS + BA 1,0 mg/lt |
5,15 a |
3,00 b |
5,10 a |
Keterangan : Angka yang diikuti huruf sama dalam kolom sama tidakmbeda nyata (P<0,05)
Pada Tabel 1 terlihat perbedaan media berpengaruh nyata (P<0,05) terhadap pertumbuhan tunas tertinggi 5,15 cm perlakuan BA 1,0 mg/lt kemudian diikuti perlakuan BA 0,5 mg/lt dan terendah pada perlakuan kontrol. Tapi jumlah tunas terbanyak pada perlakuan BA 0,5 mg/lt yaitu 4,2 batang kemudian diikuti perlakuan BA 1,0 mg/lt 3 batang dan terendah perlakuan kontrol BA 0,0 mg/lt 1,14 batang. Sedangkan jumlah daun pada perlakuan BA 0,5 mg/lt rata-rata tertinggi 7 helai. Hasil tersebut nampaknya formula media dengan konsentrasi BA 0,5 mg/lt memberikan respon pertumbuhan tunas terbaik kemudian diikuti BA 1,0 mg/lt. Jumlah tunas pada perlakuan tersebut rata-rata lebih tinggi dari pada kontrol. Lebih tingginya jumlah tunas hasil penelitian ini diduga bahwa
konsentrasi BA berfungsi merangsang pembelahan sel untuk pertumbuhan tunas. Hasil yang sama juga diperoleh pada media WPM (Tabel 2) dengan penambahan BA memberikan respon tunas terbaik pada konsentrasi 0,5 mg/lt dengan jumlah tunasnya, lebih tinggi dibanding tanpa BA. Boogher dan Hussey (2011) juga melaporkan bahwa Leucaena yang ditanam pada media dengan penambahan BA jumlah tunasnya lebih tinggi.
Tabel 2. Rataan tinggi, jumlah tunas dan daun eksplan setelah 6 minggu
|
Perlakuan |
Tinggi tunas (cm) |
Jumlah tunas (batang) |
Jumlah daun (helai) |
|
WPM + BA 0,0 mg/lt |
1,70 a |
1,00 a |
3,00 a |
|
WPM+ BA 0,5 mg/lt |
1,40 a |
2,00 b |
4,00 a |
|
WPM+ BA 1,0 mg/lt |
2,20 b |
1,30 a |
4,00 a |
Keterangan : Angka yang diikuti huruf sama dalam kolom sama tidak beda nyata (P<0,05)
Induksi tunas Leucaena KX2 yang diperoleh memperlihatkan konsentrasi BA berpengaruh nyata (P<0,05) pada WPM muncul tunas dari buku-buku pada minggu ke 3-4 setelah perlakuan media pertunasan (Gambar 3). Menurut Holt et al (1962) buku-buku merupakan eksplan yang baik untuk menginduksi tunas dan akar, dimana calon-calon tunas banyak ditemukan.
Pengaruh daya induksi berbagai formulasi media terhadap tunas, jumlah daun dari satu mata tunas terlihat bahwa perlakuan BA 0,5 mg/lt pada media MS maupun WPM merupakan konsentrasi yang paling efektif dalam menginduksi tunas. Hal ini disebabkan BA merupakan salah satu hormone sitokinin sintetis yang mempunyai peran fisiologis untuk mendorong pembelahan sel, sehingga penambahan BA kedalam media dapat merangsang pembentukan tunas majemuk (Lizawati et al, 2009). Demikian juga menurut Wattimena (1988) bahwa pengaruh sitokinin pada berbagai proses fisiologis diduga pada tingkat pembuatan protein, mengingat kesamaan struktur sitokinin dengan adenine yang merupakan kesamaan komponen dari DNA dan RNA. Selanjutnya Lizawati et al ( 2009) mengemukakan penambahan sitokinin merangsang pembelahan sel melalui peningkatan laju sintesis protein, beberapa diantara protein dapat berperan sebagai enzim yang dibutuhkan untuk terjadinya mitosis.
Multiplikasi tunas Leucaena KX2
Hasil induksi tunas Leucaena KX2 diperoleh terbaik pada media MS + BA 0,5 mg/lt dan WPM + BA 0,5 mg/lt. Media tersebut untuk multiplikasi tunas dikombinasikan dengan Tdz dan hasilnya seperti pada Tabel 3 dan Tabel 4.
Pada Tabel 3 dan 4 terlihat bahwa penambahan zat pengatur tumbuh TDZ menunjukkan adanya peningkatan multiplikasi tunas. Menurut Pierck (1987) thidiazuron merupakan senyawa organik yang banyak digunakan dalam perbanyakan in vitro karena menyerupai sitokinin. Kombinasi sitokinin
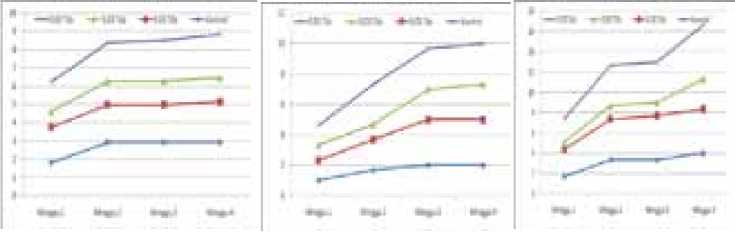
dengan auksin dapat memacu morfogenesis dalam pembentukan tunas. Perlakuan kombinasi thidiazuron dan BA pada penelitian ini juga meningkatkan jumlah tunas Leucaena KX2 yang mulai muncul pada minggu ke 2 - 3 tumbuh dari ketiak daun (Gambar 1 dan Gambar 2). Selanjutnya pada minggu ke 3– 4 pertumbuhan jumlah tunas tidak menunjukkan kenaikan yang nyata. Hasil ini diduga pertumbuhan tunas dalam waktu 4 minggu ketersediaan hara dalam media telah habis dan eksplan telah mulai layu, necrosis dan daunnya mencoklat sehingga perlu segera disubkultur. Menurut Lizawati et al (2009) bahwa setelah tanam 4 minggu perlu dilakukan subkultur karena hara dalam media telah habis agar tidak menyebabkan kematian. Kemudian Sujatha (2005) juga melaporkan bahwa subkultur pada kultur in vitro dilakukan setelah 4 minggu tanam.
Tabel 3. Rataan tinggi, jumlah tunas dan daun eksplan Leucaena KX2 pada media multiplikas MS umur 6 minggu
|
Perlakuan |
Tinggi tunas (cm) |
Jumlah tunas (batang) |
Jumlah daun (helai) |
|
MS+BA 0,5 mg/lt+Tdz 0,00 mg/lt |
2,60 b |
2,24 a |
4,07 ab |
|
MS+BA 0,5 mg/lt+Tdz 0,01 mg/lt |
1,88 a |
2,28 a |
2,75 a |
|
MS+BA 0,5 mg/lt+Tdz 0,03 mg/lt |
2,10 b |
4,00 b |
6,00 b |
|
MS+BA 0,5 mg/lt+Tdz 0,05 mg/lt |
2,01 b |
2,00 a |
3,69 a |
Keterangan : Angka yang diikuti huruf sama dalam kolom sama tidakmbeda nyata (P<0,05)
Tabel 4. Rataan tinggi, jumlah tunas dan daun eksplan Leucaena KX2 pada media multiplikasi WPM umur 6 minggu
|
Perlakuan media WPM |
Tinggi tunas (cm) |
Jumlah tunas (batang) |
Jumlah daun (helai) |
|
WPM+BA 0,5 mg/lt+Tdz 0,00 mg/lt |
2,90 b |
2,00 a |
4,00 a |
|
WPM+BA 0,5 mg/lt+Tdz 0,01 mg/lt |
2,23 b |
3,00 a |
4,30 a |
|
WPM+BA 0,5 mg/lt+Tdz 0,03 mg/lt |
1,33 a |
2,33 a |
3,00 a |
|
WPM+BA 0,5 mg/lt+Tdz 0,05 mg/lt |
2,37 b |
2,67 a |
5,30 b |
Keterangan : Angka yang diikuti huruf sama dalam kolom sama tidak beda nyata (P<0,05)
Pada media multiplikasi jumlah tunas yang dihasilkan pada media MS dan WPM menghasilkan tunas dan daun yang realtif lebih banyak dibanding perlakuan kontrol. Hasil yang sama juga dilaporkan Syahid dan Kristina (2008) bahwa kombinasi zat pengatur tumbuh BA dan TDZ juga meningkatkan jumlah tunas yang terbentuk pada umur satu bulan setelah perlakuan. Menurut Wattimena (1992) melaporkan bahwa thidizuron merupakan salah satu jenis auksin yang berfungsi untuk meningkatkan pembelahan sel untuk menghasilkan tanaman.
Pada grafik (Gambar 1 dan 2) terlihat bahwa tinggi tunas, jumlah tunas dan daun tunas mulai tumbuh setelah minggu ke dua dan terus meningkat, sedangkan tanpa thidiazuron jumlah tunasnya lebih rendah. Hasil ini nampaknya pertumbuhan tunas dipengaruhi adanya penambahan thidiazuron yang meningkatkan multiplikasi tunas. Menurut Lestari (2011) thidiazuron dapat menginduksi pembentukan
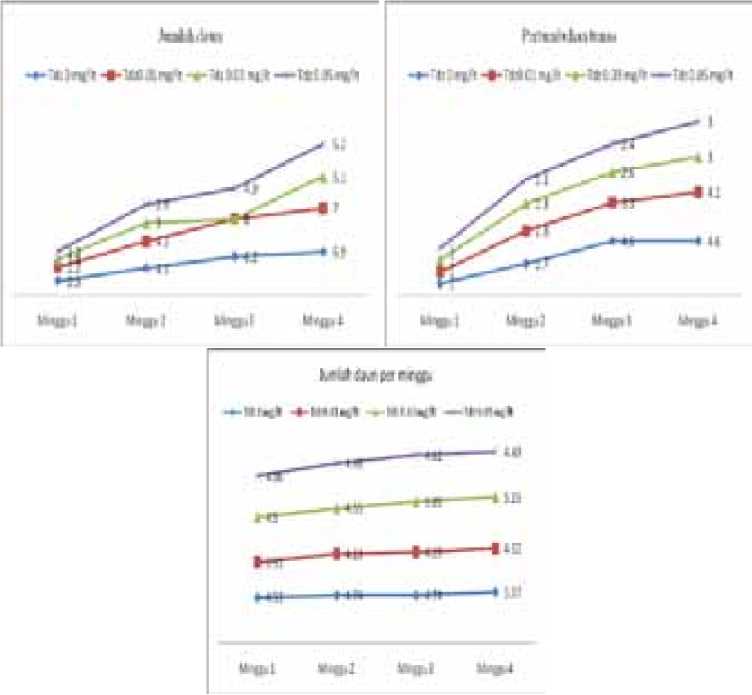
Gambar 1. Pertumbuhan tunas, jumlah tunas dan daun per minggu eksplan Leucaena KX2 pada media MS
Tinggi eksplan (cm)
Jumlah tunas (batang)
Jumlah daun (helai)
Gambar 2. Pertumbuhan tunas, jumlah tunas dan daun eksplan per minggu Leucaena KX2 pada media WPM
tunas adventif dan proliferasi tunas aksilar. Selain itu thidiazuron mendorong terjadinya perubahan sitokinin ribonukleitida menjadi ribonukleisida yang secara biologis lebih aktif memacu pembentukan tunas adventif. Perbedaan konsentrasi zat pengatur tumbuh pada penelitian ini nampaknya mempengaruhi pertumbuhan tunas berbeda. Pada kombinasi BA 0,5 mg/lt dan TDZ 0,03 mg/lt respon pertumbuhan tunas lebih baik disbanding perlakuan lainnya. Konsentrasi lebih tinggi (0,05 mg/lt TDZ) ternyata tidak nyata menaikkan jumlah tunas bahkan lebih rendah. Menurut George dan Sherington (1984) bahwa dalam batas-batas tertentu zat pengatur tumbuh tertentu mampu merangsang pertumbuhan, namun dapat bersifat sebagai penghambat apabila melebih konsentrasi optimum. Beberapa hasil penelitian juga dilaporkan bahwa kombinasi BA dan thidizuron untuk meningkatkan kemampuan proliferasi tunas. Menurut Lestari (2011) konsentrasi yang rendah thidiazuron lebih efektif dalam pembentukan tunas adventif. Hasil ini juga terlihat pada penelitian dengan kombinasi BA 0,5 mg/lt dan thidiazuron 0,03 ml pertumbuhan tunas lebih banyak sedangkan konsentrasi lainnya lebih aktif menyebabkan pertumbuhan tanaman.
Penambahan zat pengatur tumbuh TDZ 0,03 mg/lt
kedalam media yang sudah mengandung BA 0,5 mg/lt meningkatkan jumlah tunas dan berbeda nyata dengan perlakuan BA 0,5 mg/lt + TDZ 0,01 mg/lt dan BA 0,5 + TDZ 0,05 mg/lt maupun kontrol. Hasil penelitian ini menunjukkan adanya sinergisme antara kedua jenis zat pengatur tumbuh baik BA maupun TDZ yang diaplikasikan sehingga mampu memicu multiplikasi tunas kearah yang lebih banyak. Menurut Lu (1993) thidizuron kelompok sitokinin yang berfungsi dalam menginduksi pembelahan sel dan proliferasi tunas aksilar. Kemudian Nielson et al (1995) media yang mengandung dua jenis sitokinin yang berbeda dapat meningkatkan jumlah tunas yang dihasilkan dibanding satu jenis sitokinin saja.
SIMPULAN
Hasil percobaan induksi dan multiplikasi tunas pada media MS ditambahkan BA 0,5 mg/lt menghasilkan tunas lebih tinggi dibanding pada media WPM untuk menginduksi tunas eksplan Leucaena KX2 dari satu buku. Formula media MS dan WPM ditambah BA 0,5 mg/lt dikombinasikan dengan thidiazuron 0,03 mg/lt lebih efektif menginduksi multiplikasi tunas dari satu tunas menjadi 4 dan 3 tunas.
DAFTAR PUSTAKA
Ahloowalia, B.S., J. Prakash and V.A. Savangikar. 2004. Plant tissue Culture. Low cost options for tissue culture technology in developing countries. Proceeding of a Technical Meeting Organized by the Joint FAO/IAEA Division of Nuclear Techniques in Food and Agriculture and Held in Viena.Austria. P 3 – 10.
Austin, M.T., C.T. Sorensson, J.L.Brewbaker, W.G.Sun, and H.M. Shelton. 1995 Forage dry matter yields and psyl-lid resistance of thirty-one leucaena selection in Hawaii. In (eds). Brewbaker,J.l. 2008. registration of KX2-Hawaii,Interspecific-Hybrid Leucaena. Journal of Plant registration 2: 190 -193. Crop Science Society of America. USA.
Brewbaker,J.l. 2008. Registration of KX2-Hawaii,Interspecific-Hybrid Leucaena. Journal of Plant registration 2: 190 -193. Crop Science Society of America. USA.
Boogher, C.A and M.A. Hussey. 2011. Micropropagation of Leucaena leucocephala (Lam de Wit). http://agrilife.org/ forages a flexas/files/2011/01/ micropro-pagation. pdf. Akses: 13/2/2012.
Holt, R.W. 1962. Botany. Third Edition. Chapter 8: The structure and growth of stems. In: Lizawati, T.Novita dan R. Purnamaningsih. 2009. Induksi dan multiplikasi tunas jarak pagar (Jatropha curcas L) secara invitro. J. Agronomi Indonesia. 37(1) : 78 – 85.
Jones, R.J. 1979. The value of Leucaena leucocephala as a feed for ruminants in the tropics. World Anim. Rev., No.31.
Lestari, E.G. 2008. Kultur Jaringan Menjawab Persoalan Pemenuhan Kebutuhan akan Peningkatan Kualitas Bibit Unggul dan Perbanyakannya secara besar-besaran. AkaDemia. Cimanggis Bogor. 60 p.
Lestari, E.G., 2011. Peranan Zat Pengatur Tumbuh dalam perbanyakan Tanaman melalui Kultur jaringan. Jurnal Agro Biogen 7(1) : 63 – 68.
Lizawati, T.Novita dan R. Purnamaningsih. 2009. Induksi dan multiplikasi tunas jarak pagar (Jatropha curcas L) secara
invitro. J. Agronomi Indonesia. 37(1) : 78 – 85.
Lu. C.L. 1993. The Use of Thidiazuron in Tissue Culture. In Vitro. Cell Dev. Biol. 29 : 92 – 96.
Mariska, I. 2002. Perkembangan Penelitian Kultur In Vitro pada Tanaman Industri, Pangan, dan Hortikultura. Buletin AgroBio 5(20 :45-50. Bogor.
Nielson, J.M., J. Hansen dan K. Braudt, 1995. Synergisme of thidiazuron and benzyladenim in axillary shoot formation depens on sequence of application in Miscanthus X agiformis “ Gigateus”. Plant Cell Tissue and organ culture. 41 : 165 – 170. 125 p.
Purwantari,N.D, 2005. forage Production of some lesser-known Leucaena species grown on acid soil. Indonesian Journal of Agricultural sciensce. 6(2): 46 – 51.
Pierick, R.L.m. 1987. In vitro culture of higher plants. In: Suhen-taka, E.B dan Sobir. 2010. Pengaruh konsentrasi Bad an NAA pada tahap multiplikasi secara invitro terhadap keberhasilan aklkmatisasi nenas (Ananas comasus L) Merr) kultivar smooth cayenne. Makalah Seminar Dep.Agronomi dan Hortikultura. Faperta IPB. http://rpository.ipb.ac.id.
Akses : 12/2/2012.
Syahid, S.F dan N.N. Kristina. 2008. Multiplikasi tunas, aklimatisasi dan analisis mutu simplisia daun encok (Plumbago zeylanica.L). asal kultur in vitro periode panjang. Bul. littro. 19 : 117 -128.
Shi,X.B., and J.L. Brewbaker. 2006. Vegetative propagation of Leucaena hybrids by cutting. Brewbaker,J.l. 2008. registration of KX2-Hawaii,Interspecific-Hybrid Leucaena. Journal of Plant registration 2: 190 -193. Crop Science Society of America. USA.
Sujatha,M., N. Mukta. 1996. Morphogenesis and plant regeneration from tissue culture of Jatropha curcas L. Plant Cell. Tissue and organ culture. In : Lizawati, T.Novita dan R. Purnamaningsih. 2009. Induksi dan multiplikasi tunas jarak pagar (Jatropha curcas L) secara invitro. J. Agronomi Indonesia. 37(1) : 78 – 85. 12(2): 50-55.
Wattimena, G.A. 1988. Zat pengatur tumbuh tanaman. Pusat Antar Universitas. Bioteknologi. IPB. Bogor.
87
Discussion and feedback