Isolasi dan Identifikasi Bakteri Selulolitik pada Buah Kopi Arabika (Coffea arabica L.)
on
Nandur
Vol. 1, No. 3, Juli 2021 https://ojs.unud.ac.id/index.php/nandur
EISSN: 2746-6957 | Halaman 130-138 Fakultas Pertanian, Universitas Udayana
Isolasi dan Identifikasi Bakteri Selulolitik pada Buah Kopi Arabika (Coffea arabica L.)
Nona Au Waling, Made Sritamin*), I Nyoman Wijaya
Program Studi Agroekoteknologi Fakultas Pertanian Universitas Udayana Jl. PB. Sudirman Denpasar, Bali 80232
*)Email: madesritamin@gmail.com
Abstract
Cellulolytic bacteria are microorganisms that can produce cellulase enzymes. Cellulolytic bacteria contain cellulase enzymes that play a role in the cellulose degradation processes. The purpose of this study was to isolate cellulolytic bacteria that capable to degrading cellulose from arabica coffee cherries collected from Catur Village, Kintamani. The results of bacterial isolation at 10-6 and 10-8 dilutions obtained 10 bacterial colonies. From the results of bacterial purification, 4 different bacterial isolates had different morphological characters. The results of the isolation of the colonies showed differences in a round and irregular shape, had raised and convex surfaces had red, cream, white and yellow colors, had curved and smooth edges. Tests were carried out on four bacterial isolates to determine the clear zone index. Only the L isolate in the congo red test had a diameter of clear zone 2.5 mm and with score 3 based on cellulolytic index value L isolate categorized as strong degrading cellulose bacteria.
Keywords: coffee cherries, cellulolytic bacteria, cellulose
Negara Indonesia merupakan pemroduksi kopi yang terbesar pada urutan keempat di dunia setelah negara Brasil,iVietnamidaniKolombia yang dapat mencapai total produksi pertahun sebanyak 639.000 ton (ICO, 2019). Jenis kopi utama yang diproduksi di Indonesia yaitu kopi arabika serta kopi robusta. Teknik pengolahan kopi terdiri dari dua jenis teknik, yaitu teknik pengolahan kering dan teknik pengolahan basah. Pada teknik pengolahan basah memerlukan proses fermentasi selama 7 hari agar mempermudah pemisahan biji dan kulit buah kopi. Lama waktu fermentasi merupakan salah satu kelemahan pada pengolahan basah.
Buah kopi arabika mengandung selulosa, hemiselulosa serta lignin secara berturut-turut sebesar 46,5%; 35%; dan 18,8% yang dapat didegradasi oleh enzim selulase (Perez and Jose, 2016). Isolasi bakteri merupakan metode yang berguna agar memperoleh isolat yang murni dari sampel tertentu untuk diamati dan dikembangkan (Suardana et al., 2007). Media Carboxy Mehyl Cellulose (CMC) mengandung substrat selulosa untuk bakteri selulolitik.
Bakteri selulolitik adalah mikroorganisme yang dapat memproduksi enzim selulase yang berperan dalam proses degradasi selulosa. Selulosa hanya dapat disederhanakan menjadi glukosa dengan bantuan dari enzim selulase (Buselli et al., 2007). Selulosa dihidrolisis oleh enzim selulase dengan zona bening yang terbentuk disekitar koloni bakteri sebagai respons terhadap keberadaan selulosa di lingkungannya (Utama et al., 2018). Bahan organik diketahui mengandung selulosa yang termasuk sebagai substrat yang baik untuk pertumbuhan dari bakteri selulolitik (Simanungkalit et al., 2006). Buah kopi arabika yang mengandung banyak selulosa, hemiselulosa serta lignin yang dapat didegradasi oleh enzim selulase, sehingga diduga terdapat bakteri selulolitik yang berpotensi mendegradasi selulosa.
Waktu dilaksanakannya penelitian ini adalah pada bulan Januari sampai dengan Mei 2021. Tempat dilaksanakan penelitian adalah dixLaboratorium Bioteknologi Pertanian, Fakultas Pertanian Universitas Udayana. Sampel buah kopi diperoleh pada tanggal 9 Agustus 2020, dari Desa Catur, Kecamatan Kintamani, Kabupaten Bangli.
Bahan-bahan yang diaplikasikan pada pelaksanaan penelitian meliputi pulp kopi arabika, media Carboxy Methyl Cellulose (CMC), aquades, KNO3, K2HPO4, CaCl2, MgSO4, FeSO4, glukosa, etanol 95%, H2O23%, alkohol 70%, yeast ekstrak, agar, Reagen Congo Red 0,1%, larutan NaCl, nistatin, kristal violet, lugol, safranin, minyak imersi. Alat-alat yang digunakan pada penelitian ini meliputi plastic wrap, termometer, tabung reaksi, mikro pipet, autoklaf, colony counter, lemari pendingin, neraca analitik, jarum ose, pinset, cawan petri, object glass, mikroskop, vortex, microtube, rak tabung reaksi, magnetic stirrer, sendok pipih, laminar air flow, blue tip, erlenmeyer, ependrof, inkubator, baker glass, bunsen, botol film, gelas ukur, botol film, botol semprot, pipet tetes, spatula, hot plate, masker, sarung tangan, buku catatan, alat tulis, serta alat dokumentasi.
Media CMC dibuat menggunakan komposisi dalam 100 ml aquades, yaitu 1 g CMC; 0,05 g K2HPO4; 0,075 KNO3; 0,002 g FeSO4; 0,2 g yeast; 1,5 g agar; 0,02 g MgSO4; 0,1 g glukosa. Bahan-bahan tersebut dihomogenkan dan disterilisasi dengan menggunakan mesin autoklaf dengan suhu 121oC serta durasi 15 menit.
Sampel berupa fermentasi kulit buah kopi yang telah diperoleh sebanyak 5 gr digerus menggunakan mortar. Hasil gerusan sampel dimasukkan ke dalam tabung Erlenmeyer yang telah terisi dengan akuades steril 45 ml lalu dihomogenkan. Pengeceran bertingkat 10-1 hingga 10-8 dilakukan dengan mengambil sebanyak 1 ml suspensi bakteri sampel dengan mikro pipet, setelah itu suspensi bakteri dipindahkan ke dalam tabung
reaksi yang telah diisi oleh akuades 9 ml yang divortek hingga homogen. Isolasi pada media CMC sebanyak 15 ml yang telah memadat yaitu dengan meneteskan 0,1 ml cairan pada tingkat pengenceran 10-5 hingga 10-8 dengan menggunakan micro pipet. Petri berisi isolat bakteri diinkubasi selama 48 jam dengan suhu 37℃ secara anaerobik.
Identifikasi isolat bakteri yaitu dengan melakukan pengamatan morfologi secara makrokopis dan mikroskopis. Pengamatan morfologi dengan cara makroskopis yaitu pengamatan morfologi koloni yang terbentuk dari bakteri yang terdapat pada media CMC berupa jumlah, bentuk, warna serta tepian koloni bakteri. Pengamatan morfologi secara mikroskopis dengan cara pewarnaan Gram. Pewarnaan Gram diamati di bawah mikroskop dengan menggunakan pembesaran 1000 kali, agar sel bakteri tampak jelas pada mikroskop cover glass ditetesi minyak imersi. Sel bakteri yang menunjukkan Gram positif tampak berwarna biru keunguan, sedangkan pada sel bakteri Gram negatif tampak berwarna kemerahan (Cappuccino and Sherman, 1998).
Purifikasi dilakukan dengan cara pengambilan terhadap koloni yang tumbuh terpisah yang mana terlihat berbeda secara fisik (warna dan bentuk) (Gunam et al., 2018). Koloni bakteri yang dipurifikasi merupakan koloni yang tunggal pada ujung hasil goresan radian, selanjutnya diinokulasikan pada media tumbuh baru dengan metode gores radian dilanjutkan dengan Inkubasi selama 48 jam serta suhu 37℃. Setelah itu koloni tunggal bakteri yang telah tumbuh pada media tumbuh diinokulasikan sebagai stok uji isolat bakteri berikutnya.
Seleksi bakteri selulolitik dilakukan dengan metode congo red dengan media agar CMC. Pembuatan cairan congo red yaitu sebanyak 0,1 g congo red terlarut di dalam akuades 100 ml. Congo red dituangkan langsung ke kultur bakteri serta diamkan dengan durasi 15 menit. Setelah itu larutan congo red disisihkan serta dibilas menggunakan NaCl 1% dengan durasi 15 menit serta dilakukan tiga kali pengulangan. Tujuan dari proses pencucian agar adalah untuk dapat memisahkan congo red yang tidak dapat terikat pada polisakarida molekul bakteri. Setelah pencucian dilaksanakan inkubasikan media tumbuh yang baru pada suhu 37℃ selama kurang lebih 48 jam, agar zona bening dapat terbentuk lebih sempurna.
diameter zona beninq (mm) — diameter koloni(mm)
Indeks Selulolitik =----------------------, .---------------(----)
diameter koloni
Parameter daya degradasi selulosa adalah berdasarkan dari nilai IS yang didapat. Klasifikasi nilai IS digolongkan tinggi apabila nilai IS didapatkan lebih besar dari 2, nilai IS dikategorikan sedang apabila didapatkan nilai antara 1 sampai dengan 2 dan
dikategorikan rendah apabila kurang dari 1 serta tidak ada nilai IS bila tidak ditemukan zona bening (Choi et al., 2005).
Data yang telah didapatkan tersaji secara deskriptif yang meliputi hasil isolasi bakteri, penyeleksian bakteri selulolitik, karakterisasi morfologi bakteri serta ditampilkan dalam bentuk Tabel serta Gambar.
Morfologis bakteri hasil isolasi dibedakan karakternya berdasarkan pengamatan warna, bentuk koloni, elevasi koloni serta dari tepian koloni (Hadioetomo, 1993). Inkubasi bakteri setelah 48 jam didapatkan hasil pengenceran 10-5 hingga 10-8 secara berturut yaitu sebanyak 12 koloni, 6 koloni, 1 koloni dan 4 koloni bakteri. Hasil dari pengenceran 10-6 dan 10-8 didapatkan sebanyak 1 koloni berwarna merah, berbentuk bulat, elevasi tampak cembung, memiliki tepian yang licin, sebanyak 4 koloni berwarna krem, dengan bentuk tidak beraturan, elevasi tampak timbul, memiliki tepian yang berlekuk, sebanyak 3 koloni berwarna putih, berbentuk bulat, dengan evelasi timbul, memiliki tepian yang licin, sebanyak 2 koloni berwarna kuning, berbentuk bulat, dengan elevasi timbul, memiliki tepian yang licin yang tersaji pada Tabel 1.
Tabel 1. Morfologi Koloni Bakteri pada Media Tumbuh Pengenceran 10-6 dan 10-8
|
Isolat |
Morfologi Koloni Bakteri | ||||
|
Kode |
Jumlah |
Warna |
Bentuk |
Elevasi |
Tepian |
|
K |
1 |
Merah |
Bulat |
Cembung |
Licin |
|
L |
4 |
Krem |
Tak beraturan |
Timbul |
Berombak |
|
M |
3 |
Putih |
Bulat |
Timbul |
Licin |
|
N |
2 |
Kuning |
Bulat |
Timbul |
Licin |
Koloni bakteri yang tumbuh pada media CMC hasil pengenceran bertingkat 10-6 hingga 10-8 dibedakan berdasarkan warna koloni, bentuk koloni, tepian koloni serta elevasi koloni yang serupa, didapatkan 4 jenis isolat bakteri berbeda yaitu K, L, M dan N. Isolat bakteri dapat tumbuh pada substrat yang berisi CMC, menunjukkan bahwa bakteri yang tumbuh dapat menggunakan selulosa sebagai suplai nutrisi terutama suplai karbon (Alam et al., 2004).
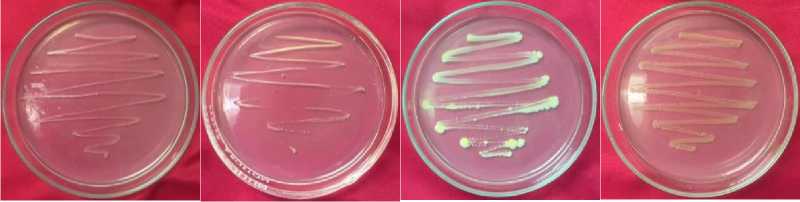
Purifikasi atau pemurnian bakteri bertujuan untuk mendapatkan suatu isolat murni yang tunggal serta dapat tumbuh sesuai dengan karakter yang telah diamati. Pemurnian isolat bakteri menggunakan metode gores yang bentuk goresan pada cawan petri dimulai dari bagian atas hingga bagian bawah membentuk garis zig-zag untuk memperkecil jumlah dari mikroba yang tumbuh pada Gambar 1.
-
(a) (b) (c) (d)
Gambar 1. Hasil Purifikasi Bakteri dengan Gores Radian pada Media Tumbuh Hasil Goresan Isolat K (a), Hasil Goresan Isolat L (b), pemurnian isolat M (c), Hasil Goresan Isolat N (d)
Inkubasi dilakukan selama 48 jam dengan suhu 37℃, koloni bakteri tunggal tampak tumbuh secara terpisah pada permukaan cawan petri yang berisi media tumbuh. Selanjutnya koloni tunggal yang telah tumbuh pada media tumbuh diinokulasikan untuk dipergunakan menjadi stok isolat uji berikutnya.
Bakteri selulolitik memiliki kemampuan untuk merombak selulosa untuk dijadikan produk sederhana seperti glukosa (Rooks et al., 2012). Terdapat aktivitas selulolitik berupa degradasi selulosa dapat diketahui dan diamati menggunakan pengujian metode congo red 0,1% selama 48 jam dengan suhu 37℃. Zona bening yang telah dihasilkan oleh koloni bakteri dapat diukur diameter koloni serta zona bening yang terbentuk. Hasil dari nilai indeks selulolitik pada media tumbuh tersaji pada Tabel 2.
Tabel 2. Hasil Nilai Indeks Selulolitik pada Media Tumbuh
|
Isolat Bakteri |
Diameter Koloni Bakteri (mm) |
Diameter Zona Bening (mm) |
Indeks Selulolitik (IS) |
Keterangan |
|
K |
0,5 |
- |
- |
Tidak ada |
|
L |
0,625 |
2,5 |
3 |
Tinggi |
|
M |
0,7 |
- |
- |
Tidak ada |
|
N |
0,5 |
- |
- |
Tidak ada |
Parameter daya degradasi dari selulosa adalah berdasarkan dari nilai IS yang didapat. Klasifikasi nilai IS digolongkan tinggi apabila nilai IS didapatkan lebih besar dari 2, IS dikategorikan sedang apabila didapatkan nilai antara 1 sampai dengan 2 dan dikategorikan rendah apabila kurang dari 1 serta tidak ada nilai IS bila tidak ditemukan zona bening (Choi et al., 2005). Berdasarkan nilai IS tersebut, kemampuan degradasi selulosa yang termasuk kategori tinggi berasal dari isolat L dengan nilai indeks selulolitik sebesar 3. Sedangkan, 3 isolat lainnya tidak menunjukkan adanya zona bening, yaitu berasal dari isolat K, M dan N.
Adanya perbedaan kemampuan adaptasi isolat dengan substrat serta faktor lain seperti pH, sumber nutrisi, suhu. Kemampuan tersebut dapat juga diakibatkan oleh gen yang dimiliki oleh bakteri tersebut (Soeka dan Triana, 2016). Ukuran dari luasan zona bening yang terbentuk membuktikan bahwa adanya bakteri selulolitik yang potensial untuk pendegradasian selulosa. Isolat bakteri selulolitik yang berpotensi didapat dengan menunjukkan zona bening yang dapat terbentuk pada lingkungan sekitaran koloni bakteri. Luasan dari zona bening berbeda-beda berdasar pada kepekatan agar serta media yang diaplikasikan (Meryandini et al., 2009). Selulosa pada media tumbuh dapat terserap oleh bakteri selulolitik, pada pengujian dengan congo red akan terlihat muncul zona bening yang disebabkan oleh tidak terikatnya selulosa dengan larutan congo red, berbeda dengan areal yang mengandung selulosa terikat dengan larutan congo red sehingga tampak media tumbuh kemerahan (Sinatryani, 2014). Hasil dari zona bening yang dihasilkan oleh isolat bakteri L dapat dilihat pada Gambar 2.
Media CMC
Koloni Bakteri
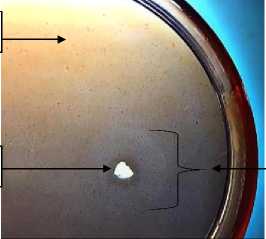
Zona Bening
Gambar 2. Zona Bening Isolat Bakteri L pada Media Tumbuh CMC dengan Penambahan Pewarna Congo Red
Pewarnaan Gram pada isolat bakteri bertujuan untuk melakukan karakterisasi mikroskopis menggunakan kristal violet serta safranin.Pengamatan isolat bakteri menggunakan mikroskop cahaya dengan perbesaran 1000 kali yang telah ditetesi minyak imersi. Pengamatan yang dilakukan pada uji pewarnaan Gram meliputi pengamatan bentuk sel serta sifat Gram isolat bakteri. Isolat K mempunyai bentuk sel batang dan tergolong Gram negatif. Isolat L mempunyai bentuk sel batang dan Gram positif. Isolat M dan N mempunyai bentuk sel bulat dan tergolong Gram negatif pada Gambar 3.
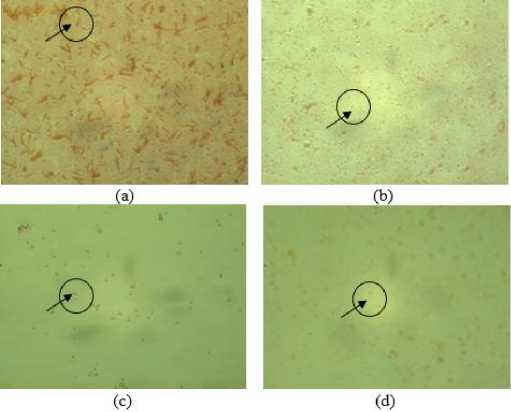
Gambar 3. Hasil pengamatan mikroskopis dengan perbesaran 1000x ( )
Isolat K Gram-, bentuk sel batang (a), Isolat L Gram +, bentuk sel batang (b), Isolat M Gram-, bentuk sel bulat (c), Isolat N Gram-, bentuk sel bulat (d)
Pada bakteri yang memiliki Gram positif, pada dinding sel bakteri terdapat lapisan peptidoglikan tebal serta tidak akan terlarut dengan adanya penetesan alkohol, sehingga warna kristal violet yang kebiruan dapat bertahan (Lay, 1994). Pada bakteri yang memiliki Gram negatif, pada dinding sel bakteri terdapat lapisan peptidoglikan tipis serta kadar lipidnya tinggi, sehingga membran sel bakteri Gram negatif dapat dengan mudah larut oleh alkohol, sehingga sel bakteri dapat lepas dengan mudahnya sel bakteri Gram negatif berubah menjadi transparan bening. Safranin digunakan sebagai pewarna pembanding, setelah ditetesi safranin dinding sel dari bakteri Gram negatif akan menyerap pewarna tersebut sehingga tampak sel bakterinya menjadi kemerahan (Kurniawan et al., 2018).
Berdasarkan karakteristik isolat bakteri yang didapat, isolat bakteri L diduga berasal dari genus Bacillus. Pada Bergey’s Manual Determination, terdapat karakteristik dari genus Bacillus, yaitu sel berbentuk batang, memiliki Gram positif, bersifat fakultatif anaerob, serta dapat aktif tumbuh di media yang mengandung glukosa. Merujuk penelitian dari Faesal et al., (2017) tentang seleksi efektifitas bakteri dekomposer terhadap limbah tanaman jagung, didapatkan isolat bakteri E7.1,E7.3,B7.1 yang mendekati genus Bacillus dengan karakter bakteri Gram positif, bentuk sel batang, tepian koloni berombak, warna koloni krem dan memiliki kemampuan menghasilkan enzim selulase.
Berdasarkan dari hasil serta pembahasan penelitian, maka ditariklah kesimpulan yaitu diperoleh 4 jenis isolat berbeda yang dapat tumbuh pada media CMC yang dikelompokkan menjadi 4 isolat berbeda yaitu isolat K,L,M dan N. Hanya isolat L yang positif merupakan bakteri selulolitik dengan nilai indeks selulolitik 3. Pada pengamatan
mikroskopis berupa bentuk dan warna sel bakteri yaitu isolat K,M, dan N tergolong sebagai Gram negatif serta memiliki sel yang berbentuk batang dan bulat. Isolat bakteri L tergolong sebagai Gram positif serta memiliki sel berbentuk batang yang termasuk bakteri selulolitik.
Daftar pustaka
Alam, M. Z., M.A. Manchulur, and M. N. Anwar. (2004). Isolation, Purification, Characterization of Cellulolytic Enzym Producer by the Isolate Streptomyces omiyaensis. Perkist Journal Biology Scientific. 7(10):1647-1653
Buselli, R.A.F., W.C. Otoni, and C. P. Joshi. (2007). Structure, organization, and functions of cellulose synthase complexes in higher plants. Brazilian Journal Plant Physiology 19(1): 1-13
Cappuccino, J.G., and N. Sherman. (1998). Microbiology: A Laboratory Manual. 5 th.
Edition. California: Benjamin/Cummings Science Publishing. 1(5): 45-70
Choi, Y. W., I. J. Hodgkiss, and K. D. Hyde. (2005). Enzyme Production by Endophytes of Brucea Javanica. J. Agri Tech, 1(5): 55-66
Faesal, F., D.J. Nurasiah, dan Soenartiningsih. (2017). Seleksi Efektivitas Bakteri Dekomposer terhadap Limbah Tanaman Jagung. Balai Penelitian Tanaman Serealia. 1(2):106-113
Hadioetomo, R. S. (1993). Mikrobiologi Dasar Dalam Praktek : Teknik dan Prosedur Dasar Laboratorium. PT. Gramedia Pustaka Utama. Jakarta.
International Coffee Organization (ICO). (2019). Trade Statistics Data Exports. International Coffee Organization: https://www.ico.org/new_historical.asp
accessed on 20 Desember 2020.
Kurniawan, A., D. Febrianti, S. P. Sari, A. A. Prihanto, E. Asriani, K. Andi, dan A. B. Sambah. (2018). Isolasi dan Identifikasi Bakteri Pedegradasi Selulosa asal Ekosistem Mangrove Tukad Sadai, Bangka Selatan. Jurnal Perikanan Pantura. 1(2): 9-16.
Lay, B. W. (1994). Analisis Mikroba di Laboratorium. PT Raja Grafindo Persada. Jakarta. Meryandini, A., W. Widosari, B. Maranatha, T.C. Sunarti, N. Rachmania, dan H. Satria.
2009. Isolasi Bakteri Selulolitik dan Karakterisasi Enzimnya. Jurnal Sains. Institut Pertanian Bogor. 13(1):33-38.
Perez, D., dan A. Jose. (2016). Sequential enzymatic saccharification and fermentation of ionic liquid and organosolv pretreated agave bagasse for ethanol production. Bioresource Technology.
Rooks, D. J., J.E. McDonald, J.N.I Houghton et al (2012) The microbial ecology of anaerobic cellulose degradation in municipal waste landfill. Enviroment Microbiol. 10:1310-1319.
Simanungkalit, R.D.M., D.A. Suriadikarta, R. Saraswati, D. Setyorini, dan W. Hartatik. (2006). Pupuk Organik dan Pupuk Hayati. Balai Besar Penelitian Dan Pengembangan Sumberdaya Lahan Pertanian. Bogor. Hal. 256-272.
Sinatryani, D. (2014). Kelimpahan Bakteri Selulolitik Di Muara Sungai Gunung Anyar Surabaya Dan Bancaran Bangkalan. Skripsi thesis. Universitas Airlangga.
Soeka, Y. S., dan E. Triana. (2016). Pemanfaatan limbah kulit udang untuk menghasilkan enzim kitinase dari Streptomyces macrosporeus InaCC A454. Jurnal Kimia Terapan Indonesia, 18(1):91-101.
Suardana, I.W., I.N. Suarsana, dan K.G. Wirayawan. (2007). Isolasi dan Identifikasi Bakteri Asam Laktat dari Cairan Rumen Sapi Bali sebagai Kandidat Biopreservatif. Jurnal Veteriner. 8(4) : 155-159.
Utama, C. S., Zuprizal, C. Hanim, dan Wihandoyo. (2018). Isolasi dan Identifikasi Bakteri Asam Laktat Selulolitik yang Berasal dari Jus Kubis Terfermentasi. Jurnal Aplikasi Teknologi Pangan. 7(1):1-6
138
Discussion and feedback