Analisis Karbon dalam Sedimen pada Ekosistem Lamun di Teluk Gilimanuk, Bali
on
JMRT, Volume 5 No 2 Tahun 2022, Halaman: 105-113
JMRT
JOURNAL OF MARINE RESEARCH AND TECHNOLOGY
journal homepage: https://ojs.unud.ac.id/index.php/JMRT
ISSN: 2621-0096 (electronic); 2621-0088 (print)
Analisis Karbon dalam Sedimen pada Ekosistem Lamun di Teluk Gilimanuk, Bali
Cindy Verniandaa, Ni Luh Watiniasihb*, Elok Faiqoh a, I Nyoman Giri Putraa
aProgram Studi Ilmu Kelautan, Fakultas Kelautan dan Perikanan, Universitas Udayana, Bali, Indonesia bProgram Studi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana, Bali, Indonesia *Corresponding author, email:luhwatiniasih@unud.ac.id
ARTICLE INFO
ABSTRACT
Article history:
Received : 9 Februari 2022
Received in revised form : 21 April 2022
Accepted : 24 Mei 2022
Available online : 31 Agustus 2022
Keywords: Carbon Stock Gilimanuk Bay Seagrass Sediment
The increased CO2 emissions in the atmosphere have caused several environmental changes. Therefore, a larger CO2 absorption capacity is required. Seagrass can absorb carbon relatively fast and able to store it. Seagrass beds can trap sediment, so the absorption of organic carbon from the sediment by seagrass can be influenced by the size of the substrate. It has been found that the larger the substrate grain, the lower the ability of plants to absorb the organic matter. This study aimed to determine the seagrass density and cover as well as carbon storage in seagrass bed sediments. The variable measured was Sediment-Organic Carbon Content (S-OCC) and Sediment-Organic Carbon Stock (S-OCS) of seagrass ecosystems in Gilimanuk Bay. Employing purposive sampling, 20 sampling points were selected randomly where seagrass beds were present. The data were obtained using a 1×1m quadrant transect. The carbon content of the sediment was calculated by the Loss of Ignition (LOI) method by removing organic matter at a temperature of 600℃ in a furnace. This study found four seagrass species: Enhalus acoroides, Cymodocea rotundata, Cymodocea serrulate, and Halophila ovalis. The average density of seagrasses in this habitat ranged from 17 – 179 #/m2, with seagrass cover values ranging from 25 to 100%. The sediment carbon content, measured as carbon stock, on seagrass ecosystems at Gilimanuk Bay was 0.21% - 5.51% for S-OCC and 0.002 – 0.059 g Corg cm-3 for S-OCS. Total S-OCS in Gilimanuk Bay was 11165.84 Mg g Corg.
2022 jmrt. all rights reserved.
Konsentrasi CO2 pada atmosfer sebelum revolusi industri yaitu 280 ppm, dan saat ini telah mencapai 419,28 ppm (NOAA, 2022). Peningkatan konsentrasi CO2 pada atmosfer telah menyebabkan perubahan lingkungan di berbagai belahan dunia, salah satunya yaitu kenaikan suhu permukaan laut sebanyak 0,74 ℃ serta pH air laut yang menurun sebanyak 0,1 pH unit (IPCC, 2017). Peningkatan emisi CO2 pada atmosfer memerlukan kapasitas penyerapan CO2 yang lebih besar (Walker dan Steffen, 1997). Karbon diserap oleh tumbuhan, baik yang di darat maupun di laut, melalui proses fotosintesis. Akan tetapi proses penyerapan karbon oleh tumbuhan darat dibatasi oleh waktu hidup tumbuhan yang singkat. Sedangkan tumbuhan laut, seperti lamun, dapat menyerap karbon lebih cepat dan menyimpannya dalam jangka waktu lebih lama (Zhou et al., 2015; Mateo, Romero dan Perez, 1997).
Lamun merupakan tumbuhan berbunga yang telah beradaptasi untuk hidup dalam air laut. Lamun biasa ditemukan pada perairan dangkal, daerah pasang surut, dan muara perairan pada wilayah tropis dan subtropis (Hemminga dan Duarte, 2000). Lamun menyerap CO2 dan mengubahnya menjadi energi, yang akan tersimpan dalam bentuk karbon organik (Duarte dan Cebrian, 1996). Salah satu fungsi dari padang lamun yaitu sebagai perangkap sedimen (Hemminga dan Duarte, 2000). Konsep padang lamun yang berperan sebagai penyerap partikel (sedimen dan unsur hara) disebabkan oleh penurunan kecepatan aliran oleh kanopi tanaman (Gacia et al., 1999). Padang lamun dapat hidup di
berbagai jenis substrat, salah satunya yaitu pasir, pecahan karang dan pasir berlumpur. Seperti yang dikemukakan oleh Yunitha (2015) bahwa penyerapan karbon organik dipengaruhi oleh besaran butiran substrat, karena butiran substrat yang lebih besar menurunkan kemampuan substrat tersebut menyerap karbon organik. Salah satu perairan di Bali yang memiliki ekosistem lamun yaitu Teluk Gilimanuk.
Teluk Gilimanuk memiliki ekosistem yang beragam, dikelilingi oleh pantai berlumpur yang ditumbuhi oleh vegetasi mangrove. Teluk Gilimanuk di dalamnya di dominasi oleh vegetasi mangrove yang ke arah laut dilapisi oleh padang lamun yang rata-rata merupakan jenis Enhalus dan rerataan terumbu karang (Cappenberg et al., 2006). Di Teluk Gilimanuk ditemukan 6 spesies lamun menurut Rosalinda (2006), yaitu spesies Cymodocea rotundata, Enhalus acoroides, Halodule pinifolia, H. uninervis, Halophila ovalis dan Thalassia hemprichii.
Penelitian mengenai penyerapan karbon oleh lamun telah banyak dilakukan. Salah satunya yaitu penelitian karbon lamun yang dilakukan oleh Lestari et al. (2020) di Teluk Gilimanuk. Penelitian tersebut membahas tentang karbon yang tersimpan di tubuh lamun. Mengingat fungsi lamun sebagai perangkap sedimen, penelitian tentang karbon pada sedimen di ekosistem lamun penting dilakukan karena ekosistem lamun memiliki kapasitas yang besar untuk menyimpan bahan organik dalam sedimen (Laffoley dan Grimsditch, 2009). Sehingga dapat diperoleh informasi dasar tentang pengaruh ekosistem lamun di Teluk Gilimanuk dalam penyerapan karbon di atmosfer.
Penelitian ini dilakukan pada Desember 2020 yang mencakup pengambilan sampel dan pengolahan sampel di laboratorium. Pengambilan sampel dilakukan di Teluk Gilimanuk (Gambar 1). Pengolahan sampel lamun dan persiapan sampel sedimen dilakukan di Laboratorium Ilmu Kelautan, Fakultas Kelautan dan Perikanan dan Laboratorium Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana. Pengolahan sampel sedimen dengan metode Loss of Ignition dilakukan di Laboratorium Tanah, Fakultas Pertanian, Universitas Udayana.

Gambar 1. Peta Lokasi Penelitian
-
2.2 Metode Pengambilan Sampel
Penelitian ini dilakukan pada 20 titik sampling yang tersebar di Teluk Gilimanuk. Pengambilan sampel lamun menggunakan metode purposive random sampling menggunakan transek kuadran (1 × 1 m) yang diletakkan satu transek pada setiap titik pengambilan sampel (Rahmawati et al., 2014) (Gambar 2). Jarak dengan bibir pantai yaitu sampai ditemukan lamun pertama. Untuk menghitung kerapatan dan tutupan lamun, transek kuadran dibagi menjadi 4 petak. Untuk menghitung biomassa lamun, pada tiap-tiap transek diambil satu tegakan dari masing-masing jenis lamun yang ditemukan.

Gambar 2. Transek kuadran di atas padang lamun (Sumber: Rahmawati et al., 2014)
Pengambilan sampel sedimen dilakukan pada setiap titik pengamatan lamun saat air sedang surut dan dilakukan secara random sampling. Pengambilan sampel sedimen dilakukan
menggunakan pipa paralon dengan panjang 40 cm dan diameter 7,5 cm yang ditancapkan pada sedimen yang berada di dalam transek kuadran. Saat pipa paralon ditarik keatas, bawah pipa paralon lalu ditutup menggunakan tutup pipa dan dieratkan menggunakan lakban pipa (Rahmawati et al., 2019) (Gambar 3). Pada saat pengambilan sampel lamun dan sedimen juga dilakukan pengukuran parameter lingkungan seperti suhu, pH, DO, salinitas dan jenis substrat menggunakan alat seperti termometer, pH meter, DOmeter, refraktometer dan pipa corer. Untuk pengukuran suhu, pH, DO dan salinitas dilakukan pada kolom perairan.
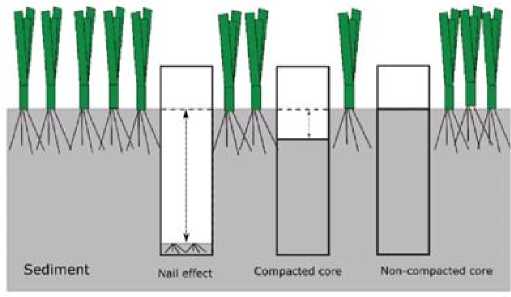
Gambar 3. Pengambilan Sampel Sedimen (Sumber: Rahmawati et al., 2019)
-
2.3 Pengolahan Sampel
-
2.3.1 Penanganan Sampel Sedimen
-
Sampel sedimen perlu dipersiapkan terlebih dahulu sebelum masuk ke laboratorium dengan langkah-langkah sebagai berikut: pipa PVC dibuka menggunakan gergaji lalu didokumentasikan sedimen dan dicatat karakteristiknya seperti warna, keberadaan tanaman maupun cangkang makrozoobentos didalamnya, serta tipe sedimen (pasir, lumpur, atau bebatuan). Setelah itu, dihitung faktor koreksi kompaksi dan dihitung juga panjang awal sampel. Sampel dipotong dengan ukuran 5 cm sesuai dengan kedalaman sedimen dan diletakkan di atas alumunium foil lalu sampel dikeringkan dalam oven dengan suhu 60 °C selama 72 jam. Sampel didinginkan pada suhu ruangan selama kurang lebih 1 jam, lalu ditimbang berat sedimen keringnya (Rahmawati et al., 2019).
-
2.3.2 Karbon pada Sampel Sedimen
Sedimen dicampur untuk menghomogenkan sampel, lalu sampel sedimen dihaluskan. Sampel sebanyak 3 g dimasukkan kedalam gelas keramik yang sebelumnya telah ditimbang beratnya. Setelah itu sampel dimasukkan ke dalam furnace dengan suhu 600 C sampai sampel menjadi abu dan berwarna putih. Tingginya temperatur adalah untuk memastikan hanya karbon organik yang teroksidasi. Kemudian sampel dikeluarkan dari movel dan dimasukkan ke dalam desikator untuk menunggu dingin. Berat sampel ditimbang, lalu dihitung nilai total bahan organik menggunakan rumus pada analisis data (Rahmawati et al., 2019).
-
2.4 Analisis Data
-
2.4.1 Kerapatan Lamun
-
Kerapatan jenis merupakan jumlah individu lamun (tegakan) per satuan luas. Kerapatan lamun dihitung berdasarkan persamaan (1) (Ira et al., 2013):
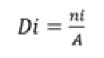
(1)
dimana Di merupakan kerapatan jenis lamun (tegakan/m2), ni merupakan jumlah tegakan lamun (tegakan) dan A merupakan luas transek (m2).
Nilai kerapatan jenis lamun dibandingkan dengan skala kondisi kerapatan lamun. Skala kondisi kerapatan lamun ditunjukkan pada tabel 1 (Gosari dan Abdul, 2012).
Tabel 1. Kategori nilai kerapatan lamun
|
Skala |
Kerapatan (ind/m2) |
Kondisi |
|
5 |
>175 |
Sangat rapat |
|
4 |
125 – 175 |
Rapat |
|
3 |
75 – 125 |
Agak rapat |
|
2 |
25 – 75 |
Jarang |
|
1 |
<25 |
Sangat Jarang |
-
2.4.2 Tutupan Lamun
Menurut Rahmawati et al. (2014), perhitungan lamun dalam suatu kuadrat adalah dengan menjumlah nilai penutupan lamun pada setiap plot dalam kuadrat yang membaginya dengan jumlah plot yaitu 4 kotak. Rumus perhitungan persentase tutupan lamun dalam kotak kecil penyusunan kuadran sebagai berikut dengan penilaian penutupan lamun dapat dilihat pada tabel 2 (Rahmawati et al., 2014).
n . , JumlahNilalPenutupanLamun(Akotak)
Penutupan lamun = i-------------≈-------1------
(2)
Tabel 2. Kategori nilai tutupan lamun
|
Kategori |
Nilai Penutupan Lamun |
|
Tutupan penuh |
100 |
|
Tutupan 3/4 Kotak Kecil |
75 |
|
Tutupan 1/4 Kotak Kecil |
50 |
|
Tutupan 1/2 Kotak Kecil |
25 |
|
Kosong |
0 |
-
2.4.3 Biomassa Lamun
Biomassa lamun dihitung dengan cara menghitung berat kering lamun kemudian dibagi luas area transek kuadran dengan menggunakan persamaan (3) (Santoso et al., 2018):
(3)
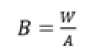
dimana B merupakan biomassa lamun (gbk/m2), W merupakan berat kering lamun (gbk) dan A merupakan luas area (m2).
-
2.4.4 Karbon pada Sedimen
-
2.4.4.1 Faktor Koreksi
-
Pengambilan sampel sedimen menggunakan pipa PVC yang diketuk dengan palu dapat menyebabkan kompaksi sedimen karena lapisan sedimen, bahan organik, maupun pergerakan pada sedimen. Kompaksi sedimen dapat memengaruhi perhitungan bulk density dan estimasi karbon dalam sedimen (Rahmawati et al., 2019). Faktor koreksi dihitung menggunakan persamaan (4) (Rahmawati et al., 2019):
Faktor Koreksi Kompaksi = -
(4)
dimana D merupakan panjang sampel sedimen (cm) dan E merupakan panjang core (cm). Setelah itu hitung panjang sampel yang telah dikoreksi menggunakan persamaan (5):
(5)
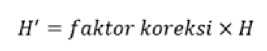
dimana H’ merupakan panjang sampel (cm) dan H merupakan panjang sampel awal (tanpa kompaksi) (cm). Sebelum dilakukan perhitungan besaran nilai karbon sedimen, terlebih dahulu dilakukan perhitungan nilai dry bulk density menggunakan persamaan (6) (Kauffman dan Donato, 2012):
Dry Bulk Density = btr?^.^ ⅛> (6) x volume sampel (cm~3)
dimana berat kering sampel (g) dibagi dengan volume sampel (cm-3).
-
2.4.4.2 Sediment-Organic Carbon Content (S-OCC)
S-OCC merupakan proporsi karbon organik terkait dengan berat kering sedimen. S-OCC dihitung menggunakan metode Loss of Ignition (LOI) berdasarkan persamaan (7). Metode ini pada prinsipnya adalah menghilangkan bahan organik melalui proses pembakaran di dalam tanur/tungku (furnace). Nilai bahan organik yang didapat merupakan berat sampel yang hilang karena pembakaran pada suhu 450-550 ºC selama 4-8 jam (Santisteban et al., 2004; Fourqurean et al., 2014).
0∙ j ∩r (massa sebelum pembakaran-massa setelah pembakaran) i λλo∕ ∏λ
% LOI — --------------—----——------------X 100% (7)
massa sebelum pembakaran
dimana massa sebelum pembakaran (g) dikurang dengan massa setelah pembakaran (g) lalu dibagi dengan massa sebelum pembakaran (g).
Penghitungan jumlah karbon organik dalam sedimen menggunakan faktor konversi pada tabel 3 (Fourqurean et al., 2012).
Tabel 3. Faktor Konversi
|
1. |
Ekosistem lamun dengan % LOI < 0,2 (r2 = 0,87) %Corg = 0,40 × % LOI – 0,33 |
|
2. |
Ekosistem lamun dengan % LOI > 0,2 (r2 = 0,96) %Corg = 0,43 × % LOI – 0,33 |
-
2.4.4.3 Sediment-Organic Carbon Stock (S-OCC)
S-OCS dihitung dengan mengalikan DBD dan S-OCC berdasarkan persamaan (8) (Rahmawati et al., 2019):
0,600 - 0,799
Kuat
(8)
0,800 - 1,000
Sangat Kuat
Untuk mengetahui nilai S-OCS pada tiap bagian kedalaman sedimen dihitung S-OCS tiap bagian dalam core sedimen menggunakan persamaan (9).
(9)
Setelah mengetahui nilai S-OCS pada tiap bagian kedalaman sedimen, kemudian dilakukan perhitungan nilai S-OCS pada tiap core sedimen menggunakan persamaan (10).
(10)
dimana n merupakan jumlah bagian dalam core sedimen. Kemudian dihitung rata-rata S-OCS pada lokasi penelitian menggunakan persamaan (11).
S - OCS (g Corg cm 2) =
S-OCS core (l+2+-+V) N
(11)
dimana n merupakan jumlah core. Sebelum menghitung total S-OCS pada lokasi penelitian, dilakukan perhitungan konversi unit untuk mengubah satuan g Corg cm-2 menjadi Mg C ha-1 menggunakan persamaan (12).
(12)
Setelah didapat hasil konversi unit, kemudian dihitung total S-OCS pada lokasi penelitian menggunakan persamaan (13).

(13)
-
2.4.5 Uji Korelasi Pearson antara Kerapatan dan Biomassa Lamun dengan Karbon Sedimen
Uji korelasi Pearson’s Product Moment merupakan uji yang digunakan untuk mengetahui derajat hubungan antara variabel bebas (independent) dengan variabel terikat (dependent) (Akdon dan Riduwan, 2008). Teknik korelasi ini dikembangkan oleh Karl Pearson, karena itulah teknik korelasi ini dikenal sebagai Korelasi Pearson. Koefisien korelasi pada uji korelasi ini didapatkan dengan mengalikan momen-momen variabel yang dikorelasikan (product moment), oleh karena itu disebut sebagai Pearson’s Product Moment (Sudijono, 2008). Uji korelasi Pearson’s Product Moment ini dilakukan menggunakan aplikasi SPSS versi 25. Adapun hasil yang didapatkan dapat diinterpretasikan menggunakan tabel 4 (Sugiyono, 2018).
Tabel 4. Interpretasi Koefisien Korelasi
|
Interval Koefisien |
Tingkat Hubungan |
|
0 - 0,199 |
Sangat Rendah |
|
0,200 - 0,399 |
Rendah |
|
0,400 - 0,599 |
Sedang |
Teluk Gilimanuk merupakan teluk yang terletak di ujung barat Pulau Bali. Sebagian perairan di teluk ini merupakan bagian dari Taman Nasional Bali Barat (TNBB). Teluk Gilimanuk memiliki ekosistem yang beragam, didominasi oleh vegetasi mangrove yang ke arah laut ditumbuhi oleh padang lamun yang didominasi oleh E. acaroides. Jenis substrat di tempat penelitian berupa endapan lumpur berpasir putih.
Hasil penelitian parameter lingkungan pada setiap titik di Teluk Gilimanuk meliputi variabel pH, salinitas, DO (Dissolved Oxygen) dan suhu yang ditampilkan pada Tabel 5. Pada tabel tersebut dapat dilihat bahwa nilai pH berkisar antara 7,8 - 8,9. Menurut Argandi (2003), nilai pH dipengaruhi oleh dekomposisi tanah dan keadaan lingkungan di sekitar perairan tersebut. Nilai pH yang baik untuk air laut yaitu berkisar antara 7,5 sampai 8,5, sedangkan nilai pH yang optimal untuk lamun yaitu antara 7,5 sampai 8,5. Pada kisaran pH tersebut ion bikarbonat yang dibutuhkan oleh lamun untuk fotosintesis melimpah (Sakaruddin, 2011). Dari hasil penelitian ini ditemukan bahwa pH perairan di Teluk Gilimanuk sedikit lebih tinggi kisarannya dibandingkan pH optimum untuk pertumbuhan lamun yang disampaikan oleh Argandi (2003). Tinggi rendahnya pH umumnya dipengaruhi oleh fluktuasi kandungan O2 maupun CO2 di perairan tersebut. Tingkat pH yang lebih rendah dari 4,8 dan lebih tinggi dari 9,2 dapat dianggap sebagai perairan yang tercemar (Sary, 2006).
Tabel 5. Parameter perairan di Teluk Gilimanuk
|
Titik |
pH |
Salinitas (0‰) |
DO (mg/L) |
Suhu | |
|
(oC) |
Jenis Substrat | ||||
|
1 |
7,8 |
36 |
10,1 |
26,8 |
Pasir Berlumpur |
|
2 |
7,8 |
33 |
9,5 |
28,1 |
Pasir Berlumpur |
|
3 |
7,9 |
36 |
10,7 |
29,7 |
Pasir Berlumpur |
|
4 |
7,9 |
35 |
9,2 |
30,7 |
Pasir Berlumpur |
|
5 |
7,8 |
34 |
10,2 |
30,9 |
Pasir Berlumpur |
|
6 |
7,8 |
35 |
10,6 |
31,4 |
Pasir Berlumpur |
|
7 |
7,9 |
35 |
10,2 |
31,1 |
Pasir Berlumpur |
|
8 |
8,3 |
34 |
10,4 |
33,8 |
Pasir Berlumpur |
|
9 |
8,4 |
31 |
12,9 |
33,1 |
Pasir Berlumpur |
|
10 |
8,2 |
30 |
9,8 |
29,7 |
Pasir Berlumpur |
|
11 |
8,2 |
35 |
11 |
28,7 |
Pasir Berlumpur |
|
12 |
8,3 |
34 |
11,9 |
29,2 |
Pasir Berlumpur |
|
13 |
8,6 |
34 |
13,7 |
29,1 |
Pasir Berlumpur |
|
14 |
8,6 |
33 |
13,4 |
29,3 |
Pasir Berlumpur |
|
15 |
8,9 |
37 |
11,2 |
30,1 |
Pasir Berlumpur |
|
Titik |
pH |
Salinitas (‰) |
DO (mg/L) |
Suhu | |
|
(C) |
Jenis Substrat | ||||
|
16 |
8,5 |
34 |
13,8 |
30,7 |
Pasir Berlumpur Pasir Berlumpur |
|
17 |
8,6 |
36 |
12 |
28,8 |
dan Pecahan Karang Pasir Berlumpur |
|
18 |
8,4 |
37 |
12,6 |
28 |
dan Pecahan Karang Pasir Berlumpur |
|
19 |
8,4 |
35 |
14,7 |
28,2 |
dan Pecahan Karang Pasir Berlumpur |
|
20 |
8,3 |
36 |
10,7 |
27,5 |
dan Pecahan Karang |
Salinitas di Teluk Gilimanuk berkisar antara 30 - 37 ‰. Kisaran salinitas tersebut mendekati kisaran salinitas optimal untuk lamun menurut KEPMEN LH No. 51 Tahun 2004. Tenribali (2015) menyatakan bahwa sebagian besar lamun dapat hidup pada salinitas yang berkisar antara 10 sampai 40 ‰ dan dapat bertahan hidup di daerah estuari, perairan tawar, laut, maupun daerah hypersaline sehingga salinitas menjadi salah satu faktor distribusi lamun secara gradien.
Dissolved oxygen (DO) pada lokasi penelitian berkisar antara 9,2 - 14,7 mg/L. Kisaran DO tersebut mendekati kisaran DO optimum untuk baku mutu air laut menurut KEPMEN LH No. 51 Tahun 2004, yaitu >5. Odum (1971) menyatakan bahwa kandungan oksigen terlarut dalam air laut akan bertambah semakin rendahnya suhu dan akan berkurang dengan semakin tingginya salinitas.
Suhu di Teluk Gilimanuk berkisar antara 26,8 - 33,8 °C, mendekati suhu optimum untuk pertumbuhan lamun
menurut KEPMEN LH No. 51 Tahun 2004. Nurzahraeni (2014) menyatakan bahwa kisaran suhu yang optimal untuk pertumbuhan lamun yaitu antara 28 - 31 C dan lamun akan tumbuh dengan baik pada suhu 25 - 30 C.
Tingginya salinitas dan suhu, masih didukung dengan ditemukannya kadar oksigen terlarut yang tinggi. Hal ini berbeda dengan pernyataan Sakaruddin (2011), bahwa perairan yang hangat memiliki kadar oksigen terlarut yang lebih rendah dibandingkan dengan perairan yang lebih dingin, dimana konsentrasi kejenuhan oksigen terlarut menurun antara 0,2 dan 0,3 mg/l untuk setiap kenaikan suhu. Wardoyo (1978) menyatakan bahwa kadar oksigen terlarut akan lebih tinggi pada permukaan perairan, hal ini karena adanya proses difusi antara air dengan udara dan juga proses fotosintesis. Semakin bertambahnya kedalaman maka akan terjadi penurunan kadar oksigen terlarut, yang disebabkan oleh semakin berkurangnya proses fotosintesis dan kadar oksigen yang ada akan digunakan untuk pernapasan serta oksidasi bahan-bahan organik maupun anorganik.
Jenis substrat yang ditemukan di Teluk Gilimanuk yaitu 2 jenis, pasir berlumpur dan pasir berlumpur dengan pecahan karang. Nontji (2002) menyatakan bahwa lamun tumbuh subur pada daerah perairan terbuka pasang surut yang memiliki dasar berupa lumpur, pasir, kerikil dan patahan karang mati. Jenis substrat memengaruhi penyerapan karbon organik. Seperti yang telah dikemukakan oleh Yunitha (2015) bahwa penyerapan karbon organik juga dipengaruhi oleh besar kecilnya butiran substrat, semakin besar butiran substrat akan menurunkan kemampuan substrat untuk menyerap karbon organik. Hal ini
sesuai dengan pernyataan Handayani et al. (2016), bahwa semakin halus tekstur dari substrat maka semakin mudah bagi lamun untuk tumbuh dan berkembang dengan baik karena lamun dapat menancapkan akarnya kedalam substrat dengan baik dan dapat menyerap unsur hara pada sedimen dengan mudah. Dengan kondisi substrat yang ada di Teluk Gilimanuk, substrat pasir berlumpur dan pasir berlumpur dengan pecahan karang, dapat mendukung pertumbuhan lamun di wilayah tersebut.
-
3.2 Kerapatan dan Tutupan Lamun
Pada Teluk Gilimanuk ditemukan 4 spesies lamun pada penelitian kali ini, yaitu E. acoroides, Cymodocea rotundata, C. serrulata dan Halophila ovalis.
Tabel 6. Kerapatan dan tutupan lamun di Teluk Gilimanuk
|
Titik |
Ea |
Kerapatan Jenis | |||||
|
Lamun (tgk) |
Ho |
Rata-Rata Kerapatan (tgk/m2) |
Kondisi Kerapatan Lamun |
Tutupan Lamun (%) | |||
|
Cr |
Cs | ||||||
|
1 |
38 |
- |
- |
- |
38 |
Jarang |
50 |
|
2 |
17 |
- |
- |
- |
17 |
Sangat Jarang |
25 |
|
3 |
24 |
- |
- |
- |
24 |
Sangat Jarang |
25 |
|
4 |
31 |
- |
- |
- |
31 |
Jarang |
50 |
|
5 |
28 |
- |
- |
- |
28 |
Jarang |
25 |
|
6 |
28 |
- |
- |
- |
28 |
Jarang |
25 |
|
7 |
55 |
- |
- |
- |
55 |
Jarang |
50 |
|
8 |
30 |
- |
- |
- |
30 |
Jarang |
50 |
|
9 |
52 |
- |
- |
- |
52 |
Jarang |
50 |
|
10 |
29 |
- |
- |
- |
29 |
Jarang |
25 |
|
11 |
34 |
- |
- |
- |
34 |
Jarang |
50 |
|
12 |
26 |
- |
- |
- |
26 |
Jarang |
25 |
|
13 |
30 |
- |
- |
- |
30 |
Jarang |
50 |
|
14 |
- |
84 |
- |
- |
84 |
Agak Rapat |
50 |
|
15 |
18 |
- |
- |
- |
18 |
Sangat Jarang |
25 |
|
16 |
- |
152 |
- |
- |
152 |
Rapat |
75 |
|
17 |
- |
151 |
187 |
200 |
179 |
Sangat Rapat |
75 |
|
18 |
- |
310 |
12 |
- |
161 |
Rapat |
75 |
|
19 |
8 |
167 |
- |
- |
88 |
Agak Rapat |
75 |
|
20 |
15 |
216 |
102 |
32 |
91 |
Agak Rapat |
100 |
Keterangan: EA = E. acoroides, CR = Cymodocea rotundata, CS = C. serrulata, HO = Halophila ovalis.
Dari hasil kerapatan jenis lamun diatas dapat dilihat bahwa titik 1 sampai titik 16 hanya ditemukan satu spesies lamun yaitu jenis E. acoroides (pada titik 1 sampai 13 dan 15) dan C. rotundata (pada titik 14 dan 16), sedangkan pada titik 17 sampai titik 20 ditemukan beberapa spesies lamun yang berbeda. Hal
tersebut dipengaruhi oleh jenis substrat yang berbeda pada tiap titik penelitian. Kerapatan jenis lamun E. acoroides juga cenderung lebih kecil dibandingkan dengan spesies lamun lainnya. Hal ini disebabkan oleh morfologi lamun E. acoroides yang cenderung lebih besar jika dibandingkan dengan lamun C. rotundata, C.serrulata dan H. ovalis.
Hasil penelitian ini sesuai dengan pernyataan dari Zurba (2018) bahwa beberapa spesies lamun menyukai substrat tertentu. Substrat yang berlumpur dan pasir dengan pecahan karang cenderung ditumbuhi lamun seperti Thalassia hemprichii, Syringodium isoetifolium, C. serrulata, Halodule uninervis dan Halophila ovalis. Sedangkan substrat keras, berpasir dan berlumpur ditumbuhi oleh lamun seperti Halodule uninervis, H. pinifolia, C. serrulata, C. rotundata, T. hemprichii dan E. acoroides.
Jika dibandingkan dengan penelitian Graha et al. (2016) di Pantai Sanur, pada perairan Sanur ini terdapat lebih banyak jenis lamun yaitu delapan jenis lamun yang terdiri dari E. acoroides, T. hemprichii, H. ovalis, C. rotundata, C. serulata, H. uninervis, H. pinifolia dan S. isoetifolium. Lamun dengan kerapatan jenis tertinggi yaitu S. isoetifolium dengan kerapatan jenis berkisar pada 15 – 545 individu/m2. Pada perairan ini lamun yang sering ditemukan yaitu jenis E. acoroides, sama dengan penelitian di Teluk Gilimanuk. Kerapatan dan tutupan lamun dipengaruhi oleh beberapa faktor, yaitu jenis substrat dan kualitas perairan seperti suhu, pH, salinitas dan DO. Seperti pernyataan dari KEPMEN LH No. 51 Tahun 2004 mengenai baku mutu perairan, lamun akan tumbuh secara optimum pada kisaran suhu 28 – 30 ℃, pH 7 – 8,5, salinitas 33 – 34 ‰, serta DO >5 mg/L.
-
3.3 Biomassa Lamun
Hasil perhitungan biomassa menunjukkan bahwa nilai biomassa individu lamun tertinggi terdapat pada lamun spesies E. acoroides. Biomassa lamun E. acoroides cenderung lebih tinggi dikarenakan lamun ini memiliki morfologi yang lebih besar, walaupun kerapatan jenisnya lebih kecil dibandingkan dengan lamun jenis lainnya.
Tabel 7. Biomassa lamun di Teluk Gilimanuk
|
Titik |
Biomassa Lamun (gbk/m2) | ||
|
Ea |
Cr Cs |
Ho | |
|
1 |
311,6 |
- - |
- |
|
2 |
248,03 |
- - |
- |
|
3 |
391,2 |
- - |
- |
|
4 |
382,85 |
- - |
- |
|
5 |
575,12 |
- - |
- |
|
6 |
378,84 |
- - |
- |
|
7 |
453,75 |
- - |
- |
|
8 |
378 |
- - |
- |
|
9 |
759,72 |
- - |
- |
|
Titik |
Biomassa Lamun (gbk/m2) | |||
|
Ea |
Cr |
Cs |
Ho | |
|
10 |
343,65 |
- |
- |
- |
|
11 |
808,52 |
- |
- |
- |
|
12 |
227,76 |
- |
- |
- |
|
13 |
406,8 |
- |
- |
- |
|
14 |
- |
161,28 |
- |
- |
|
15 |
171,36 |
- |
- |
- |
|
16 |
- |
342 |
- |
- |
|
17 |
- |
141,94 |
231,88 |
134 |
|
18 |
- |
1215,2 |
18 |
- |
|
19 |
150,88 |
786,57 |
- |
- |
|
20 |
239,28 |
382,32 |
113,22 |
17,6 |
Keterangan: EA = E. acoroides, CR = Cymodocea rotundata, CS = C. serrulata, HO = Halophila ovalis.
Dari hasil perhitungan biomassa yang telah dilakukan menunjukkan bahwa nilai biomassa individu lamun tertinggi terdapat pada lamun spesies E. acoroides dengan nilai biomassa mencapai 23,78 gbk/individu. Hal tersebut dikarenakan morfologi lamun ini yang cenderung lebih besar dibandingkan dengan lamun spesies C. rotundata, C. serrulata dan H. ovalis. Nilai biomassa individu lamun C. rotundata mencapai 4,71 gbk/individu. Kemudian nilai biomassa individu lamun C. serrulata yaitu 1,50 gbk/individu dan nilai biomassa individu terendah terdapat pada lamun H. ovalis yaitu 0,67 gbk/individu. Pada titik 17 nilai biomassa lamun H. ovalis hampir mendekati nilai biomassa lamun C. rotundata, hal ini dikarenakan kerapatan jenis lamun H. ovalis pada titik ini tinggi dan melebihi kerapatan jenis lamun C. rotundata. Ferawati et al. (2018) menyatakan bahwa tingginya nilai biomassa lamun E. acoroides disebabkan oleh ukuran morfologi lamun ini yang lebih besar dan tebal pada bagian daun, rhizoma dan akarnya. Biomassa dari padang lamun ini mempunyai peran yang penting pada siklus karbon lamun.
-
3.4 Karbon pada Sedimen
Setelah dilakukan analisis dengan metode Loss of Ignition (LOI) menggunakan persamaan (6) dan (7) didapatkan kadar bahan organik dan DBD pada setiap titik di Teluk Gilimanuk. Kadar bahan organik yaitu sebesar 1,256 - 13,578%, kerapatan lamun dapat memengaruhi kandungan bahan organik. Semakin tinggi kerapatan dan morfologi lamun akan menyebabkan semakin banyak bahan organik yang terikat di dasar perairan (Riniatsih, 2015). Nilai DBD berkisar antara 0,36 – 1,26 g cm3, nilai DBD ini dipengaruhi oleh kedalaman pada core sedimen yang berbeda sesuai dengan kedalaman sedimen pada lokasi penelitian.
S-OCC pada sedimen di ekosistem lamun Teluk Gilimanuk didapatkan menggunakan faktor konversi pada Tabel 3,
sedangkan S-OCS pada ekosistem lamun di Teluk Gilimanuk didapatkan menggunakan persamaan (8). Hasil penelitian menunjukkan simpanan karbon dalam sedimen pada ekosistem lamun di Teluk Gilimanuk yaitu sebesar 0,21% - 5,51% untuk S-OCC dan sebesar 0,002 – 0,059 g Corg cm-3 untuk S-OCS. S-OCS pada tiap bagian core sedimen pada ekosistem lamun di Teluk Gilimanuk didapatkan menggunakan persamaan (9). Nilai S-OCS pada tiap bagian core sedimen berkisar antara 0,011 – 0,295 g Corg cm-2. S-OCS pada tiap core sedimen pada ekosistem lamun di Teluk Gilimanuk didapatkan menggunakan persamaan (10). Nilai S-OCS pada tiap core sedimen berkisar antara 0,13 – 1,04 g Corg cm-2. Konversi unit pada ekosistem lamun di Teluk Gilimanuk didapatkan menggunakan persamaan (12). Nilai konversi unit berkisar antara 13 – 104 Mg C ha-1.
Rata-rata S-OCS pada ekosistem lamun di Teluk Gilimanuk didapatkan menggunakan persamaan (11). Rata-rata nilai S-OCS berkisar antara 45,024 g Corg cm-2. Total S-OCS pada sedimen ekosistem lamun di Teluk Gilimanuk didapatkan menggunakan persamaan (13) dengan cara mengalikan luas area lamun dengan S-OCS yang telah didapatkan di perhitungan sebelumnya, luas area lamun pada Teluk Gilimanuk yaitu 12,4 ha menurut Lestari et al. (2020). Total S-OCS pada Teluk Gilimanuk yaitu 11165,84 Mg g Corg. Total S-OCS diduga sebagian besar berasal dari lamun E. acoroides, hal ini dapat dilihat dari hubungan antara kerapatan dan biomassa yang menunjukkan bahwa lamun E. acoroides ditemukan hampir pada semua titik penelitian. Tingginya kandungan karbon pada sedimen dipengaruhi oleh berbagai macam faktor, seperti biomassa, kerapatan lamun dan jenis substrat. Seperti pernyataan Cyle et al. (2016) yang menyatakan bahwa besar kecilnya ukuran substrat akan memengaruhi proses pengikatan bahan organik, substrat dengan ukuran kecil dan halus seperti lumpur lebih mudah untuk mengikat bahan organik.
-
3.5 Uji Korelasi Pearson antara Kerapatan dan Biomassa Lamun dengan Karbon Sedimen
Koefisien korelasi Pearson antara kerapatan lamun dengan karbon yaitu -0,094 yang menunjukkan bahwa hubungan antara kerapatan lamun dengan karbon bersifat tidak searah (negatif) serta memiliki hubungan sangat rendah. Koefisien korelasi Pearson antara biomassa lamun dengan karbon yaitu 0,39 yang menunjukkan bahwa hubungan antara biomassa lamun dengan karbon bersifat searah (positif) dan memiliki hubungan yang rendah.
Nilai signifikansi antara kerapatan lamun dengan karbon yaitu 0,692 yang berarti bahwa korelasi antara kedua variabel tidak signifikan, sama halnya dengan nilai signifikansi antara biomassa lamun dengan karbon yaitu 0,089. Hasil tersebut kemungkinan dipengaruhi oleh kedalaman sedimen pada tiap titik penelitian yang berbeda-beda, sehingga hasil karbon yang didapatkan juga dipengaruhi oleh hal tersebut.
Hasil uji korelasi antara kerapatan dan biomassa lamun dengan karbon sedimen yang dibedakan berdasarkan kedalaman sedimen juga menunjukkan tidak ditemukannya korelasi yang kuat (Tabel 8). Hal ini diduga karena adanya arus di titik penelitian yang mempengaruhi pengendapan sedimen serta karbon organik pada dasar perairan. Seperti pernyataan Kennedy et al. (2010) yang menyatakan bahwa blue carbon pada ekosistem dibedakan menjadi autochthonous carbon dan allochtonous carbon. Autochthonous carbon merupakan tipe karbon organik yang diproduksi dan terdekomposisi pada lokasi yang sama. Sedangkan, allochtonous carbon merupakan tipe karbon organik yang diproduksi di tempat yang berbeda dengan tempat dekomposisinya. Faktor hidro-oseanografi seperti arus, gelombang dan pasang surut akan mempengaruhi distribusi blue
carbon, karena mendistribusikan sedimen dan karbon organik dari ekosistem yang letaknya berdekatan.
Tabel 8. Hasil Uji Korelasi antara Kedalaman Sedimen dengan Kerapatan dan Biomassa Lamun dengan Karbon Sedimen
|
Kedalaman |
Kerapatan Lamun |
Biomassa Lamun | ||
|
Korelasi |
Sig. (2- |
Korelasi |
Sig. (2- | |
|
Pearson |
tailed) |
Pearson |
tailed) | |
|
0 – 5cm |
0,074 |
0,0756 |
0,263 |
0,262 |
|
6 – 10cm |
0,017 |
0,945 |
0,403 |
0,078 |
|
11 – 15cm |
-0,103 |
0,666 |
0,47 |
0.037 |
|
16 – 20 cm |
-0,028 |
0,910 |
0,359 |
0,131 |
|
21 – 25cm |
-0,39 |
0,895 |
-0,299 |
0,299 |
|
26 – 30cm |
0,668 |
0,147 |
0,532 |
0,277 |
Berdasarkan penelitian yang telah dilakukan, kesimpulan yang diperoleh yaitu ditemukan 4 jenis lamun pada penelitian ini, yaitu E. acoroides, C. rotundata, C. serrulata dan H. ovalis. Rata-rata kerapatan lamun berkisar antara 17 – 179 tgk/m2, dengan nilai tutupan lamun berkisar antara 25 – 100%. Kerapatan jenis lamun tertinggi terdapat pada jenis lamun C. rotundata, hal ini dipengaruhi oleh jenis substrat dan morfologi lamun. Lamun jenis E. acoroides memiliki kerapatan yang lebih kecil dibandingkan dengan jenis lainnya dikarenakan morfologinya yang besar. Karbon dalam sedimen pada ekosistem lamun di Teluk Gilimanuk yaitu sebesar 0,21 - 5,51% untuk S-OCC dan sebesar 0,002 – 0,059 g Corg cm-3 untuk S-OCS. Total S-OCS pada Teluk Gilimanuk yaitu 11165,84 Mg g Corg. Karbon dipengaruhi oleh beberapa faktor hidro-oseanografi seperti arus, gelombang dan pasang surut. Besar kecilnya ukuran substrat juga memengaruhi proses pengikatan bahan organik, sehingga akan memengaruhi kandungan karbon pada sedimen. Kedalaman sedimen tidak berkorelasi kuat terhadap kandungan karbon, korelasi antara biomassa dan kerapatan lamun dengan stok karbon juga lemah.
Ucapan Terima Kasih
Penulis mengucapkan terimakasih kepada Bapak Hari Santoso dan Bapak Jarman, dan Taman Nasional Bali Barat (TNBB) atas bantuan di lapangan, saran dan ijin yang diberikan selama pengambilan data.
Daftar Pustaka
Akdon dan Riduwan. 2005. Rumus dan Data dalam Aplikasi Statistik. Alfabeta. Bandung
Argandi, G. 2003. Struktur Komunitas Lamun di Perairan Pangerungan, Jawa Timur [Skripsi]. Program Studi Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor.
Cappenberg, H.A.W., A. Aziz, I. Aswandy. 2006. Komunitas Moluska di Perairan Teluk Gilimanuk, Bali Barat. Oseanologi dan Limnologi No. 40: 53-64. ISSN 0125-9830.
Cyle, K. T., N. Hill, K. Young, T. Jenkins, D. Hancock, P. A. Schroeder, A. Thompson. 2016. Substrate Quality Influences Organic Matter Accumulation in The Soil Silt and Clay Fraction. Soil Biology and Biochemistry, 103: 138-148.
Duarte, C.M., dan J. Cebrian. 1996. The Fate of Marine Autotrophic Production. Limnology and Oceanograph Volume 18, No. 4: 17581766.
Ferawati, R., J. Nugroho, Y. Rahakratat. 2008. Biomassa dan Penyerapan Karbon oleh Lamun Enhalus acoroides di Pesisir Teluk Gunung Botak Papua Barat. Jurnal Sumberdaya Akuatik Indopasifik. Vol 2. No 2.
Fourqurean, J. W., G. A. Kendrick, L. S. Collins, R., M. Chambers dan M. A. Vanderklift. 2012. Carbon, Nitrogen and Phosphorus Storage in Subtropical Seagrass Meadows: Examples from Florida Bay and Shark Bay. Marine and Freshwater Research. Csiro Publishing.
Fourqurean, J. W., B. Johnson, J. B. Kauffman, H. Kennedy, I. Emmer, J. Howard, E. Pidgeon, O. Serrano. 2014. Conceptualizing the project and Developing a Field Measurement Plan. Coastal Blue Carbon: Methods for Assessing Carbon Stock and Emissions factor in Mangrove, Tidal Salt Marsh and Seagrass Meadow. The Blue Carbon Initiative. 39 - 107 hal.
Gacia, E., T. C. Granata and C. Duarte. 1999. An approach to measurement of particle flux and sediment retention within seagrass (Posidonia oceanica) meadows. Aquat. Bot. 65: 255–268.
Gosari B. A. J., Haris A. 2012. Studi Kerapatan dan Penutupan Spesies lamun di Kepulauan Spermonde. Jurnal Ilmu Kelautan dan Perikanan. 22 (03): 156-162.
Graha Y. I., I. W. Arthana, I. W. G. A. Karang. 2016. Simpanan Karbon Padang Lamun di Kawasan Pantai Sanur, Kota Denpasar. Jurnal Ilmu Lingkungan. 10 (1): 46-53.
Handayani, D.R., Armid., Emiyarti., 2016. Hubungan kandungan nutrien dalam substrat terhadap kepadatan lamun di Perairan Desa Lalowaru Kecamatan Moramo Utara. 1(2): 2503-0396.
Hemminga, M.A., dan C.M. Duarte. 2000. Seagrass Ecology. United Kingdom: Cambridge University Press.
IPCC. 2017. Climate Change 2007: The Physical Science Basis. Contribution of Working Group l to the Fourth Assessment Report of the IPCC. Solomon, S., D. Qin, M. Manning, Z. Chen, M. Marquis, K.B. Averyt, M. Tignor dan H.L. Miller (eds.) ed. Cambridge, United Kingdom, dan New York: Cambridge University Press.
Ira, Oetama D, Juliati. 2013. Kerapatan dan Penutupan Lamun pada Daerah Tanggul Pemecah Ombak di Perairan Desa Terebino Propinsi Sulawesi Tengah. Aquasains: Jurnal Ilmu Perikanan dan Sumberdaya Perairan. Volume 2, No. 1:89-96.
Kauffman, J.B. dan Daniel C. Donato. 2012. Protocols for The Measurement, Monitoring and Reporting of Structure, Biomass and Carbon Stocks in Mangrove Forest. CIFOR.
Kennedy, H., J. Beggins, C.M. Duarte, J.W. Fourqurean, M. Holmer, N. Marba, J.J. Middelburg. 2010. Seagrass Sediments as a Global Carbon Sink: Isotropic Constraints. Global Biogeochemical Cycles, 24: 1-8. doi:10.1029/2010GB003848.
Laffoley, D. dan G. Grimsditch. 2009. The Management of Natural Coastal Carbon Sinks. Gland, Switzerland: IUCN.
Lestari, K.I.V., I.G. Hendrawan, E. Faiqoh. 2020. Estimasi Simpanan Karbon pada Padang Lamun di Kawasan Pantai Karang Sewu, Gilimanuk, Bali. Journal of Marine Research and Technology. ISSN: 2621-0096.
Mateo, M.A., J. Romero, dan M. Perez. 1997. Dynamics of Millenary Organic Deposits Resulting from the Growth of the Mediterranean Seagrass Posidonia oceanica. Estuarine, Coastal and Shelf Science 44:103-110.
NOAA. 2022. Recent Global CO2. Diakses Maret 2022. https://gml.noaa.gov/ccgg/trends/.
Nontji, A. 2002. Laut Nusantara. Cetakan ketiga. Penerbit Djambatan, Jakarta: 367 hal.
Nurzahraeni. 2014. Keragaman Jenis dan Kondisi Padang Lamun di Perairan Pulau Panjang Kepulauan Derawan Kalimantan Timur. [Skripsi]. Jurusan Ilmu Kelautan. Fakultas Ilmu Kelautan Dan Perikanan. Universitas Hasanuddin. Makassar.
Odum, E. P. 1971. Dasar-Dasar Ekologi. Edisi Ketiga Gadjah Mada University Press. Yogyakarta.
Rahmawati, S., Irwan A., Supriyadi I.H., dan Azkab, M.H. 2014. Panduan Monitoring Padang Lamun. COREMAP – CTI. Lembaga Ilmu Pengetahuan Indonesia (LIPI).
Rahmawati, S., Udhi E., Hernawan, K. McMahon, B. Prayudha, H.B. Prayitno, A.J. Wahyudi, M. Vanderklift. 2019. Blue Carbon in Seagrass Ecosystem; Guideline for the Assessment of Carbon Stock and Sequestration in Southeast Asia. Gadjah Mada University Press. Yogyakarta.
Riniatsih, I. 2015. Distribusi Muatan Padatan Tersuspensi (MPT) di Padang Lamun di Perairan Teluk Awur dan Pantai Prawean Jepara. Jurnal Kelautan Tropis. Volume 18, No. 3: 121-126.
Rosalinda, R. 2006. Konektivitas Ikan Pada Ekosistem Padang Lamun dan Terumbu Karang di Teluk Gilimanuk, Taman Nasional Bali Barat, Provinsi Bali. [Skripsi]. Institut Pertanian Bogor.
Sakaruddin, M. I. 2011. Komposisi Jenis, Kerapatan, Persen Penutupan dan Luas Tutupan lamun di Perairan Pulau Panjang Tahun 1990 – 2010. [Skripsi]. Departemen Ilmu dan Teknologi Kelautan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Santisteban, J. I., M. J. Gil-Garcia, C. J. Dabrio, S. C. Castano. 2004. Loss on Ignition: a Qualitative or Quantitative method for Organic Matter and Carbonate Mineral Content in Sediments?. Journal of Paleolimnology. Volume 32, No. 3: 287-299.
Santoso B, I. G. B. S. Dharma, E. Faiqoh. 2018. Pertumbuhan dan Produktivitas Daun Lamun Thalassia hemprichii (Ehrenb) Ascherson di Perairan Tanjung Benoa, Bali. Journal of Marine and Aquatic Sciences. Volume 4, No. 2: 278-286.
Sary. 2006. Bahan Kuliah Manajemen Kualitas Air. Politehnik Vedca. Cianjur.
Sudijono, A. 2008. Pengantar Evaluasi Pendidikan. Raja Grafindo Persada 1996. Jakarta.
Sugiyono. 2018. Metode Penelitian Kuantitatif, Kualitatif, dan R&D. Alfabeta. Bandung.
Supriadi, M., R. F. Kaswadji, D. G. Bengen dan M. Hustomo. 2014. Carbon Stock of Seagrass Community in Barranglompo Island, Makassar. Ilmu Kelautan. Volume 19, No. 1: 1-10.
Tenribali. 2015. Sebaran dan Keragaman Makrozoobentos serta Keterkaitannya dengan Komunitas Lamun di Calon Kawasan Konservasi Perairan Daerah (KKPD) di Perairan Kabupaten Luwu Utara. Skripsi. Program Studi Ilmu Kelautan. Departemen Ilmu
Kelautan. Fakutas Ilmu Kelautan dan Perikanan. Universitas Hasanuddin. Makassar.
Walker, B., dan W. Steffen. 1997. An Overview of The Implication of Global Change for Natural and Managed Terrestrial Ecosystems. Conservation Ecology 1 (2).
Wardoyo, S.T.H. 1978. Kriteria Kualitas Air Untuk Keperluan Pertanian dan Perikanan. Prosiding Seminar Pengendalian Pencemaran Air. (eds Dirjen Pengairan Dep. PU.), hal 293-300.
Yunitha, A. 2015. Kandungan C-Organik pada Lamun Berdasarkan Habitat dan Jenis Lamun di Pesisir Desa Bahoi Kabupaten Minahasa Utara,
Sulawesi Utara. [Thesis]. Sekolah Pascasarjana, Institut Pertanian Bogor, Bogor
Zhou, Tao, P. Shi, G. Jia, Y. Dai, X. Zhao, W. Shangguan, L. Du, H. Wu dan Y. Luo. 2015. Age-dependent Forest Carbon Sink: Estimation via Inverse Modeling. Journal of Geophysical Research: Biogeosciences 120 (12): 2473-2492. Doi: 10.1002/2015jg002943.
Zurba, N. 2018. Pengenalan Padang Lamun, Suatu Ekosistem yang Terlupakan. Unimal Press. Sulawesi.
113
Discussion and feedback