Korelasi Kepadatan Banggai Cardinal Fish (Pterapogon kauderni) dengan Biota Asosiasi (Diadema setosum dan Fibramia thermalis) di Perairan Teluk Gilimanuk, Bali
on
JMRT, Volume 5 No 1 Tahun 2022, Halaman: 16-20
JffUT
JOURNAL OF MARINE RESEARCH AND TECHNOLOGY journal homepage: https://ojs.unud.ac.id/index.php/JMRT
ISSN: 2621-0096 (electronic); 2621-0088 (print)
Korelasi Kepadatan Banggai Cardinal Fish (Pterapogon kauderni) dengan Biota Asosiasi (Diadema setosum dan Fibramia thermalis) di Perairan Teluk Gilimanuk, Bali
Stephanus Tambunana, I Wayan Arthanaa, I Nyoman Giri Putraa*
aProgram Studi Ilmu Kelautan, Fakultas Kelautan dan Perikanan, Unuversitas Udayana, Bali, Indonesia
*Corresponding author, email: nyomangiriputra@unud.ac.id
A R TI C LE I N FO
ABSTRACT
Article history:
Received: July 23th 2021
Received in revised form: August 19th 2021
Accepted: December 4th 2021
Available online: February 28th 2022
Keywords: Correlation, Density,
Fibramia thermalis, P. kauderni, Diadema setosum
Banggai cardinal fish (Pterapogon kauderni) is a marine fish native to Indonesia. P. kauderni is listed as an endangered species in the red list category by the IUCN. P. kauderni is very dependent on microhabitats in the form of benthic animals (symbionts), namely sea urchins, sea anemones, and hard corals. Besides P. kauderni, other fish from the family Apogonidae also live in association with sea urchins. The purpose of this study was to examine the density of P. kauderni and associated biota and to calculate the density correlation between P. kauderni associated biota in the waters of Gilimanuk Bay, Bali. This study uses a modification of the Belt Transect method, with a transect of 50 meters long and 2.5 meters wide to the left and right. The total density of sea urchins was 0,088 ind/m2, the total density of Fibramia thermalis was 0,021 ind/m2, and the total density of P. kauderni was 0,071 ind/m2. Between P. kauderni and sea urchins there is a correlation with the value of r = 0,711 and a P-value of 0,031 < 0,05 which indicates that the large number of sea urchins will affect the number of P. kauderni in the waters. The correlation between density of P. kauderni and Fibramia thermalis worth r = 0,509 with P-value of 0,160 > 0,05, which means that the number of Fibramia thermalis has no effect on the number of P. kauderni.
2022 JMRT. All rights reserved.
Ikan capungan atau Banggai cardinal fish (Pterapogon kauderni) atau yang disingkat BCF merupakan ikan laut asli Indonesia. P. kauderni adalah endemik pada wilayah yang sebagian besar berada di bagian selatan dan timur Kepulauan Banggai, Sulawesi Tengah (Vagelli, 2011). P. kauderni masuk dalam daftar spesies yang terancam punah dengan kategori red list oleh IUCN (Vagelli, 2008). Adapun beberapa pihak lainnya mencoba memasukkan ikan ini ke dalam daftar Appendix II The Convention on International Trade of Endangered Species of Fauna and Flora (CITES) sehingga perdagangan ikan P. kauderni hanya boleh dilakukan dari hasil budidaya (Ndobe, 2011). Penangkapan ikan yang dilakukan terhadap P. kauderni untuk diperdagangkan sebagai ikan hias mengakibatkan menurunnya populasi dari P. kauderni di wilayah sebaran aslinya di Kepulauan Banggai (Ndobe et al., 2013). Ikan ini rawan terhadap tangkapan yang berlebih dikarenakan beberapa aspek biologi dan kehidupan yaitu ikan ini memiliki fekunditas rendah, tidak memiliki fase pelagis, dan memiliki sifat sedentary sepanjang daur hidupnya (Kolm et al., 2005). P. kauderni sangat bergantung pada mikrohabitat berupa hewan bentik yaitu bulu babi, anemon laut dan karang keras dalam hal keberhasilan reproduksi. Penurunan populasi P. kauderni terjadi bukan hanya disebabkan oleh pemanfaatannya sebagai ikan hias, melainkan juga pengaruh dari kerusakan habitat P. kauderni (Kasim et al., 2010) termasuk juga
penurunan dari kelimpahan simbion P. kauderni (Moore et al., 2012). Pelepasan P. kauderni pada jalur perdagangan berakibat pada populasi introduksi P. kauderni telah dapat ditemukan di lokasi lainnya, yaitu di Perairan Luwuk, Bitung, Ambon, Kendari, Teluk Palu dan Bali (Vagelli, 2011). Selain itu, P. kauderni juga ditemukan di beberapa lokasi di Ambon (Wibowo et al., 2019). Di Bali, P. kauderni ditemukan di Teluk Gilimanuk dengan kedalaman sekitar 10 m (Allen & Erdmann, 2012). Di Teluk Gilimanuk, sebagian besar populasi P. kauderni hidup berasosiasi dengan bulu babi (Diadema setosum), karang keras dan spons (Putra dan Putra, 2019). Selain P. kauderni, ikan – ikan lain dari famili Apogonidae juga hidup berasosiasi dengan bulu babi. Penelitian ini bertujuan untuk mengetahui korelasi kepadatan P. kauderni dengan biota asosiasi (Diadematidae dan Apogonidae) di Perairan Teluk Gilimanuk, Bali.
Penelitian ini dilaksanakan di Perairan Teluk Gilimanuk, Kecamatan Melaya, Kabupaten Jembrana, Bali, yang merupakan bagian dari Taman Nasional Bali Barat, pada Bulan Februari 2021. Pengambilan data dilaksanakan pada 3 stasiun pengamatan (Gambar 1). Penentuan stasiun ditentukan secara purposive sampling. Penentuan stasiun dilakukan juga berdasarkan parameter lingkungan yang diperkirakan memiliki perbedaan kualitas perairan. Stasiun 1 memiliki kondisi lingkungan yang dekat dengan pemukiman dan pelabuhan Gilimanuk, Stasiun 2 memiliki kondisi lingkungan yang
cukup jauh dari pemukiman dan pelabuhan tetapi masih cukup dekat dengan daratan, sedangkan Stasiun 3 memiliki kondisi lingkungan yang jauh dari pelabuhan dan pemukiman dan jauh juga dari daratan.
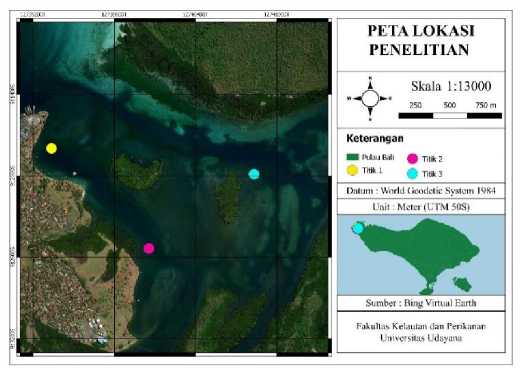
Gambar 1. Peta Lokasi Pengambilan Data
-
2.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ini meliputi alat pengukuran kualitas air dan alat yang akan digunakan dalam proses pengambilan data ikan dan invertebrata atau simbion utama sebagai mikrohabitat dari P. kauderni. Adapun alat bantu penyelaman yaitu scuba digunakan untuk membantu penyelaman, roll meter untuk mengukur batasan transek, dive computer digunakan untuk mengukur suhu perairan dan kedalaman perairan, kamera underwater digunakan untuk mendokumentasikan penelitian dan sabak untuk mencatat kelimpahan biota. Kemudian untuk alat pengukuran kualitas air meliputi secchi disk untuk mengukur kecerahan perairan, refractometer untuk mengukur salinitas, turbidity meter untuk mengukur kekeruhan, current meter untuk mengukur kecepatan arus, aquadest dan tissue untuk membersihkan peralatan pengukuran kualitas air, alat pendukung penelitian yaitu GPS untuk mencatat lokasi penelitian, dan buku identifikasi untuk mengidentifikasi spesies Apogonidae.
-
2.3 Metode Penelitian
-
2.3.1 Pengambilan Data Biota
-
Metode untuk menghitung jumlah ikan adalah Underwater Visual Census yang akan mendeskripsikan ikan yang berada di dalam transek 50 m x 5 m (panjang dan lebar) (Manuputty et al., 2006; Hill & Clive, 2004). Luasan transek untuk pengambilan data tiap titik lokasi yaitu 250m2 dan total luasan transek adalah 750m2. Kelimpahan ikan tiap jenis mulai dihitung dengan batasan jarak pantau 2,5 m pada sisi kiri dan 2,5 m bagian kanan transek sepanjang 50 m. Metode untuk pengambilan data bulu babi yaitu dengan menggunakan metode belt transect yang dimodifikasi. (Johan, 2003). Metode belt transect menggunakan roll meter yang dibentang sepanjang 50 meter kemudian 2 pengamat atau penyelam melakukan pengambilan data.
-
2.3.2 Pengambilan Data Parameter Fisika – Kimia Perairan
Pengambilan data parameter lingkungan meliputi kecerahan, suhu, kedalaman, salinitas, kekeruhan, dan kecepatan arus dilakukan setelah pengambilan data ikan dan habitatnya (bulu babi) sebagai parameter penunjang dalam melakukan penelitian. Pengukuran kecerahan menggunakan Secchi disk. Kecepatan arus
diukur dengan menggunakan Current meter. Kemudian suhu dan kedalaman menggunakan dive computer, dapat dihitung ketika berada di bawah perairan, nilai akan muncul pada layar dive computer. Refractometer digunakan untuk mengukur salinitas dan turbidity meter digunakan untuk mengukur tingkat kekeruhan.
-
2.4 Analisis Data
Kepadatan merupakan jumlah individu per satuan luas (Junianto, 2013; Odum, 1971). Kepadatan masing – masing biota yang ada pada setiap stasiun dapat dihitung menggunakan rumus:
D = Ni (1)
Keterangan:
D : Kepadatan (Ind/m2)
Ni : Jumlah Individu (Ind)
A : Luas transek pengamatan (m2)
Kelimpahan relatif individu dapat didefinisikan sebagai persentase dari jumlah individu sesuatu terhadap total individu yang terdapat didaerah tertentu. Perhitungan rumus dapat dilakukan sebagai berikut (Michael, 1994):
KR = Ni x 100% (2)
N
Keterangan:
KR : Kelimpahan relatif
Ni : Jumlah Individu
N : Jumlah total individu per stasiun pengamatan.
-
2.4.1 Analisis Korelasi
Analisis korelasi pearson dengan menggunakan bantuan software RStudio digunakan untuk menganalisis hubungan antara P. kauderni dengan Diadema setosum dan Fibramia thermalis. Untuk mengetahui tingkat hubungan antar variabel, diperlukan koefisien korelasi yang merupakan ukuran untuk mengetahui tingkat hubungan antar variabel (Siregar, 2013).
Dalam korelasi pearson product moment diperlukan pengujian hipotesis sebagai berikut:
H0: Suatu variabel independent (P. kauderni) tidak berpengaruh signifikan terhadap variabel dependent (Diadema setosum dan Fibramia thermalis).
H1: Suatu variabel independent (P. kauderni) berpengaruh signifikan terhadap variabel dependent (Diadema setosum dan Fibramia thermalis).
Berdasarkan hasil pengamatan yang dilakukan di 3 stasiun lokasi pengamatan di Perairan Teluk Gilimanuk, didapatkan nama spesies dari ikan Apogonidae yang hidup berasosiasi dengan bulu babi (Diadema setosum) dan Pterapogon kauderni ialah Fibramia
thermalis atau sangi cardinal fish yang masih juvenile. Hasil didapatkan berdasarkan ciri morfologi ikan tersebut sesuai dengan buku identifikasi dari Allen et al. (2003). Adapun ciri morfologi yang mencolok dari Fibramia thermalis yaitu memiliki bentuk mulut terminal dengan panjang tubuh kira – kira 3,5 cm, memiliki warna tubuh yang transparan sehingga bentukan tulang menyerupai patahan terlihat cukup mencolok berwarna putih, kemudian terdapat titik hitam di bagian ekor dan terdapat 2 titik hitam pada bagian dorsal. Pada penelitian ini, ikan sangi cardinal fish atau Fibramia thermalis ditemukan pada kedalaman 2 hingga 3 meter. Fibramia thermalis ditemukan berasosiasi dengan bulu babi dan P. kauderni. Sama seperti P. kauderni, Fibramia thermalis juga akan berlindung diantara duri dari bulu babi ketika merasa terancam.
-
3.2 Kepadatan Biota
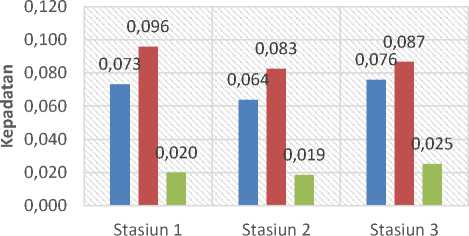
Berdasarkan hasil perhitungan didapatkan nilai kepadatan biota bulu babi (Diadema setosum), P. kauderni dan F. thermalis.
-
■ Pterapogon kauderni ■ Bulu Babi ■ Fibramia thermalis
Gambar 2. Kepadatan Biota
Kepadatan P. kauderni di stasiun pertama 0,073 ind/m2, pada stasiun kedua 0,064 ind/m2, dan pada stasiun ketiga 0,076 ind/m2 (Gambar 2). Kemudian kepadatan bulu babi (D. setosum) di stasiun pertama yaitu 0,096 ind/m2, pada stasiun kedua 0,083 ind/m2, dan pada stasiun ketiga 0,087 ind/m2 (Gambar 2). Kemudian didapatkan kepadatan F. thermalis di stasiun pertama yaitu 0,02 ind/m2, pada stasiun kedua 0,019 ind/m2, dan pada stasiun ketiga 0,025 ind/m2 (Gambar 2). Hasil ini berbeda dengan penelitian sebelumnya yang mendapatkan nilai kepadatan 0,208 ind/m2 (Arbi et al.,2019). Adapun perbandingan kepadatan di wilayah introduksi lainnya di perairan Kendari, Sulawesi Tenggara. Penelitian tersebut mendapatkan variasi kepadatan populasi pada masing – masing tahap perkembangan P. kauderni yang berkisar antara 0 – 0,4 ind/m2 (Kusumawardhani et al., 2019). Sedangkan perbandingan kepadatan di wilayah introduksi lainnya di perairan Ambon didapatkan variasi kepadatan P. kauderni yang ditemukan di 3 dari 5 lokasi yang dipilih sebagai area restocking berkisar antara 0,02 – 0,73 ind/m2 yang terbagi atas beberapa ukuran (Wibowo et al, 2019). Ndobe et al. (2013), menjelaskan adanya perbedaan kepadatan P. kauderni dalam menempati suatu habitat dapat disebabkan karena pada saat pelepasan rekrut induk jantan, P. kauderni memiliki pola pelepasan rekrut yang tidak serentak yang teramati di wadah kontrol dan diduga juga terjadi di alam. Pola pelepasan yang tidak serentak ini berkaitan dengan upaya indukan jantan untuk menghindari dan mengurangi pemangsaan terhadap rekrut ikan. Menurut Kusumawardhani et al (2019), P. kauderni memiliki kecenderungan lebih menyukai hidup menetap dan tidak berpindah jauh, dimana P. kauderni memilih area perairan dekat dasar dengan cara berasosiasi dengan karang bercabang atau bulu babi terutama jenis Diadema setosum. Posisi Teluk Gilimanuk yang merupakan perairan semi tertutup merupakan habitat yang cocok bagi P. kauderni (Arbi et al, 2019). Hal tersebut sesuai dengan penelitian Wibowo et al. (2019)
yang mengatakan bahwa P. kauderni umumnya ditemukan di perairan yang terlindungi di daerah dangkal dengan kedalaman rata – rata 0,5 – 4,5 m.
-
3.3 Kelimpahan Relatif Biota
Kelimpahan relatif biota pada setiap stasiun penelitian didefinisikan dalam persentase individu di dalam jumlah individu yang ada di setiap stasiun pengamatan.

-
Gambar 3. Kelimpahan Relatif Biota
Kelimpahan relatif masing – masing jenis pada stasiun pertama yaitu P. kauderni sebesar 38,7%, kemudian kelimpahan relatif jenis bulu babi (D. setosum) sebesar 50,7% dan kelimpahan relatif jenis F. thermalis sebesar 38,7% (Gambar 3). Pada stasiun kedua yaitu P. kauderni sebesar 39%, kemudian kelimpahan relatif jenis bulu babi (D. setosum) sebesar 50%, dan kelimpahan relatif jenis F. thermalis sebesar 11% (Gambar 3). Selanjutnya pada stasiun ketiga yaitu P. kauderni yaitu sebesar 40,4%, kemudian kelimpahan relatif jenis bulu babi (D. setosum) sebesar 46,1%, dan kelimpahan relatif jenis F. thermalis sebesar 13,5% (Gambar 3).
Menurut Ndobe & Moore (2006), salah satu penyebab rendahnya kehadiran P. kauderni diduga karena semakin berkurangnya populasi bulu babi (D. setosum) sebagai tempat untuk berlindung. Pengambilan bulu babi secara berlebihan banyak dilakukan masyarakat baik untuk konsumsi maupun digunakan sebagai umpan (Kasim et al, 2012).
-
3.4 Korelasi Kepadatan P. kauderni dengan Diadema setosum dan Fibramia thermalis.
Nilai korelasi dari P. kauderni dengan bulu babi (D. setosum) yaitu r = 0,711 artinya tingkat hubungan antara P. kauderni dengan bulu babi (D. setosum) kuat. Diketahui nilai p-value dari korelasi tersebut 0,031 (P < 0,05) maka H0 ditolak yang artinya ada hubungan antara P. kauderni dengan bulu babi. Jika jumlah bulu babi semakin banyak, maka jumlah P. kauderni semakin banyak juga. Hal ini sesuai dengan data kelimpahan relatif total, bulu babi memiliki nilai kelimpahan relatif total 49% dan P. kauderni memiliki nilai kelimpahan relatif total 39%. Menurut Ndobe et al., (2013), kanibalisme P. kauderni tahap rekrut teramati oleh P. kauderni dewasa selain induk pada saat pelepasan oleh induk jantan. Ketika induk jantan yang mengerami larva berada dekat dengan kelompok ikan P. kauderni dewasa yang lain, sejumlah P. kauderni dewasa akan melayang disekitar induk jantan dan ketika rekrut dilepas, satu atau lebih rekrut P. kauderni tersebut akan langsung dimangsa oleh P. kauderni dewasa tersebut (Kusumawardhani et al., 2019). Dalam hal ini bulu babi sangat penting sebagai mikrohabitat bagi P. kauderni dalam kelulusan fase rekrut maupun untuk perlindungan semua ukuran P. kauderni. Sehingga banyaknya kepadatan dari bulu babi (D. setosum) juga akan meningkatkan kepadatan dari P. kauderni karena memperbesar peluang kurangnya kanibalisme dalam ekosistem tersebut. Selanjutnya korelasi antara P. kauderni dengan F. thermalis didapatkan nilai r = 0,509 dan hasil p-value sebesar 0,160 (P < 0,05). Hasil tersebut mengindikasikan bahwa P. kauderni dengan F.
thermalis tidak memiliki hubungan yang signifikan. Dengan demikian, banyaknya kepadatan F. thermalis tidak akan mempengaruhi kepadatan P. kauderni, begitupun sebaliknya. Sesuai dengan hasil data kelimpahan relatif total yang menunjukkan kelimpahan relatif total F. thermalis hanya 12%. Nilai kelimpahan tersebut sangat kecil dibandingkan dengan kelimpahan dari P. kauderni dan D. setosum. Hubungan korelasi antara P. kauderni dengan D. setosum sama halnya dengan hubungan korelasi ikan baronang dengan lamun. Spesies ini memiliki kesamaan yaitu spesies ikan yang sangat bergantung terhadap mikrohabitatnya. Menurut Fakhri et al (2016), keberadaan organisme ikan baronang dipengaruhi oleh vegetasi lamun. Terdapatnya ekosistem lamun pada suatu wilayah maka akan menarik ikan baronang muda untuk menetap dan tumbuh disana, hal ini dikarenakan peran tumbuhan lamun yang begitu besar terhadap kelangsungan hidup ikan baronang. Hal ini sesuai dengan peranan bulu babi terhadap P. kauderni dimana P. kauderni menjadikan bulu babi sebagai mikrohabitat untuk berlindung untuk kelangsungan hidupnya.
-
3.5 Kondisi Kualitas Parameter Lingkungan
Secara ekologis, faktor – faktor yang mempengaruhi penyebaran ikan dan biota lainnya sangat tergantung pada kondisi fisik, kimia dan biologi perairan (lingkungan) yang seringkali kondisinya berubah baik karena faktor alami maupun karena kegiatan manusia (Ndobe et al, 2013). Kedalaman pada stasiun 1, 2 dan 3 hampir sama yaitu berkisar 2 – 3 m, kisaran salinitas pada stasiun 1, 2 dan 3 adalah antara 25 - 26 ppt. Selanjutnya nilai suhu perairan, kecerahanan, kecepatan dan arus tidak memiliki perbedaan yang berarti (Tabel 1). Sedangkan nilai kekeruhan cukup fluktuatif yaitu berkisar 1.53 – 2.14 NTU.
Tabel 1. Parameter Lingkungan
|
Parameter |
Satuan |
Stasiun | ||
|
1 |
2 |
3 | ||
|
Kedalaman |
Meter |
2 |
3 |
3 |
|
Suhu |
oC |
25 |
25 |
24 |
|
Kecerahan |
Meter |
2 |
2 |
1 |
|
perairan Salinitas |
‰ |
26 |
26 |
25 |
|
Kekeruhan |
NTU |
1,53 |
1,94 |
2,14 |
|
Kecepatan |
m/s |
0,07 |
0,07 |
0,06 |
|
arus | ||||
Menurut Arbi et al (2019), di Perairan Teluk Gilimanuk ikan dapat ditemukan pada kedalaman antara 0,5 – 8 meter, dan secara menyeluruh ditemukan pada kedalaman rata – rata 1,5 – 2 meter. Kondisi suhu di perairan ini pada 3 stasiun hampir sama dengan nilai 24 – 25 oC. Kemudian penelitian Arbi et al. (2019) juga menyebutkan bahwa Perairan Teluk Gilimanuk termasuk keruh dengan jarak pandang kurang dari 5 meter. Kondisi kecepatan arus umumnya lemah. Jika dibandingkan dengan penelitian Saraswati et al (2017), hasil kualitas air di Perairan Pulau Serangan Bagian Utara mendapatkan hasil pengukuran suhu berkisar antara 28,9oC sampai dengan 30,5 oC, kemudian hasil pengukuran salinitas berkisar 29,9‰ sampai dengan 32,7‰, hasil pengukuran kekeruhan yaitu berkisar 1,9 NTU sampai dengan 7,6 NTU. Hasil kualitas air tersebut menunjukkan adanya perbedaan dengan penelitian ini.
Kepadatan P. kauderni di Perairan Teluk Gilimanuk berkisar antara 0,064 – 0,076 ind/m2, kemudian kepadatan bulu babi (D. setosum) berkisar antara 0,083 – 0,096 ind/m2, dan kepadatan F. thermalis berkisar antara 0,019 – 0,025 ind/m2. Korelasi kepadatan P. kauderni dengan bulu babi (D. setosum) bersifat kuat (r = 0,711) dan signifikan (p-value = 0,031) yang berarti P. kauderni dan bulu babi (D. setosum) memiliki hubungan yang signifikan, jadi banyaknya bulu babi (D. setosum) akan mempengaruhi banyaknya jumlah P. kauderni di perairan tersebut. Korelasi kepadatan P. kauderni dengan F. thermalis tidak signifikan (p-value = 0,160) dengan nilai koefisien korelasi (r = 0,509) yang berarti P. kauderni dan F. thermalis tidak memiliki hubungan yang signifikan sehingga kepadatan dari F. thermalis tidak akan mempengaruhi kepadatan P. kauderni, begitupun sebaliknya.
Daftar Pustaka
Allen, G., & Erdmann, M. V. (2012). Reef Fishes of Bali, Bali Marine Rapid Assesment Program 2011 (Second English Edition). Denpasar, Bali: RAP Bulletin of Biological Assessment 64.
Allen, G., Steene, R., Humann, P., & DeLoach, N. (2003). Reef Fish Identification Tropical Pacific. Singapore: New World Publications.
Arbi, U. Y., Suharti, S. R., Huwae, R., Rizqi, M. P., & Suratno. (2019). Populasi Ikan Endemik Capungan Banggai (Pterapogon Kauderni) di Habitat Introduksi di Teluk Gilimanuk, Bali. Semnaskan-UGM XVI.
Fakhri A. S., Riyantini, Indah, P, Donny Juliandri, & Hamdani, Herman (2016). Korelasi Kelimpahan Ikan Baronang (Siganus Spp) Dengan Ekosistem Padang Lamun di Perairan Pulau Pramuka Taman Nasional Kepulauan Seribu. Jurnal Perikanan Kelautan, 165 - 171.
Hill, J., & Clive, C. (2004). Method For Ecological Monitoring of Coral Reefs (Ver. 1). Townsville, Australia: Australian Institute of Marine Science.
Johan, O. (2003). Metode Survei Terumbu Karang Indonesia. Dalam Makalah Training Course: Karakteristik Biologi Karang. Yayasan Terangi.
Junianto, D. (2014). Studi Ekologi Teripang (Holothuroidea) di Perairan Desa Pengudang Kabupaten Bintan. Skripsi. Riau: Universitas Maritim Raja Ali Hijau.
Kasim, K., Hartati, S. T., Prihatingsih, & Thordarson, G. (2010). Impact of Fishing and HabitatDegradation on the Density of Banggai Cardinal Fish (Pterapogon kauderni, Koumans 1933) in Banggai Archipelago, Indonesia. Indonesian Fisheries Research Journal, 20(1): 29-36.
Kasim, K., Sadiyah, L., & Hartati, S. T. (2012). Parameter Oseanografi dan Pengaruhnya Terhadap Kelimpahan Ikan Banggai Kardinal (Pterapogon kauderni) Di Perairan Kepulauan Banggai. Jurnal Penelitian Perikanan Indonesia. 14
Kolm, N., Hoffman, E. A., Olsson, J., Berglund, A., & Jones, A. G. (2005). Group stability and homing behavior but no kin group structures in a coral reef fish. Behavioral Ecology, 16(3): 521-527.
Kusumawardhani, N. R., Arbi, U. Y., & Aunurohim. (2019). Analisis Preferensi Habitat Ikan Capungan Banggai (Pterapogon Kauderni) di Lokasi Introduksi Perairan Kendari, Sulawesi Tenggara. Seminar Nasional Kelautan XIV.
Manuputty, A., Giyanto, Winardi, S. R., Suharti, & Djuwariah. (2006). Manual Monitoring Kesehatan Karang (Reef Health Monitoring). Jakarta: CRITC COREMAP Indonesia.
Michael, P. (1994). Metode Ekologi untuk Penyelidikan Lapangan dan Laboratorium. Jakarta: UI Press.
Moore, A., & Ndobe, S. (2006). Toward a Sustainable Fishery for The Endemic Ornamental Fish Pterapogon kauderni in The Banggai Archipelago, Central Sulawesi, Indonesia. 6 p.
Moore, A., Ndobe, S., Salanggon, A., & Rahman, A. (2012). Banggai Cardinalfish Ornamental Fishery: The Importance of Microhabitat. Proceedings of the 12th International Coral Reef Symposium, 13C_1: 9-13.
Ndobe, S. (2011). Pertumbuhan Ikan Hias Banggai Cardinalfish (Pterapogon kauderni) Pada Media Pemeliharaan Salinitas Yang Berbeda. Media Litbang Sulteng, IV (1), 52-56.
Ndobe, S., Setyohadi, D., Herawati, E. Y., Soemarno, Moore, A., Palomares, M. D., & Pauly, D. (2013). Life History of Banggai Cardinalfish Pterapogon kauderni (Actinopterygii: Pisces: Apogonidae) in Banggai Islands and Palu Bay, Sulawesi, Indonesia. Acta Ichthyologica Et Piscatoria, 433: 237-250.
Ndobe, S., Widiastutui, I., & Moore, A. (2013). Sex Ratio dan Pemangsaan terhadap Rekrut pada Ikan Hias Banggai Cardinalfish (Pterapogon Kauderni). Konferensi Akuakultur Indonesia, 9-20.
Odum, E. P. (1971). Dasar-dasar Ekologi. Catatan ke-3. Yogyakarta: Gajah Mada University Press. 15
Putra, I. N.G., & Putra, N. I. (2019). Recent Invasion of the Endemic Banggai Cardinalfish, Pterapogon kauderni at The Strait of Bali: Assessment of the Habitat Type and Population Structure. Indonesia Journal of Marine Science, Vol 24(1): 15-22.
Saraswati, N. R., Arthana, I. W., & Hendrawan, I. G. (2017). Analisis Kualitas Perairan Pada Wilayah Perairan Pulau Serangan Bagian Utara Berdasarkan Baku Mutu Air Laut. Journal of Marine and Aquatic Sciences, 163 - 170.
Siregar, S. (2013). Statistik Parametrik untuk Penelitian Kualitatif. Jakarta: Bumi Aksara.
Vagelli, A. A. (2008). The Unfortunate Journey of Pterapogon Kauderni: A Remakable Apogonid Endangered by the International Ornamental Fish Trade and Its Case in CITES. SPC Live Reef Information Bulletin, 18, 7-28.
Vagelli, A. A. (2011). The Banggai Cardinalfish: Natural History, Conversation, and Culture of Pterapogon kauderni. Chichester, UK: John Wiley & Sons, Ltd.
Wibowo, K., Arbi, U. Y., & Vimono, I. B. (2019). The Introduced Banggai Cardinal Fish (Pterapogon Kauderni) Population in Ambon Island, Indonesia. IOP Conference Series: Earth and Environmental Science.
20
Discussion and feedback