Pengaruh Warna Lampu yang Berbeda terhadap Laju Pertumbuhan Chaetoceros calcitrans
on
JMRT, Volume 7 No 1 Tahun 2024, Halaman: 49-54
JOURNAL OF MARINE RESEARCH AND TECHNOLOGY
journal homepage: https://ojs.unud.ac.id/index.php/JMRT
ISSN: 2621 - 0096 (electronic); 2621 - 0088 (print)
Pengaruh Warna Lampu yang Berbeda terhadap Laju Pertumbuhan Chaetoceros calcitrans
Rijal Rahmatullaha, I Wayan Nuarsaa*, Gede Surya Indrawana
aProgram Studi Ilmu Kelautan, Fakultas Kelautan dan Perikanan, Unuversitas Udayana, Bali, Indonesia
*Corresponding author, email: nuarsa@unud.ac.id
ARTICLE INFO
A B S T R A C T
Article history:
Received: 15 April 2023
Received in revised form: 5 Mei 2023
Accepted: 13 Juli 2023
Available online: 6 Februari 2024
Keywords:
Chaetoceros calcitrans;
Growth rate;
Light color
Kata Kunci :
Chaetoceros calcitrans;
Laju Pertumbuhan;
Warna lampu
Chaetoceros calcitrans is one of the diatoms commonly used as a natural feed for cultivated fish larvae. The cultivation of C. calcitrans as natural feed is influenced by various factors, including light as a source for photosynthesis. This research aimed to determine the effect of different light colors on the growth rate and identify the optimal color for the growth rate of C. calcitrans. The research was conducted at the BPIU2K Karangasem laboratory. The experimental method with a Completely Randomized Design (CRD) was employed, consisting of three treatments and one control. Treatment A used yellow-colored lights, treatment B used blue-colored lights, treatment C used green-colored lights, and treatment D served as the control using white-colored lights. The observed parameters included population density, specific growth rate, and doubling time. The results were analyzed using ANOVA. The findings indicated that the light color significantly affected the population density, specific growth rate, and doubling time with a value of (Sig.<0.05). The best treatment was the use of white-colored lights, followed by yellowcolored lights, which resulted in the highest density on the 5th day, reaching 1.238,88 x 104 cells/ml and 1.040,55 x 104 cells/ml, respectively. The specific growth rate for white and yellow lights was 8.51%/hour and 7.53%/hour, respectively. The doubling time for white and yellow lights was 14.93 hours and 15.75 hours, respectively. White and yellow light irradiation exhibited wavelengths suitable for the cultivation of C. calcitrans.
A B S T R A K
Chaetoceros calcitrans adalah salah satu jenis diatom yang umumnya digunakan sebagai pakan alami untuk larva ikan yang dibudidayakan. Budidaya C. calcitrans sebagai pakan alami dipengaruhi oleh berbagai faktor, termasuk cahaya sebagai sumber fotosintesis. Tujuan penelitian ini adalah untuk menentukan pengaruh warna cahaya yang berbeda terhadap laju pertumbuhan dan mengidentifikasi warna cahaya optimal untuk laju pertumbuhan C. calcitrans. Penelitian dilakukan di laboratorium BPIU2K Karangasem. Metode eksperimental yang dipakai Rancangan Acak Lengkap (RAL), terdiri dari tiga perlakuan dan satu kontrol. Perlakuan A menggunakan lampu berwarna kuning, perlakuan B menggunakan lampu berwarna biru, perlakuan C menggunakan lampu berwarna hijau, dan perlakuan D sebagai kontrol menggunakan lampu berwarna putih. Parameter yang diamati meliputi kepadatan populasi, laju pertumbuhan spesifik, dan waktu penggandaan diri. Hasil dianalisis menggunakan ANOVA. Temuan menunjukkan bahwa warna cahaya secara signifikan mempengaruhi kepadatan populasi, laju pertumbuhan spesifik, dan waktu penggandaan diri dengan nilai (Sig.<0,05). Perlakuan terbaik adalah penggunaan lampu berwarna putih, diikuti oleh lampu berwarna kuning, yang menghasilkan kepadatan tertinggi pada hari ke-5, mencapai 1.238,88 x 104 sel/mL dan 1.040,55 x 104 sel/mL, secara berturut-turut. Laju pertumbuhan spesifik untuk lampu putih dan kuning adalah 8,51%/jam dan 7,53%/jam, secara berturut-turut. Waktu penggandaan diri untuk lampu putih dan kuning adalah 14,93 jam dan 15,75 jam, secara berturut-turut.pencahayaan cahaya putih dan kuning menunjukkan panjang gelombang yang cocok untuk budidaya C. calcitrans.
2024 jmrt. all rights reserved.
Kebutuhan pakan alami dalam industri budidaya dibutuhkan dalam jumlah besar untuk kegiatan budidaya perikanan hal ini mengharuskan pembudidaya untuk tidak bisa
terus bergantung terhadap pasokan alami yang berada di alam (Nita, 2022). Zooplankton dan fitoplankton ialah pakan alami yang digunakan dalam kegiatan budidaya. fitoplankton menjadi salah satu pakan alami terpenting dalam ekosistem perairan yang merupakan produsen utama yang memberikan kontribusi 49
terbesar terhadap total produk primer suatu kawasan perairan. (Lestari et al., 2019). Pakan alami jenis fitoplankton memerlukan sinar matahari untuk melakukan proses fotosintesis dan menghasilkan energi. Keberadaan fitoplankton yang melimpah pada perairan menjadi sumber makanan primer untuk kehidupan akuatik karena bersifat autotrof (Nindarwi et al., 2019).
Kelompok Fitoplankton yang sangat penting untuk produksi budidaya dan pemeliharaan keseimbangan ekosistem perairan adalah fitoplankton yang dari kelompok diatom (Nita, 2022). Ciri khas dari diatom adalah berdinding sel keras tersusun dari 2 klep yang disebut frustule, Epiteka adalah klep yang menutup bagian atas sementara klep bawahnya disebut hipoteka. Penutup di bawah dan atasnya berbentuk layaknya cawan petri yang dapat menutupi satu sama lain (Nugroho, 2019). Dibutuhkan kultur berskala laboratorium dalam menjaga C. calcitrans sebagai faktor yang berperan dalam menjaga ekosistem perairan dan pemenuhan kebutuhan sektor budidaya. Caranya dengan membangun lingkungan hidup seperti habitat asli mereka di alam. Faktor penting yang perlu di perhatikan dalam kultur pakan alami antara lain suhu, cahaya, dan unsur hara (Buwono dan Nurhasanah, 2018). Cahaya menjadi salah satu faktor dalam kegiatan pakan alami. Cahaya meliputi intensitas, kualitas spektrum dan fotoperiode (Wicaksono, 2014). Damanik (2020) menyatakan bahwa pigmen fotosintesis cenderung menyerap energi foton, dan mentransfernya ke pusat reaksi fotokimia. Organisme fotosintesis berisikan pigmen organik untuk memanen energi cahaya. Terdapat tiga kelas pigmen yaitu: klorofil, karotenoid, dan fikobilin. C. calcitrans sendiri memiliki jenis pigmen berupa karotenoid yang jangkauan penyerapan panjang gelombang cahaya antara 450570 nm (Richmond, 2004; Arifah et al., 2019)
Mengetahui warna lampu yang terbaik untuk pertumbuhan C. calcitrans dapat berkontribusi untuk para pembudidaya yang menggunakan C. calcitrans sebagai pakan alami dan juga dapat menjadi infomasi lebih untuk pembudidaya untuk mengambil kesimpulan tentang warna lampu yang akan digunakan. Oleh sebab itu penelitian ini bertujuan untuk mengetahui pengaruh penggunaan warna lampu yang berbeda terhadap laju pertumbuhan dan mengetahui warna lampu yang optimal untuk laju pertumbuhan C. calcitrans.
Penelitian dilakukan di Ruang Laboratorium Produksi Fitoplankton Unit Kekerangan Balai Produksi Induk Udang Unggul dan Kekerangan (BPIU2K) Karangasem. Waktu Pelaksanaan penelitian selama 60 hari dimulai pada 18 Desember 2022 – 26 Januari 2023.
-
2.2 Metode penelitian
Peneliti di sini memanfaatkan desain ekperimen sebagai metode penelitiannya berupa percobaan murni dalam penerapan manipulasinya, replikasi dilakukan sekali lalu mengacak pembagian subjeknya ke dalam kelompok kontrol maupun
ekperimen (Anthony et al., 2014). Rancangan dalam eksperimen yang dilakukan menggunakan Rancangan Acak Lengkap (RAL) dengan tiga perlakuan (A = Kuning, B = Biru, C = Hijau) dan satu kontrol (D = Putih) dimana masing-masing percobaan dilakukan tiga kali pengulangan. Perlakuan yang dilakukan berupa perbedaan warna lampu yang menyinari pada proses pemeliharaan. Penyinaran dilakukan selama 24 jam. Pada setiap perlakuan diberikan sekat untuk menjaga agar lampu lain tidak menyinari perlakuan disebelahnya. Berikut posisi penempatan wadah yang dipakai dalam penelitian (Gambar 1).
-
2.3 Prosedur eksperimen
-
2.3.1 Teknik Persiapan
-
Teknik persiapan meliputi persiapan media kultur berupa air laut steril yang sudah ditampung di bak penampungan, persiapan alat dan bahan kultur dengan cara mensterilisasi alat berupa wadah botol, kaca aerasi, gelas ukur, pipet tetes yang akan digunakan untuk kultur dan menyiapakan bahan-bahan seperti pupuk KW 21 dan larutan pupuk silikat.
-
2.3.2 Teknik Seleksi Bibit
Teknik seleksi bibit diamati dengan cara mematikan aerasi sehingga tidak adanya gelembung dalam air media lalu di diamkan beberapa saat. Setelah itu akan muncul plankton yang melayang di atas dan endapan di bawahnya. Bibit diseleksi berdasarkan warna, endapan, dan kepadatan.
-
2.3.3 Penyiapan Bibit C. calcitrans
Bibit C. calcitrans yang peneliti gunakan diperoleh dari BPIU2K Karangasem. Bibit C. calcitrans sebelum digunakan dihitung terlebih dahulu untuk menyesuaikan padat tebar awal. Untuk mendapatkan jumlah inokulan awal yang diperlukan selama kultur dapat dihotung dengan rumus menurut Ekawati (2005), seperti pada persamaan (1) :
V1 =
M2 × M2
V2
(1)
Keterangan:
V1 = Jumlah bibit awal (ml)
M1 = Jumlah kepadatan bibit (sel/ml)
V2 = Volume air media yang diinginkan(ml)
M2 = Jumlah kepadatan sel yang diinginkan (sel/ml).
Jumlah kepadatan awal yang digunakan sebesar 250 x 104 sel/ml dengan volume tebar awal sebesar 25 ml.
-
2.4 Parameter yang diamati
Penelitian ini memfokuskan pada pengamatan laju pertumbuhan spesifik dan kepadatan dari doubling time C. calcitrans.
-
2.4.1 Kepadatan
Kepadatan C. calcitrans dipantau setiap hari sampai kepadatan sel menurun setelah penebaran pertama. Penhitungan dilakukan dengan haemocytometer dan digunakan handcounter untuk memudahkan penghitung. dilakukan dibawah mikroskop dengan pembesaran 400x dan menggunakan haemocytometer. Menghitung kepadatan C. calcitrans menggunakan rumus menurut Lestari et al (2019). seperti pada persamaan (2) :
N
P = × 25 × 104
5
(2)
Keterangan:
P = Kepadatan sel
N = Jumlah sel pada lima kotak
5 = Jumlah area hitung
25 = Jumlah kotak haemocytometer
104 = Volume area haemocytometer
-
2.4.2 Laju Pertumbuhan Spesifik
Perkembangan pembelahan sel pada fitoplankton perlu diketahui dan ditentukan dengan cara menghitung laju pertumbuhan spesifiknya (µ). Hal ini dilakukan untuk mengetahui sebanyak apa dan seberapa lama hasil pembelahan yang dihasilkan oleh fitoplankton. Berikut persamaan perhitungannya berdasarkan Hariyanto (2020):
(μ ) =
ln Nt - ln N 0 ------------× 100
t
(3)
Keterangan:
µ = Laju pertumbuhan spesifik (%/jam)
N0 = Kepadatan awal sel (Ind/mL)
Nt = Kepadatan akhir sel fase eksponensial (Ind/ml) t = Waktu (jam) dari N0 ke Nt
-
2.4.3 Doubling time
Satuan waktu atau periode penggandaan sebuah sel disebut dengan menggandakan waktu atau doubling time. Untuk menentukan Doubling time (DT) dengan menggunakan rumus menurut Lestari et al (2019). Seperti pada persamaan (4)
log (2)×∆ t
DT =-- ---
log Ct - log Co
(4)
Keterangan:
DT = Waktu penggandaan diri (jam)
Co = Kepadatan awal sel (sel/ml)
Ct = Kepadatan akhir sel (sel/ml)
Δt = Lama waktu dalam satu periode pengamatan (jam).
-
2.5 Analisis Data
Data hasil pengamatan ditampilkan dalam bentuk gambar dan tabel. Analisis data menggunakan Rancangan Acak Lengkap satu faktorial. Kemudian data dianalisa dengan uji (ANOVA) menggunakan software SPSS 24 untuk membandingkan rata-rata antara kelompok perlakuan. Apabila nilai Sig. < 0,05 maka adanya pengaruh nyata dari perlakuan yang diberikan ke C. calcitrans. Jika hasil ANOVA menunjukan pengaruh nyata, maka peneliti bisa melanjutkannya ke pengujian selanjutnya yakni BNT (Beda Nyata Terkecil) sebagai cara menunjukkan adanya perbedaan yang signifikan diantara kelompok-kelompok tersebut.
Kepadatan sel plankton C. calcitrans yang diamati selama 9 hari mulai dari hari ke-0 hingga hari ke-9 dengan pengaruh warna lampu berbeda. Hasil perhitungan kepadatan sel C. calcitrans ditampilkan dalam bentuk grafik yang mencakup semua perlakuan. Hasil kepadatan bisa diamati pada (Gambar 2).
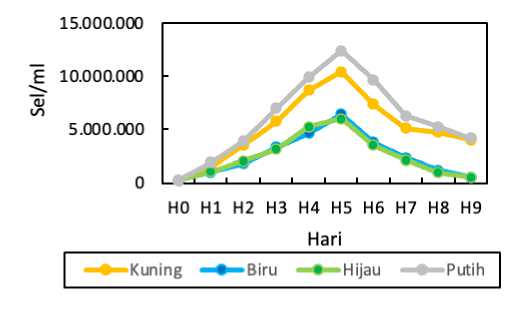
Gambar 2. Grafik rata-rata kepadatan sel C. calitrans pada masing-masing perlakuan
Berdasarkan hasil pengamatan kepadatan sel C. calcitrans didapatkan fakta bahwa hari kelima pemeliharaan (Gambar 3) menjadi masa dengan rata-rata pertumbuhan tertinggi dalam aspek kepadatannya. Ada sebesar 1.238,88 x 104 sel/ml kepadatanpada kontrol lampu putihnya, 1.040,55 x 104 sel/ml kepadatan pada lampu kuning, sebesar 642,77 x 104 sel/ml kepadatan pada lampu biru, dan yang terkecil pada perlakuan lampu hijau yakni 600,55 x 104 sel/ml. Hasil analisis uji ANOVA pada kepadatan sel C. calcitrans menunjukan nilai Sig. 0.00 < 0.01 maka dapat dinyatakan bahwa perlakuan memberi pengaruh sangat nyata terhadap kepadatan sel C. calcitrans sehingga dapat di lanjut dengan pengujian BNT.
Tabel 1. Uji Lanjut BNT Kepadatan sel C. calcitrans
|
Uji BNT | ||
|
Perlakuan |
Rerata Kepadatan sel (sel/ml) |
Simbol |
|
Hijau |
2.488.333 |
a |
|
Biru |
2.536.944 |
a |
|
Kuning |
5.130.000 |
b |
|
Putih |
6.068.888 |
b |
Keterangan: Perbedaan signifikansi sebanyak 0,05 pada uji BTN dibuktikan dengan perbedaan simbol dalam satu kolom yang sama. Angka paling tinggi bersimbol b merupakan hasil paling optimalnya.
Hasil uji lanjut BNT pada kepadatan sel C. calcitrans menunjukan bahwa perlakuan penyinaran menggunakan lampu bewarna kuning dan putih memiliki nilai Sig < 0.05 terhadap perlakuan penyinaran warna lampu hijau dan biru sedangkan perlakuan hijau dan biru memiliki nilai Sig > 0.05.
Perlakuan pada lampu putih dan kuning membuat sel mengalami kepadatan paling tinggi. Pengaruh pencahayaan warna putih dan kuning bagus untuk kultur C. calcitrans karena pencahayaan warna putih dan kuning memiliki panjang gelombang yang lebih panjang di bandingkan dengan warna biru dan hijau hal ini membuat proses fotosintesis pada C. calcitrans lebih maksimal dan memberikan kepadatan sel yang lebih tinggi dibandingkan dengan pencahayaan dengan panjang gelombang yang lebih pendek hal ini sesuai dengan Nor (2016), karotenoid yang dimiliki C. calcitrans mampu menyerap tenaga cahaya pada panjang gelombang 450 – 570 nm. Akan tetapi jika panjang gelombang melebihi batas penyerapan aktifitas fotosintesis akan menurun dan mempengaruhi kepadatan sel fitoplankton (Wahyuni dan Widjanarko, 2015). Pencahayaan warna biru dan hijau menghasilkan kepadatan sel yang rendah karena intensitas cahaya yang dihasilkan lebih rendah dari pada intensitas cahaya putih dan kuning, selain itu panjang gelombang dari warna biru dan hijau lebih pendek dari pada lampu warna putih dan kuning (Lama, 2020).
Pigmen karotenoid pada fitoplankton memeiliki peran sebagai pigmen aksesori dan fotoproteksi untuk membantu proses fotosintesis dan memproteksi dari cahaya berlebih (Fitriyani, 2017). Pada pertumbuhan populasi sel C. calcitrans tidak hanya karetonoid saja yang berperan dalam proses pertumbuhan populasi sel tetapi terdapat faktor internal dan eksternal seperti bentuk dari fitoplankton, kandungan nutrient pada wadah kultur dan paramater kualitas air selama masa pemeliharaan (Dormegawaty dan Hasbi, 2021; Rahmah et al., 2022).
-
3.2 Laju Pertumbuhan Spesifik
Laju pertumbuhan spesifik dihitung mulai hari pertama terjadi pertumbuhan sampai fase eksponensial/pertumbuhan paling tinggi. Nilai rata-rata pertumbuhan selnya dari awal hingga akhir pertumbuhan ditunjukkan pada Gambar 3.
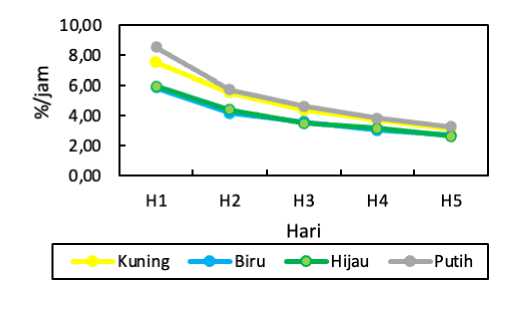
Gambar 3. Grafik Rata-rata Laju Pertumbuhan Spesifik C. calcitrans
Laju pertumbuhan spesifik selama pemeliharaan menunjukkan laju pertumbuhan spesifik tertinggi terdapat pada perlakuan lampu putih pada hari pertama dengan nilai 8,51 %/jam, diikuti perlakuan lampu kuning dengan nilai 7,53 %/jam, lalu perlakuan lampu hijau dengan nilai 5,97 %/jam dan terkecil pada perlakuan lampu biru dengan nilai 5,86 %/jam. Hasil dari analisis statistik ANOVA pada kepadatan laju pertumbuhan spesifik C. calcitrans menunjukan hasil Sig < 0,05. Sehingga dapat dinyatakan bahwa perlakuan memberi pengaruh berbeda nyata terhadap laju pertumbuhan spesifik C. calcitrans sehingga perlu dilakukannya uji lanjut BNT.
Tabel 2. Uji Lanjut BNT Laju pertumbuhan spesifik C. calcitrans
Uji BNT
Perlakuan Rerata laju pertumbuhan spesifik Simbol
(%/jam)
Kuning 4.84ab
Keterangan: Perbedaan signifikansi sebanyak 0,05 pada uji BTN dibuktikan dengan perbedaan simbol dalam satu kolom yang sama. Angka paling tinggi bersimbol b merupakan hasil paling optimalnya.
Hasil uji lanjut BNT pada laju pertumbuhan spesifik C. calcitrans menunjukan bahwa perlakuan penyinaran menggunakan lampu bewarna putih memiliki nilai Sig < 0.05 terhadap perlakuan penyinaran warna lampu hijau dan biru, sedangkan pada perlakuan lampu warna kuning tidak ada pengaruh nyata karena nilai Sig > 0.05 (Tabel 2).
Warna cahaya penyinaran juga dapat mempengaruhi produktivitas premier yang ada pada fitoplankton hal tersebut sesuai dengan percoaban yang dilakukan oleh Maltsev et al. (2021) tentang pengaruh cahaya terhadap kandungan lipid pada fitoplankton. Lipid adalah komponen vital dari membran sel dan juga dapat digunakan untuk penyimpanan energi. Oleh karena itu, kandungan lipid dapat mempengaruhi struktur dan fungsi membran sel, yang dapat berimplikasi pada pembelahan sel (Morales et al., 2021). Lipid yang dihasilkan dari proses fotosintesis akan digunakan untuk proses pembelahan sel fitoplankton dan mempercepat prosses laju pertumbuhan dan meningkatkan kepadatan sel dari fitoplankton. Penelitian yang dilakukan oleh Linggar (2019), penambahan intensitas cahaya yang sesuai meningkatkan laju pertumbuhan, kepadatan, dan total lipid yang dihasilkan C. calcitrans.
-
3.3 Doubling time
Douling time C. calcitrans dengan pengaruh beberapa warna lampu ditampilkan pada Gambar 4.
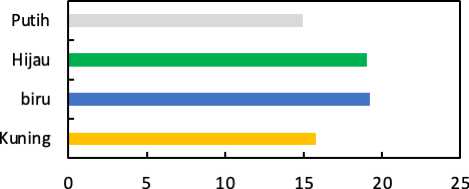
■ Kuning Bbiru BHijau Putih
menyediakan energi untuk proses pembelahan sel fitoplankton (Rahmah et al., 2022). Cahaya dengan panjang gelombang sesuai akan mengoptimalkan proses fotosintesis dan juga akan mempercepat proses pembelahan sel pada fitoplankton, hal ini sesuai dengan penelitian dilakukan oleh Bergström dan Karlsson (2019) dimana penambahan cahaya pada perairan dapat meningkatkan produksi fitoplankton, dan waktu penggandaan diri.
-
2.4 Parameter Kualitas Air
Pengukuran parameter kualitas air selama masa pemeliharaan disajikan pada Tabel 4.
Gambar 4. Grafik Rata-rata Doubling time C. calcitrans
Hasil dari pengamatan didapati waktu penggadaan diri tercepat terdapat pada perlakuan kontrol dengan rata-rata lama waktu penggandaan diri selama 14,93 jam, diikuti perlakuan kuning dengan lama waktu 15,75 jam, lalu perlakuan hijau dengan lama waktu 19,04 jam, dan terakhir perlakuan biru dengan lama waktu 19,23 jam. Hasil dari analisis (ANOVA) pada Doubling time C. calcitrans yang dilakukan menunjukan hasil nilai Sig. < 0.05 maka dapat dinyatakan bahwa perlakuan memberi pengaruh berbeda nyata terhadap Doubling time C. calcitrans sehingga harus melakukan pengujian lanjut BNT (Tabel 3).
Tabel 3. Uji Lanjut BNT Doubling time C. calcitrans
|
Uji BNT | ||
|
Perlakuan |
Rerata Doubling time (jam) |
Simbol |
|
Biru |
19.23 |
a |
|
Hijau |
19.04 |
a |
|
Kuning |
15.75 |
ab |
|
Putih |
14.93 |
b |
Keterangan: Perbedaan signifikansi sebanyak 0,05 pada uji BTN dibuktikan dengan perbedaan simbol dalam satu kolom yang sama. Angka paling tinggi bersimbol b merupakan hasil paling optimalnya.
Hasil uji lanjut BNT pada Doubling time C. calcitrans menunjukan bahwa perlakuan penyinaran menggunakan lampu bewarna putih memiliki nilai Sig < 0.05 terhadap perlakuan penyinaran warna lampu hijau dan biru, sedangkan pada perlakuan lampu warna kuning tidak ada pengaruh nyata karena nilai Sig > 0.05.
Populasi berkembang dengan lebih cepat jika doubling time yang dihasilkan rendah sebab kepadatan maksimal dan pembelahan sel membutuhkan waktu yang lebih singkat. Hasil waktu penggandaan diri ini lebih singat dibandingkan dengan riset yang dilakukan oleh Lestari et al (2019) dengan perlakuan pemberian pupuk Nutrisil serta KW21+Silikon 1ml dengan kecepatan waktu penggandaan diri 34 jam. Perihal ini diprediksi sebab waktu generasi dipengaruhi oleh sebagian aspek. Suryani dan Taupiqurrahman (2021) menyatakan waktu generasi dipengaruhi oleh aspek hayati semacam wujud serta sifat jasad serta faktor non biologi seperti nutrient, temperatur dan cahaya. Cahaya dengan panjang gelombang sesuai lebih cepat merangsang waktu pembelahan sel karena cahaya diteruskan ke klorofil secara optimal dalam proses pembelahan sel.
Cahaya tidak berperan langsung dalam proses pembelahan sel namun cahaya berperan penting untuk fotosintesis, yang
Tabel 4. Kualitas Air
|
Percobaan |
Suhu (oC) |
pH |
Salinitas (ppt) | |
|
pagi |
sore | |||
|
A1 |
20.2 - 20.4 |
20.4 - 20.6 |
7.6 |
33 |
|
A2 |
20.3 - 20.6 |
20.5 |
7.4 |
33 |
|
A3 |
20.4 - 20.6 |
20.6 |
7.5 |
33 |
|
B1 |
20.2 - 20.7 |
20.4 - 20.7 |
7.5 |
33 |
|
B2 |
20.2 - 20.8 |
20.5 - 20.8 |
7.4 |
33 |
|
B3 |
20.4 - 21 |
20.5 - 20.9 |
7.5 |
33 |
|
C1 |
20.4 - 21 |
20.4 - 20.6 |
7.4 |
33 - 34 |
|
C2 |
20.4 - 20.6 |
20.4 - 20.7 |
7.6 |
33 |
|
C3 |
20.3 - 20.7 |
20.4 - 20.7 |
7.6 |
33 |
|
D1 |
20.3 - 20.5 |
20.4 - 20.5 |
7.6 |
33 |
|
D2 |
20.4 |
20.4 - 20.6 |
7.6 |
33 |
|
D3 |
20.2 - 20.6 |
20.3 - 20.8 |
7.6 |
33 |
|
Rata-rata |
20.4 ± 0.17 |
20.5 ± 0.12 |
7.52 ± 0.08 |
33 ± 0.12 |
Dari hasil pengecekan kualitas air harian pada masa pemeliharaan ditemukan suhu pada pagi hari berkisar 20,221°C dan rentang suhu pada sore hari berkisar 20,3-20,9°C. Salinitas selama masa pemeliharaan ditemukan berkisar 32-34 ppt, dan pH berkisar 7,4-7,6. Suhu selama masa pemeliharaan tidak mengalami fluktuasi yang terlalu tinggi karena adanya AC untuk menjaga suhu ruang kultur tetap terjaga. Suhu selama masa pemeliharaan sudah sesuai dengan kultur mikroalga skala laboratorium yang dijelaskan oleh Rafaelina et al. (2016) yakni suhu ruangan yang sesuai untuk kultur mikroalga dalam skala Iabroratorium berkisar 20-25oC.
Salinitas air pada wadah pemeliharaan didapati nilai 3234 ppt. Salinitas bisa pengaruhi penyerapan nutrisi karena tekanan osmosis di dalam badan mikroalga dipengaruhi oleh salinitas yang bisa menimbulkan kegiatan sel jadi tersendat (Rudiyanti, 2011). pH air sepanjang masa pemeliharaan ialah 7,4-7,6. Pada nilai ini C. calcitrans sanggup menyesuaikan diri serta berkembang dengan baik. Padang (2013) menyebutkan kalau “kisaran pH optimum buat perkembangan alga air laut merupakan 7,5- 8,5 sebaliknya kultur alga pH yang maksimal antara 7- 9”. Mutu air sepanjang masa pemeliharaan riset ini masih dibatas toleransi untuk C. calcitrans tumbuh dengan baik (Jati et al., 2012).
-
1. Perbandingan warna lampu penyinaran yang dilakukan terhadap C. calcitrans mempunyai pengaruh nyata terhadap kepadatan sel, laju pertumbuhan spesifik serta doubling time.
-
2. Warna sinar putih serta kuning jadi warna sinar terbaik untuk kultur C. calcitrans karena mempunyai nilai kepadatan sel, laju pertumbuhan spesifik, serta doubling time tercepat.
Ucapan Terima Kasih
Penulis mengucapkan terima kasih pada BPIU2K Karangasem untuk fasilitas selama penelitian.
Daftar Pustaka
Anthony, R., Aryani, F., and Wrastari, T. 2014. Pengaruh Penggunaan Film Sebagai Media Belajar Terhadap Pencapaian Higher Order Thinking Skill Pada Mahasiswa Fakultas Psikologi UNAIR. Jurnal Psikologi Klinis dan Kesehatan Mental, 3(1): 40-47
Arifah, R. U., Sedjati, S., Supriyantini, E., dan Ridlo, A. 2019. Kandungan Klorofil dan Fukosantin Serta Pertumbuhan Skeletonema costatum Pada Pemberian Spektrum Cahaya Yang Berbeda. Buletin Oseanografi Marina, 8(1): 25.
Bergström, A. K., and Karlsson, J. 2019. Light And Nutrient Control Phytoplankton Biomass Responses To Global Change In Northern Lakes. Global Change Biology, 25(6): 2021–2029
Buwono, N. R., dan Nurhasanah, R. Q. 2018. Studi Pertumbuhan Populasi Spirulina sp. Pada Skala Kultur Yang Berbeda. Jurnal Ilmiah Perikanan dan Kelautan, 10(1):1.
Damanik, R. 2020. The Effect Of Using Different Light Colors On The Growth Of Nanochloropsis sp. Journal Of Aquaculture Science, 5(2):99–109.
Dormegawaty, A., Budijono, B., dan Hasbi, M. H. M. 2021 Growth Of Trachelomonas sp. as A Step For Heavy Metal Toxicity Test. Jurnal Online Mahasiswa (JOM) Bidang Perikanan dan Ilmu Kelautan, 8(2), 1-11.
Ekawati, A. W. 2005. Diktat Kuliah Budidaya Pakan Alami. Fakultas Perikanan Universitas Brawijaya. Malang. Hal, 3.
Fitriyani, W. 2017. Pengaruh Intensitas Cahaya Terhadap Pigmen Carotenoid, Fucoxanthin dan Phaeophytin Zooxanthellae dari Isolat Karang Lunak Zoanthus Sp. Maspari Journal, 9(2),121-130.
Hariyanto, D. C. 2020. Pengaruh Pemberian Pupuk Ekstrak Daun Lamtoro (LeucaenaLeuchocepala) dengan Dosis Berbeda terhadap Laju Pertumbuhan, Biomassa dan Protein Mikroalga C. calcitrans. Skripsi. Malang, Indonesia: Fakultas Perikanan dan Ilmu Kelautan, Universitas Brawijaya.
Jati, F., Hutabarat, J., dan Herawati, V. E. 2012. Pengaruh penggunaan dua jenis media kultur teknis yang berbeda terhadap pola pertumbuhan, kandungan protein dan asam lemak omega 3 EPA (Chaetoceros gracilis). Journal of Aquaculture Management and Technology, 1(1), 221-235.
Lama, K. L. 2020. Pengaruh Penggunaan Warna Cahaya yang Berbeda Terhadap Pertumbuhan Nanochloropsis sp The Effect of Using Different Light Colors on the Growth of Nanochloropsis sp. Journal of Aquaculture, 5(2), 99-109.
Lestari, U. A., Mukhlis, A., and Priyono, J. 2019. Effect of Nutrisil And KW21+ Si Fertilizer on C. calcitrans GROWTH. Jurnal Perikanan Unram, 9(1), 66-74.
Linggar, D. P. 2019. Pertumbuhan dan Kandungan Total Lipid Mikroalga C. calcitrans Pada Kultivasi dengan Intensitas Cahaya Berbeda. (Doctoral dissertation. Semarang, Fakultas Perikanan dan Ilmu Kelautan, Universitas Diponegoro).
Maltsev, Y., Maltseva, K., Kulikovskiy, M., and Maltseva, S. 2021. Influence of light conditions on microalgae growth and content of lipids, carotenoids, and fatty acid composition. Biology, 10(10), 1060.
Morales, M., Aflalo, C., and Bernard, O. 2021. Microalgal lipids: A review of lipids potential and quantification for 95 phytoplankton species. Biomass and Bioenergy, 150, 106-108.
Nindarwi, D. D., Masithah, E. D., Zulian, D., and Suyoso, A. L. 2019. The dynamic relationship of phytoplankton abundance and diversity in relation to white shrimp (Litopenaeus vannamei) feed
consumption in intensive ponds. In IOP Conference Series: Earth and Environmental Science 236 (1): 12-72.
Nita, P. 2022. Pengaruh Kepadatan Awal Inokulan Dan Dosis Pupuk KW21 Yang Berbeda Terhadap Kepadatan Chaetoceros simplex. (Doctoral dissertation, Universitas Pendidikan Ganesha).
Nor, M. E. M. 2016. Penghasilan Karotenoid Oleh Bakteria Fotosintetik. Buletin Teknologi Mardi, 10(2016): 99–106.
Nugroho, S. H. 2019. Karakteristik Umum Diatom Dan Aplikasinya Pada Bidang Geosains. Oseana, 44(1): 70–87.
Padang, A. 2013. Pertumbuhan fitoplankton Coccolithophore sp di Wadah Terkontrol Dengan Kepadatan Inokulum Yang Berbeda. Agrikan: Jurnal Agribisnis Perikanan, 6(3): 33-38.
Rafaelina, M., Rustam, Y., dan Amini, S. 2016. Pertumbuhan dan Aktivitas Antioksidan dari Mikroalga Porphyridium cruentum dan Chlorella sp. Bioma, 12(1):12-21
Rahmah, N., Zulfikar, A., dan Apriadi, T. 2022. Kelimpahan Fitoplankton dan Kaitannya dengan Beberapa Parameter Lingkungan Perairan di Estuari Sei Carang Kota Tanjungpinang. Journal of Marine Research, 11(2), 189-200.
Rahmah, N., Zulfikar, A., dan Apriadi, T. 2022. Kelimpahan Fitoplankton dan Kaitannya dengan Beberapa Parameter Lingkungan Perairan di Estuari Sei Carang Kota Tanjungpinang. Journal of Marine Research, 11(2), 189-200.
Richmond, A. 2004. Handbook Of Microalgal Culture: Biotechnology And Applied Phycology. John Wiley and Sons
Rudiyanti, S. 2011. Pertumbuhan Skeletonema costatum pada Berbagai Tingkat Salinitas Media The Growth Of Skeletonema costatum on Various Salinity Level’s Media. In Jurnal Saintek Perikanan 6(2): 69-76
Suryani, Y., dan Taupiqurrahman, O. 2021. Mikrobiologi Dasar (Cetakan Pertama). Lp2m Uin Sgd Bandung.
Wahyuni, D. T., dan Widjanarko, S. B. 2015. Pengaruh Jenis Pelarut dan Lama Ekstraksi Terhadap Ekstrak Karotenoid Labu Kuning Dengan Metode Gelombang Ultrasonik. Jurnal Pangan dan Agroindustri, 3(2), 390-401.
Wicaksono, G. 2014. Pengaruh Pemberian Spektrum Cahaya yang Berbeda Terhadap Kandungan Klorofil Spirulina sp. (Doctoral Dissertation, Universitas Airlangga).
54
Discussion and feedback