Keragaman Genetik Penyu Lekang (Lepidochelys olivacea) Dan Kaitannya Dengan Pola Arus Di Perairan Samudera Hindia Dan Perairan Tengah Indonesia
on
Journal of Marine and Aquatic Sciences 8(2), 254-266 (2022)
Keragaman Genetik Penyu Lekang (Lepidochelys olivacea) Dan Kaitannya Dengan Pola Arus Di Perairan Samudera Hindia Dan Perairan Tengah Indonesia
Samsul Bahri a*, Hawis H. Madduppa b, Agus S. Atmadipoera b a Program Studi Ilmu Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Universitas Teuku Umar, Meuerubo, Kabupaten Aceh Barat, Aceh, Indonesia
b Jurusan Ilmu Kelautan, Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor Jl. Raya Darmaga, Bogor, Jawa Barat, Indonesia
* Penulis koresponden. Tel.: +62-853-6115-3215
Alamat e-mail: samsulbahri@utu.ac.id
Diterima (received) 13 Juli 2022; disetujui (accepted) 30 Juli 2022; tersedia secara online (available online) 1 Desember 2022
Abstract
Indonesia is an important habitat for olive ridley (Lepidochelys olivacea) that it is necessary for sustainable management with respect to biological and ecological aspects as well as its environment. Genetic diversity and connectivity of L. olivacea can be calculated by using mitochondrial DNA analysis approach. The water circulation pattern are greatly affects to the distribution of L. olivacea that can be a transport medium for its migrations. This study aims to determined the genetic diversity of L. olivacea and its relation to water circulation across western and center of Indonesian waters. Samples of L. olivacea were collected in 6 locations across western and center of Indonesian waters from August 2015 to December 2016. The molecular analysis was conducted on control region gen based on 791-bp fragment. The water circulation analysis was performed through INDESO data and visualized by using Ferret software. Phylogenetic analysis showed that there are population connectivity of L. olivacea between western and central Indonesian waters. While population of L. olivacea in Kapoposang Island tend to be different compared to other populations. Genetic diversity analysis showed that L. olivacea from western Indonesia are more higher than center Indonesia. The water circulation analysis suggests that there is an established connection between western and center indonesian waters that connected by Northwest and Southeast seasons current, which the current vector indicates the movement of alternating water throughout Aceh, Pariaman, Panggul, Serangan, Kapoposang Island and Tuafanu populations.
Keywords: coral triangle; genetic diversity; indian ocean; Olive ridley; water circulation
Abstrak
Indonesia merupakan salah satu habitat penting bagi penyu lekang (L. olivacea) sehingga sangat penting untuk dilakukanmanajemen ekologi dan biologi yang berkelanjutan serta ramah lingkungan. Keragaman genetik dan konektifitas penyu lekang (L. olivacea) dapat dihitung melalui pendekatan molekular DNA mitokondria. Pola arus sangat berpengaruh terhadap distribusi L. olivacea dimana penyu memanfaatkan arus sebagai media tranportasi dalam melakukan migrasi. Penelitian ini bertujuan untuk menghitung keragaman genetik L. olivacea dan pengaruh arus terhadap sebaran genetik di perairan barat dan tengah Indonesia. Sampel L. olivacea dikoleksi pada 6 lokasi disepanjang perairan barat dan tengah Indonesia pada bulan Agustus 2015 hingga Desember 2016. Analisis molekuler dilakukan pada gen control region dengan panjang skuens 791-bp (basepair). Analisis pola arus dilakukan melalui data INDESO yang divisualisasikan menggunakan perangkat lunak Ferret. Hasil filogenetik menggambarkan konektifitas populasi L. olivacea di sepanjang perairan Selatan Indonesia pada wilayah Barat dan tengah Indonesia. Sementara populasi L. olivacea pada wilayah Kapoposang cenderung berdiri sendiri membentuk kelompok yang terpisah dari populasi lainnya. Hasil analisis keragaman genetik menunjukkan bahwa L. olivacea pada wilayah barat cenderung lebih tinggi dibanding wilayah tengah. Hasil analisis pola arus menunjukkan adanya interaksi yang terjadi antar perairan wilayah barat dan tengah yang dihubungkan oleh musim barat laut dan musim tenggara, dimana vektor arus menunjukkan adanya pergerakan massa air bolak balik di sepanjang populasi Aceh, Pariaman, Panggul, Serangan, Pulau Kapoposang dan Tuafanu
Kata Kunci: Keragaman genetik, Penyu lekang, Pola arus, Samudera Hindia, Segitiga terumbu karang
Penyu merupakan salah satu biota reptil yang hidup di laut dengan kemampuan migrasi yang cukup jauh untuk melakukan proses perkawinan atau mencari makan (Harnino et al., 2021; Whiting et al., 2007)Enam dari tujuh jenis penyu yang terdapat di dunia hidup di Indonesia. Penyu lekang (L. olivacea) merupakan salah satu spesies penyu yang hingga saat ini masih hidup di Indonesia dengan penyebaran hampir di seluruh pantai di Indonesia. Penyu lekang termasuk kedalam famili Cheloniidae dari dua famili besar jenis penyu Cheloniidae dan Dermochelyidae (Rachman, 2021). Memiliki ciri fisik ukuran tubuh yang lebih kecil dibandingkan jenis penyu lainnya. Keberadaan penyu lekang dianggap tersebar luas di Samudera Hindia dan Pasifik serta diantara kedua samudera tersebut (Polovina et al., 2004). Populasi dan habitat sarang penyu lekang tersebar secara global di perairan hangat dan laut tropis (Bowen et al., 1997). Namun demikian, keberadaan populasi L. olivacea di Indonesia telah mengalami pergeseran habitat karena kegiatan antropogenik dan pemanasan global (Maulany et al., 2012). Penurunan jumlah populasi penyu yang sangat drastis terutama disebabkan oleh konsumsi telur penyu, perdagangan penyu serta kerusakan habitat sarang akibat perubahan kondisi alam (Meylan & Donnelly, 1999). Status keberadaan penyu telah masuk ke dalam red list pada IUCN dan Appendix I CITES yang berarti bahwa keberadaannya di alam telah terancam punah (Zedan, 2004).
Teknik molekular telah berkembang secara cepat dan banyak digunakan dalam menjawab pertanyaan ekologi yang belum banyak dijelaskan secara biologi, termasuk konservasi, kekerabatan dan penanda spesies (Madduppa et al., 2016). Penanda genetik mampu melakukan penilaian yang sangat cepat dalam menjawab permasalahan biologi populasi serta banyak dilakukan secara luas pada pengamatan biota penyu untuk mengetahui kekerabatan dan struktur populasi(Bowen et al., 1997; Tammu, 2018). Keragaman genetik menjadi sangat penting dalam pendekatan konservasi karena memberikan informasi tentang perubahan suatu populasi di
alam serta dapat dijadikan alat dalam memonitoring dan melakukan konservasi (Hoffman et al., 2009; Schwartz et al., 2007) Pemahaman tentang keragaman genetik sangat diperlukan dalam upaya konservasi karena rendahnya suatu keragaman genetik dari suatu populasi akan berpengaruh terhadap potensi dan resiko kepunahan suatu spesies (Jena et al., 2011). Kemampuan proses adaptasi suatu makhluk hidup terhadap suatu perubahan kondisi lingkungan sangat dipengaruhi oleh keragaman genetiknya, semakin variasi keragaman genetik suatu makhluk hidup akan semakin baik dalam bertahan terhadap suatu perubahan lingkungan tertentu (Booy et al., 2000).
Pergerakan penyu sangat dipengaruhi oleh proses oseanografi. Beberapa pengamatan telah dilakukan untuk membuktikan kemungkinan pengaruh pergerakan penyu oleh faktor oseanografi laut(Ario et al., 2016; Luschi et al., 2003). Meskipun memiliki perbedaan yang besar pada kebiasaan hidup dan kebiasaan makan, ketujuh jenis penyu yang diketahui ini masih memiliki siklus hidup yang hampir sama mencakup periode yang panjang di laut terbuka pada semua tahap perkembangan (Musick & Limpus, 2017). Arus merupakan salah satu faktor utama yang mempengaruhi pergerakan penyu di laut sehingga dapat menghasilkan gaya yang besar dalam melakukan kegiatan migrasi (Luschi et al., 2003). Efek faktor lingkungan oseanografi dalam mempengaruhi pergerakan penyu masih sangat sedikit diketahui dan hanya beberapa yang telah dilakukan melalui pendekatan tagging pada penyu (Schroeder & Balazs, 2001). Penelitian ini sangat menarik untuk dilakukan disebabkan Indonesia yang berada di antara dua samudera yaitu samudera Pasifik dan Hindia melalui arus lintas Indonesia(Kusmana & Hikmat, 2015; Wyrtki, 1961). Mengetahui pengaruh faktor oseanografi seperti arus sangat penting dalam mempelajari pola distribusi dan migrasi penyu. Hal ini juga akan mendukung penelitian melalui marka genetik dalam mempelajari pola distribusi dan pengaruhnya terhadap struktur populasi penyu. Oleh karena itu, penelitian ini dilakukan dengan tujuan menghitung keragaman genetik L. olivacea
dan menganalisis pengaruh arus terhadap sebaran L. olivacea.
Penelitian dilaksanakan pada bulan Agustus 2015 hingga Februari 2016. Penelitian dimulai dengan mengoleksi sampel pada 6 lokasi yakni Aceh, Pariaman, Panggul, Serangan, Tuafanu dan Kapoposang. Penentuan lokasi pengambilan sampel berdasarkan populasi pantai peneluran L. olivacea baik secara alami maupun semi alami. Sampel yang diambil adalah tukik (anakan penyu) yang telah mati, jaringan daging yang diambil adalah bagian tungkai kaki depan. Sampel jaringan penyu yang diperoleh akan ditransport sesuai dengan prosedur standar yang direkomendasikan oleh (Bahri et al., 2017). Sampel kemudian disimpan dalam tube 1,6 ml yang berisi larutan ethanol 96% untuk menjaga kualitas sampel. Sampel yang telah diperoleh kemudian dibawa ke laboratorium untuk dilakukan uji laboratorium lebih lanjut.
-
2.2 Analisis Data
-
2.2.1. Keragaman Genetik
-
Proses isolasi DNA dilakukan di Laboratorium
BIODIVS Departemen Ilmu dan Teknologi Kelautan Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor. DNA yang dianalisis adalah DNA mitokondria (mtDNA) melalui gen Control Region. Proses analisis laboratorium molekuler dilakukan melalui tahapan ekstraksi DNA, Amplifikasi DNA, elektroforesis dan sekuensing DNA. Proses ekstraksi DNA menggunakan metode Chelex 10% dengan komposisi air molekuler dan resin 100% (Walsh et al., 2013). Jaringan daging sampel kemudian dimasukkan kedalam larutan Chelex 10% guna dilakukan proses ekstraksi terhadap sampel.
Amplikasi sampel produk esktraksi dilakukan menggunakan teknik PCR (Polymerase Chain Reaction) secara invitro menggunakan primer depan LTEi9 dan primer belakang H950(Bahri et al., 2017; Tolve et al., 2018). PCR dilakukan pada kondisi 2 µl template DNA, 10 µl ddH2O, 1,25 µl Primer depan dan belakang (10 mM), dan 12,5 µl KAPPA ready mix dengan total 38 siklus. Setiap siklusnya terdiri atas denaturation pada suhu 94°C selama 30 detik, annealling pada suhu 50°C selama 30 detik, extention pada suhu 72°C selama 45 detik dan final elongated pada suhu 72°C selama 5 detik (Madduppa et al., 2021).
Analisis keragaman genetik dilakukan terhadap semua individu yang diperoleh pada 6 lokasi pengamatan sebagai keterwakilan sampel pada setiap lokasi. Rekontruksi pohon filogenetik
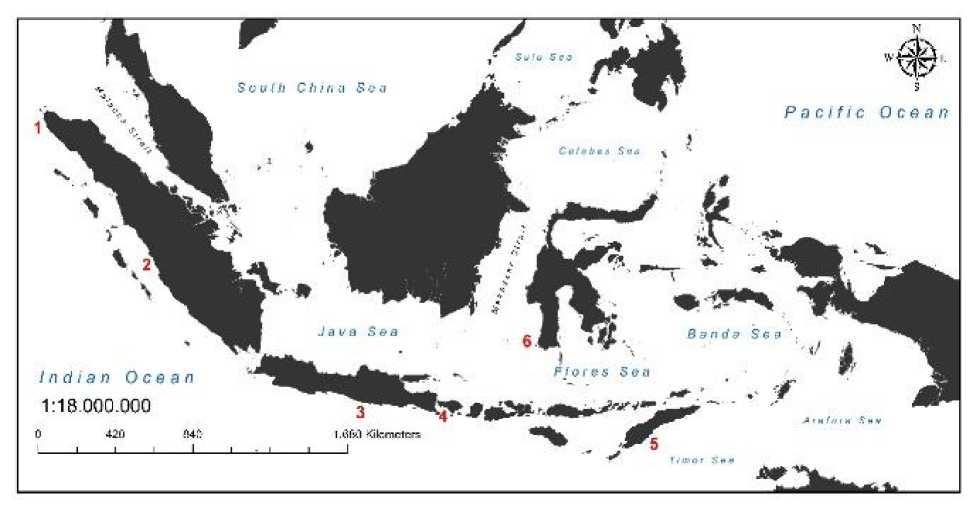
Gambar 1. Lokasi pengambilan sampel penyu lekang (L. olivacea) pada 6 populasi yang meliputi (1) Aceh, (2) Pariaman, (3) Panggul, (4) Serangan, (5) Tuafanu dan (6) Kapoposang.
dianalisis menggunakan metode Neighbour Joining dengan replikasi bootstrap 1000x melalui perangkat lunak MEGA(Kandeel et al., 2022; Keskin & Atar, 2012). Keragaman genetik dianalisis menggunakan perangkat lunak DNA Squence Polymorphism (Rozas Liras et al., 2003) sebagai ukuran standar dalam menghitung keragaman genetik yang meliputi keragaman haplotip (Hd) jumlah haplotip (Nhp) dan keragaman nukleotida (π).
-
2.2.2. Pola Sirkulasi Arus
Data yang digunakan pada penelitian ini adalah data keluaran model sirkulasi laut INDESO (Infrastructure Development of Space Oceanography) dari simulasi model yang dilakukan oleh CLS France, sebagai bagian dari program INDESO Kementerian Kelautan dan Perikanan (Gautama et al., 2016).
Model INDESO merupakan model sirkulasi laut dengan menggunakan sistem model NEMO (Madec et al., 2017). Konfigurasi model INDESO adalah resolusi horizontal 1/12° dengan 50 tingkat kedalaman dengan resolusi vertikal yang lebih dekat di dekat permukaan; model didorong oleh gaya atmosfer ECMWF dan gaya pasang surut barotrofik TPOX07; dan batas lateral menerapkan data arus dan sifat air laut (suhu dan salinitas) dari output model sirkulasi global MERCATOR (Tranchant et al., 2016). Data yang digunakan pa a penelitian ini meliputi data time series rata – rata harian untuk komponen arus zonal, arus meridional, suhu, dan salinitas dekat permukaan (permukaan hingga 6 m) pada tahun 2015. Pola arus dianalisis menggunakan software Ferret yang dioperasikan melalui Sistem operasi LINUX dalam pemrosesannya (Horhoruw, 2016). Pola sirkulasi ini diharapkan dapat memberikan informasi tambahan tentang kemungkinan penyebaran penyu remaja atau penyu dewasa yang bermigrasi di ketiga wilayah tersebut, dan dapat membantu menjelaskan hubungan kekerabatan biogeografinya (Permadi et al., 2015).
Ferret adalah perangkat lunak yang dapat memvisualisasikan dan mensimulasikan vektor arus yang dikombinasikan dengan data salinitas dan suhu yang dapat dilakukan secara offline. Visualisasi data dilakukan melalui hasil analisis pada citra vektor arus simulasi pergerakan arus. Data keluaran citra dianalisis dari data vektor (zonal dan meridional) yang telah digabungkan dengan data suhu dan salinitas rata – rata setiap
bulan selama satu tahun. Data simulasi dianalisis dengan citra animasi dari data vektor (zonal dan meridional) yang telah digabungkan dengan simulasi data suhu dan salinitas selama satu tahun (365 hari).
Rekontruksi filogenetik terhadap 6 populasi L. olivacea menggunakan metode Neighbor Joining menggambarkan 5 kelompok (cluster) L. olivacea (Gambar 2). Data sekuen lain yang berasal dari India Timur juga diunduh dari GenBank untuk digunakan sebagai pembanding dari data yang diperoleh pada 8 populasi L. olivacea yang terdapat di Indonesia. Data hasil Rekontruksi filogenetik menggambarkan 5 kelompok (cluster) L. olivacea yang terdapat pada 6 populasi pengamatan di Indonesia. Kelompok L. olivacea yang pertama berasal dari populasi Aceh, Serangan dan Panggul. Kelompok kedua berasal dari populasi Kapoposang. Kelompok ketiga berasal dari Aceh, Kapoposang dan Tuafanu. Kelompok keempat adalah kelompok yang paling dominan dimana berasal dari 5 populasi yakni Aceh, Pariaman, Panggul, Serangan dan Tuafanu. Kelompok yang kelima berasal dari populasi Pariaman dimana pada kelompok ini ditemukan kemiripan L. olivacea yang berasal dari Indonesia dengan populasi L. olivacea yang berasal dari Jazirah India Timur.
Hasil analisis keragaman genetik L. olivacea pada 6 populasi L .olivacea menunjukkan variasi yang berkorelasi dengan hasil analisis filogenetik (Tabel 1). Berdasarkan hasil analisis yang telah dilakukan, keragaman genetik tertinggi ditemukan pada populasi Aceh dengan jumlah haplotip (Nhp) sebanyak 5 haplotip diikuti dengan tingginya nilai keragaman haplotip (Hd) sebesar 0,7573 dan nilai keragaman nukleotida (π) sebesar 0,00422. Sementara populasi dengan keragaman genetik terendah ditemukan pada populasi Panggul dengan jumlah haplotip (Nhp) sebanyak 2 haplotip diikuti dengan rendahnya nilai keragaman haplotip (Hd) sebesar 0,2684 dan nilai keragaman nukleotida (π) sebesar 0,00159. Jumlah sampel (n) L. olivacea rata – rata yang diperoleh berkisar pada 18 sampel dimana jumlah sampel terbanyak ditemukan pada populasi Serangan, sementara jumlah populasi terkecil ditemukan pada populasi
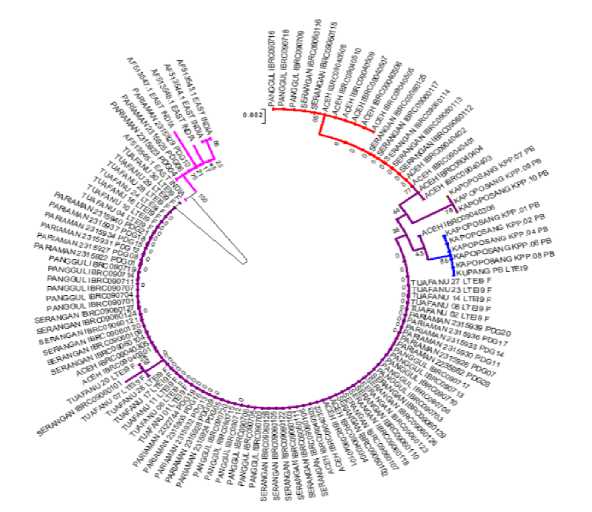
Gambar 2. Rekontruksi filogenetik L. olivacea pada 6 populasi pengabilan sampel menggunakan metode Neighbor Joining (NJ) dengan model Kimura 2-parameter melalui replikasi bootstrap 1000 kali.
Kapoposang. Persentase komposisi nukleotida yang diperoleh pada seluruh populasi cenderung sama dimana rata – rata nilai perbandingan nilai A + C = G + T adalah 53,71 = 46,26.
Hubungan filogenetik antara L. olivacea pada 6 populasi pengamatan membentuk 4 kelompok besar L. olivacea yang ada di Indonesia dari total 112 individu. Kelompok yang paling dominan terbentuk pada kelompok 4 dimana pada
(Gambar 2). Hal ini menjelaskan bahwa kelima populasi ini masih memiliki kekerabatan yang dekat secara filogenetik. Hasil analisis pola arus yang diperoleh menggambarkan adanya arus monsun secara bolak balik di sepanjang tersebut. Arus dan kemampuan penyebaran larva tinggi menjadi salah satu faktor yang menyebabkan kekerabatan suatu biota secara genetik (Kartika et al., 2017). Populasi Kapoposang merupakan
Tabel 1
Keragaman genetik L. olivacea pada 6 populasi pengambilan sampel berdasarkan jumlah sampel (n), komposisi nukleotida, jumlah haplotip (Nhp), keragaman haplotip (Hd) dan keragaman nukleotida (π).
|
Populasi |
Komposisi Nukleotida Keragaman Genetik n T(U) C A G Nhp Hd π |
|
Aceh Pariaman Panggul Serangan Tuafanu Kapoposang |
17 34,3 19,5 32,9 13,3 5 0,7573 0,00422 20 34,4 19,4 32,8 13,4 2 0,2684 0,00478 20 34,4 19,4 32,8 13,4 2 0,2684 0,00159 27 34,4 19,4 32,8 13,4 4 0,4814 0,00244 20 34,4 19,4 32,8 13,4 3 0,2789 0,00077 8 34,9 18,4 32,6 14,0 2 0,5357 0,00318 |
kelompok ini berasal dari 5 populasi yang berbeda kelompok filogenetik yang berbeda dengan
dalam satu kelompok filogenetik yang sama populasi lain yang terbentuk pada kelompok 2 dan
-
3. Secara filogenetik, populasi Kapoposang cenderung berbeda dan berdiri sendiri. Pergerakan migrasi L. olivacea yang telah dipasangi transmitter tidak menunjukkan adanya pergerakan dari perairan Selat Makasar menuju ke Laut Timor atau Selat Bali, melainkan berpotensi menuju ke Kalimantan timur mengikuti pola arus musim barat laut (Manurung & Hartoko, 2013). Hasil analisis pola arus juga menunjukkan adanya vektor pergerakan arus dari perairan Selat Makasar menuju ke Kalimantan timur pada musim barat laut. Perbedaan L. olivacea pada populasi Kapoposang mengindikasikan perbedaan karakter molekuler L. olivacea pada populasi ini dibandingkan populasi lainnya (Zhao et al., 2013). Pohon filogenetik juga dapat digunakan sebagai acuan kekerabatan berdasarkan lokasi geografis, sehingga dapat mengindikasikan kekerabatan individu dan spesies melalui rekontruksi pohon filogenetik(McCormack et al., 2013; Vélez-Zuazo & Agnarsson, 2011)
Hasil analisis filogenetik juga memperoleh kekerabatan yang dekat antara L. olivacea di populasi Pariaman dan populasi India timur di perairan Samudera Hindia. Kemiripan L. olivacea pada wilayah Samudera Hindia diduga dipengaruhi oleh Bengal Gyre yang merupakan salah satu fenomena arus yang terdapat diantara Pantai India dan Indonesia bagian Barat yang dipengaruhi oleh angin musiman(Haditiar et al., 2022; Shetye et al., 1993). Arus merupakan faktor utama yang dimanfaatkan oleh penyu sebagai media migrasi, adanya gyre dan eddies juga sangat mendukung dalam proses migrasi penyu yang menyebabkan adanya aliran genetik (Luschi et al., 2003). Keragaman genetik L. olivacea pada 6
populasi menunjukkan nilai yang bervariasi. Perbedaan nilai keragaman haplotip, keragaman nukleotida dan komposisi nukleotida
mengindikasikan bahwa sebaran aliran gen pada L. olivacea pada 6 populasi terbatas (Kochzius & Nuryanto, 2008).
Tingginya keragaman haplotip di Aceh mengindikasikan bahwa habitat dan eksploitasi L. olivacea pada lokasi ini masih terkontrol dengan baik. Keragaman genetik dapat ditentukan oleh 2 faktor yaitu eksploitasi yang berlebihan dan kondisi habitat (Chiu et al., 2013). Keanekaragaman nukleotida tertinggi terdapat di Pariaman dimana nilai keanekaragamannya mencapai 0,00478 (Tabel 1). Hal ini disebabkan karena ditemukan 2 kelompok filogenetik yang berbeda jauh antara kedua populasi ini dimana
salah satu kelompok tergabung kedalam sekuen L. olivacea yang berasal dari Pantai India Timur. Tuafanu menjadi populasi dengan keragaman haplotip dan keragaman nukleotida yang paling rendah. Rendahnya keragaman haplotip dan keragaman nukleotida di Tuafanu diduga karena eksploitasi yang berlebihan yang berpengaruh terhadap ketersediaan gen(Kochzius & Nuryanto, 2008; Zamroni & Suwarso, 2016).
-
3.2 Pola Sirkulasi Arus
-
3.2.1. Perairan Samudera Hindia
-
Pergerakan arus dari perairan selatan Sumatera menuju ke selatan Jawa hingga Laut Sawu terjadi pada bulan November hingga Mei dimana pada kisaran bulan tersebut vektor arus menuju ke perairan timur nusantara (musim barat laut), sebaliknya pada kisaran bulan Juni hingga Oktober pergerakan arus bergerak dari Laut Sawu dan selatan Jawa menuju ke selatan Sumatera dan tersebar ke Samudera Hindia (musim tenggara) (Gambar 3). Hasil analisis rataan vektor arus U dan V pada bulan Januari menunjukkan vektor arus pada wilayah perairan selatan Sumatera dan Laut Natuna menuju ke perairan selatan Jawa hingga ke Laut Banda dan Laut Sawu. Bulan Januari merupakan fase puncak musim barat laut, sehingga pada bulan ini pergerakan arus cenderung mengarah ke perairan timur nusantara. Sementara hasil analisis rataan vektor arus U dan V pada bulan Agustus menujukkan pergerakan arus dari perairan timur nusantara menuju ke perairan barat (Samudera Hindia). Bulan Agustus merupakan fase puncak musim tenggara, sehingga pada bulan ini pergerakan arus cenderung mengarah ke perairan barat nusantara.
Hasil analisis juga menggambarkan sebaran suhu dan salinitas permukaan laut selama satu tahun pada kedalaman hingga 6 m. Dari hasil analisis data yang diperoleh, sebaran suhu dipengaruhi oleh pergerakan arus permukaan dimana pada musim barat laut suhu perairan di wilayah selatan Sumatera dan selatan Jawa berkisar pada 28-32 °C. Sementara di wilayah perairan Laut Natuna sebaran suhu permukaan pada musim barat laut justru lebih rendah yakni berkisar pada 25-28 °C. Sebaliknya, pada musim tenggara suhu permukaan pada perairan selatan Sumatera dan laut Natuna cenderung lebih tinggi yakni berkisar pada 28-32 °C, sementara pada
perairan selatan Jawa cenderung lebih rendah yakni berkisar pada 25-28 °C (Gambar 4). Sebaran salinitas pada wilayah perairan barat nusantara cenderung lebih seragam dimana hasil analisis data selama setahun menujukkan pola sebaran salinitas yang lebih tinggi pada perairan Samudera Hindia yakni berkisar pada 33-35 psu dan lebih rendah pada perairan Laut Natuna yakni berkisar pada 30-32 psu.
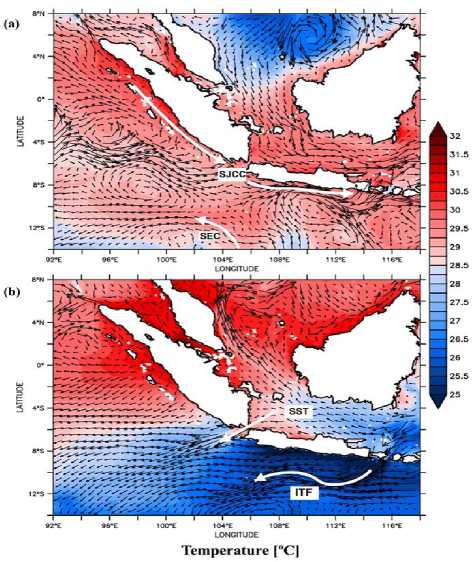
Gambar 3. Pola sebaran arus yang dikombinasikan dengan data suhu permukaan laut pada bulan Januari 2015 (a) dan bulan Agustus (b) di perairan kepulauan Barat.
Perairan wilayah barat Indonesia sangat menarik untuk dikaji karena wilayah ini berbatasan langsung dengan Samudera Hindia dan dipengaruhi oleh beberapa fenomena oseanografi seperti Arus Lintas Indonesia (Arlindo) dan pola pergerakan angin monsun(Bahri et al., 2020; Kunarso et al., 2011). Arlindo berasal dari dua komponen massa air yang berbeda, yakni dari Pasifik utara dan Pasifik selatan (Ilahude & Gordon, 1996). Massa air Pasifik utara ditarik oleh arus Mindanao dan mengikuti jalur barat melalui Laut Sulawesi timur menuju ke Selat Makassar lalu ke Laut Flores, pada perairan ini sekitar 20% massa air arlindo yang menuju ke Samudera Hindia melewati Selat Lombok(Murray & Arief, 1988; Pratomo et al., 2016). Sedangkan
massa air Pasifik Selatan memiliki peran yang sangat kecil dalam fenomena arlindo (Gordon & Fine, 1996). Hasil analisis data pola arus menunjukkan pergerakan massa air bolak balik di perairan selatan Sumatera dan selatan Jawa di perairan Samudera Hindia secara bergantian selama satu tahun pada musim barat laut dan musim tenggara (Gambar 3). Selain pola arlindo, angin monsun berpengaruh terhadap pergerakan arus permukaan yang menjadi salah satu media transportasi migrasi L. olivacea, adanya angin monsun yang bersifat musiman ini berpengaruh terhadap arus yang membantu dalam kegiatan migrasi L. olivacea (Luschi et al., 2003). Hal ini sesuai dengan hasil kajian yang telah dilakukan berdasarkan pendekatan molekuler dimana secara filogenetik populasi L. olivacea yang berasal dari populasi Aceh, Pariaman dan Panggul terbentuk dalam satu kelompok filogenetik yang sama. Hal ini mengkonfirmasi bahwa terdapat kekerabatan yang dekat antar L. olivacea pada populasi di sepanjang perairan barat Indonesia. Arus memberikan peran yang penting terhadap sebaran tukik dan juvenil pada beberapa organisme laut (Simanullang et al., 2016),hal ini juga akan mengurangi resiko predasi terhadap tukik dan juvenil dibandingkan pada wilayah pantai dan perairan dangkal (Collard, 1990).
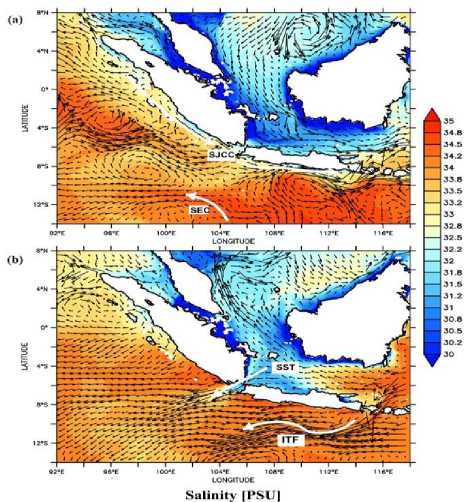
Gambar 4. Pola sebaran arus yang dikombinasikan dengan data salinitas pada bulan Januari 2015 (a) dan Agustus 2015 (b) di perairan nusantara bagian barat.
Perairan wilayah barat Indonesia sangat menarik untuk dikaji karena wilayah ini berbatasan langsung dengan Samudera Hindia dan dipengaruhi oleh beberapa fenomena oseanografi seperti Arus Lintas Indonesia (Arlindo) dan pola pergerakan angin monsun(Bahri et al., 2020; Kunarso et al., 2011). Arlindo berasal dari dua komponen massa air yang berbeda, yakni dari Pasifik utara dan Pasifik selatan (Ilahude & Gordon, 1996). Massa air Pasifik utara ditarik oleh arus Mindanao dan mengikuti jalur barat melalui Laut Sulawesi timur menuju ke Selat Makassar lalu ke Laut Flores, pada perairan ini sekitar 20% massa air arlindo yang menuju ke Samudera Hindia melewati Selat Lombok(Murray & Arief, 1988; Pratomo et al., 2016). Sedangkan massa air Pasifik Selatan memiliki peran yang sangat kecil dalam fenomena arlindo (Gordon & Fine, 1996). Hasil analisis data pola arus menunjukkan pergerakan massa air bolak balik di perairan selatan Sumatera dan selatan Jawa di perairan Samudera Hindia secara bergantian selama satu tahun pada musim barat laut dan musim tenggara (Gambar 3).
Selain pola arlindo, angin monsun berpengaruh terhadap pergerakan arus permukaan yang menjadi salah satu media transportasi migrasi L. olivacea, adanya angin monsun yang bersifat musiman ini berpengaruh terhadap arus yang membantu dalam kegiatan migrasi L. olivacea (Luschi et al., 2003). Hal ini sesuai dengan hasil kajian yang telah dilakukan berdasarkan pendekatan molekuler dimana secara filogenetik populasi L. olivacea yang berasal dari populasi Aceh, Pariaman dan Panggul terbentuk dalam satu kelompok filogenetik yang sama. Hal ini mengkonfirmasi bahwa terdapat kekerabatan yang dekat antar L. olivacea pada populasi di sepanjang perairan barat Indonesia. Arus memberikan peran yang penting terhadap sebaran tukik dan juvenil pada beberapa organisme laut (Simanullang et al., 2016),hal ini juga akan mengurangi resiko predasi terhadap tukik dan juvenil dibandingkan pada wilayah pantai dan perairan dangkal (Collard, 1990).
Penyu pada umumnya akan melakukan migrasi untuk mencari makan dan melakukan perkawinan dalam proses pertumbuhan dan mencari pasangan (Musick & Limpus, 2017). Hasil analisis data menunjukkan sebaran suhu permukaan laut yang hangat pada musim barat laut dimana kisaran suhu pada populasi Aceh, Pariaman dan Panggul
berkisar pada 28-32 °C (Gambar 4). Suhu tersebut merupakan suhu normal bertelur bagi L. olivacea dan juga menentukan jenis kelamin tukik dimana pada suhu 28 °C akan menghasilkan individu jantan dan 32 °C akan menghasilkan individu betina (Collard, 1990). Pada bulan November - Mei suhu permukaan perairan selatan Sumatera dan selatan Jawa cenderung lebih hangat dengan arah vektor arus U dan V menuju ke perairan timur Indonesia.
Penyu di perairan selatan Afrika cenderung mengikuti arus Agulhas dengan suhu yang lebih hangat dibandingkan perairan disekitarnya dalam melakukan migrasi. Penyu akan melakukan proses kawin secara poliandri selama satu hingga dua bulan sebelum musim peneluran pertama berlangsung (Luschi et al., 2003; Nuitja, 1992). Hasil analisis pola arus menunjukkan kondisi salinitas yang cenderung seragam di sepanjang perairan Selatan Jawa. Namun demikian, ditemukan perubahan sebaran salinitas yang sedikit berbeda pada musim transisi (April – Juni) dimana terlihat salinitas yang lebih rendah di sepanjang perairan Selatan Jawa hingga Selat Lombok. Kondisi tersebut disebabkan tingginya masukan air darat melalui sungai – sungai dan curah hujan yang tinggi pada musim transisi yang berlangsung selama 1 hingga 5 bulan. kondisi ini menyebabkan turunnya salinitas di sekitar pantai perairan Selatan Jawa yang juga mempengaruhi perairan selat lombok(Atmadipoera et al., 2009; Kaharuddin & Simarangkir, 2017).
-
3.2.2. Perairan Tengah Indonesia
Hasil analisis data pola arus selama satu tahun di perairan tengah nusantara menunjukkan konektifitas antara perairan selatan dan utara di wilayah tengah nusantara. Hal ini ditunjukkan melalui pola sirkulasi arus lintas Indonesia dari Selat Makasar menuju ke Samudera Hindia melalui Selat Lombok dan Laut Banda yang berbelok menuju ke Laut Timor pada bulan April. Pada musim barat laut, arus cenderung bergerak dari Laut Jawa dan Samudera Hindia menuju ke Laut Banda dan Laut Timor, sementara pada musim tenggara, arus cenderung bergerak dari arah sebaliknya (Gambar 5). Puncak musim barat laut terjadi pada bulan Januari dimana arus bergerak secara dominan menuju ke Laut Banda dan Laut Timor, sedangkan puncak musim tenggara terjadi pada bulan Agustus dimana arus
bergerak secara dominan menuju ke Laut Jawa dan Samudera Hindia.
Sebaran suhu pada perairan wilayah tengah Indonesia menunjukkan kondisi yang berbeda pada musim barat laut dan musim tenggara. Suhu di perairan Laut Jawa, Laut Flores, Laut Banda, Laut Timor dan Samudera Hindia cenderung lebih tinggi pada musim barat laut dimana suhu permukaan perairan berkisar pada 29-32 °C. sementara pada musim tenggara suhu permukaan perairan Laut Jawa, Laut Flores, Laut Banda, Laut Timor dan Samudera Hindia cenderung lebih rendah dengan kisaran suhu 25-28 °C (Gambar 6). Sebaran salinitas di perairan tengah nusantara cenderung lebih seragam pada semua perairan. Hal ini terlihat dari hasil analisis data dimana salinitas menyebar secara merata dengan nilai kisaran salinitas berada pada 33-35 psu. Namun kondisi salinitas yang berbeda terlihat di wilayah perairan Laut Jawa pada musim barat laut dimana salinitas pada perairan ini cenderung lebih rendah dibandingkan dengan wilayah perairan lainnya dengan kisaran 32 psu.
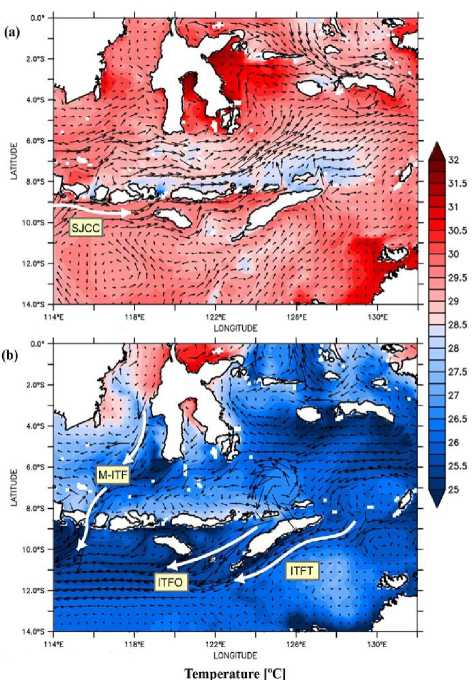
Gambar 5. Pola sebaran arus yang dikombinasikan dengan data suhu permukaan laut pada bulan Januari 2015 (a) dan bulan Agustus (b) di perairan nusantara bagian tengah.
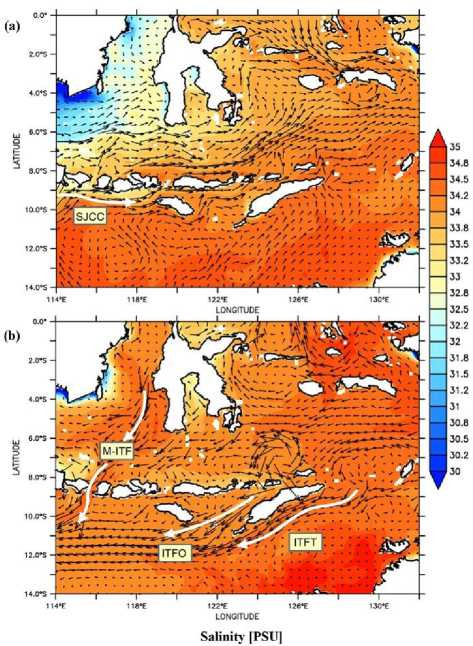
Gambar 6. Pola sebaran arus yang dikombinasikan dengan data salinitas pada Januari 2015 (a) dan Agustus 2015 (b) di Perairan Nusantara Tengah.
Pola pergerakan arus di wilayah perairan tengah nusantara menunjukkan adanya konektifitas L. olivacea antara populasi Kapoposang, Tuafanu dan Serangan. Ketiga populasi tersebut berada pada wilayah perairan tengah Indonesia dimana pada wilayah ini sangat dipengaruhi oleh Arus Lintas Indonesia (Arlindo) melalui Selat Makasar, Laut Flores dan Laut Banda (jalur barat), jalur Arlindo timur masuk melalui Laut Maluku dan Laut Halmahera (Radjawane & Hadipoetranto, 2014). Keluaran massa air arlindo pada wilayah selat makasar sangat dipengaruhi oleh Selat Lombok melalui celah sempit sehingga massa air yang keluar dari selat ini cenderung lebih kuat menuju Selat Makasar hingga ke Samudera Pasifik atau sebaliknya. Sedangkan keluaran massa air arlindo pada wilayah perairan Timor sangat berkaitan dengan perairan Laut Banda, dimana celah pada selat ini cenderung lebih lebar dan menjadi jalur arlindo dari Laut Banda dan berbelok ke Selat Lombok atau sebaliknya (Atmadipoera et al., 2009). Berdasarkan hasil analisis data molekuler, populasi L .olivacea di
Tuafanu cenderung lebih dekat dengan populasi di Serangan serta terbentuk kedalam satu kelompok filogenetik yang sama. Hasil ini sesuai dengan data keluaran analisis pola arus yang diperoleh dimana terdapat vektor arus yang sejajar di sepanjang Laut Timor menuju ke Samudera Hindia pada musim tenggara, dan vektor arus dari Samudera Hindia menuju ke Laut Timor hingga Laut Arafura pada musim barat laut (Gambar 5). Pergerakan arus tersebut berpotensi terhadap aliran genetik pada kedua populasi ini karena terdapat pergerakan arus yang menghubungkan antar kedua populasi pada dua musim yang berbeda. Hasil analisis molekuler terhadap populasi L. olivacea di Kapoposang menunjukkan hasil yang berbeda dari populasi Tuafanu dan Serangan yang juga berada di wilayah perairan tengah, populasi Kapoposang justru cenderung membentuk kelompok filogenetik sendiri. Pergerakan migrasi L. olivacea yang telah dipasangi transmitter tidak menunjukkan adanya pergerakan dari perairan Selat Makasar menuju ke Laut Timor atau Selat Bali, melainkan berpotensi menuju ke Kalimantan timur mengikuti pola arus musim barat laut (Manurung & Hartoko, 2013). Persebaran penyu lekang di Indonesia berada di Sumatera, Jawa Timur, Kalimatan Timur dan Nusa Tenggara Timur (NTT) (Dahuri, 2003).
Berdasarkan hasil pengamatan di lapangan selama proses pengambilan sampel L. olivacea, wilayah Indonesia yang berbatasan langsung dengan Samudera Hindia memiliki pola musim peneluran yang berbeda dengan wilayah timur Indonesia yang berbatasan dengan Samudera Pasifik. Pada wilayah yang berbatasan dengan Samudera Hindia, musim peneluran cenderung terjadi pada akhir hingga awal tahun dimana suhu permukaan pada kisaran bulan tersebut kembali meningkat sehingga penyu dapat menetaskan telurnya. Ini disebabkan karena penyu cenderung berenang menuju ke perairan yang lebih hangat dalam melakukan migrasi dan bertelur (Luschi et al., 2003; Whiting et al., 2007). Hal ini sesuai dengan hasil analisis suhu permukaan pada wilayah tengah yang menunjukkan adanya peningkatan suhu yang tinggi pada bulan Oktober hingga April berkisar pada 32-35 °C dimana pada bulan tersebut adalah musim peneluran L. olivacea di wilayah Samudera Hindia (Gambar 6). Salinitas pada wilayah perairan tengah cenderung seragam, namun pada wilayah Laut Flores dan Laut Banda, terdapat perubahan salinitas yang disebabkan
adanya pergerakan arus yang dominan dari Selat Makasar yang merupakan jalur masuk Arus Lintas Indonesia menuju ke Laut Flores dan Laut Banda pada musim barat laut. Pada wilayah Perairan Barat Nusantara, selat Lombok adalah jalur Arlindo yang paling dekat dengan bentuk celah yang sempit, sehingga arus yang melewati selat ini akan lebih kuat dan mendorong massa air yang lebih jauh ke Samudera Hindia (Pratomo et al., 2016). Hal ini diasumsikan menjadi salah satu penyebab tingginya variasi suhu dan salinitas di perairan selatan Jawa dibandingkan perairan Selat Ombai dan Laut Timor di Perairan Timur Nusantara (Atmadipoera et al., 2009).
Populasi L. olivacea di 6 lokasi pantai peneluran membentuk 5 kelompok filogenetik yang berbeda dimana ditemukan kesamaan karakter molekuler terhadap 5 populasi di sepanjang perairan Selatan Indonesia yang meliputi Aceh, Pariaman, Panggul, Serangan dan Tuafanu. Kapoposang menjadi populasi yang berbeda dibandingkan dengan populasi lainnya dimana secara filogenetik populasi ini cenderung berdiri sendiri. Aceh menjadi populasi dengan keragaman genetik L. olivacea tertinggi dimana ditemukan 5 haplotip L. olivacea pada populasi ini, sementara populasi dengan keragaman genetik terendah ditemukan pada populasi Tuafanu dengan jumlah haplotip sebanyak 2 buah dan keragaman nukleotida sebesar 0,00077.
Distribusi L. olivacea di perairan nusantara sangat dipengaruhi oleh pergerakan arus dimana hasil analisis pola arus menunjukkan pola yang sesuai antara pergerakan massa air di di wilayah Samudera Hindia dan analisis pengelompokkan filogenetik. Arus diduga menjadi salah satu faktor yang membantu distribusi L. olivacea di perairan nusantara karena arus menyediakan transportasi bagi juvenil yang belum mampu bergerak secara bebas (Kusuma et al., 2016)Sementara pada populasi Kapoposang tidak ditemukan distribusi yang menyatu dengan populasi lain. Hasil analisis pola arus menggambarkan arah pergerakan massa air dari selat Makasar menuju ke Kalimantan timur melalui pola arus musim barat laut yang diduga menjadi penyebab tidak ditemukannya kekerabatan L. olivacea pada populasi Kapoposang terhadap populasi lainnya.
Daftar Pustaka
Ario, R., Wibowo, E., Pratikto, I., & Fajar, S. (2016). Pelestarian habitat penyu dari ancaman kepunahan di turtle conservation and education center (TCEC), Bali. Jurnal Kelautan Tropis, 19(1), 60–66.
Atmadipoera, A., Molcard, R., Madec, G., Wijffels, S., Sprintall, J., Koch-Larrouy, A., Jaya, I., & Supangat, A. (2009). Characteristics and variability of the Indonesian throughflow water at the outflow straits. Deep Sea Research Part I: Oceanographic Research Papers, 56(11), 1942–1954.
Bahri, S., Atmadipoera, A. S., & Madduppa, H. H. (2017). Genetic diversity of olive ridley Lepidochelys olivacea associated with current pattern in Cendrawasih Bay, Papua. Jurnal Ilmu Dan Teknologi Kelautan Tropis, 9(2), 747–760.
Bahri, S., Purnama, D. A., Syawal, S., & Khairi, I. (2020). Evaluasi Tutupan Terumbu Karang Berbasis Masyarakat Di Wilayah Kawasan Konservasi Perairan Daerah (Kkpd) Kabupaten Aceh Selatan. Jurnal Laot Ilmu Kelautan, 2(2), 129–136.
Booy, G., Hendriks, R. J. J., Smulders, M. J. M., Van Groenendael, J. M., & Vosman, B. (2000). Genetic diversity and the survival of populations. Plant Biology, 2(04), 379–395.
Bowen, B. W., Clark, A. M., Abreu-Grobois, F. A., Chaves, A., Reichart, H. A., & Ferl, R. J. (1997). Global phylogeography of the ridley sea turtles (Lepidochelys spp.) as inferred from mitochondrial DNA sequences. Genetica, 101(3), 179–189.
Chiu, Y.-W., Bor, H., Tan, M.-S., Lin, H.-D., & Jean, C.-T. (2013). Phylogeography and genetic differentiation among populations of the moon turban snail Lunella granulata Gmelin, 1791 (Gastropoda: Turbinidae). International Journal of Molecular Sciences, 14(5), 9062– 9079.
Collard, S. B. (1990). The influence of oceanographic features on post-hatchling sea turtle distribution and dispersion in the pelagic environment. Proc. 10th Ann. Symp. on Sea Turtle Biology and Conservation. NOAA Tech. Memo. NMFS-SEFC-278, 111–114.
Dahuri, R. (2003). Keanekaragaman hayati laut aset pembangunan berkelanjutan Indonesia: Gramedia
Pustaka Utama.
Gautama, B. G., Longépé, N., Fablet, R., & Mercier, G. (2016). Assimilative 2-D Lagrangian transport model for the estimation of oil leakage parameters from SAR images: Application to the Montara oil spill. IEEE Journal of Selected Topics in Applied Earth Observations and Remote Sensing, 9(11), 4962–4969.
Gordon, A. L., & Fine, R. A. (1996). Pathways of water
between the Pacific and Indian oceans in the Indonesian seas. Nature, 379(6561), 146–149.
Haditiar, Y., Putri, M. R., Ismail, N., Muchlisin, Z. A., Ikhwan, M., Ramli, M., Sugianto Sugianto, R.,
Wafdan, M. A., & Rizal, S. (2022). The Effect Of Monsoon On The Bay Of Bengal Based On A Hydrodynamic Model. Journal of Engineering Science and Technology, 17(2), 936–955.
Harnino, T. Z. A. E., Parawangsa, I. N. Y., Sari, L. A., & Arsad, S. (2021). Efektifitas Pengelolaan Konservasi Penyu di Turtle Conservation and Education Center Serangan, Denpasar Bali. Journal of Marine and Coastal Science Vol, 10, 1.
Hoffman, J. I., Dasmahapatra, K. K., Amos, W., Phillips, C. D., Gelatt, T. S., & Bickham, J. W. (2009).
Contrasting patterns of genetic diversity at three different genetic markers in a marine mammal metapopulation. Molecular Ecology, 18(14), 2961–2978.
Horhoruw, S. M. (2016). StrukturdanvariabilitasArlindo di Selat Makassar [tesis]. Bogor (ID): InstitutPertanian Bogor.
Ilahude, A. G., & Gordon, A. L. (1996). Thermocline stratification within the Indonesian Seas. Journal of Geophysical Research: Oceans, 101(C5), 12401–12409.
Jena, S. N., Srivastava, A., Singh, U. M., Roy, S., Banerjee, N., Rai, K. M., Singh, S. K., Kumar, V., Chaudhary, L. B., & Roy, J. K. (2011). Analysis of genetic diversity, population structure and linkage disequilibrium in elite cotton (Gossypium L.) germplasm in India. Crop and Pasture Science, 62(10), 859–875.
Kaharuddin, K., & Simarangkir, O. R. (2017). Kajian Awal Identifikasi Pengaruh El-nino Terhadap Suhu Permukaan Laut In-situ Perairan Teluk Bontang. Jurnal Pertanian Terpadu, 5(1), 35–44.
Kandeel, M., Mohamed, M. E. M., Abd El‐Lateef, H. M., Venugopala, K. N., & El‐Beltagi, H. S. (2022).
Omicron variant genome evolution and phylogenetics. Journal of Medical Virology, 94(4), 1627– 1632.
Kartika, G. R. A., Sartimbul, A., & Widodo, W. (2017). Varian genetik Sardinella lemuru di Perairan Selat Bali. Jurnal Kelautan: Indonesian Journal of Marine Science and Technology, 10(1), 21–28.
Keskin, E., & Atar, H. H. (2012). Molecular identification of fish species from surimi‐based products labeled as A laskan pollock. Journal of Applied Ichthyology, 28(5), 811–814.
Kochzius, M., & Nuryanto, A. (2008). Strong genetic population structure in the boring giant clam, Tridacna crocea, across the Indo‐Malay Archipelago: implications related to evolutionary processes and
connectivity. Molecular Ecology, 17(17), 3775–3787.
Kunarso, K., Hadi, S., Ningsih, N. S., & Baskoro, M. S. (2011). Variabilitas suhu dan klorofil-a di daerah upwelling pada variasi kejadian ENSO dan IOD di perairan selatan Jawa sampai Timor. ILMU KELAUTAN: Indonesian Journal of Marine Sciences, 16(3), 171–180.
Kusmana, C., & Hikmat, A. (2015). Keanekaragaman hayati flora di Indonesia. Jurnal Pengelolaan Sumberdaya Alam Dan Lingkungan (Journal of Natural Resources and Environmental Management), 5(2), 187.
Kusuma, A. B., Bengen, D. G., Madduppa, H., Subhan, B., & Arafat, D. (2016). Keanekaragaman genetik karang lunak Sarcophyton trocheliophorum pada populasi laut jawa. Nusa tenggara dan Sulawesi. Jurnal Enggano, 1(1), 89–96.
Luschi, P., Hays, G. C., & Papi, F. (2003). A review of long‐distance movements by marine turtles, and the possible role of ocean currents. Oikos, 103(2), 293–302.
Madduppa, H., Ayuningtyas, R. U., Subhan, B., & Arafat, D. (2016). Exploited but unevaluated: DNA
barcoding reveals skates and stingrays (Chordata, Chondrichthyes) species landed in the Indonesian fish market. IJMS, 21, 77–84.
Madduppa, H., Bahri, S., Ghozali, A. T., Atmadipoera, A. S., Subhan, B., Santoso, P., Natih, I. N. M., & Arafat, D. (2021). Population genetic structure of Olive ridley (Lepidochelys olivacea) across Indonesian archipelago revealed by mitochondrial DNA: Implication for management. Regional Studies in Marine Science, 41, 101600.
Madec, G., Bourdallé-Badie, R., Bouttier, P.-A., Bricaud, C., Bruciaferri, D., Calvert, D., Chanut, J., Clementi, E., Coward, A., & Delrosso, D. (2017). NEMO ocean engine.
Manurung, M. E. S., & Hartoko, A. (2013). Hubungan Jalur Migrasi Penyu Lekang (Lepidochelys Olivacea) Terhadap Tinggi Muka Laut, Suhu Permukaan Laut, Klorofil-a Di Perairan Indonesia. Management of Aquatic Resources Journal (MAQUARES), 2(3), 150–160.
Maulany, R. I., Booth, D. T., & Baxter, G. S. (2012). The effect of incubation temperature on hatchling quality in the olive ridley turtle, Lepidochelys olivacea, from Alas Purwo National Park, East Java, Indonesia: implications for hatchery management. Marine Biology, 159(12), 2651–2661.
McCormack, J. E., Hird, S. M., Zellmer, A. J., Carstens, B. C., & Brumfield, R. T. (2013). Applications of nextgeneration sequencing to phylogeography and phylogenetics. Molecular Phylogenetics and Evolution, 66(2), 526–538.
Meylan, A. B., & Donnelly, M. (1999). Status justification for listing the hawksbill turtle (Eretmochelys imbricata) as critically endangered on the 1996 IUCN Red List of Threatened Animals. Chelonian Conservation and Biology, 3(2), 200–224.
Murray, S. P., & Arief, D. (1988). Throughflow into the indian ocean through the lombok strait, January 1985–January 1986. Nature, 333(6172), 444–447.
Musick, J. A., & Limpus, C. J. (2017). Habitat utilization and migration in juvenile sea turtles. In The biology of sea turtles (pp. 137–163). CRC Press.
Nuitja, I. N. S. (1992). Biologi dan ekologi pelestarian penyu laut: Penerbit IPB.
Permadi, L. C., Indrayanti, E., & Rochaddi, B. (2015). Studi Arus Pada Perairan Laut Di Sekitar Pltu Sumuradem Kabupaten Indramayu, Provinsi Jawa Barat. Journal of Oceanography, 4(2), 516–523.
Polovina, J. J., Balazs, G. H., Howell, E. A., Parker, D. M., Seki, M. P., & Dutton, P. H. (2004). Forage and migration habitat of loggerhead (Caretta caretta) and olive ridley (Lepidochelys olivacea) sea turtles in the central North Pacific Ocean. Fisheries Oceanography, 13(1), 36–51.
Pratomo, Y., Pranowo, W. S., & Setiadi, H. (2016).
Identifikasi penjalaran gelombang panjang Samudera Hindia ke Selat Lombok berdasarkan komponen harmonik arus. Omni-Akuatika, 12(1).
Rachman, M. R. (2021). Karakteristik habitat peneluran penyu lekang (lepidochelys olivacea) di pantai Cemara Banyuwangi. Dissertation. Program Studi Biologi, Fakultas Sains dan Teknologi UIN Sunan Ampel Surabaya.
Radjawane, I. M., & Hadipoetranto, P. P. (2014).
Karakteristik massa air di percabangan arus lintas Indonesia perairan Sangihe Talaud menggunakan data index satal 2010. Ilmu Dan Teknologi Kelautan Tropis, 6(2), 525–536.
Rozas, J., Sánchez-DelBarrio, J. C., Messeguer, X., & Rozas, R. (2003). DnaSP, DNA polymorphism analyses by the coalescent and other methods. Bioinformatics, 19(18), 2496-2497.
Schroeder, B. A., & Balazs, G. H. (2001). Migration
Routes and Destination Characteristics of PostNesting Hawksbill Turtles Satellite-Tracked from Barbados, West Indies JULIA A. HORROCKS’, LOTUS A. VERMEER~, BARRY KRUEGER~, MICHAEL COYNE~. Chelonian Conservation and Biology, 4(1–2001).
Schwartz, M. K., Luikart, G., & Waples, R. S. (2007). Genetic monitoring as a promising tool for conservation and management. Trends in Ecology &
Evolution, 22(1), 25–33.
Shetye, S. R., Gouveia, A. D., Shenoi, S. S. C., Sundar, D., Michael, G. S., & Nampoothiri, G. (1993). The
western boundary current of the seasonal subtropical gyre in the Bay of Bengal. Journal of Geophysical Research: Oceans, 98(C1), 945–954.
Simanullang, F., Djuwito, D., & Ghofar, A. (2016).
Distribusi dan Kelimpahan Larva Ikan Pada Ekosistem Mangrove Di Desa Pasar Banggi Kabupaten Rembang. Management of Aquatic Resources Journal (MAQUARES), 5(4), 199–208.
Tammu, R. M. (2018, June). Peran Pembelajaran Biologi Sel dan Molekuler Dalam Pengelolaan dan Konservasi Keanekaragaman Hayati Indonesia. Dalam Prosiding Seminar Nasional Pendidikan Biologi 2018. Indonesia, 8 Juni 2018 (pp. 878-885).
Tranchant, B., Reffray, G., Greiner, E., Nugroho, D., Koch-Larrouy, A., & Gaspar, P. (2016). Evaluation of an operational ocean model configuration at 1/12 spatial resolution for the Indonesian seas (NEMO2. 3/INDO12)–Part 1: Ocean physics. Geoscientific Model Development, 9(3), 1037–1064.
Vélez-Zuazo, X., & Agnarsson, I. (2011). Shark tales: a molecular species-level phylogeny of sharks
(Selachimorpha, Chondrichthyes). Molecular
Phylogenetics and Evolution, 58(2), 207–217.
Walsh, P. S., Metzger, D. A., & Higuchi, R. (2013). Chelex 100 as a medium for simple extraction of DNA for PCR-based typing from forensic material. Biotechniques, 54(3), 134–139.
Whiting, S. D., Long, J. L., & Coyne, M. (2007). Migration routes and foraging behaviour of olive ridley turtles Lepidochelys olivacea in northern Australia. Endangered Species Research, 3(1), 1–9.
Wyrtki, K. (1961). Physical oceanography of the Southeast Asian waters. (2nd ed). University of California: Scripps Institution of Oceanography.
Zamroni, A., & Suwarso, S. (2016). Genetika populasi Rastrelliger kanagurta Di Perairan Barat Sumatera, Selat Malaka Dan Laut Cina Selatan. Jurnal Penelitian Perikanan Indonesia, 22(1), 1–8.
Zedan, H. (2004). 2004 IUCN red list of threatened species: a global species assessment: Iucn.
Zhao, Y., Gentekaki, E., Yi, Z., & Lin, X. (2013). Genetic differentiation of the mitochondrial cytochrome
oxidase c subunit I gene in genus Paramecium (Protista, Ciliophora). PLoS One, 8(10), e77044.
© 2022 by the authors; licensee Udayana University, Indonesia. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution license (http://creativecommons.org/licenses/by/3.0/).
J. Mar. Aquat. Sci. 8: 254-266 (2022)
Discussion and feedback