Pemeliharaan Larva Ikan Kerapu Sunu (Plectropomus Leopardus) Stadia Awal Pada Bak Berbeda Warna
on
Journal of Marine and Aquatic Sciences 6(1), 27-35 (2020)
Pemeliharaan Larva Ikan Kerapu Sunu (Plectropomus Leopardus) Stadia Awal Pada Bak Berbeda Warna
Ni Ketut Maha Setiawati a*, Regina Melianawati a
a Balai Besar Riset Budidaya Laut dan Penyuluhan Perikanan Banjar Dinas Gondol, Ds. Penyabangan, Kec. Gerokgak, Buleleng, Bali, Indonesia
* Penulis koresponden. Tel.: +62-821-4401-9979
Alamat e-mail: mahasetiawati@yahoo.com
Diterima (received) 28 Mei 2019; disetujui (accepted) 28 Agustus 2020; tersedia secara online (available online) 29 Agustus 2020
Abstract
Tank color supposed to have influence to larvae rearing of fish. The aim of this research was to know the effect of different tank colors in early stage larvae rearing of coral trout that started from hatching until 10 days after hatching. The tank colors tested were Yellow (Y), Blue (B), White (W) and Black (Bc). Larvae were fed rotifers and copepods. The observed parameters were rearing success rate, survival rate, total length, number of rotifers in larval digestive tract and light intensity above the water surface and which is reflected from the water. The results showed, rearing success rate in treatment (K) and (B) were four times, whereas in (P) two times and (H) once. Difference of tank colors did not have significantly effect to larval survival rate (P>0.05), which was 4.87±3.74% (Y), 2.28±3.52% (B), 0.28±0.49% (Bc) and 0.15±0.31% (W). In contrast, the difference of tank colors had very significant effect (P <0.01) on larval total length, where the larval total length from (H) and (P) is greater than (B) and (K). Larvae from (P) had the highest number of rotifers in their digestion tract, while larvae (B) had the least number. The light intensity above the water surface of each different tank colors did not differ much. However, the light intensity reflected from water surface from (K) and (P) had higher intensity than from (B) and (H). Based on these results, tank color yellow is highly recommended to use in early stage larvae rearing of coral trout.
Keywords: tank color; light intensity; early stage of larvae; coral trout
Abstrak
Warna bak pemeliharaan diduga berpengaruh dalam pemeliharaan larva ikan. Penelitian ini bertujuan mengetahui pengaruh perbedaan warna bak dalam pemeliharaan larva ikan kerapu sunu pada stadia awal, yang dimulai saat larva menetas sampai berumur 10 hari. Penelitian dilakukan menggunakan empat bak fiber volume 400 L. Perlakuan warna bak yang diuji adalah: Kuning (K), Biru (B), Putih (P) dan Hitam (H). Larva diberi pakan alami rotifer dan kopepod. Parameter yang diamati adalah tingkat keberhasilan pemeliharaan, sintasan, panjang total dan jumlah rotifer dalam pencernaan larva serta intensitas cahaya di permukaan air dan yang dipantulkan dari dalam air pada media pemeliharaan larva. Hasil penelitian menunjukkan bahwa tingkat keberhasilan pemeliharaan yang mencapai umur 10 hari pada perlakuan (K) dan (B) adalah 4 kali, sedangkan pada (P) 2 kali dan (H) 1 kali. Perbedaan warna bak tidak berpengaruh nyata (P>0,05) terhadap sintasan, yang masing-masing adalah 4,87±3,74% (K), 2,28±3,52% (B), 0,28±0,49% (H) dan 0,15±0,31% (P). Sebaliknya, perbedaan warna bak tersebut berpengaruh sangat nyata (P<0,01) terhadap panjang total larva pada umur 10 hari, dimana panjang total larva (H) dan (P) lebih besar dibandingkan (B) dan (K). Larva (P) memiliki jumlah rotifer yang terbanyak dalam pencernaannya, sedangkan larva (B) yang paling sedikit. Intensitas cahaya di permukaan air setiap bak berbeda warna tersebut tidak berbeda jauh. Namun, intensitas cahaya yang dipantulkan dari permukaan air media pemeliharaan pada bak (K) dan (P) memiliki intensitas yang lebih tinggi dibandingkan pada bak (B) dan (H). Berdasarkan hasil penelitian tersebut, bak dengan warna kuning sangat direkomendasikan bagi pemeliharaan larva ikan kerapu sunu stadia awal.
Kata Kunci: warna bak; intensitas cahaya; larva stadia awal; kerapu sunu
Ikan kerapu sunu (Plectropomus leopardus) merupakan salah satu jenis ikan laut yang memiliki
prospek sangat baik dalam skala budidaya karena permintaan terhadap jenis ikan tersebut sangat besar, terutama di kawasan Asia (Akmalia, 2011). Usaha pembenihan terhadap ikan kerapu sunu
tersebut telah dilakukan di Balai Besar Riset Budidaya Laut dan Penyuluhan Perikanan (BBRBLPP) yang berlokasi di wilayah Bali Utara (Aslianti dkk., 2008). Namun demikian, kontinyuitas keberhasilan pembenihan masih perlu ditingkatkan lagi melalui inovasi yang terkait dengan teknik pembenihannya, utamanya pada stadia larva.
Stadia larva merupakan masa kritis dalam periode kehidupan ikan laut, salah satunya karena pada stadia awal larva tersebut terjadi peralihan sumber pakan larva dari pakan endogen ke pakan eksogen (Kohno et al., 1986). Keberhasilan larva untuk memangsa pakan alami sebagai pakan endogen awalnya akan berpengaruh tehadap sintasan larva selanjutnya.
Kegiatan aktivitas pemangsaan larva ikan laut tersebut juga sangat tergantung pada ketersediaan cahaya (Tandler and Mason, 1983). Hasil penelitian pada beberapa larva ikan laut yang dipelihara dalam panti benih seperti kerapu lumpur Epinephelus coioides (Imanto et al., 2001), kakap merah jenis Lutjanus argentimaculatus
(Melianawati, 2005) dan L. sebae (Melianawati dkk., 2006a), menunjukkan bahwa pola pemangsaan larva ikan tersebut sangat tergantung pada kondisi tingkat pencahayaan yang ada.
Pencahayaan di dalam media pemeliharaan larva, disamping berasal dari cahaya yang masuk ke permukaan air, diduga juga dapat berasal dari warna dinding sebelah dalam bak pemeliharaan itu sendiri. Beberapa hasil penelitian menunjukkan bahwa warna dinding media pemeliharaan ternyata memiliki pengaruh terhadap aktivitas makan ikan (Papoutsoglou et al., 2005; Volpato et al., 2013) dan pertumbuhan larva (García-Arteaga et al., 1997; Tamazouzt et al., 2000; Ullmann et al., 2011; Sebesta et al., 2018).
Pemeliharaan beberapa jenis larva ikan laut yang dilakukan di BBRBLPP umumnya menggunakan warna kuning atau biru pada bagian dinding dan bagian dasar baknya (Sugama et al., 2012). Warna kuning pada dinding bak telah terbukti memberi dampak terhadap peningkatan produksi benih ikan bandeng Chanos chanos (Ahmad dkk., 1994) dan pertumbuhan yang lebih baik pada ikan cardinal tetra Paracheirodon axelrodi (Nurhidayat dkk., 2017). Namun demikian, Sebesta et al. (2018) menyatakan bahwa setiap jenis ikan memiliki kebutuhan intensitas cahaya minimal dan warna bak yang optimal bagi perkembangan dan pertumbuhannya yang normal.
Ikan merupakan visual feeder sehingga aktivitas pemangsaannya tergantung pada warna yang kontras antara pakan dan warna latar belakangnya (Tamazouzt et al., 2000). Jenis pakan alami yang biasa digunakan sebagai pakan awal bagi larva ikan kerapu adalah rotifer Brachionus sp. (Sim et al., 2005). Rotifer memiliki ukuran yang relatif kecil dan gerakan renangnya lambat sehingga mudah untuk dimangsa oleh larva (Lubzens et al., 1989), terutama pada masa peralihan sumber pakan, yaitu dari pakan endogen ke pakan eksogen, dimana pada saat itu gerakan renang larva sendiri masih sangat terbatas.
Pada larva ikan kerapu sunu, aktivitas makannya secara alami juga sangat tergantung pada pencahayaan yang ada (Melianawati dkk., 2006b). Hasil penelitian tersebut selanjutnya dikembangkan dengan penelitian mengenai lama waktu pencahayaan dengan menggunakan pencahayaan buatan (Andamari, 2008). Hasilnya menunjukkan bahwa lama waktu pencahayaan juga berpengaruh terhadap aktivitas pemangsaan dan sintasan larva.
Kedua penelitian tentang pencahayaan tersebut menggunakan sumber cahaya yang berasal dari atas permukaan air media pemeliharaan larva, sedangkan penelitian mengenai sumber cahaya yang berasal dari warna dinding bak belum pernah dilakukan. Bahkan, hingga saat ini belum pernah dilakukan penelitian mengenai keterkaitan antara warna dinding bak pemeliharaan dengan intensitas cahaya. Oleh karenanya perlu dilakukan penelitian terhadap hal tersebut.
Tujuan dari penelitian ini adalah untuk mengetahui pengaruh warna bak pemeliharaan terhadap keberhasilan pemeliharaan, sintasan, pertumbuhan dan aktivitas pemangsaan larva ikan kerapu sunu pada stadia awal, yaitu mulai dari larva menetas sampai dengan larva umur 10 hari. Hasil penelitian ini diharapkan dapat menjadi acuan dalam pemeliharaan larva ikan kerapu sunu, khususnya pada stadia awal.
Penelitian dilakukan pada bulan Desember 2017 sampai dengan Maret 2018 di Balai Besar Riset Budidaya Laut dan Penyuluhan Perikanan (BBRBLPP), Kabupaten Buleleng, Provinsi Bali, Indonesia. Penelitian dilakukan di dalam ruang pembenihan (hatchery) yang terdapat di BBRBLPP.
-
2.2 Rancangan Penelitian
Penelitian dilakukan dengan rancangan acak kelompok, terdiri dari 4 perlakuan dan 4 ulangan waktu yang berbeda. Perlakuan yang diuji adalah warna bagian dalam bak yang berbeda untuk pemeliharaan larva kerapu sunu, yaitu: Kuning (K), Biru (B), Putih (P) dan Hitam (H). Pewarnaan dilakukan dengan mengecat dinding bagian dalam bak masing-masing tersebut. Penelitian ini dilakukan sampai dengan larva berumur 10 hari.
-
2.3 Penetasan Telur dan Pemeliharaan Larva
Penelitian ini dilakukan dengan menggunakan empat buah bak fiber berbentuk bulat yang masing-masing berkapasitas 400 L dan dilengkapi dengan aerasi sebagai sumber oksigen terlarut. Ke dalam setiap bak tersebut ditebar sebanyak 8.000 butir telur ikan kerapu sunu sehingga kepadatan telur dalam setiap bak adalah 20 butir/L. Telur yang digunakan berasal dari pemijahan induk ikan kerapu sunu alam yang sudah didomestikasi dalam bak pemeliharaan induk di BBRBLPP. Telur berdiameter 790-820 µm. Tingkat penetasan telur berkisar antara 50 hingga 70%.
Pada hari ke-2 setelah menetas, ke dalam masing-masing bak pemeliharaan larva diberi mikroalga Nannochloropsis sp. sebagai green water dengan kepadatan 300.000 sel/mL. Pada hari ke-3, rotifer Brachionus sp. dan naupli kopepod mulai diberikan sebagai pakan awal bagi larva. Kepadatan rotifer di bak pemeliharaan adalah 10 ind./mL, sedangkan kepadatan kopepod adalah 10 ind./L. Baik rotifer maupun kopepod yang digunakan berasal dari hasil kultur di BBRBLPP.
-
2.4 Parameter pengamatan
-
2.4.1. Keberhasilan Pemeliharaan
-
Pemeliharaan larva dianggap berhasil dalam penelitian ini apabila masih terdapat larva dalam suatu media pemeliharaan pada saat larva berumur 4 hari (d-4), 7 hari (d-7) dan 10 hari (d-10). Jadi keberhasilan pemeliharaan merupakan jumlah pemeliharaan larva yang berhasil dari keseluruhan pemeliharaan yang terdiri dari 4 kali ulangan.
-
2.4.2. Sintasan
Sintasan larva dihitung pada hari ke-10, yaitu dengan cara menghitung seluruh jumlah larva yang
ada di dalam masing-masing bak pemeliharaan. Selanjutnya, sintasan larva dihitung sesuai dengan rumus Effendie (1997).
-
2.4.3. Panjang Total
Pengukuran panjang total dilakukan terhadap larva umur 4, 7 dan 10 hari, masing-masing dengan menggunakan 5 ekor larva sebagai sampel. Larva sampel diambil secara hati-hati kemudian diletakkan pada object glass. Pengukuran larva dilakukan di laboratorium Biologi BBRBLPP dengan menggunakan mikroskop stereoskopis Olympus SZH yang sudah dilengkapi dengan pengukur mikrometer.
-
2.4.4. Jumlah Rotifer dalam Pencernaan Larva
Larva umur 4, 7 dan 10 hari digunakan sebagai sampel untuk penghitungan jumlah rotifer dalam pencernaannya. Pada masing-masing umur tersebut digunakan 5 ekor larva sebagai sampel. Sampel dalam analisa ini sama dengan sampel yang diukur panjang totalnya. Setelah larva diukur, kemudian dianalisa isi pencernaannya dengan cara meletakkan larva pada object glass kemudian menutupnya dengan cover glass dan selanjutnya dilakukan pengamatan dan penghitungan jumlah rotifer yang ada dengan mikroskop binokuler Olympus CH2 di laboratorium Biologi BBRBLPP.
-
2.4.5. Intensitas Cahaya
Variabel kualitas air media pemeliharaan larva yang diamati adalah intensitas cahaya. Pengukuruan ini menggunakan luxmeter, dilakukan 3 kali sehari yaitu pada pukul 08:00, 12:00 dan 15:00. Intensitas cahaya yang diukur ada dua, yaitu intensitas cahaya yang masuk ke permukaan air pada media pemeliharaan larva dan intensitas cahaya yang dipantulkan dari permukaan air pada media pemeliharaan. Pengukuran dilakukan dengan cara menempatkan sensor cahaya pada luxmeter menghadap ke atas untuk mengukur cahaya yang masuk ke permukaan air pemeliharaan (Gambar 1a). Sebaliknya, sensor cahaya pada luxmeter diarahkan ke bawah untuk mengukur intensitas cahaya yang dipantulkan dari permukaan air pemeliharaan larva (Gambar 1b). Jarak antara luxmeter dan permukaan air pemeliharaan 10 cm.

W (b)
Gambar 1. Posisi luxmeter untuk pengukuran intensitas cahaya yang masuk (a) dan yang dipantulkan (b)
-
2.4.6. Analisis Data
Keberhasilan pemeliharaan larva merupakan jumlah pemeliharaan yang berhasil dibandingkan dengan total pemeliharaan yang dilakukan dan dinyatakan dalam bentuk persentase. Data sintasan, panjang total dan aktivitas pemangsaan larva dianalisa dengan anova satu arah menggunakan program Rcmdr dan ditampilkan dalam bentuk gambar box plot. Hasil pengukuran intensitas cahaya ditampilkan dalam bentuk grafik dan dianalisis secara deskriptif.
Keberhasilan pemeliharaan larva yang dipelihara dalam bak warna kuning dan biru adalah sebesar 4 kali ulangan, baik pada d-4, d-7 maupun d-10 dan keberhasilan pemeliharaan tersebut lebih tinggi dibandingkan dengan pada larva yang dipelihara dalam bak warna putih dan hitam (Gambar 2). Keberhasilan pemeliharaan larva dalam bak warna putih dan hitam mulai menurun sejak larva umur 7 hari. Pada umur 10 hari, keberhasilan pemeliharaan larva dalam bak warna hitam kembali menurun hingga hanya menjadi satu kali ulangan yang berhasil mencapai d-10, sedangkan dalam bak warna putih tetap sebesar 2 kali. Hasil ini memperlihatkan bahwa keberhasilan pemeliharaan larva pada bak warna kuning dan biru lebih baik dibandingkan dalam bak warna putih dan hitam. Hal ini menunjukkan bahwa pada warna bak hitam dan putih larva diduga mengalami stress yang dapat mengakibatkan kematian larva mulai d-7 pemeliharaan. Menurut Rotllant et al. (2003),
intensitas cahaya dan warna bak pemeliharaan mungkin mempengaruhi stress pada ikan.

Gambar 2. Keberhasilan pemeliharaan larva. B: Biru, H: Hitam, K: Kuning, P: Putih.
-
3.2 Sintasan
Sintasan larva pada bak warna kuning dan biru, masing-masing adalah 4,87±3,74% dan 2,28±3,52%, relatif lebih tinggi dibandingkan pada bak warna putih dan hitam yang masing-masing sebesar 0,28±0,49% dan 0,15±0,31% (Gambar 3). Namun demikian, secara statistik, sintasan larva dari semua perlakuan tersebut tidak berbeda nyata (P>0,05). Hal ini disebabkan karena cukup tingginya variasi nilai dari keempat ulangan.
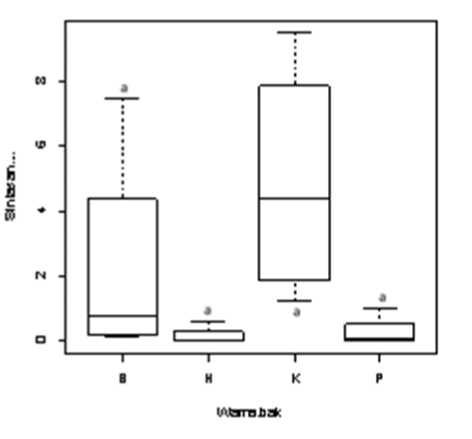
Gambar 3. Sintasan larva pada akhir penelitian. B: Biru, H: Hitam, K: Kuning, P: Putih. Huruf yang sama menunjukkan nilai yang tidak berbeda nyata (P>0,05).
-
3.3 Panjang Total
Panjang total larva pada umur 4 hari adalah masih sama pada semua perlakuan, namun pada umur 7
dan 10 hari mulai terlihat adanya perbedaan (Gambar 4). Larva pada bak warna putih mulai menunjukkan ukuran panjang total yang lebih besar dibandingkan larva pada bak lainnya mulai umur 7 hari. Pada pemeliharaan 10 hari, larva pada bak putih dan hitam mencapai pertumbuhan panjang total yang lebih besar dan berbeda sangat nyata (P<0,01) dibandingkan dengan larva pada bak kuning dan biru (Gambar 5). Hasil tersebut menunjukkan bahwa perbedaan warna dinding bak memberikan pengaruh terhadap panjang total larva.
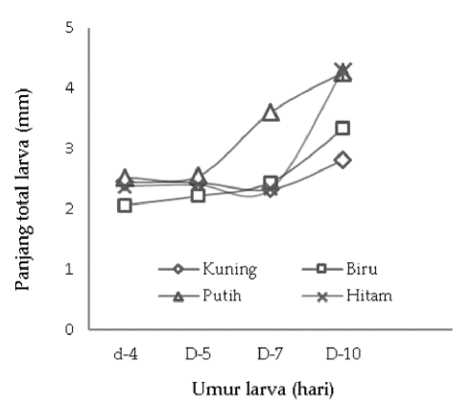
Gambar 4. Panjang total larva selama penelitian
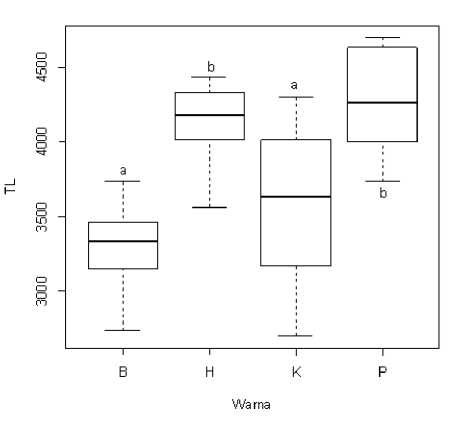
Gambar 5. Panjang total larva pada akhir penelitian. B: Biru, H: Hitam, K: Kuning, P: Putih. Huruf yang sama menunjukkan nilai yang tidak berbeda nyata (P>0,05). TL: Total length.
Bila dikaitkan dengan sintasan larva pada
Gambar 3, nampak terlihat adanya keterkaitan
antara sintasan larva dengan panjang total larva. Hal tersebut terlihat jelas pada larva dari bak warna putih dan hitam, dimana larva dari kedua perlakuan tersebut memiliki ukuran panjang total yang lebih tinggi karena tingkat sintasan larva pada kedua perlakuan tersebut lebih rendah, yang berarti kepadatan larva dalam bak pemeliharaan tersebut juga rendah dan hal itu menyebabkan ketersediaaan pakan bagi larva menjadi lebih banyak karena pemberian pakan dilakukan berdasarkan volume media pemeliharaan. Keadaan tersebut berbanding terbalik dengan yang terjadi pada bak warna kuning dan biru, dimana sintasan larva yang lebih tinggi pada kedua bak tersebut, berarti tingkat kepadatan larvanya lebih tinggi, yang mengakibatkan pakan yang tersedia harus digunakan oleh lebih banyak larva. Dampaknya, kepadatan pakan yang tersedia lebih rendah, konsumsi pakan lebih rendah dan hal tersebut menyebabkan pertumbuhan panjang total larva yang lebih rendah.
Pada stadia awal, larva masih memiliki kemampuan gerak yang sangat terbatas karena masih belum lengkapnya perkembangan morfologis larva. Ruang gerak yang masih terbatas tersebut mengakibatkan larva baru mampu untuk menangkap mangsa yang berada dekat dengan posisinya. Pada larva dari bak warna kuning dan biru, dengan kepadatan larva yang lebih tinggi dan kemampuan renang yang masih terbatas, maka larva tersebut hanya mampu menangkap pakan yang berada di dekatnya saja. Hal inilah yang menyebabkan ketersediaan pakan di wilayah jelajah larva tersebut menjadi terbatas dan berdampak pada pertumbuhan larva yang lebih rendah.
-
3.4 Jumlah Rotifer dalam Pencernaan Larva
Aktivitas pemangsaan larva diidentifikasi dari banyaknya jumlah pakan alami rotifer yang ditemukan dalam pencernaan larva sampel. Pada larva yang dipelihara dalam bak warna putih terdapat jumlah rotifer yang paling banyak dalam pencernaannya yaitu 7,8±4,0 ind./larva, sedangkan pada larva yang dipelihara dalam bak biru ditemukan rotifer dalam jumlah yang paling sedikit yaitu 4,9±3,8 ind./larva (Gambar 6). Secara statistik, tidak terdapat beda nyata diantara semua perlakuan warna bak yang diujikan (P>0,05). Namun demikian, terlihat bahwa jumlah rotifer yang terdapat dalam pencernaan larva dari bak putih dan hitam cenderung lebih tinggi, meskipun
dari bak hitam terdapat variasi jumlah yang besar. Hal ini menunjukkan bahwa larva pada bak warna putih dan hitam mengkonsumsi rotifer dalam jumlah yang relatif lebih banyak dibandingkan dengan yang dikonsumsi oleh larva pada bak kuning dan biru. Berdasarkan hal ini, warna dinding bak media pemeliharaan larva nampaknya berpengaruh terhadap kemudahan larva untuk menangkap mangsanya. Warna tangki dan mangsa yang terlihat kontras adalah sangat penting dalam aktivitas makan larva di tahap awal karena pada saat itu larva sedang belajar untuk menangkap mangsanya (Delabbio, 2015a).
Keberhasilan larva untuk menangkap pakannya tergantung pada intensitas cahaya. Oleh karenanya, peningkatan intensitas cahaya berpengaruh terhadap peningkatan jumlah pakan yang dapat dikonsumsi oleh larva (Peña et al., 2004). Dalam penelitian ini, intensitas cahaya pada bak warna putih adalah yang paling tinggi dan hal tersebut diikuti dengan jumlah rotifer yang paling banyak dalam pencernaan larvanya. Namun demikian, meskipun pada bak warna hitam yang intensitas cahayanya paling rendah, ternyata juga ditemukan rotifer dalam jumlah yang juga cukup banyak. Hal ini dapat disebabkan karena warna hitam memberikan latar belakang yang kontras dengan rotifer sehingga rotifer tersebut dapat dengan mudah terlihat dan dimangsa oleh larva.
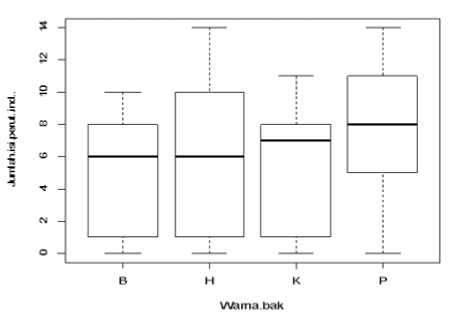
Gambar 6. Jumlah rotifer dalam pencernaan larva. B: biru, H: hitam, K: kuning, P: putih. Huruf yang sama menunjukkan nilai yang tidak berbeda nyata (P>0,05).
Jumlah rotifer yang dikonsumsi larva nampak terkait pula dengan sintasan larva yang berkorelasi dengan ketersediaan pakan alami. Sebagai contoh, sintasan larva pada bak warna putih dan hitam sangat rendah sehingga demikian ketersediaan pakan alami akan lebih tinggi. Sedangkan pada bak
warna kuning dan biru, sintasan larva lebih tinggi sehingga ketersediaan pakan alami lebih rendah. Walaupun ketersedian pakan alami dalam satu bak relatif sama tetapi karena sifat larva masih cenderung mengumpul atau bergerombol maka ketersediaan pakan alami pada larva jadi berbeda. Hal ini dapat dilihat dari jumlah isi pencernaan pada larva dari bak warna putih dan hitam relatif lebih tinggi dibandingkan pada larva dari bak warna kuning dan biru.
-
3.5 Intensitas Cahaya
Intensitas cahaya di permukaan air adalah berkisar antara 400-500 lux pada pukul 09.00, kemudian meningkat 580-720 lux pada pukul 12.00 dan menurun kembali menjadi 160-240 lux pada pukul 15.00 wita (Gambar 7a). Intensitas cahaya yang terukur dari bak warna kuning terlihat yang paling rendah, sedangkan pada bak warna hitam intensitanya paling tinggi, baik pada pukul 09:00, 12:00 dan 15:00. Namun demikian, perbedaan intensitas pada keempat warna bak tersebut tidak berbeda jauh.
Hasil penelitian Sebesta et al. (2018) menunjukkan, bak pemeliharaan larva dengan warna dinding yang terang seperti putih atau abu-abu ternyata berhubungan dengan pencahayaan yang tinggi berkisar 400-800 lux dan berpengaruh terhadap pertumbuhan dan sintasan larva ikan Perca fluviatilis. Hasil penelitian lainnya, menunjukkan, warna dinding bak yang gelap dapat meningkatkan persepsi larva terhadap pakan alami yang menjadi mangsanya (Tamazout et al., 2000). Boeuf dan Le Bail (1999) menjelaskan bahwa intensitas cahaya berpengaruh terhadap pertumbuhan banyak spesies ikan dan stadia larva membutuhkan lebih banyak cahaya untuk mendapatkan pakannya dibandingkan pada stadia yang lebih tua.
Intensitas cahaya yang dipantulkan dari permukaan air media pemeliharaan larva pada bak warna kuning dan putih memiliki intensitas yang lebih tinggi dibandingkan pada bak biru dan hitam (Gambar 7b). Intensitas cahaya yang dipantulkan dari bak warna putih adalah yang paling tinggi, yaitu berkisar 29-145 lux, sedangkan intensitas yang dipantulkan dari bak warna hitam adalah yang paling rendah yaitu berkisar 4-15 lux. Intensitas yang dipantulkan dari bak warna kuning dan biru, masing-masing adalah 19-98 lux dan 7-30 lux. Hasil ini menunjukkan bahwa perbedaan
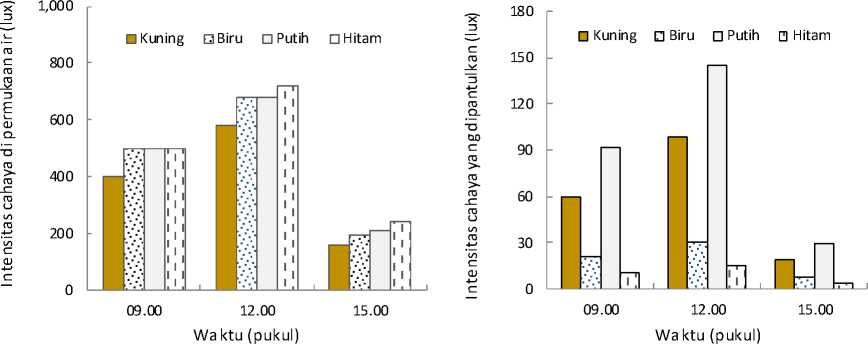
(b)
(a)
Gambar 7. Intensitas cahaya pada media pemeliharaan larva di permukaan air (a) dan yang dipantulkan dari air media pemeliharaan larva (b)
warna dinding bak berpengaruh terhadap intensitas cahaya yang dipantulkan dari permukaan media pemeliharaan tersebut. Warna yang lebih terang, dalam penelitian ini adalah warna putih, memberikan intensitas yang lebih terang, sebaliknya warna yang gelap, dalam penelitian ini adalah warna hitam, memberikan intensitas yang juga lebih rendah.
Jadi Gambar 7 tersebut menunjukkan bahwa intensitas di permukaan air setiap media pemeliharaan hampir sama, tetapi intensitas yang dipantulkan dari media pemeliharaan tersebut terdapat perbedaan. Intensitas cahaya yang banyak dipantulkan adalah pada bak warna putih, sedangkan intensitas cahaya yang paling rendah dipantulkan atau yang banyak diserap adalah pada bak warna hitam. Intensitas cahaya yang dipantulkan ini diduga memberikan pengaruh terhadap sintasan larva.
Jika intensitas cahaya yang dipantulkan tersebut terlalu rendah atau terlalu tinggi diduga akan menyebabkan perubahan tingkah laku ikan berupa aktivitas renang yang tinggi, menjadi agresif dan stress (Rotllant et al., 2003), bahkan pada jenis ikan tertentu dapat menyebabkan perilaku kanibalisme yang meningkat (Almazán-Rueda et al., 2004; Delabbio, 2015b). Ketajaman warna atau kekontrasan yang dapat dilihat oleh mata ikan merupakan hal yang penting untuk memungkinkannya membedakan benda-benda dengan ukuran tertentu dari suatu jarak yang cukup jauh (Syam dan Satria, 2009).
Larva yang dipelihara dalam bak warna kuning menghasilkan keberhasilan pemeliharaan dan sintasan yang paling tinggi. Larva dari bak warna hitam memiliki pertumbuhan panjang total yang terbesar, sedangkan larva yang dipelihara dalam bak warna putih mengkonsumsi rotifer dalam jumlah yang paling banyak. Terkait dengan tujuan utama kegiatan budidaya adalah untuk peningkatan produksi benih, maka penggunaan bak dengan warna kuning sangat
direkomendasikan dalam pemeliharaan larva ikan kerapu sunu terutama pada stadia awal.
Ucapan terimakasih
Ucapan terimakasih disampaikan kepada teknisi Litkayasa BBRBLPP yang telah membantu dalam penelitian ini: Bapak Mujimin, Komang Suarsana, dan Made Miniartini untuk kegiatan pemeliharaan larva, serta Nyoman Restiada, Muhdiat, Kadek Ardika, Feri Priatna dan Kurdi untuk penyediaan pakan alami.
Daftar Pustaka
Ahmad, T., Aslianti, T., & Rohaniawan, D. (1994). Laju pertumbuhan dan kelangsungan hidup nener, Chanos chanos, dalam berbagai nuansa warna wadah. J. Penelit. Perikanan Indonesia, 5(2), 6-13.
Akmalia, M. (2011). Perkembangan kerapu di Indonesia. [online],(www.indonesianaquaculture.com). [diakses: 02 Mei 2019].
Almazán-Rueda, P., Schrama, J. W., & Verreth, J. A. (2004). Behavioural responses under different feeding methods and light regimes of the African catfish (Clarias gariepinus) juveniles. Aquaculture, 231(1-4),
347-359.
Andamari, R. (2008). Peran lama pencahayaan dalam pemeliharaan larva ikan kerapu sunu (Plectropomus leopardus). Dalam Prosiding Seminar Nasional Tahunan V Hasil Penelitian Perikanan dan Kelautan, Universitas Gadjah Mada. Yogyakarta, Indonesia, 26 Juli 2008 (pp. BP-12:1-5).
Aslianti, T., Suwirya, K., & Asmanik, A. (2016). Teknologi Pemeliharaan Larva Kerapu Sunu (Plectropomus leopardus) Secara Massal. Jurnal Riset Akuakultur, 3(1), 1-11.
Boeuf, G., & Le Bail, P. Y. (1999). Does light have an influence on fish growth?. Aquaculture, 177(1-4), 129152.
Delabbio, J. (2015a). The importance of environmental light to the culture of marine fish larvae. [online] ONCE
Aquaculture Lighting, (http://www.once.group/wp-content/uploads/2018/04/3-9-15-
EnvironmentalLighting-and-Marine-Fish-Larvae-ONCEWhitepaper.pdf), [diakses: 03 Maret 2019].
Delabbio, J. (2015b). Advantages of LED Lighting System in Larval Fish Culture. [online] ONCE Aquaculture Lighting, (http://www.once.group/wp-
content/uploads/2018/04/Delabbio-1-1.pdf), [diakses: 03 Maret 2019].
Effendie, M. I. (1997). Biologi Perikanan. Yogyakarta, Indonesia: Yayasan Pustaka Nusantara.
García-Arteaga, J. P., Claro, R., & Valle, S. (1997). Lengthweight relationships of Cuban marine fishes. Naga, the ICLARM Quarterly, 20(1), 38-43.
Guma'a, S. A. (1982). Retinal development and retinomotor responses in perch, Perca fluviatilis L. Journal of Fish Biology, 20(5), 611-618.
Kohno, H., Hara, S., & Taki, Y. (1986). Early larval development of the seabass Lates calcarifer with emphasis on the transition of energy sources. Bulletin of the Japanese Society of Scientific Fisheries, 52(10), 17191725.
Lubzens, E., Tandler, A., & Minkoff, G. (1989). Rotifers as food in aquaculture. Hydrobiologia, 186(1), 387-400.
Melianawati, R. (2005). Aktivitas Makan Larvaikan Kakap Merah, Lutjanus argentimaculatus Pada Sistem Pemeliharaan Dengan Penggunaan Cahaya Buatan. Jurnal Penelitian Perikanan Indonesia, 11(1), 33-38.
Melianawati, R., Andamari, R., & Imanto, P. T. (2006b). Aktivitas makan harian larva ikan kerapu sunu (Plectropomus leopardus). Dalam Prosiding Seminar Nasional Tahunan III Hasil Penelitian Perikanan dan Kelautan, Universitas Gadjah Mada, Yogyakarta, Indonesia, 27 Juli 2006 (pp 266-274).
Melianawati, R., Imanto, P. T., & Suastika, M. (2006a). Pola Pemangsaan Larva Ikan Kakap Merah, Lutjanus sebae. Jurnal Riset Akuakultur, 1(1), 49-54.
Nurhidayat, Koswawati, R., & Ardi, I. (2017).
Kelangsungan Hidup Dan Pertumbuhan Ikan Cardinal Tetra Paracheirodon axelrodi pada Warna Wadah Pemeliharaan yang Berbeda. LIMNOTEK-Perairan Darat Tropis di Indonesia, 24(1), 15-25.
Papoutsoglou, S. E., Karakatsouli, N., & Chiras, G. (2005). Dietary L-tryptophan and tank colour effects on growth performance of rainbow trout (Oncorhynchus mykiss) juveniles reared in a recirculating water system. Aquacultural engineering, 32(2), 277-284.
Peña, R., Dumas, S., Saldivar ‐ Lucio, R., García, G., Trasviña, A., & Hernández‐Ceballos, D. (2004). The effect of light intensity on first feeding of the spotted sand bass Paralabrax maculatofasciatus
(Steindachner) larvae. Aquaculture research, 35(4), 345349.
Rotllant, J., Tort, L., Montero, D., Pavlidis, M., Martinez, M., Bonga, S. W., & Balm, P. H. M. (2003). Background colour influence on the stress response in cultured red porgy Pagrus pagrus. Aquaculture, 223(1-4), 129-139.
Sebesta, R., Stejskal, V., Matousek, J., & Lundova, K. (2019). The effect of light intensity and tank wall colour on survival and growth of peled Coregonus peled Gmelin 1788 larvae. Turkish Journal of Fisheries and Aquatic Sciences, 19(7), 541-549.
Sim, S. Y., Rimmer, M. A., Toledo, J. D., Sugama, K., Rumengan, I., Williams, K. C., Phillips, M. J. (2005). Panduan Teknologi Hatcheri Ikan Laut Skala Kecil. Bangkok, Thailand: Network of Aquaculture Centres in Asia-Pacific.
Sugama, K., Rimmer, M. A., Ismi, S., Koesharyani, I., Suwirya, K., Giri, N. A., & Alava, V. R. (2012). Hatchery management of tiger grouper (Epinephelus fuscoguttatus): a best-practice manual. Canberra, Australia: Australian Centre for International Agricultural Research (ACIAR).
Syam, A. R., & Satria, H. (2009). Adaptasi Fisiologis Retinamata Dan Tingkah Laku Ikan Terhadap Cahaya. BAWAL Widya Riset Perikanan Tangkap, 2(5), 215-224.
Tamazouzt, L., Chatain, B., & Fontaine, P. (2000). Tank wall colour and light level affect growth and survival of Eurasian perch larvae (Perca fluviatilis L.). Aquaculture, 182(1-2), 85-90.
Tandler, A & Mason, C. (1983). Light and food density effects on growth and survival of larvae Gilthead Seabream (Sparus aurata, Linnaeus, Sparidae). Journal World Mariculture Soc., 3, 103-116.
Ullmann, J. F., Gallagher, T., Hart, N. S., Barnes, A. C., Smullen, R. P., Collin, S. P., & Temple, S. E. (2011). Tank color increases growth, and alters color preference and spectral sensitivity, in barramundi (Lates calcarifer). Aquaculture, 322-323, 235-240.
|
Volpato, G. L., Bovi, T. S., de Freitas, R. H. A., da Silva, D. F., Delicio, H. C., Giaquinto, P. C., & Barreto, R. E. |
(2013). Red light stimulates feeding motivation in fish but does not improve growth. PloS one, 8(3), 1-5. |
© 2020 by the authors; licensee Udayana University, Indonesia. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution license (http://creativecommons.org/licenses/by/3.0/).
J. Mar. Aquat. Sci. 6: 27-35 (2020)
Discussion and feedback