Seroprevalensi Infeksi Virus Newcastle Disease dan Deteksi Paramyxovirus Pada Itik di Peternakan dan Pasar Unggas di Bali
on
Jurnal Ilmu dan Kesehatan Hewan, Agustus 2015
Vol 3 No 2: 55-63
Seroprevalensi Infeksi Virus Newcastle Disease dan Deteksi Paramyxovirus Pada Itik di Peternakan dan Pasar Unggas di Bali
Seroprevalence of Newcastle Disease Virus Infection and Detection of Paramyxovirus on Duck at Farmland and Poultry Market in Bali
I GBA Purwanda1, I Gusti Ngurah Kade Mahardika2, Gusti Ayu Yuniati Kencana1*
-
1 Program Magister Kedokteran Hewan Unud Jl. P.B. Sudirman, Denpasar, Bali
-
2 Laboratorium Biomedik dan Biologi Molekuler FKH Unud Jl. Raya Sesetan Gang Markisa, Denpasar, Bali
*Corresponding outhor: yuniatikencana@gmail.com
ABSTRACT
Seroprevalence of Newcastle Disease Virus (NDV) infection and the presence of paramyxovirus on ducks at the farmland and the poultry market in Bali have not been known. The purpose of this study was to determine the comparison of seroprevalence of NDV infection and the presence of paramyxovirus on duck at farmlands and poultry markets in Bali. Locations sampled were Gelgel, Tojan, Akah, Takmung, Tusan villages in Klungkung Regency, as well as Mengwi, Mengwitani, Lukluk, Sangeh, and Blahkiuh villages of Badung Regency. The poultry market samples were Galiran of Klungkung Regency, and Bringkit of Badung Regency. Serum samples and cloacal-tracheal swabs were taken using stratified-random sampling from adult ducks of both markets and farmland that had more than 500 individuals in a flock. Sampling was carried out every month for 6 months. Antibody against NDV was detected with Inhibition Haemagglutination test (HI). Tracheal and cloacal swabs were propagated in fertile chicken eggs of 9-11 days old. Paramyxovirus was detected by the haemagglutination (HA) test and Reverse Transcriptase-Polymerase Chain Reaction (RT-PCR). The correlation between NDV seroprevalences at farmland and poultry markets was analyzed using non-parametric test of Chi-square. The results showed that the seroprevalence of NDV on March until August 2012 reached 45% on farmlands in both regencies, while in the markets were up to 32.6%. There was no correlation between NDV seroprevalence at farmlands and poultry markets in the two regencies (r = 0.522, P> 0.05). The paramyxoviruses detected were APMV-5 and APMV-8, while NDV was not found.
Key words: NDV, ducks, seroprevalence, RT-PCR, Paramyxovirus, Poultry Market
ABSTRAK
Seroprevalensi infeksi virus Newcastle Disease (NDV) dan deteksi paramyxovirus pada itik di peternakan dan di pasar unggas di Bali belum banyak diketahui. Tujuan penelitian ini adalah untuk mengetahui perbandingan seroprevalensi NDV dan mendeteksi paramyxovirus pada itik di peternakan dan pasar unggas di Bali. Lokasi pengambilan sampel adalah di Desa Gelgel, Desa Tojan, Desa Akah Kecamatan Klungkung, Desa Takmung, Desa Tusan, Kecamatan Banjarangkan Kabupaten Klungkung dan Desa Mengwi, Desa Mengwitani, Desa Lukluk, Kecamatan Mengwi, Desa Sangeh, Desa Blahkiuh Kecamatan Abiansemal Kabupaten Badung serta Pasar Unggas Galiran Kabupaten Klungkung dan Pasar Unggas Bringkit Kabupaten Badung. Sampel serum dan swab kloaka dan trakea diambil secara acak bertingkat pada itik dewasa dan pedagang di kedua pasar serta peternakan dengan populasi lebih dari 500 ekor. Pengambilan sampel dilakukan setiap bulan selama 6 bulan. Antibodi terhadap NDV dideteksi dengan uji Hambatan Hemaglutinasi (HI). Swab trakea dan kloaka dipropagasi pada telur ayam berembrio umur 9-11 hari. Virus dideteksi dengan uji Hemaglutinasi (HA) dan uji Reverse Transcriptase-polymerase Chain Reaction (RT-PCR). Perbandingan seroprevalensi NDV pada itik di peternakan dan pasar unggas dianalisis menggunakan uji Non-Parametrik Chi-square. Hasil penelitian ini menunjukkan bahwa seroprevalensi NDV pada itik pada Bulan Maret sampai Agustus 2012 di peternakan kedua kabupaten mencapai 45%, sedangkan pada kedua pasar mencapai 32,6%. Perbandingan seroprevalensi NDV pada itik di peternakan dan pasar unggas di kedua kabupaten tidak memiliki hubungan yang signifikan (r=0,522, P>0,05). Paramyxovirus yang terdeteksi adalah APMV-5 dan APMV-8, sedangkan Virus ND tidak ditemukan di kedua pasar unggas di kabupaten.
Kata Kunci: NDV, Itik, Seroprevalensi, RT-PCR, Paramyxovirus, Pasar Unggas
PENDAHULUAN
Wabah Newcastle Disease(ND) akibat virus familia paramyxoviridae dilaporkan pertama kali tahun 1926 di Indonesia dan Inggris. Sejak pertama kali dilaporkan sampai sekarang, ND sudah menyebar di seluruh dunia termasuk Indonesia (OIE, 2009). Virus strain velogenik pernah menjadi masalah yang besar di peternakan unggas di Benua Afrika dan Asia (Awan et al., 1994 dalam Ezema et al., 2008). Delapan serotipe Paramyxovirus lainnya telah diakui, yaitu APMV-2 sampai dengan APMV-9. Sebagian besar serotipe merupakan reservoir alami spesies burung liar, meskipun spesies inang lainnya biasanya rentan, tetapi hanya APMV-2 dan APMV-3 yang menyebabkan penyakit pernafasan dan penurunan produksi telur (Alexander, 2000). Serotipe lainnya, yaitu APMV-4, APMV-5, APMV-6, APMV-7, APMV-8, dan APMV-9 pada umumnya menyerang itik, angsa, merpati, betet, dan beberapa jenis unggas lainnya, akan tetapi tidak menimbulkan tanda klinis (Saepulloh, 2005). Berbagai tipe paramyxovirus selain APMV-1 belum pernah dipelajari di Indonesia.
Negara Amerika Serikat sekitar tahun 2002 sampai 2003 mengalami wabah ND yang membunuh lebih dari tiga juta ekor unggas dan menyebabkan kerugian ekonomi sekitar 5 miliar dolar Amerika (CFSPH, 2005). Sampai saat ini ND masih mewabah di beberapa negara, termasuk Indonesia. Pada Tahun 2010, terjadi wabah ND di Jepang pada bulan Februari (OIE, 2010a) diikuti oleh Peru pada bulan Juli (OIE, 2010b) dan Israel pada bulan Agustus (OIE, 2010c).
Newcastle Disease telah terbukti dapat menyerang lebih dari 200 jenis burung (OIE, 2009) sedangkan ayam merupakan hospes utamanya (Alexander, 1997 dalam Rout, 2007). Unggas lain yang juga sering dilaporkan terserang virus ini antara lain kalkun, itik, burung puyuh, burung Cormorant, dan merpati.
Penyebaran NDV pada itik terutama di negara Asia Tenggara sudah banyak diteliti. Penyebaran NDV sangat ditentukan oleh
kepadatan populasi itik. Populasi itik di Thailand dan Vietnam sangat tinggi hingga mencapai 33 dan 69 juta ekor. Penelitian sebelumnya yang dilakukan di Jepang dan Texas pada 1.324 ekor itik yang bermigrasi menunjukkan 5,5% itik terinfeksi NDV (Hanson et al., 2005).
Penyakit akibat virus ini masih merupakan masalah utama di berbagai peternakan di Indonesia (OIE, 2009). Tahun 2012 virus ND virulen telah terdeteksi di Bali. Newcastle Disease Virus juga dapat menginfeksi itik, walaupun itik lebih tahan terhadap NDV dibandingkan dengan unggas lainnya, tanda klinis yang teramati diantaranya tortikolis, tremor, dan inkordinasi (Capua dan Alexander, 2009). Sebuah studi seroepidemiologi NDV pada itik di Bali telah dilakukan pada tahun 2005 oleh Adi et al. (2005), bahwa itik bisa terinfeksi oleh NDV dan oleh karena itu, itik berpotensi sebagai reservoir NDV pada hewan rentan seperti ayam (Adi et al., 2005; Saepulloh, 2005).
Perkembangan prevalensi NDV pada itik masih perlu dipelajari. Umumnya, unggas air yang terinfeksi virus influenza A tidak menunjukkan gejala klinis. Sifat ekologi virus ND tampaknya mirip dengan infeksi AI. Itik juga diketahui sebagai reservoir berbagai virus influenza (Hewajuli et al., 2012). Unggas air liar terutama Anseriformes (itik, entok dan angsa) dan Charadriiformes (burung camar laut, burung laut, burung liar) merupakan reservoir alami virus influenza tipe A dan berperan penting dalam ekologi dan propagasi virus. Dari reservoir ini, virus influenza tipe A biasanya dapat ditularkan ke unggas lain, mamalia termasuk manusia dan dapat menyebabkan wabah penyakit yang sangat parah atau mematikan. Tanda klinis ND dan AI sangat mirip pada ayam dan kedua penyakit tersebut bersifat endemis di Indonesia (Hewajuli et al., 2012). Oleh karena itu perlu dilakukan penelitian tentang keberadaaan kedua virus tersebut.
Penelitian ini ditujukan untuk mengungkapkan perbandingan seroprevalensi NDV pada itik di pasar unggas (Beringkit dan Galiran) dengan peternakan itik disekitarnya
secara periodik dalam jangka waktu 6 bulan.
MATERI DAN METODE
Lokasi Sampling
Penelitian ini menggunakan model rancangan penelitian observasional
kuantitatif. Pengambilan sampel dilakukan di Pasar Unggas Beringkit Kabupaten Badung dan Pasar Unggas Galiran Kabupaten Kelungkun serta peternakan itik disekitar pasar unggas. Sampel diuji di laboratorium Biomedik dan Biologi Molekuler Hewan Fakultas Kedokteran Hewan Universitas Udayana. Pengumpulan sampel dilakukan setiap bulan selama 6 bulan, mulai bulan Maret tahun 2012 sampai dengan bulan Agustus tahun 2012.Pasar unggas dan lokasi peternakan tempat pengambilan spesimen ditentukan dengan menggunakan metode Purposive Selection. Pengambilan sampel spesimen darah dan swab kloaka dan trakea pada itik di peternakan dan pasar unggas menggunakan metode acak bertingkat (Stratified Random Sampling). Jumlah minimal sampel darah yang diambil di peternakan adalah 33 sampel per kabupaten. Sampel swab kloaka minimal yang diambil adalah sebanyak 75 sampel per kabupaten. Jumlah minimal sampel serum yang diambil adalah sebanyak 33 sampel per pasar unggas. Sedangkan untuk sampel swab minimal yang diambil adalah 75 sampel per pasar unggas.
Pengambilan Serum Darah dan Swab
Sebanyak 1-2 ml darah itik diambil melalui vena brachialis menggunakan spuite 3 ml. Spuite yang telah berisi darah unggas diletakkan dalam posisi horizontal agar serum dapat terpisah dari plasma dengan sempurna. Serum yang telah terpisah kemudian ditempatkan pada tabung mikro 1,5 ml,disimpan dalam suhu 2-8 derajat celcius sampai dipergunakan.Swab kloaka diambil dari itik dengan menggunakan cotton bud kemudian dimasukan ke dalam tabung mikro yang telah berisi transport medium. Tabung kemudian diletakan di dalam cool bag untuk dibawa ke Laboratorium Biomedik.
Propagasi NDV
Masing-masing sampel swab kloaka disentifuse selama 5 menit dengan kecepatan 5000 rcf, kemudian dilakukan penggabungan sampel (pooling) yang diseuaikan dengan spesies dan asal unggas. Sampel yang telah dipooling selanjutnya ditambahkan antibiotik (penicilin dan streptomicin) sebanyak 150 µl dengan konsentrasi akhir 2500 µl. Dengan menggunakan spuit 1 ml, sebanyak 0,2 ml sampel disuntikan ke dalam ruang alantois telur ayam bertunas (TAB). Telur ayam bertunas dipantau setiap hari, jika ada TAB yang mati dilakukan pemanenan cairan alantois. Namun jika embrio masih hidup maka telur dipanen 3 hari pasca inokulasi.
Uji Hemaglutinasi
Sebanyak 25 µl NaCl 0,9% dimasukkan ke dalam sumuran plate berbentuk U, kemudian ditambahkan antigen NDV yang berasal dari caitan alantois. Suspensi sel darah merah (SDM) konsentrasi 0,5% ditambahkan ke dalam lubang sebanyak 50 µl. Mikroplate diayak selama 30 detik lalu diinkubasikan selama 30 menit pada suhu kamar. Pembacaan dilakukan setelah sel darah merah kontrol mengendap.
Uji Hambatan Hemaglutinasi
Uji Hambatan Hemaglutinasi (HI) dilakukan dengan cara mengisi 0,025 ml NaCl 0,9% ke dalam sumuran plate mikro dengan bentuk U mulai dari sumuran pertama sampai sumuran ke-12. Sumuran pertama kemudian ditambahkan serum unggas yang telah diencerkan 10X sebanyak 0,025 µl lalu dilakukan pengenceran bertingkat dengan mengambil 0,025 cairan pada sumuran pertama dan ditambahkan pada sumuran ke-2 demikian seterusnya sampai sumuran ke-11. Sebanyak 25 µl Antigen ND 4 HA ditambahkan dari sumuran pertama sampai sumuran ke-11. Mikroplate kemudian diayak selama 30 detik lalu diinkubasikan pada suhu kamar selama 30 menit. Suspensi SDM konsentrasi 0,5% ditambahkan ke semua sumuran sebanyak 50 µl. Mikroplate kembali diayak dan diinkubasikan selama 30 menit.
Pembacaan dilakukan setelah sel darah merah kontrol mengendap.
Isolasi RNA Virus
Sebanyak 250 µl cairan swab kloaka ditambahkan dengan 750 µl Trizol LS Reagen (invitrogen). Campuran divortek selama 1 menit kemudian diinkubasikan dalam suhu kamar selama 5 menit, kemudian ditambahkan dengan 200 µl kloroform, lalu divortek selama 15 detik. Setelah itu campuran disentrifuse dengan kecepatan 12000 rcf selama 15 menit sampai terbentuk aquaeus. Aquaeus dipindahkan ke tabung mikro 1,5 ml yang steril dan ditambah dengan 500 µl isopropil alkohol. Larutan diinkubasi dalam suhu kamar selama 10 menit, kemudian disentrifuse dengan kecepatan 12000 rcf selama 10 menit. Supernatan yang terbentuk dibuang kemudian ditambahkan 1000 µl alkohol 70%. Suspensi kemudian disentrifuse dengan kecepatan 7500 rcf selama 5 menit. Supernatan dibuang dan dilakukan air dry. Setelah cairan dalam tabung agak mengering tambahkan 20 µl aquabidest steril, kemudian disimpan dalam freezer sampai digunakan.
RT-PCR RNA Virus
Uji Reverse Transcriptase-Polymerase Chain Reaction (RT-PCR) dilakukan dengan mencampurkan 5 µl Rmix (Invitrogen) (mengandung 0,2 mM dNTP, 1,6 mM MgSO4, dan buffer), sepasang primer dengan volume masing-masing primer 0,6 µl (10mM), 0,25 µl enzim SuperScriptTMIII
One-Step RT-PCR System with Platinum® Taq DNA Polymerase (Invitrogen), 1 µl RNA cetakan, dan aquabidest sampai volume menjadi 10 µl ke dalam tabung PCR. Campuran tadi kemudian dimasukan ke dalam mesin Termocycler yang telah diprogram dengan kondisi 1) 50°C selama 1 jam, 2) 95°C selama 7 menit, 3) 94°C selama 45 detik, 4) 55°C selama 45 detik, 5) 72°C selama 1 menit, siklus kemudian diulang dari tahapan ke-3 sampai tahapan ke-5 sebanyak 39 kali, 6) 72°C selama 5 menit, dan 7) 22°C selama-lamanya.
Untuk mengetahui hasil uji RT-PCR maka dilakukan elektroforesis. Sebelum dilakukan elektroforesis maka terlebih dahulu dibuat media elektroforesis berupa gel agarose 1% (caranya dengan melarutkan 1 gram agarose dengan 100 ml 1X Tris Acid Edta (TAE)). Larutan kemudian dipanaskan sampai mendidih dan berwarna bening. 3 µl etidium bromide ditambahkan ke dalam larutan. Larutan kemudian dicetak pada cetakan agar. Setelah mengeras gel agarose diletakkan ke dalam mesin elektroforesis yang telah mengandung 1X TAE. Produk hasil RT-PCR sebanyak 4 µl ditambahkan dengan 1 µl 10X BluejuiceTM Gel Loading Buffer (Invitrogen) (mengandung Bromphenol-blue dan Cyline Cyanol). Lubang pertama pada gel agarose dimasukan 100 bp DNA ladder (Invitrogen) yang berfungsi sebagai marker untuk menentukan panjang basa, lubang selanjutnya dimasukan DNA produk RT-PCR. Mesin elektroforesis kemudian diberi tegangan 100 V selama 30 menit. Visualisasi DNA dilakukan dengan meletakkan gel agarose diatas UV Transluminator, kemudian didokumentasikan menggunakan kamera digital.
Analisis Data
Perbandingan prevalensi NDV pada itik antara peternakan dan pasar unggas dianalisis menggunakan uji statistik Non-Parametrik Chi square. Data seroprevalensi NDV pada itik pada peternakan dibandingkan dengan data di pasar Bringkit dan Pasar Galiran dibuat per bulan.
HASIL DAN PEMBAHASAN
Hasil
Hasil penghitungan seroprevalensi NDV pada itik di peternakan dan pasar Galiran di Kabupaten Klungkung serta di peternakan dan pasar Beringkit di Kabupaten Badung ditampilkan pada Tabel 1. Seroprevalensi NDV pada itik di peternakan dan pasar di kedua kabupaten pada bulan maret sampai agustus 2012 bervariasi antara 2,9% - 77,1%. Seroprevalensi NDV pada itik di peternakan
di kedua kabupaten pada bulan Maret, April, dan Mei terjadi penurunan sebesar 62,8%, 38,6%, dan 32,8%. Bulan Juni, Juli dan Agustus terjadi peningkatan seroprevalensi menjadi 24,3%, 54,3% dan 57,2%. Seroprevalensi NDV yang tinggi juga terjadi di kedua pasar unggas (Beringkit dan Galiran). Penurunan seroprevalensi terjadi pada bulan Juni sebesar 21,4%, peningkatan seroprevalensi terjadi lagi pada bulan Juli dan Agustus sebesar 28,5%, dan 38,6%.
Hasil uji statistik Non-Parametrik Chisquare seroprevalensi NDV pada itik antara peternakan di Kabupaten Klungkung dan Badung serta antara Pasar Galiran dan Beringkit disajikan pada Tabel 2. Analisis statistik menunjukkan bahwa perbedaan seroprevalensi infeksi NDV pada itik di peternakan di Kabupaten Klungkung dan Badung tidak berbeda nyata (P>0,05) kecuali pada bulan Juni, Juli, Agustus.
Tabel 1.Seroprevalensi NDV pada Itik di Peternakan dan Pasar Unggas di Bali menggunakan uji HI
|
Lokasi |
Bulan |
Total | |||||
|
Mar |
Apr |
Mei |
Jun |
Jul |
Agu | ||
|
Jumlah sampel |
35 |
35 |
35 |
35 |
35 |
35 |
210 |
|
KLK Sampel positif |
22 |
12 |
10 |
1 |
27 |
24 |
96 |
|
Seroprevalensi (%) |
62,9 |
34,3 |
28,6 |
2,9 |
77,1 |
68,6 |
45,7 |
|
Jumlah sampel |
35 |
35 |
35 |
35 |
35 |
35 |
210 |
|
T BDG Sampel positif |
22 |
15 |
13 |
16 |
11 |
16 |
93 |
|
Seroprevalensi (%) |
62,9 |
42,9 |
37,1 |
45,7 |
31,4 |
45,7 |
44,3 |
|
Jumlah sampel Total |
70 |
70 |
70 |
70 |
70 |
70 |
420 |
|
Sampel positif |
44 |
27 |
23 |
17 |
38 |
40 |
189 |
|
Seroprevalensi (%) |
62,8 |
38,6 |
32,8 |
24,3 |
54,3 |
57,2 |
45 |
|
Jumlah sampel |
35 |
35 |
35 |
35 |
35 |
35 |
210 |
|
GLR Sampel positif |
12 |
12 |
13 |
8 |
10 |
15 |
70 |
|
Seroprevalensi (%) |
34,3 |
34,3 |
37,1 |
22,9 |
28,6 |
42,9 |
33,3 |
|
Jumlah sampel |
35 |
35 |
35 |
35 |
35 |
35 |
210 |
|
BRK Sampel positif |
14 |
10 |
14 |
7 |
10 |
12 |
67 |
|
Seroprevalensi (%) |
40 |
28,6 |
40 |
20 |
28,6 |
34,3 |
31,9 |
|
Jumlah sampel |
70 |
70 |
70 |
70 |
70 |
70 |
420 |
|
Total Sampel positif |
26 |
22 |
27 |
15 |
20 |
27 |
137 |
|
Seroprevalensi (%) |
37,1 |
31,4 |
38,6 |
21,4 |
28,5 |
38,6 |
32,6 |
T lahan peternakan, U pasar unggas, KLK Kelungkung, BDG Badung, GLR pasar unggas Galiran, BRK pasar unggas Beringkit
Pada Bulan Juni, Juli, Agustus perbandingan seroprevalensi NDV pada itik antara peternakan di Kabupaten Klungkung dan Badung berbeda nyata (P<0,05), kecuali pada bulan Maret, April, Mei menunjukkan perbandingan prevalensi tidak berbeda nyata (P>0,05). Perbandingan seroprevalensi NDV di Pasar Galiran dan Beringkit tidak berbeda nyata (P>0,05).
Dari total 96 gabungan sampel (pool) pada peternakan dan pasar, aktivitas antigen ND (Uji HA) dapat dideteksi pada 5 pool asal peternakan dan 15 pool asal pasar (Tabel 3).
Hasil RT-PCR NDV terhadap 20 pool positif HA, didapatkan 11 pool dengan hasil band yang tipis yang dianggap kurang spesifik untuk mendiagnosa bahwa itu adalah ND, sementara 9 lainnya negatif (Gambar 1).
Untuk itu, keseluruhan 11 pool tersebut kemudian di re-pool kembali menjadi 1 untuk dilakukan pengujian ulang untuk ND dan berbagai varian serotipe APMV. Hasil pengujian ulang menunjukkan ND nagetif, tetapi hasil positif pada APMV-5 dan APMV-8. Hasil negatif ditemukan pada APMV-2, APMV-3, APMV-4, APMV-6, APMV-7 dan APMV-9 (Gambar 2).
Tabel 2. Hasil Satistik Perbandingan
Seroprevalensi infeksi NDV pada Itik di Peternakan dan Pasar Beringkit dan Galiran di Bali
|
Lokasi |
Bulan | |||||
|
Mar |
Apr |
Mei |
Jun |
Ju |
Ag | |
|
KLK x |
1 |
0,46 |
0,45 |
0 |
0 |
0,05 |
|
BDG |
ns |
ns |
ns |
s |
s |
ns |
|
GLR x |
0,62 |
0,61 |
0,81 |
0,77 |
1 |
0,46 |
|
BRK |
ns |
ns |
ns |
ns |
ns |
ns |
ns tidak berbeda nyata (P≥0,05), s berbeda nyata (P<0,05)
Tabel 3. Uji HA 96 Isolat (Pool) Itik dari
Peternakan dan Pasar Unggas di Bali
|
Kabupaten |
Lokasi |
Jumlah |
HA (+) | |
|
Sampel |
Pool | |||
|
Badung |
Peternakan |
450 |
48 |
5 |
|
Pasar |
450 |
48 | ||
|
unggas | ||||
|
Klungkung |
Peternakan |
450 |
48 |
15 |
|
Pasar |
450 |
48 | ||
|
unggas | ||||
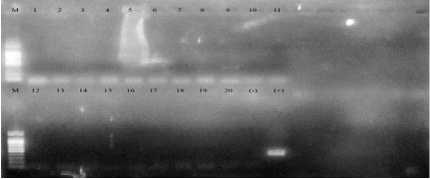
Gambar 1. Visualisasi pada agarose gel terhadap RT-PCR NDV pada itik di Peternakan dan Pasar Unggas di Bali. M marker 100bp DNA ladder; 1-20 isolat (pool); (-): kontrol negatif; (+): kontrol positif. Elekroforesis gel agarose 1,5%.
Pembahasan
Studi seroepidemiologi NDV pada itik yang dilakukan di Bali dengan menggunakan uji ELISA dan teknik Western Immunoblotting menunjukkan bahwa itik di
Bali sudah terbukti terinfeksi NDV. Seroprevalensi NDV pada unggas air termasuk itik di Bali mencapai angka (91,6%) (Adi et al., 2005).Virus ND terdapat di berbagai tempat, seperti peternakan dan pasar unggas. Populasi yang padat pada peternakan dan pasar unggas sangat memungkinkan penyebaran virus ini menjadi sangat cepat. Unggas yang dipelihara secara berkoloni pada tempat tersebut memudahkan penyebaran NDV. Unggas pada peternakan juga sering memiliki genetik yang seragam, sehingga dapat memperkuat penyebaran virus diantara unggas tersebut.
M APMV APMV APMV APMV APMV APMV APMV APMV 2345678 9
I
Gambar 2. RT-PCR APMV 2- APMV 9 pada itik di Peternakan dan Pasar Unggas di Bali. M marker 100bp DNA ladder; 2-9 isolat APMV. Elektroforesis gel agarose 1,5%.
Penyebaran virus yang lebih cepat mungkin saja terjadi di pasar unggas. Penjualan unggas dari berbagai daerah ke pasar unggas yang ada di daerah lainnya memungkinkan penyebaran virus ini sangat cepat. Berbagai spesies unggas juga sering ditempatkan dalam satu tempat, sehingga mempermudah penularan virus ini pada unggas lainnya.Perubahan musim juga diduga bisa menyebabkan peningkatan penyebaran dan perkembangan virus ND.Hasil penelitian menunjkkan bahwa pengambilan sampel yang dilakukan pada musim peralihan dari musim hujan ke musim kemarau) cenderung meningkatkanseroprevalensi. Hal ini mungkin berkaitan dengan peningkatan temperatur lingkungan yang membuat unggas mengalami stres sehingga respon kekebalan terhadap virus menurun (Beard et al., 1987).
Seperti yang telah diketahui, APMV-5 dan APMV-8 memiliki induk semang yang sama, yaitu itik dan angsa, sedangkan gejala
klinis yang ditimbulkan belum diketahui atau tanpa gejala klinis. Sedangkan untuk APMV-2, APMV-3, APMV-4, APMV-6, APMV-7, AMPV-9 memiliki induk semang yang berbeda, diantaranya ayam, kalkun, betet, angsa, merpati, dan kalkun. Dengan gejala klinis yang timbul dari infeksi saluran pernafasan, produksi telur menurun, sampai tidak menimbulkan gejala klinis. Penelitian tentang APMV-5 dan APMV-8 belum terlalu banyak dilakukan, beberapa penelitian tentang APMV-5 dan APMV-8 hanya dilakukan sebatas menentukan gen dari virus tersebut.
Penelitian lain menyebutkan bahwa pernah mengidentifikasi NDV dari itik putih dan menentukan genotipe dari virus ND tersebut (Xie et al., 2013). Identifikasi terhadap APMV-6 juga pernah dilakukan, sampel diambil dari migrasi unggas liar (Bui et al., 2014). Penelitian lain juga menyebutkan APMV-4 telah teridentifikasi pada itik di Delaware, Amerika Utara (Parthiban et al., 2013). Sebagian besar Paramyxovirus yang diisolasi dari unggas diklasifikasikan dalam genus Avulavirus dari subfamili Paramyxoviridae, klasifikasi yang didasarkan pada testHaemaglutinin Inhibition (HI) danNeuraminidase Inhibition (NI) (Alexander, 2003). APMV-1 (ND) merupakan satu-satunya serotipe yang menyebabkan morbiditas, mortalitas dan kerugian ekonomi yang sangat tinggi karena penyakit ini sangat virulen. APMV-2 dan APMV-3 juga telah dilaporkan menyebabkan penyakit yang sangat signifikan pada unggas (Alexander, 1982; Beck, 2003), sedangkan patogenisitas APMV-4 sampai APMV-9 umumnya tidak diketahui (Alexander, 1982). Infeksi dari APMV-4, APMV-8 dan APMV-9 tampaknya terbatas pada bebek dan angsa, sementara infeksi APMV-6 dan APMV-7 pada kalkun menyebabkan turunnya produksi telur dan menginduksi penyakit pernafasan (Alexander, 1982). Pengetahuan tentang APMV berkembang dengan ketersediaan urutan genom lengkap dengan prototipe dari semua serotipe APMV (Krishnamurty, 1998).
APMV-5 belum dikenali dengan baik, tetapi tampaknya berbeda dari semua serotipe APMV lainnya dalam ketidakmampuan untuk
tumbuh dalam rongga allantois dari telur ayam berembrio dan kegagalan untuk menyebabkan hemaglutinasi (Nerome, 1978). Pemahaman tentang karakteristik biologi dan molekuler dari APMV-5 sangat penting untuk mencirikan urutan dan hubungan antigenik diantara serotipe APMV lainnya dan untuk mengembangkan vaksin dan reagen diagnostik terhadap virus ini. Virus ini tidak menyebabkan kematian embrio ayam dalam waktu kematian rata-rata bahkan setelah infeksi 168 jam. Indeks patogenisitas intraserebral (ICPI) pada DOC dan ayam dewasa untuk APMV-5 galur Kunitachi adalah nol, menunjukkan virus tidak patogen bagi ayam (Nerome,1978).
APMV diisolasi dari berbagai spesies burung dan dikelompokkan ke dalam sembilan tipe didasarkan pada tes antigen yang melibatkan protein HN. Sampai saat ini, tidak terlalu banyak tersedia tentang rician molekul APMV lainnya kecuali APMV-1 (NDV). Namun, analisis terakhir urutan prototipe APMV-2, APMV-3, APMV-4, APMV-6, APMV-7, APMV-8, dan APMV-9 telah mengungkapkan banyak rincian molekul dari APMV-5 (Subbiah, 2008). Sebagai langkah pertama menuju karakterisasi molekul APMV-5, pertumbuhan dan urutan genom legkap dari APMV-5 galur Kunitachi telah dikarakterisasi. APMV-5 tumbuh di banyak baris sel dari spesies yang berbeda, dan menariknya pula APMV-5 mampu tumbuh di rongga alantois dan rongga amnion dari telur ayam berembrio (Nerome, 1978; Mustaffa et al., 1974).
APMV-8 tumbuh dalam rongga alantois dari telur ayam berembrio setelah 3 hari diinokulasi. Namun, patogenisitas APMV-8 perlu dievaluasi secara langsung pada ayam serta ditentukan untuk spesies unggas lainnya. Panjang nukleotida genom dari APMV-8 adalah 15.342 nukleotida. Panjang nukleotida dari genom APMV-8 merupakan anggota genera Respirovirus, Rubulavirus, Morbillavirus, dan Avulavirus (Wang et al., 2000; Jack et al.,2005) . APMV-8 strain Delaware dan Wakuya memiliki identitas nukleotida 96,8%. Dua strain tersebut juga mempunyai tingkat identitas asam amino
yang sama seperti N, P, M, F, HN dan protein L. Protein F Paramyxovirus disintesis sebagai prekursor tidak aktif yang dibelah oleh protease kedalam bentuk aktif yang terdiri dari disulfida-linked F1-F2 (Lamb dan Park, 2007). Tempat pembelahan protein F merupakan penentu utama patogenisitas NDV pada ayam. Tempat pembelahan dari APMV-8 protein F diduga memiliki residu dasar dan residu L pada F1 dan membutuhkan protease eksogen untuk pertumbuhan dalam kultur sel. Hal ini mirip dengan pembelahan protein F dari APMV-1 avirulen yang terlepas dari asam amino dasar dengan memerlukan protease eksogen untuk pertumbuhan virus dalam kultur sel (Lamb dan Park, 2007; Kumar et al., 2008)
Analisis filogenetik dari APMV-8 dengan anggota keluarga Paramyxoviridae menunjukkan bahwa APMV-8 lebih erat dengan APMV lain daripada dengan genus lainnya. APMV-8 menunjukkan hubungan evolusi yang erat dengan APMV-2 dan APMV-6. Analisis tambahan strain APMV-8 akan diperlukan untuk memahami sepenuhnya variasi genetik serotipe APMV-8. Penelitian selanjutnya tentang epidemiologi dan patogenistas virus ini pada spesies burung yang berbeda akan sangat bermanfaat untuk memahami peran virus ini dalam populasi burung.
Pengendalian NDV maupun serotype lainnya dapat dilakukan dengan berbagai cara. Pemisahan unggas dari jenis lainnya merupakan cara termudah dalam mencegah penularan NDV. Disenfeksi yang rutin harus dilakukan di kandang unggas maupun di sekitar pasar unggas. Vaksinanasi dan surveilance secara terus menerus juga harus dilakukan di peternakan dan pasar unggas.Surveilance yang berkelanjutan cukup dilakukan di pasar unggas saja, karena itik dari pasar unggas berasal dari peternakan. Tindakan pengendalian lainnya adalah dengan stamping out pada peternakan yang sudah tertular penyakit NDV, unggas yang mati dapat dibakar atau dikubur, sedangkan unggas yang sakit harus dimusnahkan (Saepulloh, 2005).
SIMPULAN
Seroprevalensi NDV pada itik di peternakan dan pasar Galiran dan Beringkit tidak berbeda. Paramyxovirus yang terdeteksi di peternakan dan pasar Galiran dan Beringkit adalah virus APMV-5 dan APMV-8.
UCAPAN TERIMAKASIH
Penulis mengucapkan terimakasih kepada pihak-pihak yang telah membantu dalam proses penelitian di Laboratorium Biomedik dan Biologi Molekuler Fakultas Kedokteran Hewan Universitas Udayana.
DAFTAR PUSTAKA
Adi AA Ayu Mirah, Winaya IBO, Kardena IM, Suardana IW, Suarsana IN, Utama IH, Astawa NM, Erawan IGMK, Apsari IAP, Hayashi Y, Matsumoto Y. 2005. Deteksi Antibodi Newcastle Disease Pada Itik di Bali Menggunakan Metode ELISA Dan Western Blotting. Jurnal Veteriner Vol. 8 (1).
Alexander DJ. 1982. Avian Paramyxoviruses other than Newcastle Disease Virus. World’s poul Sci. J. 38: 97-104.
Alexander DJ. 2000. Newcastle disease and other avian paramyxoviruses. Rev. sci. tech. Int. Off. Epiz. 19 (2): 443-462.
Alexander DJ. 2003. Avian Paramyxoviruses 2-9. University Press. Pp. 88-92.
Beard CW, Mitchell BW. 1987. Infuence of Enviromental Temperature on The Serologic Response of Broiler Chickens to Inactived and Viable Newcastle Disease Vaccines. American Association of Avian Pathologist. Inc, Avian Disease Vol. 31, No. 2.
Beck I, Gerlach H, Burkhardt E, Kaleta EF. 2003. Investigation of Several Selected Adjuvants Regarding their Efficacy and Side Effect for the Production of a Vaccine for Parakeets to Prevent a Disease Caused by a Paramyxoviruses Type 3. Vaccine 21: 10061022.
Bui VN, Mizutani T, Nguyen TH. 2014. Characterization of a Genetic Variant of Avian Paramyxoviruses 6 Isolated From a Migratory Wild Bird. Arch Virol. 159(11):
3101-5.
Capua I, dan Alexander DJ. 2009. Avian Influenza and Newcastle Disease A Field and Laboratory Manual. Spinger-Verlag. Italia.
Ezema WS, Okoye JOA, and Nwanta JA. 2008. Lasota Vaccination may not protect agains
The Lesions of Velogenic Newcastle Disease in Chickens. Trop Anim Health Prod.
Hanson, Britta A. David E. Swayne, Dennis A. Senne, David S. Lobpries, Hurst J,.
Stallknecht DE. 2005. Avian Influenza
Viruses and Paramyxoviruses in Wintering and Resident Ducks in Texas.
Hewajuli DA, Dharmayanti NLPI. 2012. Hubungan AI dan Unggas Air Dalam Menciptakan Keragaman Genetik Serta Peran Unggas Air Sebagai Reservoir Pada Penyebaran AI.
Jack PJ, Boyle DB, Eaton BT, Wang LF. 2005. The Complete Genom Sequence of J Virus Reveals a Unique Genom Structure in the Family Paramyxoviridae. J Virol 79: 1069010700.
Krishnamurthy S, Samal SK. 1998. Nucleotide sequences of the trailer, nucleocapsid protein gene and intergenic regions of Newcastle disease virus strain Beaudette C and completion of the entire genome sequence. Journal of General Virology, 79: 2419-2424.
Kumar S, Nayak B, Collins PL, Samal SK. 2008. Complete Genom Sequence of Avian Paramyxoviruses type 3 reveals an unsually long trailer region. Virus Res 137: 189-197.
Lamb RA, Park G. 2007. The Viruses Paramyxoviridae and Their Replication.
Mustaffa-Babjee A, Spradbrow PB, Samuel JL. 1974. A Pathogenic Paramyxoviruses from Budgerigars. Avian Dis 18: 226-230.
Nerome K, Nakayama M, Ishida M, Fukumi H. 1978. Isolation of a New Avian Paramyxoviruses from Budgerigars
(Melopsittacus Undulatus). J Gen Virol 38: 293-301
OIE. 2009. Newcastle Disease Chapter. 2. 3.14. OIE Terrestrial Manual 2009.
OIE. 2010a. Immediate notification report, ref OIE: 9475.
OIE. 2010b. Immediate notification report, ref
OIE:9538.
OIE. 2010c. Immediate notification report, ref
OIE:8870.
Parthiban M, Xiao S, Paldural A. 2013. Complete Genom Sequence of an Avian Paramyxoviruses Type 4 From North America Reveals a Shorter Genome and New Genotype. Genom Announc: 1(1).
Rout SN. 2007. The Role Of Newcastle Disease Virus Internal Proteins In Pathogenesis. Disertasi. University of Maryland.
Saepulloh MD. 2005. Kajian Newcastle Disease Pada Itik dan Upaya Pengendaliannya. Balai Penelitian Veteriner, Bogor.
Subbiah M, Xiao S, Collins PL, Samal SK. 2008. Complete Sequence of thr genom of Avian Paramyxoviruses Type 2 Strain Yucaipa and Comparassion with other Paramyxoviruses. Virus Res 137: 40-48.
Wang LF, Yu M, Hansson E, Pritchard L, Shiell B, Michalski WP, Eaton BT. 2000. The exceptionally large genom the family Paramyxoviridae. J Virol 74: 9972-9979.
Xie Z, Xie L, Liu J, Pang Y, Fan Q, Luo S. 2013. Identification of a Genotype IX Newcastle Disease Virus in a Guangxi White Duck. Genome Announce:1(1).
63
Discussion and feedback