Crude Antigen Cystisercus Taenia Saginata Isolat Bali untuk Deteksi Sistiserkosis pada Sapi
on
Jurnal Ilmu dan Kesehatan Hewan, Pebruari 2014
Vol 2 No 1: 13-21
Crude Antigen Cystisercus Taenia Saginata Isolat Bali untuk Deteksi Sistiserkosis pada Sapi
Crude Antigen of Taenia saginata Cysticercus Bali Isolate for Detection of Bovine Cysticercosis
Hertati Anriani Lubis1, I Made Damriyasa1,2, Nyoman Sadra Dharmawan1,2* 1Centre for Studies on Animal Diseases (CSAD) FKH Unud Kampus Bukit Jimbaran 2Laboratorium Patologi Klinik Veteriner FKH Unud Jl. PB. Sudirman Denpasar *Corresponding author Email: nsdharmawan@gmail.com
ABSTRACT
The purpose of this study was to evaluate Taenia saginata cystisercus antigen for the detection of bovine cysticercosis. Taenia saginata cysticercus antigen was derived from local isolates, obtained from the experimental infection of Taenia saginata tape worms from Bali. The research was done by ELISA (Enzyme Linked Immunosorbent Assay) optimized by determining the optimal concentration of antigen, the optimal dilutions of serum and the optimal dilutions of conjugate. The results showed that Taenia saginata cysticercus crude antigen (Bali isolate) are antigenic and can be used to detect cattle cysticercosis. Optimal concentration of antigen: 2 ug/ml, optimal dilutions of serum: 1:80 and optimal dilution of conjugate: 1:4000.
Key words: Taenia saginata cysticercus, Antigen, ELISA.
ABSTRAK
Telah dilakukan penelitian dengan tujuan mengevaluasi antigen Cysticercus T. saginata untuk deteksi sistisekosis pada sapi. Antigen Cysticercus T. saginata yang digunakan adalah isolat lokal yang diperoleh dari hasil infeksi eksperimental Taenia saginata asal Bali. Penelitian dilakukan dengan optimalisasi ELISA (Enzyme Linked Immunosorbent Assay) terhadap antigen dengan cara penentuan konsentrasi optimal antigen, pengenceran serum serta pengenceran konjugat. Hasil penelitian menunjukkan bahwa Cysticercus T. saginata isolat Bali bersifat antigenik dan dapat digunakan untuk mendeteksi sistiserkosis pada sapi, dengan konsentrasi optimal antigen 2 µg/ml, pengenceran optimal serum 1:80 dan pengenceran konjugat 1:4000.
Kata kunci: Cysticercus T. saginata, Antigen, ELISA.
PENDAHULUAN akan terinfeksi sistiserkosis bila menelan
telur atau proglotid T. saginata yang Cystisercus T. saginata merupakan dikeluarkan manusia lewat feses. Manusia
bentuk larva cacing pita T. saginata. Sapi terinfeksi taeniasis bila mengonsumsi
daging sapi yang tidak dimasak atau di masak kurang matang yang mengandung Cysticercus T. Saginata. Kejadian sistiserkosis pada sapi kebanyakan diperoleh dari laporan pemeriksaan kesehatan daging yang biasanya tidak seluruh negara melakukannya (Dharmawan, 2009). Prevalensi taeniasis pada manusia di Kabupaten Gianyar Bali mencapai 27,5% (Wandra et al., 2006; 2007; 2011).
Upaya penanggulangan sistiserkosis dan taeniasis sebenarnya tidak sulit, salah satunya dengan memutus siklus hidup parasit dengan menekan sumber infeksinya pada sapi. Permasalahannya sampai sekarang data tentang kejadian sistiserkosis pada sapi di Bali tidak ada atau belum pernah dilaporkan. Akhir-akhir ini, uji diagnostik serologi yang banyak dikembangkan untuk dipakai mendeteksi keberadaan sistiserkosis pada hewan adalah enzyme linked immunosorbent assay (ELISA). Uji tersebut ternyata memberi kemudahan dalam penggunaan reagen dan prosedur pengerjaannya (Iskandar et al., 2005).
Pengembangan ELISA untuk mendeteksi keberadaan Cysticercus T. solium melalui pemeriksaan antibodi antiCysticercus T. solium pada serum telah berhasil dilakukan Sato dan kerabat kerjanya pada 1997-1998 (Sato et al.,
2003). Harrison et. al. (2005) melaporkan metode ELISA dinilai paling cocok untuk dipakai menetapkan sebaran infeksi Cysticercus T. saginata dalam suatu wilayah dengan wabah infeksi tinggi. Sementara itu, Dorny et.al. (2002) melaporkan bahwa sensitifitas dan spesifisitas uji ini adalah 64,5% dan 91,2%. Dengan demikian, ELISA dapat dinyatakan sebagai uji dengan tingkat sensitifitas dan spesifisitas yang baik.
Penelitian ini dilakukan dengan tujuan untuk pengembangan teknik diagnostik sistiserkosis pada sapi bali menggunakan metode ELISA. Pada tahap awal akan dicari berapa konsentrasi optimal antigen yang berasal dari protein Cysticercus T. saginata isolat lokal Bali. Di samping itu, akan ditelusuri pula berapa pengenceran optimal serum dan konjugat yang efektif untuk digunakan mendeteksi keberadaan Cysticercus T. saginata pada sapi terinfeksi.
METODE PENELITIAN
Ekstraksi Protein
Antigen diperoleh dengan cara ekstraksi protein Cystisercus T. saginata. Ekstraksi dilakukan dengan cara menghomogenkan kista. Selanjutnya homogenat disentrifus dengan kecepatan 1500 RPM selama 15 menit. Supernatan
diambil dan ditampung dalam satu tabung 10 ml kemudian ditambahkan penicilin 10.000 IU dan streptomisin 10.000µg/ml. Konsentrasi protein dihitung dengan menggunakan kit invitrogen, diperoleh hasil 113µg/ml. Protein antigen Cystisercus T. saginata ini disimpan pada suhu -20o C sampai akan digunakan.
Optimalisasi ELISA
Optimalisasi ELISA dilakukan dengan tujuan untuk mengetahui konsentrasi optimal antigen, pengenceran optimal serum dan pengenceran optimal konjugat. Optimalisasi ELISA meliputi titrasi protein, titrasi serum kontrol positif dan negatif serta titrasi konjugat.
Titrasi Protein
Larutan yang digunakan adalah 0.1 M karbonat pH 9.6. Titrasi protein dilakukan mulai dari konsentrasi 50 µg/ml diencerkan sampai 0.1 µg/ml dimasukkan ke dalam plate ELISA. Kemudian diinkubasi pada suhu 4o C selama 15 jam. Selanjutnya dilakukan uji ELISA sehingga diperoleh konsentrasi antigen yang optimal.
Titrasi Serum
Serum positif dan serum negatif diencerkan dengan PBS-Tween 20 dimulai dari pengenceran 1:10 sampai
1:100 pada plate ELISA. Selanjutnya dilakukan inkubasi selama 1 jam pada suhu 37o C. Proses uji ELISA dilanjutkan sampai diperoleh pengenceran serum yang optimal.
Titrasi Konjugat
Titrasi konjugat dilakukan pada uji ELISA menggunakan konsentrasi antigen dan pengenceran serum yang diperoleh sebelumnya. Titrasi konjugat dimulai dari pengenceran 1:3000 sampai 1:5000. Selanjutnya dilakukan inkubasi selama 1 jam pada suhu 37oC. Proses uji ELISA dilanjutkan sampai diperoleh pengenceran konjugat yang optimal.
Pemeriksaan ELISA
Sembilan puluh enam well polystyrene ELISA plate dilapisi dengan crude antigen, kemudian diinkubasi selama 15 jam pada suhu 4oC. Setelah inkubasi dicuci dengan ELISA washer. Sampel serum diencerkan dengan PBS-0,5 Tween, ditambahkan pada plate dan diinkubasi selama 1 jam pada temperatur kamar. Setelah inkubasi, plate dicuci lagi sebanyak 3 kali dengan PBS-0,5 Tween. Selanjutnya ditambahkan konjugat, diinkubasikan lagi selama 1 jam pada suhu 37oC. Setelah dilakukan pencucian 3 kali dengan PBS-0,5 Tween, dilakukan penambahan substrat. Optical density
(OD) kemudian dibaca menggunakan ELISA-reader pada 405 nm.
HASIL DAN PEMBAHASAN
Hasil optimalisasi ELISA pada penelitian ini dinyatakan dalam bentuk konsentrasi optimal antigen, pengenceran optimal serum dan pengenceran optimal konjugat. Untuk menentukan konsentrasi dan pengenceran optimal ketiga parameter tersebut telah dilakukan penghuitungan titrasi menggunakan uji ELISA.
Titrasi Antigen
Titrasi dimaksudkan untuk
menentukan konsentrasi antigen yang optimal, dilakukan dengan pelapisan antigen. Antigen yang digunakan berasal dari crude antigen Cystisercus T. saginata isolat Bali. Konsentrasi terakhir untuk optimalisasi dibuat dalam empat tingkatan yaitu 1 µg/ml, 2 µg/ml, 3 µg/ml, dan 4 µg/ml. Serum kontrol positif diperoleh dari serum sapi yang terinfeksi Cystisercus T. saginata secara buatan (Dharmawan et al., 2012). Serum kontrol negatif diperoleh dari pedet yang dipotong di RPH Pesanggaran. Hasil optical density (OD) antigen dengan uji ELISA pada penelitian ini dapat dilihat pada Gambar 1. Dari hasil tersebut diketahui bahwa antigen optimal ada pada konsentrasi 2 µg/ml.
Titrasi Sampel Serum
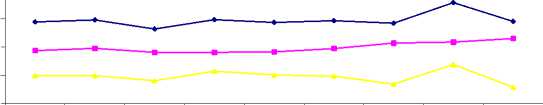
Pengenceran serum kontrol positif dan serum kontrol negatif dibuat secara seri yaitu 1:10, 1:20, 1:30, 1:40, 1:50, 1:60, 1:70, 1:80, 1:90 dan 1:100. Pengenceran dilakukan dengan menambahkan serum kontrol positif dan kontrol negatif dengan PBS-Tween 20. Pada penelitian ini, dari hasil optical density (OD) uji ELISA titrasi serum kontrol positif dan serum kontrol negatif, diketahui pengenceran optimal serum ada pada pengenceran 1:80. Selanjutnya hasil OD titrasi serum pengenceran 1:80 tersebut, dapat digambarkan seperti berikut (Gambar 2).
Titrasi Konjugat
Mengacu pada penelitian yang sama, namun menggunakan cairan Cysticercus bovis sebagai antigen, Dharmawan et al. (2009) telah melakukan pengenceran konjugat bertingkat, yaitu 1:3000, 1:4000 dan 1:5000. Tingkatan pengenceran yang sama digunakan pada penelitian ini. Hasil penelitian menunjukkan bahwa nilai OD titrasi konjugat seperti pada Gambar 3. Dari ketiga pengenceran konjugat tersebut diperoleh pengenceran paling optimal pada 1:4000.
Penelitian ini dilakukan untuk kepentingan uji diagnostik sistiserkosis pada sapi, dengan mengevaluasi kemampuan crude antigen Cysticercus T.
saginata isolat Bali sebagai antigen. Langkah awal dilakukan dengan optimalisasi ELISA dengan cara menetapkan konsentrasi optimal antigen, pengenceran optimal serum dan pengenceran optimal konjugat. Hasil
penelitian menunjukkan bahwa nilai optimal yang diperoleh untuk konsentrasi antigen, pengenceran serum dan pengenceran konjugat sebagai berikut: antigen 2 µg/ml, serum 1:80 dan konjugat 1:4000.
1,200
1,000
0,800
0,600
0,400
0,200
0,000

12

34
Konsentrasi 1 µg/ml, 2 µg/ml, 3 µg/ml dan 4 µg/ml
---> Positif
--■-- Negatif
Selisih
Gambar 1. Optical density ELISA serum kontrol positif dan kontrol negatif pada berbagai pengenceran
1,200
1,000
0,800
0,600
0,400
0,200
0,000
—•— Positif
--■-- Negatif Selisih
123456789
Pengenceran 1:80
Gambar 2. Optical density ELISA serum kontrol positif dan serum kontrol negatif pada berbagai pengenceran
1,200
1,000
0,800
0,600
0,400
0,200
0,000
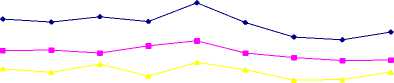
1234567
Pengenceran (1,2,3 = 1:3000; 4,5,6, = 1:4000; 7,8,9 = 1:5000)
89
---∙--- Positif
---■--- Negatif
Selisih
Gambar 3. Optical density ELISA serum kontrol positif dan kontrol negatif pada berbagai pengenceran konjugat.
Hasil penelitian ini tidak jauh berbeda dengan penelitian yang dilakukan Dharmawan et al. (2010) yang mendeteksi sistiserkosis pada sapi dengan menggunakan cairan kista T. saginata sebagai antigen. Dharmawan et al. (2010) melaporkan bahwa pengenceran optimal yang diperoleh untuk antigen adalah 1:60; pengenceran optimal serum 1:80 dan pengenceran konjugat 1:4000. Jika hasil penelitian ini dibandingkan dengan penelitian Kandil et al. (2012) yang menggunakan crude antigen T. saginata untuk diagnosis sistiserkosis pada sapi, ada sedikit perbedaan. Hasil checkerboard titration yang dilakukannya, menemukan konsentrasi optimal antigen adalah 5µg/ml (Kandil et al., 2012).
Sementara itu, Rodriguez et al. (2009) yang melakukan penelitian deteksi antigen T. solium menggunakan ELISA dan deteksi antibodi anti T. solium menggunakan enzyme-linked immunotransfer blot (EITB) pada sampel serum dan sampel cairan cerebrospinal pasien neurosistiserkosis, melaporkan bahwa deteksi antigen dengan ELISA lebih baik untuk cairan cerebrospinal dibandingkan sampel serum. Pengenceran optimal serum yang dilakukan untuk penelitiannya adalah 1:50 (Rodriguez et al., 2009). Menurut Minozzo et al. (2008) yang mengungkapkan crude antigen
Cysticercus T. crassiceps efektif untuk deteksi neurosistiserkosis pada manusia di Brazil, ternyata menggunakan pengenceran optimal antigen 1:500, pengenceran optimal serum 1:800 dan pengenceran optimal konjugat 1:4000.
Pada penelitian ini, rentang selisih OD dari serum kontrol positif dan serum kontrol negatif relatif rendah. Hal ini kemungkinan karena sampel serum kontrol negatif yang digunakan berasal dari Rumah Potong Hewan Pesanggaran Denpasar. Walaupun sapi-sapi yang diambil darahnya diyakini bebas sistiserkosis, belum tentu bebas dari infeksi parasit lainnya. Menurut Pinto et al. (2000) yang menjadi kendala utama dalam uji serologi adalah adanya reaksi silang. Huebner (2004) menyatakan reaksi silang (cross-reactivity) terjadi apabila ada dua antigen yang memiliki epitop yang identik atau antibodi yang spesifik untuk satu epitop juga mengikat epitop lain yang tidak berhubungan tetapi memiliki sifat kimia yang sama.
Berdasarkan hasil penelitian ini dapat dinyatakan bahwa crude antigen Cysticercus T. saginata isolat Bali dapat digunakan untuk mendeteksi sistiserkosis pada sapi. Tersedianya antigen isolat lokal akan memudahkan melakukan seroprevalensi kejadian sistiserkosis pada sapi di Bali pada khususnya, di Indonesia
pada umumnya. Menurut Allepuz et al. (2012) penentuan seroprevalensi kejadian sistiserkosis pada sapi memberi nilai yang lebih tinggi dibandingkan hanya dengan mengandalkan pemeriksaan inspeksi visual post mortem. Walaupun demikian, hasil penelitian ini masih perlu dievaluasi dan dikembangkan untuk mengetahui adanya reaksi silang.
SIMPULAN
Crude antigen Cystisercus T. saginata isolat Bali mempunyai sifat antigenik yang dapat digunakan sebagai antigen untuk mendeteksi antibodi sistiserkosis pada sapi. Optimalisasi ELISA menunjukkan bahwa nilai optimal untuk konsentrasi antigen adalah 2 µg/ml, pengenceran optimal serum adalah 1:80 dan pengenceran optimal konjugat adalah 1:4000.
UCAPAN TERIMA KASIH
Penelitian ini merupakan bagian dari Proyek Hibah Unggulan Perguruan Tinggi Universitas Udayana Tahun 2012 dengan Ketua Prof. Dr. drh. Nyoman Sadra Dharmawan, MS. yang sekaligus bertindak sebagai Pembimbing Utama Tesis. Terimakasih disampaikan kepada Direktorat Penelitian dan Pengabdian
kepada Masyarakat, Direktorat Jenderal Pendidikan Tinggi, atas dukungan dana yang diberikan.
DAFTAR PUSTAKA
Allepuz A, Gabriel S, Dorn P, Napp JF, Vilar MJ, Lives L, Picart L, Ortuna A. 2012. Comparison of Bovine Cystisercosis Prevalene Detected by Antigen ELISA and Visual Inspection in the North East of Spain. Res. Vet. Sci. 92:393-395.
Dharmawan NS. 2009. Fenomena penyakit cacing pita daging babi di Bali dan peran laboratorium klinik dalam menegakkan diagnosis. Di dalam: Tim Editor BPMU. Pemikiran Kritis Guru Besar Universitas Udayana. Bidang Agrokomplek. . Udayana University Press. 1(2):152-164.
Dharmawan NS, Dwinata IM, Damriyasa IM. 2010. Evaluasi Cairan Kista Taenia saginata untuk uji Serologi Taenia Saginata sistiserkosis. Prosiding Seminar Hasil Penelitian Hibah Stategis Nasional Lembaga Penelitian Universitas Udayana. 3847.
Dharmawan NS, Dwinata IM, Swastika K, Damriyasa IM, Oka IBM, Agustina KK. 2012. Studi biologi
perkembangan metacestoda Taenia
saginata pada sapi Bali. Prosiding Seminar Nasional “Peningkatan Produksi dan Kualitas Daging Sapi Bali Nasional” Bali, 14 September 2012.
Dorny P, Gabriel N, Speybroeck, and Vercuysse J. 2002. A sero epidemiological study of Taenia saginata cysticercosis in Zambia cattle. Vet. Parasitol. 104:211-215.
Harrison LJ, Grate T, Brsyce D, Ganzalez M, Foster LM, Wamae LW, and Onyango JA. 2005. Vaccination of cattle against Taenia saginata cysticercosis using an oncospheral adhesion protein (HP6). 37 (2): 103120.
Huebner J. 2004. Antibody-antigen
interactions and measurements of
immunologic reactions. Di dalam: Pier GB, Lyczak JB, Wetzler LM, editor. Immunology, infection, and
immunity. Washington, DC : ASM Press. 207-232.
Iskandar T, Subekti DT, dan Suhardono. 2005. Isolasi Antigen Sistiserkosis pada Babi dan Sapi. Seminar Nasional Tekhnologi Peternakan dan Veteriner. Balai Penelitian Veteriner; Bogor.
Kandil M, Mona S, Mahmoud, Shalaby HA. 2012. Value of Taenia saginata Crude Antigen in Diagnosis of Bovine Cystisercosis With Reference ti its
Characterization. Global Vet. 9(4): 474-478.
Minozzo CJ, Moura DEJ, Almeida MS, Soccol TV. 2008. Crude Antigen from Taenia crassiceps Cystisercus Used as Heterologous Antigen in ELISA and In EITB for Neurocysticercosis Diagnosis of Patient from Parana-Brazil. Braz. Arch. Biol. Technol.
51(6): 1127-1137.
Pinto PS, Vaz AJ, Germano PM,
Nakamura PM. 2000. Performance of the ELISA test for swine cysticercosis using antigens of Taenia solium and Taenia crassiceps cysticerci. Vet. Parasitol. 88 (1-2): 127-130.
Rodriquez S, Dorny P, Victor CW, Tsang E, Pretell J, Brandt J, Andres G, Lescano, Gonzalez AE, Gilman HR, Garcia HH. 2009. Detection of Taenia solium Antigens and Anti–T. solium Antibodies in Paired Serum and Cerebrospinal Fluid Samples from Patient With Intraparenchymal or Extraparenchymal Neurocysticercosis. JID. 199:1345-52.
Sato MO, Yamasaki H, Sako Y, Nakao M, Plancarte A, Kassuku AA, Dorny P, Geerts S, Benitez-Ortis W, Hashiguchi Y. 2003. Evaluation of tongue inspection and serology for diagnosis of Taenia solium cysticercosis inswine: usefulness of
ELISA using purified glycoproteins and recombinant antigen. Vet. Parasitol. 111, 309-322.
Wandra T, Sutisna P, Dharmawan NS, Margono SS, Sudewi R, Suroso T, Craig PS, and Ito A. 2006. High prevalence of Taenia saginata taeniasis and status of Taenia solium cysticercosis in Bali, Indonesia, 20022004. Trans R Soc Trop Med Hyg. 100: 346-353.
Wandra T, Margono SS, Gafar MS, Saragih JM, Sutisna P, Dharmawan NS, Raka Sudewi AA, Depary AA,
Yulfi H, Darlan DM, Samad I, Okamoto M, Sato MO, Yamasaki H, Nakaya K, Craig PC, Ito A. 2007. Taeniasis/cysticercosis in Indonesia, 1996-2006. Southeast Asian J Trop Med Public Health. 38 (1): 140-143).
Wandra T, Raka Sudewi AA, Swastika IK, Sutisna P, Dharmawan NS, Yulfi H, Darlan DM, Kapti IN, Samaan G, Sato OM, Okamoto M, Sako Y, Ito A. 2011. Taeniasis/Cysticercosis in Bali, Indonesia. Southeast Asian J. Trop. Med. Public Health. 42 (4): 793-802.
21
Discussion and feedback