VALIDASI METODE UJI KONFIRMASI SENYAWA GOLONGAN BENZODIAZEPIN DENGAN HPLC-DAD
on
Validasi Metode Uji Konfirmasi Senyawa Golongan Benzodiazepin (Khatija T.A., Pitri S., Gelgel
W.)
VALIDASI METODE UJI KONFIRMASI SENYAWA GOLONGAN BENZODIAZEPIN DENGAN HPLC-DAD
Khatija Taher Ali1, Ni Made Pitri Susanti1, I M.A.G. Wirasuta1
-
1 Jurusan Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana Jalan Kampus Unud-Jimbaran, Jimbaran-Bali, Indonesia 80364
Telp/Fax: 0361-703837
*Corresponding author: mgelgel1@yahoo.de
ABSTRAK
Telah dilakukan validasi metode uji konfirmasi senyawa golongan benzodiazepin, yang meliputi spesifisitas, selektivitas, presisi, ketahanan (robustness), serta sensitivitas dengan HPLC-DAD. Penelitian ini bertujuan untuk memperoleh metode uji konfirmasi yang telah tervalidasi untuk senyawa golongan benzodiazepin.
Penelitian dilakukan terhadap senyawa nitrazepam, bromazepam, flurazepam, klordiazepoksida, dan diazepam. Sistem kromatografi yang digunakan adalah fase diam kolom Luna C8-strong cation exchange dengan fase gerak campuran dapar fosfat 0,05 M pH 3 dan asetonitril 90% (68,5:31,5, v/v). Sistem ini menghasilkan pemisahan yang spesifik, selektif, dan seksama untuk semua senyawa uji, namun tidak senstitif dan tidak tahan (robust).
Kata kunci: HPLC-DAD, benzodiazepin, uji konfirmasi
-
1. PENDAHULUAN
Penyalahgunaan psikotropika di Indonesia merupakan masalah yang mengkhawatirkan. Salah satu golongan obat psikotropika yang sering disalahgunakan adalah golongan benzodiazepin (BNN, 2008). Overdosis benzodiazepin dapat menyebabkan depresi pada sistem saraf pusat dan sering menyebabkan kematian (Yokchue, 2004).
Analisis penyalahgunaan obat diawali dengan pemeriksaan pendahuluan (screening test), yang kemudian dilanjutkan dengan uji konfirmasi. Uji konfirmasi dalam analisis obat melibatkan metode kromatografi (umumnya dengan deteksi secara spektroskopik) untuk menentukan satu atau lebih senyawa tunggal dan digunakan sebagai analisis lanjutan untuk memastikan hasil dari uji imunokimia. High Performance Liquid Chromatography-Diode Array Detector (HPLC-DAD) merupakan salah satu metode kromatografi yang dapat digunakan dalam uji konfirmasi (SCDAT, 2011). HPLC-DAD telah banyak dimanfaatkan untuk uji konfirmasi (Lambert et al., 1997; Moffat et al., 2005; Schonberg, 2008).
Pengembangan metode uji konfirmasi dengan HPLC-DAD untuk senyawa psikotropika yang termasuk ke dalam golongan benzodiazepin telah dilakukan sebelumnya untuk memperoleh sistem pemisahan dan deteksi yang optimal (Syarifudin, 2012). Pada penelitian tersebut, dilakukan optimasi fase gerak dengan
memvariasikan polaritas dan pH fase gerak pada fase diam C8-cation exchange.
Suatu metode analisis harus dievaluasi dan diuji untuk menjamin validitas data yang dihasilkan. Uji validasi yang perlu dilakukan terhadap metode analisis untuk uji konfirmasi dalam sampel biologis adalah spesifisitas, selektivitas, presisi, batas deteksi, dan stabilitas (UNODC, 2009). Selain itu, juga perlu dilakukan uji ketahanan metode (Snyder, 2010). Pada penelitian ini, akan dilakukan validasi metode uji konfirmasi senyawa psikotropika golongan benzodiazepin dengan HPLC-DAD yang telah dikembangkan sebelumnya oleh Syarifudin (2012).
-
2. METODE PENELITIAN
-
2.1 Bahan Penelitian
-
Bahan kimia dan pelarut yang digunakan pada penelitian ini mempunyai derajat kemurnian pro analisis (Merck-Germany), antara lain: metanol, kalium dihidrogen fosfat (KH2PO4), natrium hidroksida (NaOH), dan asetonitril. Air yang digunakan dalam melarutkan bahan dan pencucian kolom HPLC adalah Water for Irrigation (WFI) (PT. Otsuka Indonesia). Bahan yang diteliti adalah bromazepam, klordiazepoksid, flurazepam, diazepam, dan nitrazepam yang diperoleh dari Badan Pengawas Obat dan
Makanan (BPOM) dan Laboratorium Forensik Poltabes Denpasar.
-
2.2 Alat Penelitian
Alat yang digunakan meliputi alat-alat gelas yang umum dipakai dalam laboratorium analitik, seperti pipet ukur (IWAKI Pyrex), labu ukur (IWAKI Pyrex), gelas beker (IWAKI Pyrex), Erlenmeyer (IWAKI Pyrex), dan vial. Selain itu, juga digunakan tabung Effendorf, pipet mikro, timbangan analitik (AND), ballfiller, oven (Memmert), alat pengaduk mekanik (Ika vibrax VXR basic), Erlenmeyer vakum, pompa vakum (Gast), dan pH-meter (Oakton). Kromatografi dilakukan dengan HPLC Shimadzu LC-20AT dengan kolom Luna C8-SCXTM (150×4,6 mm i.d, ukuran partikel 5 μm), syringe LC manual 100 µL, dan Diode Array Detector (SPD-M20A).
-
2.3 Prosedur Penelitian
-
2.3.1 Penyiapan Larutan
-
-
A. Larutan Dapar Fosfat 0,05 M pH 3,0
Ditimbang 0,6804 g KH2PO4, dilarutkan dengan WFI sedikit demi sedikit sampai larut, kemudian dimasukkan ke dalam labu ukur 100 mL. Ke dalam labu ukur, ditambahkan WFI hingga tanda batas dan dikocok hingga homogen. Larutan KH2PO4 ini kemudian diatur pH-nya dengan penambahan larutan asam fosfat 85% v/v secara hati-hati hingga pH larutan mencapai 3 menggunakan pH-meter.
-
B. Larutan Baku Stok 1 mg/mL
Ditimbang masing-masing 10 mg senyawa bromazepam, nitrazepam, flurazepam, diazepam, dan klordiazepoksida, dan masing-masing dimasukkan ke dalam labu ukur 10 mL yang berbeda. Ke dalam masing-masing labu ukur, ditambahkan sedikit metanol sampai larut. Kemudian, ditambahkan metanol sampai tanda batas, dan dikocok hingga homogen.
-
C. Larutan Baku Kerja 100 µg/mL dan 10 µg/mL
Masing-masing larutan baku stok 1 mg/mL dipipet sebanyak 1 mL dan dimasukkan ke dalam labu ukur 10 mL yang berbeda. Ke dalam masing-masing labu ukur, ditambahkan metanol sampai tanda batas, dan dikocok hingga homogen. Diperoleh larutan masing-masing senyawa dengan konsentrasi 100 µg/mL. Masing-masing larutan 100 µg/mL dipipet sebanyak 1 mL lalu dimasukkan ke dalam labu ukur 10 mL yang berbeda. Ke dalam masing-masing labu ukur, ditambahkan metanol sampai tanda batas, dan dikocok hingga homogen. Diperoleh larutan
masing-masing senyawa dengan konsentrasi 10 µg/mL.
-
D. Larutan Campuran Senyawa Golongan Benzodiazepin 10 µg/mL
Dipipet sebanyak 1 mL larutan baku stok 100 µg/mL senyawa bromazepam, diazepam, flurazepam, klordiazepoksida, dan nitrazepam, kemudian dimasukkan ke dalam labu ukur 10 mL. Ke dalam labu ukur, ditambahkan metanol hingga tanda batas dan dikocok hingga homogen.
-
2.3.2 Pemilihan Sistem Kromatografi
-
A. Pemilihan Fase Gerak
Fase gerak dipilih berdasarkan pada sistem terbaik yang telah ditentukan oleh peneliti lain, yaitu campuran dapar fosfat 0,05 M pH 3 dan asetonitril 90% dalam air dengan perbandingan 68,5:31,5 %v/v (Syarifuddin, 2012).
-
B. Pemilihan panjang Gelombang Pengukuran
Panjang gelombang pengukuran dipilih berdasarkan panjang gelombang dimana setiap komponen analit memberikan respon deteksi yang terbaik.
-
2.3.3 Uji Validasi Metode
-
A. Spesifisitas, Selektivitas, dan Presisi
Masing-masing larutan baku dan larutan campuran dengan konsentrasi 10 µg/mL diinjeksikan sebanyak 20 µL ke dalam sistem HPLC-DAD dengan laju alir 1 mL/menit. Masing-masing larutan diinjeksikan sebanyak tiga kali. Spesifisitas ditentukan dari nilai indeks kemurnian puncak dan indeks kesesuaian spektrum puncak sedangkan selektivitas ditentukan dari nilai selektivitas (α) dan resolusi (Rs) antar puncak. Perhitungan presisi untuk larutan campuran baku dilakukan terhadap waktu retensi, waktu retensi relatif, dan faktor kapasitas dari masing-masing senyawa. Presisi dinyatakan sebagai standar deviasi (SD) dan koefisien variansi (KV).
-
B. Batas Deteksi (Limit of Detection/LOD)
Disiapkan larutan seri konsentrasi yang terdiri dari 6 konsentrasi yang berbeda. Larutan seri konsentrasi diinjeksikan sebanyak 20 µL ke dalam sistem HPLC-DAD dengan laju alir 1 mL/menit. Proses tersebut dilakukan sebanyak tiga kali untuk masing-masing larutan. Dibuat grafik antara konsentrasi dan AUC rata-rata dari tiga kali pengulangan masing-masing komponen dan ditentukan persamaan regresi liniernya
(y=bx+a). Dari persamaan regresi linier, dihitung nilai simpangan baku residual S(y/x). LOD ditentukan menggunakan persamaan:
LOD = 3 × S(y / x) b
-
C. Ketahanan (Robustness)
Uji ketahanan metode pada kolom Luna C8-SCXTM dilakukan terhadap perubahan kondisi kolom, yaitu penuaan kolom (ageing). Masing-masing larutan baku dan larutan campuran dengan konsentrasi 10 µg/mL diinjeksikan ke dalam sistem HPLC-DAD dengan fase gerak campuran dapar fosfat 0,05 M pH 3,0 dan asetonitril 90% dalam air (68,5:31,5 %v/v). Masing-masing larutan diinjeksikan sebanyak tiga kali. Parameter yang dianalisis adalah waktu retensi relatif. Hasil
analisis dibandingkan dengan data sebelum kolom mengalami penuaan.
-
3. HASIL DAN PEMBAHASAN
-
3.1 Pemilihan Panjang Gelombang
-
Pengukuran
Berdasarkan penelitian yang dilakukan oleh Syarifudin (2012), panjang gelombang yang memberikan serapan optimal untuk senyawa golongan benzodiazepin adalah 240 nm.
-
3.2 Penentuan Validasi Metode
-
3.2.1 Spesifisitas dan Selektivitas
-
Kromatogram hasil pemisahan campuran senyawa golongan benzodiazepin ditunjukkan pada Gambar A.1.
PpAf.tl.lH. 1
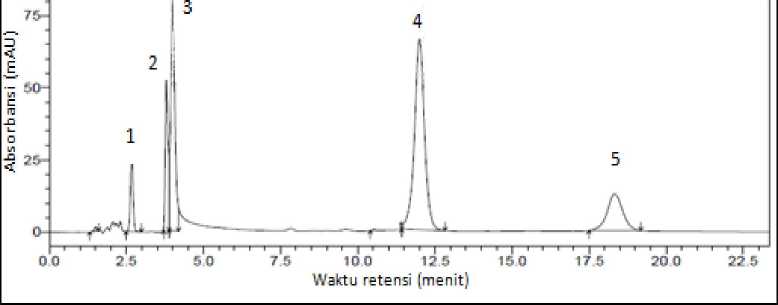
Gambar A.1 Kromatogram pemisahan campuran senyawa golongan benzodiazepin dengan Luna C8-SCXTM
Keterangan: 1 = nitrazepam, 2 = bromazepam, 3 = flurazepam, 4 = klordiazepoksida, 5 = diazepam
Identifikasi setiap puncak kromatogram dilakukan dengan mencocokkan parameter waktu retensi dan spektrum masing-masing puncak dengan senyawa tunggal.
Hasil uji spesifisitas pemisahan campuran senyawa golongan benzodiazepin ditunjukkan pada Tabel B.1.
Tabel B.1. Hasil Uji Spesifisitas Campuran Senyawa Golongan Benzodiazepin, dengan kolom Luna C8-SCXTM
|
Senyawa |
tR Rata-rata ± SD (%KV) |
PPI Rata-Rata ± SD |
SI Rata-Rata ± SD |
|
Nitrazepam |
2.673 ± 0,011 (0,396) |
0.999 ± 0,001 |
0,999 ± 0,000 |
|
Flurazepam |
3.804 ± 0,010 (0,259) |
0.999 ± 0,001 |
0,999 ± 0,000 |
|
Bromazepam |
4.037 ± 0,030 (0,741) |
0.999 ± 0,001 |
0,999 ± 0,000 |
|
Klordiazepoksida |
12.051 ± 0,048 (0,400) |
0.999 ± 0,001 |
0,999 ± 0,000 |
|
Diazepam |
18.422 ± 0,084 (0,456) |
0.998 ± 0,001 |
0,999 ± 0,000 |
Keterangan: tR = waktu retensi, PPI = Peak Purity Index (indeks kemurnian puncak), SI = Similarity Index (Indeks kesesuaian spektrum), SD = Standar Deviasi, KV = Koefisien Variansi
Menurut Moffat et.al. (2005), dua spektrum senyawa dikatakan identik apabila nilai SI ≥0,999. Pada kasus puncak yang berhimpit sebagian, nilai SI >0,990 sudah dapat menjadi kriteria identifikasi. Berdasarkan ketentuan tersebut, maka
semua spektrum memenuhi kriteria identik. Pada semua puncak tidak terdeteksi adanya pengotor. Mengacu pada ketentuan yang diberikan Stahl (2003) mengenai kemurnian puncak, maka nilai PPI semua puncak senyawa memenuhi rentang
nilai yang dipersyaratkan, yaitu ≥0,995. Berdasarkan hal tersebut, maka sistem pemisahan yang digunakan mampu menghasilkan puncak yang murni mengandung satu senyawa.
Nilai resolusi (Rs) dan faktor selektivitas (α) dari puncak-puncak yang berdekatan pada campuran senyawa golongan benzodiazepin dapat dilihat pada Tabel B.2.
Tabel B.2. Hasil Uji Selektivitas Campuran Senyawa Golongan Benzodiazepin dengan Kolom Luna C8-SCXTM
|
Puncak Senyawa |
α rata-rata ± SD |
Rs rata-rata ± SD |
|
Nitrazepam dan Flurazepam |
1,955 ± 0,010 |
7,825 ± 0,306 |
|
Flurazepam dan Bromazepam |
1,101 ± 0,008 |
1,375 ± 0,061 |
|
Bromazepam dan Klordiazepoksida |
4,145 ± 0,031 |
20,830 ± 0,155 |
|
Klordiazepoksida dan Diazepam |
1,603 ± 0,002 |
8,670 ± 0,018 |
Keterangan: α = selektivitas puncak yang berdekatan, Rs = Resolusi puncak yang berdekatan, dan SD = Standar Deviasi
Menurut Snyder et al. (2010), puncak dikatakan selektif apabila menghasilkan nilai α >1. Meyer (2010) menyatakan bahwa dua puncak dengan Rs =1 tidak sepenuhnya terpisah, namun masih dapat teridentifikasi. Mengacu pada ketentuan yang ditetapkan oleh Snyder et al. (2010) dan Meyer (2010), maka nilai α dan Rs yang dihasilkan semua puncak memenuhi kriteria selektif.
Spesifisitas metode ditentukan oleh indeks kemurnian puncak dan indeks kesesuaian spektrum, sedangkan selektivitas metode ditentukan oleh faktor selektivitas dan resolusi puncak yang berdekatan. Berdasarkan nilai SI
spektrum, PPI, α, dan Rs, sistem pemisahan menggunakan kolom Luna C8-SCXTM dengan fase gerak campuran dapar fosfat 0,05 M pH 3,0 dan asetonitril 90% (68,5:31,5 %v/v) spesifik dan selektif dalam memisahkan senyawa-senyawa dalam campuran golongan benzodiazepin.
-
3.2.2 Presisi
Pada analisis senyawa tunggal maupun campuran dengan pengulangan sebanyak 3 kali, diperoleh KV <2% untuk waktu retensi, faktor kapasitas, dan waktu retensi relatif (Tabel B.3. dan Tabel B.4.).
Tabel B.3. Presisi Waktu Retensi Campuran Senyawa Golongan Benzodiazepin dengan Kolom Luna C8-SCXTM
|
Puncak |
I PenIgIulangan III Rata-Rata ± SD %KV |
|
Nitrazepam Flurazepam Bromazepam Klordiazepoksida Diazepam |
2,662 2,675 2,683 2,673 ± 0,011 0,396 3,793 3,807 3,812 3,804 ± 0,010 0,259 4,005 4,043 4,064 4,037 ± 0,030 0,741 11,999 12,061 12,094 12,051 ± 0,048 0,400 18,325 18,464 18,476 18,422 ± 0,084 0,456 |
Keterangan : SD = Standar Deviasi, KV = Koefisien Variansi
Tabel B.4. Presisi Waktu Retensi Relatif dan Faktor Kapasitas Campuran Senyawa Golongan Benzodiazepin dengan Kolom Luna C8-SCXTM
|
Puncak Senyawa |
Parameter |
Pengulangan |
Rata-Rata ± SD |
%KV | ||
|
I |
II |
III | ||||
|
Nitrazepam |
RRT |
1,000 |
1,000 |
1,000 |
1,000 ± 0,000 |
0,000 |
|
k’ |
0,787 |
0,798 |
0,802 |
0,795 ± 0,008 |
0,995 | |
|
Flurazepam |
RRT |
1,965 |
1,954 |
1,946 |
1,955 ± 0,010 |
0,500 |
|
k’ |
1,546 |
1,558 |
1,560 |
1,555 ± 0,008 |
0,510 | |
|
Bromazepam |
RRT |
2,146 |
2,152 |
2,157 |
2,152 ± 0,005 |
0,251 |
|
k’ |
1,688 |
1,717 |
1,729 |
1,711 ± 0,021 |
1,243 | |
|
Klordiazepoksida |
RRT |
8,967 |
8,907 |
8,882 |
8,919 ± 0,044 |
0,488 |
|
k’ |
7,053 |
7,106 |
7,122 |
7,094 ± 0,036 |
0,509 | |
|
Diazepam |
RRT |
14,364 |
14,302 |
14,227 |
14,298 ± 0,069 |
0,481 |
|
k’ |
11,299 |
11,409 |
11,408 |
11,372 ± 0,063 |
0,557 | |
Keterangan : RRT = Relative Retention Time (waktu retensi relatif), k’ = faktor kapasitas SD = Standar Deviasi, KV = Koefisien Variansi
Nilai KV waktu retensi analit yang berada di bawah 2% menunjukkan sistem HPLC memiliki presisi waktu retensi yang baik dalam pemisahan (Snyder et al., 2010). Berdasarkan hal tersebut, maka sistem pemisahan dengan kolom Luna C8-SCXTM dengan fase gerak campuran dapar fosfat 0,05 M pH 3,0 dan asetonitril 90% (68,5:31,5 %v/v) memberikan presisi yang baik dan memenuhi ketentuan untuk pemisahan campuran senyawa golongan benzodiazepin.
-
3.2.3 Ketahanan
Uji ketahanan dilakukan terhadap parameter penuaan kolom. Waktu retensi relatif masing-masing puncak yang dianalisis dengan kolom yang telah mengalami penuaan fase diam dengan pengulangan sebanyak 3 kali ditunjukkan pada pada Tabel B.5.
Tabel B.5. RRT Campuran Senyawa Golongan Benzodiazepin dengan Kolom Luna C8-SCXTM yang Mengalami Penuaan
|
Puncak Senyawa |
RRT Rata-Rata ± SD |
%KV |
|
Nitrazepam |
1.000 ± 0,000 |
0.000 |
|
Flurazepam |
2.307 ± 0,047 |
2.038 |
|
Bromazepam |
2.207 ± 0,045 |
2.052 |
|
Klordiazepoksida |
8.875 ± 0,137 |
1.540 |
|
Diazepam |
13.198 ± 0,276 |
2.088 |
Keterangan: RRT = Relative Retentin Time (waktu retensi relatif), SD = Standar Deviasi, KV = Koefisien Variansi
Pada Tabel B.5. Terlihat bahwa hanya klordiazepoksida yang memberikan nilai KV <2%, sedangkan senyawa lainnya memberikan nilai KV >2%. Hal ini berarti bahwa kolom yang mengalami penuaan tidak memberikan presisi yang yang baik sehingga tidak dapat digunakan untuk uji konfirmasi. Nilai RRT pada kolom yang telah mengalami penuaan tidak dapat digunakan
untuk mengidentifikasi puncak karena jauhnya perbedaan yang diberikan terhadap RRT kolom normal.
-
3.2.4 Sensitivitas
Nilai LOD untuk senyawa golongan benzodiazepin ditunjukkan pada Tabel 6.
Tabel B.6. LOD Golongan Benzodiazepin dengan Kolom Luna C8-SCXTM
|
Senyawa |
LOD (µg/mL) |
Cutoff Untuk Uji Konfirmasi |
|
Nitrazepam |
1,318 | |
|
Flurazepam |
1,620 | |
|
Bromazepam |
1,434 |
0,3 µg/mL |
|
Klordiazepoksida |
1,456 | |
|
Diazepam |
1,550 |
Keterangan : LOD = Limit of Detection (batas deteksi)
Pada tabel tersebut, terlihat bahwa nilai LOD senyawa golongan benzodiazepin berada di atas nilai cutoff. Clinical Reference Laboratory (2006) menyebutkan bahwa nilai cutoff adalah konsentrasi terendah dari suatu senyawa dalam urin agar dapat dideteksi. Penetapan nilai cutoff didasarkan atas konsentrasi minimum senyawa dalam urin pada dosis normal. Berdasarkan hal tersebut, sistem pemisahan menggunakan kolom Luna C8-SCXTM dengan fase gerak campuran dapar fosfat 0,05 M pH 3,0 dan asetonitril 90% (68,5:31,5 %v/v) tidak sensitif untuk analisis senyawa golongan benzodiazepin
-
4. KESIMPULAN
Uji konfirmasi dengan kolom Luna C8-SCXTM menggunakan fase gerak campuran dapar fosfat 0,05 M pH 3,0 dan asetonitril 90% (68,5:31,5 %v/v) spesifik, selektif, dan seksama, namun tidak tahan pada keadaan kolom yang mengalami penuaan dan tidak sensitif untuk campuran senyawa golongan benzodiazepin.
UCAPAN TERIMA KASIH
Ucapan terima kasih disampaikan kepada Bapak I Nyoman Kadjeng Widjaja, M.Si., Apt., dan Ibu Luh Putu Mirah Kusuma Dewi, SF., Apt. sebagai reviewer, serta Kadek Duwi Cahyadi, S.Farm., M.Si., Apt., Agus Didik Sudiandika, S.Farm., Made Chandra Wrasmitha Dewi, S.Farm., Teguh
Kurnia, S.Farm., I Putu Adi Kusuma, S.Farm, dan Syarifudin, S.Farm., atas segala bantuan teknis, informasi, saran, dan dukungannya.
DAFTAR PUSTAKA
Badan Narkotika Nasional. (2008). Pedoman Pemeriksaan Laboratorium Narkotika, Psikotropika dan Obat Berbahaya. Jakarta: BNN. hal. 1-2.
Clinical Reference Laboratory. (2006). The 10 Most Common Drug of Abuse. Kansas: Clinical Reference Laboratory. p. 3.
Lambert, W.E, J.F. Van-Bocxlaer, and A.P. De-Leenheer. (1997). Potential of High-Performance Liquid Chromatography with Photodiode Array Detection in Forensic Toxicology. J. Chromatogr. B, 689: 45-53.
Meyer, Veronica R. (2010). Practical High-Performance Liquid Chromatography 5th ed. St. Gallen: John Wiley and Sons, Ltd. p. 2325.
Moffat, C. A., M. D. Osselton, and B. Widdop.
(2005). Clarke’s Analysis of Drugs and Poisons (Electronic Edition). London: Pharmaceutical Press.
SCDAT. (2011). Guidelines for Drugs of Abuse Testing. Vienna: SCDAT. p. 18.
Schonberg, von Lena. (2008). Development of a Screening System for the Determination of Compounds in Urine by Automated On-line
Extraction HPLC-DAD for Toxicological Analysis. Dissertation. Natural Sciences I/Life Sciences-Martin-Luther University, Halle-Wittenberg. p. 2, 89.
Snyder, L.R., J.J. Kirkland, and J.W. Dolan. (2010). Introduction to Modern Liquid Chromatography 3rd ed. Hoboken: John Wiley and Sons Inc. p. 25-26, 165-166, 516518.
Stahl, Mark. (2003). Peak Purity Analysis in HPLC and CE Using Diode Array Technology. Boeblingen: Agilent
Technology. p.1-16.
Syarifudin. (2012). Uji Konfirmasi Senyawa Golongan Benzodiazepin Menggunakan HPLC-DAD (Skripsi). Jurusan Farmasi-Fakultas MIPA-Universitas Udayana, Jimbaran. hal. 28-35.
United Nation Office on Drugs and Crimes. (2009). Guidance for The Validation of Analytical Methodology and Calibration of Equipment Used for Testing of Illicit Drugs in Seized Materials and Biological Specimens. Vienna: United Nations. p. 8-12, 37.
Yokchue, Tanasiri. (2004). Analysis of 15 Benzodiazepines in Blood by HPLC. Thesis. Forensic Science-Faculty of Graduate Studies-Mahidol University, Bangkok. p. 14.
6
Discussion and feedback