UJI PEMISAHAN SIANIDIN DAN PEONIDIN DARI EKSTRAK UMBI UBI JALAR UNGU (Ipomoea batatas L.) DENGAN METODE HPTLC SPEKTROFOTODENSITOMETRI C-18
on
JURNAL FARALkSIUDAYANA
Vol. 5 No 2 Tahun 2016 Jurnal Farmasi Udayana Vol S 5, No 2, 39-41
UJI PEMISAHAN SIANIDIN DAN PEONIDIN DARI EKSTRAK UMBI UBI JALAR UNGU (Ipomoea batatas L.) DENGAN METODE HPTLC SPEKTROFOTODENSITOMETRI C-18
Susanti, N.M.P. 1, Primadewi, C. 1, Dewi, A.A.R.P.1,Wirasuta, I. M.A.G.1
1Jurusan Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana
Korespondensi: Ni Made Pitri Susanti
Jurusan Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana
Jalan Kampus Unud-Jimbaran, Jimbaran-Bali, Indonesia 80364 Telp./Fax. 703837
Email: dekpitsusanti@unud.ac.id
Abstrak
Umbi ubi jalar ungu memiliki kandungan senyawa aktif antioksidan antosianin. Antosianin dalam umbi ubi jalar ungu terdiri atas dua, yaitu sianidin dan peonidin. Pemisahan kedua jenis antosianidin dalam ubi jalar ungu (Ipomoea batatas L.) perlu dilakukan karena adanya perbedaan potensi aktivitas antioksidan dari kedua antosianidin tersebut.
Sampel yang digunakan adalah ekstrak etanol kasar ubi jalar ungu. Pemisahan diakukan dengan metode HPTLC spektrofotodensitometri C-18 menggunakan fase diam Silika Gel RP-18 F254 dan fase gerak n-butanol : asam asetat : air atau BAW (4 : 1 : 5 v/v).
Hasil pemisahan menunjukkan bahwa terdapat empat buah noda yang berhasil terpisah, yang kemudian teridentifikasi sebagai 1 senyawa peonidin dan 3 senyawa sianidin. Noda senyawa peonidin berada nilai Rf 0,10, sedangkan ketiga senyawa sianidin berada pada nilai Rf berturut-turut 0,40; 0,58 dan 0,66.
Kata Kunci: Antosianidin, HPTLC spektrofotodensitometri C-18, BAW, Ipomoea batatas L.
-
1. PENDAHULUAN
Antosianin ubi ungu tersusun oleh 5 jenis turunan sianidin dan 5 jenis peonidin. Senyawa-senyawa sianidin dan peonidin
tersebut adalah sianidin-3-sophoroside-5-glikosida, sianidin-3-(6”,6’”-dicaffeoylsoph_-
5-glikosida, sianidin-3-(6”-caffeoyl-6’”p-
hidroksibenzoylsoph)-5-glikosida, sianidin-3-
(6:-caffeoylsoph)-5-glikosida, sianidin-3-(6”-
caffeoyl-6’”-feruloylsoph)-5-glikosida, peonidin-3-soph-5-glikosida, peonidin-3-
(6”,6’”-dicaffeoylsoph)-5-glikosida, peonidin-3-(6”-caffeoylsoph)-5-glikosida, peonidin-3-
(6”caffeoyl-6’”-p-hidroksibenzoylsoph)-5-glikosida dan peonidin-3-(6”-caffeoyl-6’”-feruloylsoph)-5-glikosida (Montilla et al., 2011). Pemisahan sianidin dan peonidin bertujuan untuk mengelusidasi senyawa penyusun atau membuat sidikjari kromatografi, yang dapat digunakan sebagai kontrol kualitas ekstrak ubi ungu. Pemisahan senyawa ini umumnya menggunakan HPLC-C18(Montilla et al., 2011; Terahara et al., 2004).
Dalam penelitian ini dilaporkan pemisahan sianidin dan peonidin menggunakan HPTLC-C18. Tujuan pemisahan ini adalah pengembangan metode sidikjari HPTLC-C18
yang dapat digunakan untuk mengontrol kualitas ekstrak etanol umbi ubi jalar ungu.
-
2. BAHAN DAN METODE
-
2.1 Bahan
-
Bahan yang digunakan dalam penelitian ini adalah umbi ubi jalar ungu (Ipomoea batatas L.) yang diperoleh dari Kabupaten Karangasem Bali, plat HPTLC Silica Gel 60 RP-18, bahan-bahan kimia derajat teknis seperti etanol 70%, metanol, aquadest, asam asetat glasial, n-butanol, AlCl3, Amonia.
-
2.2 Alat Penelitian
Alat penelitian yang digunakan dalam penelitian ini adalah beker gelas, vial, timbangan analitik, pisau, CAMAG ATS 4, CAMAG Scanner 4, CAMAG TLC Visualizer.
-
2.3 Prosedur Penelitian
-
2.3.1 Pemisahan Antosianidin
-
Sampel yang berupa ekstrak etanol kasar umbi ubi jalar ungu, ditotolkan pada plat HPTLC Silika Gel RP-18 F254 sebanyak 6 μL menggunakan CAMAG Automatic TLC Sampler. Plat dielusi dalam chamber dengan fase gerak n-butanol : asam asetat : air (4:1:5 v/v). Plat yang telah dielusi kemudian dikeringkan dengan CAMAG plate heater III pada suhu 35oC selama 15 menit.
-
2.3.2 Identifikasi Hasil Pemisahan
Plat yang telah selesai dikeringkan di scan kromatogramnya pada 540 nm dan spektrumnya
pada rentang panjang gelombang 200-700 nm. Kemudian plat disemprot dengan pereaksi AlCl3, lalu dikeringkan kembali pada suhu 35oC. Plat yang telah direaksikan di scan kembali seperti pada prosedur sebelumnya.. Dilihat pergeseran spektrum yang terjadi pada masing-masing noda untuk mengidentifikasi senyawa sianidin dan peonidin.
-
3. HASIL
Pemisahan antosianidin dari ekstrak etanol kasar umbi ubi jalar ungu dengan fase diam silika gel F254 RP-18 dan fase gerak BAW (4:1:5 v/v) menghasilkan empat noda yang diidentifikasi sebagai senyawa antosianidin berdasarkan kemiripan bentuk spektrumnya dengan spektrum antosianin pada pustaka (Xu, 2013). Keempat noda tersebut (P1,P2, P3 dan P4) berada pada nilai Rf 0,10; 0,40; 0,58 dan 0,66. Hasil identifikasi senyawa antosianidin menggunakan pereaksi semprot AlCl3 adalah bahwa P1 tidak berubah warna dari merah muda menjadi kuning. Sementara untuk P2, P3 dan P4 mengalami perubahan warna dari merah muda menjadi kuning. Hasil pemisahan dapat dilihat pada gambar 1.
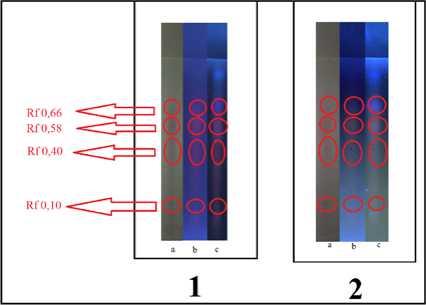
Gambar 1. Visualisasi plat HPTLC C-18 setelah elusi (1)sebelum reaksi; (2) setelah reaksi AlCl3; (a) sinar tampak; (b) UV 254 nm; (c) UV 366 nm
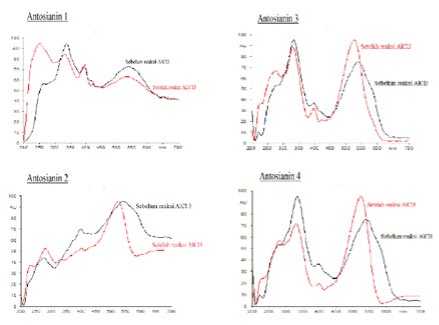
Gambar 2. Pergeseran puncak maksimum keempat noda
|
Tabel 1. |
Hasil reaksi warna antara noda dengan pereaksi | ||
|
Jenis |
Markham, |
Hasil |
Kesimpula |
|
pereaks |
1988 |
n | |
|
i | |||
|
Tanpa |
Sinar UV: |
Sinar UV: |
(+) |
|
pereaks |
merah |
merah |
keempat |
|
i |
jingga / merah jambu atau fluoresens i kuning |
jingga |
noda |
|
AlCl3 |
Sinar UV: |
Sinar UV: |
(+) Rf |
|
bercak |
bercak |
0,40, 0,58, | |
|
fluoresens |
fluoresens |
0,66 | |
|
i kuning |
i kuning | ||
|
(sianidin) |
jingga (noda di Rf 0,40, 0,58 dan 0,66) dan |
(-) Rf 0,10 | |
|
Merah muda | |||
|
redup (noda di Rf 0,10) | |||
|
Gambar 2 menunjukkan |
bahwa noda | ||
|
pada Rf 0,10 tidak |
mengalami pergeseran | ||
|
puncak |
maksimum |
sedangkan |
ketiga noda |
|
lainnya |
mengalami |
pergeseran puncak | |
|
maksimum. | |||
-
4. PEMBAHASAN
Noda P1 tidak memberikan warna kuning ketika direaksikan dengan AlCl3. P1 diduga tidak memiliki gugus orto dihidroksi di cincin B pada struktur flavonoid. Senyawa peonidin
dilaporkan tidak memiliki gugus orto dihidroksi tersebut (Bordonaba et al., 2011). Sedangkan P2, P3 dan P4 memberikan warna kuning ketika direaksikan, sehingga ketiga noda tersebut diduga memiliki gugus orto dihidroksi pada cincin B. Senyawa sianidin memiliki gugus orto dihidroksi pada cincin B. Berdasarkan hasil reaksi AlCl3, sistem ini tidak dapat memisahkan kandungan peonidin dalam umbi ubi jalar ungu, namun sistem ini mampu memisahkan sianidin kedalam 3 noda, yaitu P2, P3, dan P4.
Gambar 3 menampilkan spektrum dari P1-P4 sebelum dan setelah direaksikan dengan AlCl3. P1 tidak memberikan geseran spektrum pada rentang 400-600 nm. Serapan pada rentang panjang gelombang ini diberikan oleh pita I dari antosianin (Markham, 1988). Noda tersebut tidak memiliki gugus orto dihidroksi. Hal ini memperkuat dugaan bahwa P1 adalah komponen peonidin dari antosianin umbi ubi jalar ungu. Noda P2-P4 memberikan geseran puncak maksimum pada pita I. Pergeseran yang terjadi adalah pergeseran ke panjang gelombang yang lebih pendek atau hipsokromik. Pada umumnya reaksi AlCl3 dengan antosianin memberikan geseran bathokromik (Harborne, 1959). Geseran batokromik dilaporkan dari hasil pengukuran flavonoid dalam larutan menggunakan spektrofotometri. Pada penelitian ini diperoleh in-situ spktrum UV-Vis, dimana pengukuran spektrum pada media padat, yaitu plat HPTLC-C18. Perbedaan media diduga berpengaruh pada geseran hipsokromik dari ketiga senyawa sianidin.
Senyawa antosianidin dari ekstrak etanol kasar umbi ubi jalar ungu yang berhasil dipisahkan terdiri dari empat noda pada Rf 0,10; 0,40; 0,58 dan 0,66. Noda pada Rf 0,10 teridentifikasi sebagai peonidin, sedangkan ketiga noda lainnya teridentifikasi sebagai sianidin.
Penulis mengucapkan rasa terimakasih kepada seluruh Tim Analisis Farmasi Universitas Udayana atas bantuan teknis maupun moral bagi penulis.
DAFTAR PUSTAKA
Ahuja, S. and M. W. Dong. 2005. Handbook of Pharmaceutical Analysis by HPLC. Volume 7. New York: Elsevier Academic Press.
Bordonaba, J. G., P. Crespo dan L. Terry. 2011. A New Acetonitrile Free Mobile Phase for HPLC-DAD Determination of Individual Anthocyanins in Blackcurrant and Strawberry Fruit: A Comparation Validation Study. Food Chem. 129: 1265-1273.
Harborne, J. B. 1959. Anthocyanin Production in the Cultivated Potato. Plant Polyphenols. Pp 262-269.
Harborne, J. B. 1998. Phytochemicals Methods: A Guide to Modern Techniques of Plant Analysis. London: Chapman & Hall.
Montilla, E. C., S. Hillebrand dan P. Winterhalter. 2011. Anthocyanins in Purple Sweet Potato (Ipomoea batatas L.) Varieties. Fruit, Vegetable and Cereal Science and Biotechnology. 5:1924.
Terahara, N., I. Konczak, H. Ono, M. Yoshimoto dan O. Yamakawa. 2004. Characterization of Acylated Anthocyanins in Callus Induced From Storage Root of Purple-Fleshed Sweet Potato, Ipomoea batatas L. Journal of Biomedicine and Biotechnology. 5:279286.
41
Discussion and feedback