The AKTIVITAS ANTIBAKTERI EKSTRAK n-HEKSANA KULIT PISANG HIJAU LUMUT (Musa × paradisiaca L.)
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 18 (1), JANUARI 2024 DOI: https://doi.org/10.24843/JCHEM.2024.v18.i01.p08
p-ISSN 1907-9850
e-ISSN 2599-2740
AKTIVITAS ANTIBAKTERI EKSTRAK n-HEKSANA KULIT PISANG HIJAU LUMUT (Musa × paradisiaca L.) SERTA IDENTIFIKASI SENYAWANYA
W. S. Rita*, A. O. Pardede dan S. R. Santi
Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana, Jimbaran, Badung, Bali, Indonesia
*Email: susanah.rita@unud.ac.id
ABSTRAK
Kulit pisang hijau lumut (Musa x paradisiaca L.) merupakan sampah organik yang tidak tersebar luas manfaatnya, seperti sebagai antibakteri. Tujuan dari analisis ini adalah guna menetapkan konsentrasi hambat minimum (KHM) dan konsentrasi bunuh minimum (KBM) ekstrak kasar n-heksana kulit pisang hijau lumut, dan mendeteksi kandungan senyawa dalam ekstrak kasar n-heksana. Maserasi dan partisi diterapkan untuk mendapatkan ekstrak n-heksana. Reaksi penyabunan dilakukan menggunakan refluks, uji aktivitas antibakteri dikerjakan dengan metode sumur difusi agar, pemisahan dikerjakan dengan metode kromatografi, serta identifikasi senyawa aktif menggunakan Gas Chromatography-Spectroscopy Massa (GC-MS). Maserasi 1 kg serbuk kulit pisang hijau lumut dengan 10 L metanol menghasilkan 120,34 g ekstrak kental metanol. Partisi ekstrak kental metanol dengan n-heksana menghasilkan 23,41 g ekstrak kental n-heksana. Hasil percobaan aktivitas antibakteri memperlihatkan nilai KHM dari ekstrak kasar n-heksana kulit pisang hijau lumut sebesar 3,125% baik terhadap bakteri S. aureus maupun E. coli sedangkan KBM ekstrak kasar n-heksana pada 50% terhadap kedua bakteri. Senyawa aktif sebagai antibakteri dalam ekstrak kasar n-heksana yang didapat diantaranya kariofilena, oktadekana, metil palmitat, dan stigmasterol.
Kata kunci: Antibakteri, Escherichia coli, kulit pisang, GC-MS, Staphylococcus aureus.
ABSTRACT
Musa x paradisiacal L. peels are organic wastes whose benefits as antibacterial have not been widespread yet. This research aimed to determine the minimum inhibitory concentration (MIC) and minimum bactericidal concentration (MBC) of the n-hexane extract of the green banana peels and to detect the compounds present in the n-hexane crude extract. Maceration and partitioning were applied to obtain n-hexane extract. The saponification reaction was carried out using reflux, the antibacterial activity test was carried out by the agar diffusion well method, the separation was carried out by the chromatography method, and the identification of active compounds was carried out using Gas Chromatography-Mass Spectroscopy (GC-MS). Maceration of 1 kg of the peel powder with 10 L of methanol produces 120.34 g of methanol extract. Partitioning of the methanol extract with n-hexane yielded 23.41 g of n-hexane extract. The results of the antibacterial activity experiment showed that the MIC value of the n-hexane crude extract of moss green banana peels was 3.125% against S. aureus and E. coli, and the KBM of n-hexane extract was 50% against both bacteria. The active compounds as antibacterial in the n-hexane crude extract obtained include caryophyllene, octadecane, methyl palmitate, and stigmasterol.
Keywords: Antibacterial, Escherichia coli, Banana peel, GC-MS, Staphylococcus aureus.
PENDAHULUAN
Aktivitas masyarakat modern telah banyak menimbulkan persoalan, salah satunya adalah masalah kesehatan akibat dari lingkungan yang tercemar. Lingkungan yang tercemar berdampak pada perkembangan bakteri yang merugikan dan mengakibatkan berbagai macam penyakit seperti infeksi. Salah satu pemicu penyakit infeksi ialah bakteri (Rubiyanto et al., 2014).
Brooks et al. (2012) menyatakan bahwa staphylococcus aureus serta escherichia coli adalah bakteri patogen yang amat luas menginfeksi makhluk hidup dan merupakan bagian dari flora normal tubuh manusia. Bbakteri ini menyebar melalui kontak langsung, dan selanjutnya ditularkan melalui oral (Bhaskara et al., 2019). Bakteri memiliki potensi sebagai mikroorganisme yang berbahaya bagi kesehatan manusia, oleh sebab itu perlu dilakukan penanggulangan untuk perkembangannya dengan penggunaan bahan
aktif dari tumbuhan. Tanaman pisang merupakan salah satu tanaman yang bisa dipergunakan sebagai antibakteri. Rita et al. (2020) melakukan studi tentang aktivitas antibakeri dan antioksidan ekstrak metanol beberapa kulit pisang yang dikembangkan Bali. Hasil menunjukkan bahwa kulit pisang hijau lumut (KPHL) aktif terhadap bakteri S. aureus dan E. coli dengan daya hambat 12,30 dan 11,67 mm.
Rita et al. (2021) telah melakukan uji aktivitas antibakteri dari ekstrak n-heksana kulit pisang susu (Musa x paradisiaca L.), pada konsentrasi 25%, ekstrak dapat menghambat pertumbuhan S. aureus sebesar 6,00 mm. Yanti (2020) melaporkan bahwa ekstrak n-heksana KPHL pada konsentrasi 20% mampu menghambat perkembangan S. aureus dan E. coli dengan daya hambat sebesar 11,00 serta 10,50 mm. Resaputra (2020) juga melaporkan bahwa ekstrak n-heksana kulit pisang seribu dapat menghambat pertumbuhan S. aureus dan E. coli yaitu masing-masing sebesar 10,5 mm. Keaktifan antibakteri ekstrak n-heksana dari ketiga kulit pisang tersebut kemungkinan disebabkan adanya senyawa-senyawa non polar baik asam-asam lemak, gliserida, dan lemak tidak tersabunkan seperti terpenoid, dan steroid. Gabungan senyawa-senyawa ini bisa berefek sinergis atau antagonis.
Asam lemak adalah asam organik baik sebagai ester trigliserida ataupun lemak, baik yang bersumber pada tumbuhan maupun hewan. Asam lemak terdiri dari asam lemak jenuh serta asam lemak tidak jenuh (Aisyah et al., 2019). Asam lemak yang berpotensi sebagai antibakteri diantaranya asam oleat, linoleat, palmitat, asam miristat, serta stearat (Kawaroe et al., 2012).
Ekstrak n-heksana kulit pisang hijau lumut memiliki aktivitas paling besar sebagai antibakteri dibandingkan dengan keaktifan ekstrak n-heksana kulit pisang susu, serta pecah seribu. Oleh karena itu analisis ini perlu dikerjakan guna menguji lebih lanjut bagaimana kekuatan ekstrak n-heksana untuk menghambat perkembangan bakteri dengan menentukan KHM dan KBM, serta mengidentifikasi kandungan senyawanya.
MATERI DAN METODE
Bahan
Bahan dalam analisis ini meliputi kulit buah pisang hijau lumut (Musa × paradisiaca L.) diambil di daerah Denpasar, Bali. Bakteri yang dipakai yakni Staphylococus aureus dan Escherichia coli yang diperoleh dari Laboratorium Mikrobiologi Fakultas
Kedokteran Unud Denpasar. Bahan kimia yang digunakan antara lain metanol (PA dan teknis), n-heksana (PA), akuades, pereaksi Mayer dan Wagner, HCl, serbuk Mg, FeCl3, Nutrient Agar (NA), Nutrient Broth (NB), alkohol 70%, KMNnO4, Tween 80, amoxicillin, NaOH, H2SO4 pekat, HCl pekat, dan NaSO4 anhidrat.
Peralatan
Alat dalam analisis ini adalah pisau, blender, timbangan analitik, cawan porselen, oven, desikator, corong gelas, kain kasa, kertas saring, rotary vacum evaporator, corong pemisah, tabung reaksi, plastik warp, labu ukur, cawan petri, pipet volume, pipet tetes, pipet mikro, bunsen, hotplate, magnetik stirer, autoklaf, stopwatch, Laminar Air Flow (LAF), jarum ose, kapas, penggaris, inkubator, statif, klem, dan Gas Chromatography-Mass Spectrometry (GCMS) Shimadzu/GCMS-QP2010 Ultra.
Persiapan Sampel dan Penentuan Kadar Air
Kulit pisang dicuci lalu ditiriskan, dipotong kecil-kecil kemudian dikeringkan selama 3 hari di ruangan terbuka. Kulit yang telah kering dihaluskan dengan cara diblender guna memperbesar luas permukaan. Analisis kadar air pada sampel dengan cara dioven cawan tempat sampel pada suhu 100oC sampai berat konstan. Sampel sejumlah 1 gram dalam cawan ditimbang lalu dipanaskan pada oven selama 1 jam (berat konstan) dengan suhu 1050C. Sampel dibiarkan dingin di desikator selanjutnya ditimbang. Tahapan ini diulang hingga dicapai massa tetap. Penentuan kadar air dicari menggunakan rumus:
Kadar Air (%) = (m0 ^m1) × 100% (m0) ....................(1)
Dimana:
m0 = Massa sampel awal
m1 = Massa sampel setelah pemanasan
Ektraksi dan partisi
Sebanyak 1 kg serbuk kering kulit pisang dimaserasi dengan pelarut methanol 99%. Ekstrak disaring sehingga terpisah residu dan filtrat. Residunya dimaserasi ulang memakai pelarut yang serupa hingga 3 kali pengulangan. Filtrat yang diperoleh disatukan dan diuapkan pada tekanan serta suhu rendah menggunakan rotary vacuum evaporator, maka diperoleh ekstrak kental metanol.
Ekstrak tersebut dicampurkan menggunakan cairan metanol:air (7:3) dan setelah metanolnya diuapkan maka didapatkan ekstrak air. Ekstrak air tersebut selanjutnya dipartisi memakai n-heksana hingga didapat ekstrak n-heksana. Ekstrak n-heksana diuapkan dan diperoleh ekstrak kental n-heksana, kemudian diuji antibakteri, dan identifikasi menggunakan GC-MS.
Uji aktivitas antibakteri
Uji aktivitas antibakteri KPHL dilakukan dengan metode sumur difusi. Enam cawan petri berisi 20 mL media NA dan 100 μL suspensi bakteri uji (3 petri untuk S. aureus dan 3 petri untuk E. coli). Selanjutnya sumur difusi dibuat pada substrat NA yang sudah mengeras memakai cork borer ukuran 0,5 cm yang telah steril lalu ditekan pada wadah hingga tercipta sumur difusi, masing-masing wadah dibuat 4 sumuran. Ekstrak kasar n-heksana dengan konsentrasi 100; 50; 25; 12,5; 6,25; dan 3,125; 1,560; 0,780%; kontrol negatif (Tween 10%); serta kontrol positif (amoxicillin 0,03%), masing-masing sejumlah 20 μL ditambahkan pada sumur difusi yang sudah berisi kultur S. aureus dan E. coli lalu diberi tanda, selanjutnya diinkubasi selama 24 jam pada suhu 370C. Uji dilakukan dengan 3 kali pengulangan.
Zona bening yang muncul setelah inkubasi di daerah sekeliling sumur merupakan zona hambat bakteri dan diukur berdasarkan diameter (mm). Konsentrasi sampel terkecil yang berhasil menahan kenaikan bakteri (ditandai adanya zona bening) dinyatakan menjadi KHM. KBM dapat diketahui dengan cara inkubasi kembali hasil tes KHM yang sudah dikerjakan sebelumnya. KBM merupakan konsentrasi paling rendah yang mana pada zona bening tidak terdapat pertumbuhan koloni bakteri.
Identifikasi dengan GC-MS (Gas
Chromatography-Mass Spectrometry)
Ekstrak kasar n-heksana dimasukkan ke alat GC-MS guna menganalisis lebih lanjut. Spesifikasi instrument GC-MS yang dipakai yakni Gas Chromatography (GC) Agilent seri 7890B digabung dengan Mass Spectrometry (MS) Agilent seri 5977B, kolom yang digunakan HP 5, gas pembawa helium, model splitles, serta temperature injector 290℃. Ekstrak diinjeksi kedalam inlet mesin GC (Gas Chromatography), selanjutnya produk pemecahan GC dilanjutkan ke mesin MS (Mass Spectrometry). Detektor ionisasi nyala GC (FID) kemudian menyuguhkan TRC (Total Respond Chromatogram), serta MS menyediakan informasi mengenai analisis tersendiri waktu retensi maupun puncak TRC.
HASIL DAN PEMBAHASAN
Ekstraksi KPLH
Hasil preparasi sampel diperoleh bubuk daun pisang yang berwarna coklat tua dengan kadar air sebesar 7,66%. Ekstraksi serbuk sampel daun pisang dikerjakan dengan metode maserasi memakai pelarut metanol. Pelarut metanol digunakan pada proses maserasi sebab sifatnya yang universal yaitu bisa meluluhkan nyaris seluruh senyawa organik (baik polar, semipolar ataupun non polar) hingga membuahkan ekstrak yang maksimal. Kondisi ini dikarenakan metanol mempunyai gugus fungsi hidroksil (-OH) yang bersifat polar dan gugus fungsi metil (-CH3) bersifat non polar (Astarina et al., 2013). Maserasi 1000 g serbuk kulit pisang hijau lumut dalam 10 liter metanol menghasilkan ekstrak kental sebesar 120,34 gram yang bewarna coklat kehitaman dengan rendemen sebesar 12,034%.
Screening Fitokimia
Sreening fitokimia dengan pereaksi pendeteksi warna menunjukkan bahwa esktrak kasar n-heksana mengandung fenol, steroid, dan triterpenoid. Hsil uji tersebut disajikan dalam Tabel 1.
Tabel 1. Hasil Screening Fitokimia
|
Uji Fitokimia |
Pengamatan |
Hasil | |
|
Uji Alkaloid • Pereaksi Mayer (Endapan putih) |
Orange |
Tidak terjadi perubahan |
Negatif |
|
• Pereaksi Wagner (Endapan coklat) |
Orange |
Tidak terjadi perubahan |
Negatif |
|
Uji Flavonoid • MgHCl (kuning, jingga, merah) |
Orange |
Memudar |
Negatif |
|
Uji fenol • FeCl3 (hijau/biru kehitaman) |
Orange |
Hijau kehitaman |
Positif |
|
Uji terpenoid/steroid • Lieberman-Burchad (steroid: hijau-biru terpenoid: merah-ungu) |
Orange |
Kehijauan dan Merah magenta |
Positif steroid dan terpenoid |
Teridentifikasinya golongan senyawa fenol pada ekstrak ditunjukkkan dengan perubahan warna dari orange menjadi hitam kehijauan. Hal tersebut dikarenakan ion hidroksi dari campuran fenol beraksi bersama Fe3+ pada pereaksi FeCl3 menghasilkan campuran kompleks seperti yang ditunjukkan pada reaksi seperti Gambar 1.
Adanya terpenoid ditunjukkan dengan perubahan warna menjadi warna merah keunguan, sementara untuk steroid menghasilkan warna hijau biru. Kondisi ini didasarkan pada kesanggupan sintesis triterpenoid dan steroid menciptakan warna karena adanya pelarut H2SO4 dan asam asetat anhidrid. Perbandingan warna yang tercipta dengan triterpenoid dan streoid dikarenakan beda gugus di atom C-4 (Iskandar, 2020).
Adapun proses kimia yang berlangsung sesuai dalam Gambar 2.
Menurut Ehiowemwenguan et al. (2014) senyawa metabolit sekunder semacam fenol, steroid, dan triterpenoid terbukti mempunyai sifat antibakteri. Senyawa golongan fenol berfungsi menjadi antibakteri dengan cara menonaktifkan protein dalam polikel sel bakteri. Dimana fenol yang terhubung oleh protein akan mengganggu sistem selaput bakteri, akibatnya bakteri mengalami lisis (Mahardani dan Yuanita, 2021). Senyawa triterpenoid bereaksi dengan cara merusak porin di membran luar dinding sel bakteri akibatnya sel kehilangan nutrisi dan terjadi gangguan perkembangan bakteri (Wulansari et al., 2020).
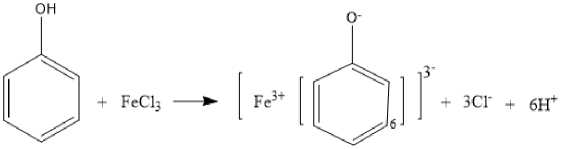
Gambar 1. Reaksi pembentukan senyawa kompleks dari fenol dengan FeCl3
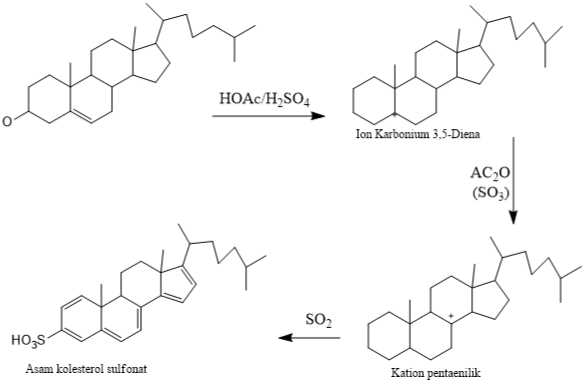
Gambar 2. Mekanisme proses uji steroid dan terpenoid
Uji Aktivitas Antibakteri
Uji keaktifan antibakteri ekstrak kasar n-heksana dibuat dengan variasi konsentrasi antara lain 100; 50; 25; 12,5; 6,25; 3,125; 1,56; dan 0,78% dengan cara diencerkan memakai tween-80 10%. Kontrol positif yang dipakai yaitu amoxicillin 0,03% serta kontrol negatif yang dipakai yakni tween-80 10%. Kontrol negatif berfungsi untuk mengetahui pengaruh pelarut terhadap pertumbuhan kedua bakteri. Tween-80 merupakan surfaktan yang pada konsentrasi 1-10% berfungsi sebagai pengemulsi bahan yang kurang larut (Gunawi et al., 2015).
Ekstrak kasar n-heksana memiliki nilai KHM pada 3,125% atas terhadap bakteri S. aureus sebesar 6,30 mm dan E. coli sejumlah 6,10 mm. Kategori daya hambat perkembangan bakteri ialah diameter zona keruh ≥ 20 mm
masuk di kategori sangat kuat, 10 - 20 mm kategori kuat, 5 - 10 mm kategori sedang serta 5 mm atau kurang dikategorikan lemah, maka untuk aktivitas ekstrak n-heksana KPHL pada konsentrasi 3,125% menghambat bakteri S. aureus dan E. coli dengan kategori sedang. Pengujian KBM ekstrak juga dilakukan terhadap kedua bakteri, dimana konsentrasi terendah ekstrak kasar n-heksana yang tidak terdapat pertumbuhan bakteri pada zona bening untuk bakteri S. aureus dan E. coli masing-masing sebesar 50% dengan daya hambat masing-masing 8,60 dan 8,10 mm. Perbandingan aktivitas ekstrak kasar n-heksana terhadap bakteri S. aureus dan E. coli dengan konsentrasi yang berdeda disajikan pada Gambar 3 dan 4.
Tabel 2. Hasil Penentuan KHM Ekstrak Kasar n-Heksana
|
Konsentrasi (%) |
Daya Hambat (mm) | |
|
S. aureus |
E. coli | |
|
100 |
9,00 |
8,83 |
|
50 |
8,60 |
8,10 |
|
25 |
7,50 |
7,20 |
|
12,5 |
7,00 |
6,70 |
|
6,25 |
6,60 |
6,50 |
|
3,125 |
6,30 |
6,10 |
|
1,560 |
0,00 |
0,00 |
|
0,780 |
0,00 |
0,00 |
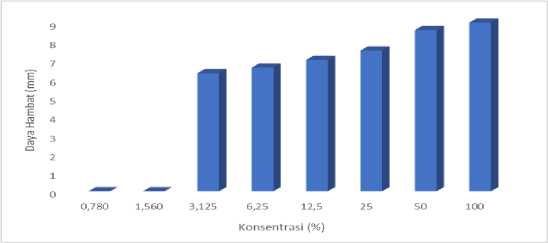
Gambar 3. Perbandingan aktivitas ekstrak kasar n-heksana pada bakteri Staphylococcus aureus dengan konsentrasi yang berbeda
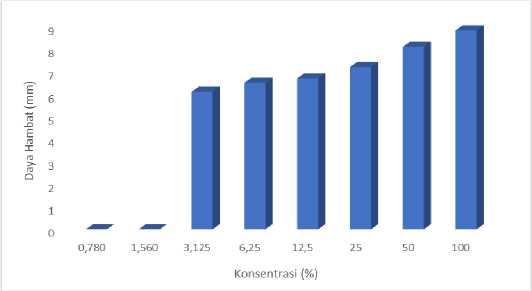
Gambar 4. Perbandingan aktivitas ekstrak kasar n-heksana pada bakteri Escherichia coli dengan konsentrasi berbeda
Berdasarkan Gambar tampak bahwa daya hambat perkembangan bakteri lebih besar terhadap bakteri S. aureus daripada bakteri E. coli, hal tersebut karena bakteri S. aureus tergolong dalam gram positif, dimana golongan bakteri ini cenderung lebih sensitif dari pada bakteri gram negatif sebab penyusun sistem sel bakteri gram positif tidak kompleks dan mengakibatkan zat antibakteri lebih gampang memasuki sel bakteri gram positif (Sinarsih et
al., 2016). Data hasil pengujian aktivitas antibakteri ekstrak selanjutnya dilakukan analisis dengan software IBM SPSS 25.0 dengan uji One Way ANOVA untuk mencari apakah data terdistribusi normal, bersifat homogen, serta menanggapi ada tidaknya perbedaan daya hambat yang signifikan pada varian konsentrasi. Hasil uji normalitas data ekstrak kasar n-heksana dapat dilihat pada Tabel 3.
Tabel 3. Hasil Uji Normalitas Ekstrak Kasar n-Heksana
|
Konsentrasi (%) |
Daya Hambat (mm) |
P* S. aureus |
P* E. coli | |
|
S. aureus |
E. coli | |||
|
0 |
0,00 ± 0,00 |
0,00 ± 0,00 |
- |
- |
|
0,780 |
0,00 ± 0,00 |
0,00 ± 0,00 |
- |
- |
|
1,560 |
0,00 ± 0,00 |
0,00 ± 0,00 |
- |
- |
|
3,125 |
6,25 ± 0,25 |
6,08 ± 0,38 |
1,000 |
0,637 |
|
6,25 |
6,58 ± 0,42 |
6,50 ± 0,41 |
0,463 |
1,000 |
|
12,5 |
7,00 ± 0,25 |
6,66 ± 0,38 |
1,000 |
0,637 |
|
25 |
7,50 ± 0,36 |
7,16 ± 0,40 |
0,363 |
0,463 |
|
50 |
8,58 ± 0,42 |
8,08 ± 0,24 |
0,463 |
0,253 |
|
100 |
9,00 ± 0,39 |
8,83 ± 0,26 |
1,000 |
0,637 |
Keterangan : P* = Data terdistribusi normal pada signifikan (p > 0,05)
Berdasarkan Tabel 3 terlihat bahwa data pada ekstrak kasar n-heksana variasi berbagai konsentrasi terdistribusi normal, dikarenakan nilai signifikan (p) pada uji normalitas lebih dari 0,05. Selain data terdistribusi normal, ekstrak juga diuji homogenitasnya. Uji homogenitas ekstrak disajikan pada Tabel 4.
Tabel 4 menunjukkan data pada ekstrak bersifat homogen, karena nilai signifikan pada
uji homogenitas > 0,05. Selanjutnya uji LSD (Least Significant Different) dilakukan untuk menentukan ada tidaknya perbedaan signifikan pada setiap konsentrasi. Adapun Adapun uji LSD tiap ekstrak bisa dilihat di Tabel 5. Tabel tersebut mengindikasikan bahwa tiap konsentrasi ekstrak pada umumnya berbeda secara signifikan.
Tabel 4. Hasil Uji Homogenitas Ekstrak Kasar n-Heksana
|
Ekstrak |
Nilai Signifikan |
|
S. aureus E. coli | |
|
Kasar n-heksana |
0,451 0,312 |
Ekstrak Kasar n-Heksana
|
S. aureus |
E. coli | |
|
0 |
0,00 ± 0,00 a |
0,00 ± 0,00 a |
|
0,780 |
0,00 ± 0,00 a |
0,00 ± 0,00 a |
|
1,560 |
0,00 ± 0,00 a |
0,00 ± 0,00 a |
|
3,125 |
6,25 ± 0,25 b |
6,08 ± 0,38 b |
|
6,25 |
6,58 ± 0,42 c |
6,50 ± 0,41 c |
|
12,25 |
7,00 ± 0,25 d |
6,66 ± 0,38 d |
|
25 |
7,50 ± 0,36 e |
7,16 ± 0,40 e |
|
50 |
8,58 ± 0,42 f |
8,08 ± 0,24 f |
|
100 |
9,00 ± 0,39 g |
8,83 ± 0,26 g |
Tabel 5. Perolehan Uji LSD (Least Significant Different) Ekstrak Kasar n-Heksana
Daya Hambat (mm)
Konsentrasi (%)
Identifikasi dengan GC-MS (Gas Chromatography-Mas Spectrometry)
Hasil analisis ekstrak kasar n-heksana berupa kromatogram dengan waktu retensi yang bervariasi. Berdasarkan analisis kromatogram diperoleh 16 puncak utama. Masing-masing puncak ditentukan ion molekulernya dengan mencocokkan salah satu spektra melalui pendekatan database untuk menentukan senyawa yang terkandung pada ekstrak.
Perkiraan senyawa yang aktif sebagai antibakteri diantaranya trans-kariofilena pada waktu retensi 8,751 menit. Kariofilena (C15H24) merupakan senyawa sesquiterpen alami (Ghelardini et al., 2001) serta aktif sebagai
antibakteri (Yustiningsih, 2020; Wulandari, 2020). Penilitian mengenai uji aktivitas antibakteri senyawa kariofilena pernah dilakukan oleh Ramadhani et al. (2020) dimana senyawa kariofilena mampu menghambat bakteri E. coli sebesar 11,67 mm di konsentrasi 4%. Waktu retensi 13,010 menit diperoleh senyawa oktadekana, dimana oktadekana merupakan alkana rantai lurus yang membawa 18 atom karbon serta mempunyai peran sebagai metabolit bakteri (Cepeda et al., 2020). Amalia et al. (2014) melaporkan bahwa oktadekana sanggup menghalangi perkembangan bakteri Staphylococcus aureus sejumlah 11,17 mm di 20.000 ppm atau 20 mg/mL.
p-ISSN 1907-9850
e-ISSN 2599-2740
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 18 (1), JANUARI 2024 DOI: https://doi.org/10.24843/JCHEM.2024.v18.i01.p08
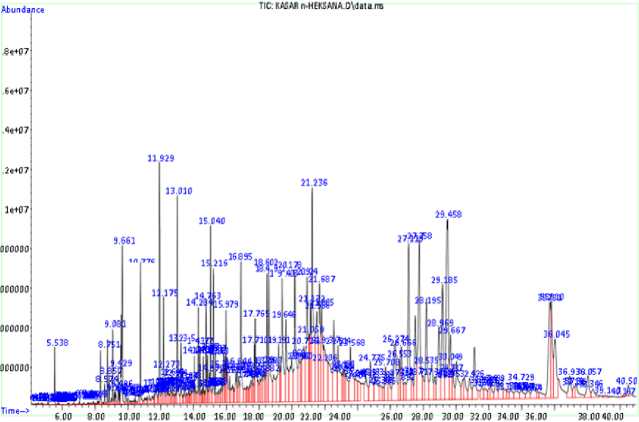
Gambar 5. Kromatogram ekstrak kasar n-heksana
Hasil analisis pada waktu retensi 14,284 menit ialah metil heksadekanoat (metil palmitat) dimana senyawa ini tergolong senyawa organik yang diketahui sebagai metil ester asam lemak. Karunia et al. (2017) menyatakan bahwa metil palmitat berperan menjadi antibakteri dan mampu menghalangi perkembangan bakteri S. aureus dan E. coli pada konsentrasi 100%. Padmini et al. (2010) juga menyatakan bahwa metil palmitat mempunyai karakter sebagai antibakteri dengan cara mengacau susunan selaput serta membran sel lewat proses sinergis dengan bermacam senyawa aktif maka mampu menaikkan dampak dari keaktifan antibakteri. Waktu retensi 20,119 menit diperoleh senyawa stigmasterol. Stigmasterol mempunyai kemampuan menghalangi perkembangan bakteri S. aureus dan E. coli di konsentrasi 6,25 µg/mL masing-masing sejumlah 29 dan 24 mm (Yusuf et al., 2019). Edilu et al. (2015) melaporkan bahwa keaktifan antibakteri in vitro stigmasterol menghambat bakteri S. aureus dan E. coli pada area hambatan mulai dari 12 mm hingga 18 mm di konsentrasi yang lebih tinggi (50 mg/mL).
SIMPULAN
Perolehan uji keaktifan antibakteri membuktikan bahwa KHM dari ekstrak kasar n-heksana kulit pisang hijau sebesar 3,125% atas bakteri S. aureus dan E. coli sedang KBM ekstrak kasar n-heksana pada 50% terhadap bakteri S. aureus dan E. coli. Senyawa aktif sebagai antibakteri ekstrak kasar n-heksana
yang didapat diantaranya kariofilena, oktadekana, metil heksadekanoat (metil palmitat), dan stigmasterol.
DAFTAR PUSTAKA
Aisyah, N. F., Aisyah, N., Kusuma, T. S., dan Widyanto, R. M. 2019. Profil Asam Lemak Jenuh Dan Tak Jenuh serta Kandungan Kolesterol Nugget Daging Kelinci New Zealand White (Oryctolagus cuniculus). Jurnal AL-Azhar Indonesia Seri Sains Dan Teknologi. 5(2):92-100.
Amalia, S., Wahdaningsih, S., dan Untari, E. K. 2014. Uji Aktivitas Antibakteri Fraksi N-Heksan Kulit Buah Naga Merah (Hylocereus polyrhizus Britton & Rose) Terhadap Bakteri Staphylococcus aureus ATCC 2592. Jurnal Fitofarmaka Indonesia. 1(2):61-64.
Astarina, N. W. G., Astuti, K. W., dan Warditiani, N. K. 2013. Skrining Fitokimia Ekstrak Metanol Rimpang Bangle (Zingiber purpureum Roxb.). Jurnal Farmasi Udayana. 2(4):1-7.
Bhaskara, I. B. A., Hendrayana, M. A., dan Pinatih, K. J. P. 2019. Identifikasi Bakteri Escherichia coli,
Staphylococcus aureus, dan Salmonella sp. pada Kenop Pintu Keluar Toilet Umum Pria dan Wanita di Kampus Fakultas Kedokteran Universitas Udayana Denpasar. Jurnal Medika Udayana. 8(8):1-9.
Brooks, G. F., Carroll, K. C., Butel, J. S., Morse, S. A. dan Mietzner, T. A. 2012. Mikrobiologi Kedokteran Jawetz, Melnick, dan Adelberg. Edisi 23. a.b Huriawati, Hartanto Chaerunnisa Rachman, Alifa Dimanti, dan Aryana Diani. EGC. Jakarta.
Cepeda, G. N., Lisangan, M. M., dan Silamba, I. 2020. Kandungan Senyawa Fenolik Dan Terpenoid Ekstrak Etilasetat Daun Drimys piperita Phenolic and Terpenoid Compounds Content of Ethylacetate extracts of Drimys piperita Leaves. Agritechonoly. 3(1):21-27.
Edilu, A., Adane, L., dan Woyessa, D. 2015. In vitro antibacterial activities of compounds isolated from roots of Caylusea abyssinica. Annals of Clinical Microbiology and Antimicrobials. 1-8.
Ehiowemwenguan, G., Emoghene, A. O., and Inetianbor, J. E. 2014. Antibacterial and Phytochemical Analysis of Banana Fruit Peel. IQSR Journal of Pharmacy. 4(8):18-25.
Ghelardini, C., Galeotti, N., Mannelli, L. D. C., Mazzanti, G., dan Bartolini, A. 2001. Local anaesthetic activity of β-caryophyllene. IL Farmaco. 56:387389.
Gunawi, R. H., Kurniawan, D. W., dan Ratna, U. V. V. F. 2015. Peningkatan Laju Disolusi Tablet Piroksikam
Menggunakan Polisorbat 80. Acta Pharmaciae Indonesia. 1(1):8-15.
Iskandar, D. 2020. Aplikasi Uji Skrining Fitokimia terhadap Daun Uncaria tomentosa Sebagai Bahan Utama Dalam Pembuatan Teh. Jurnal
Teknologi Technoscientia. 12(2):153-158.
Karunia, S. D., Supartono, dan Sumarni, W. 2017. Analisis Sifat Antibakteri Ekstrak Biji Srikaya (Annona
Squamosa L) Dengan Pelarut Organik. Indonesian Journal of Chemical Science. 6(1):56-60.
Kawaroe, M., Tri, P., Ayi, R., dan Dahlia, Y. 2012. Laju Pertumbuhan Spesifik dan Kandungan Asam Lemak pada Mikroalga Spirulina platensis, Isochrysis sp. dan Porphyridium
cruentum. Jurnal Ilmu Kelautan.
17(3):125-131.
Mahardani, O. T dan Yuanita, L. 2021. Efek Metode Pengolahan dan Penyimpanan terhadap Kadar Senyawa Fenolik dan Aktivitas Antioksidan. UNESA Journal of Chemistry. 10(1):64-78.
Ramadhani, F. A., Warsinah, dan Wijaya, T. H. 2020. Identifikasi Senyawa Fraksi n-Heksana Daun Jeruju (Acanthus ilicifolius L) dan Aktivitas Antibakteri terhadap Escherichia coli dan Shigella dysenteriae. Thesis. Universitas
Jenderal Soedirman. Purwokerto.
Resaputra, I. H. 2020. Uji Aktivitas Antibakteri Kulit Pisang Pecah Seribu (Musa × paradisiaca L.) Terhadap Bakteri
Staphylococcus aureus dan Escherichia coli Serta Identifikasi Senyawa Aktifnya. Skripsi. Universitas Udayana. Denpasar.
Rita, W. S., Asih, I. A. R. A, Swantara, I M. D., and Damayanti, N. L. Y. 2021. Antibacterial Activity of Flavonoids from Ethyl Acetate Extract of Milk Banana Peel (Musa x paradisiaca L.). Hayati Journal of Biosciences, 28(3): 223-231.
Rita, W. S., Swantara, I M. D., Asih, I. A. R. A., and Puspawati, N. M. 2020. Antibacterial Activity and Antioxidant Capacity of Selected Local Banana Peel (Musa sp.) Methanol Extracts Cultivated In Bali. International Journal of Agriculture, Environment and Bioresearch, 5(3): 242-251.
Rubiyanto, D., Hady, A., Hardjono, S., and Chairil, A. 2014. Antibacterial Activities of Green Basil (Ocimum violaceum) Essential Oil and
Derivatives By MAOS (Microwave Assisted Organic Synthesis) Against Staphyllococus aureus and Escherichia coli. Jurnal Kimia. 14(1):1-19.
Sinarsih, N. K., Rita, W. S., dan Puspawati, N. M. 2016. Uji Efektivitas Ekstrak Daun Trembesi (Samanea saman (jacq.)
Merr) Sebagai Antibakteri Escherichia coli dan Staphylococcus aureus. Cakra Kimia. 4(2):120-128.
Yanti, N. K. L. E. 2020. Uji Aktivitas Antibakteri Kulit Pisang Hijau Lumut (Musa × paradisiaca L.) Terhadap Bakteri Staphylococcus aureus dan Escherichia coli Serta Identifikasi
|
Senyawa Aktifnya. Skripsi. Universitas Udayana. Denpasar. Yustiningsih, Y. P. 2020. Aktivitas Antibakteri Minyak Atsiri Tumbuhan Suku Asteraceae Dan Aplikasinya Dalam Bentuk Sediaan Antibakteri. Thesis. Universitas Atma Jaya Yogyakarta. Yogyakarta. Yusuf, A. J., Abdullah, M. I., Aleku, G. A., Ibrahim, I. A. A., Alebiosu, C. O., Yahaya, M., Adamu, H. W., Sanusi, A., Mailafiya, M. M., dan Abubakar, H. 2018. Antimicrobial activity of stigmasterol from the stem bark of Neocarya macrophylla. Journal of |
Medicinal Plants for Economic Development. 2(1):2-5. Wulandari, T. 2020. Karakterisasi Minyak Atsiri Tanaman Jahe (Zingiber officinale) dari Daerah Kabupaten Solok dengan Gas Chromatograpy Mass Spectrometry (Gc-Ms) Serta Uji Aktivitas Antibakteri. Thesis. Universitas Andalas. Padang. Wulansari, E. D., Lestari, D., dan Khoirunissa, M. A. 2020. Kandungan Terpenoid dalam Daun Ara (Ficus Carica L.) Sebagai Agen Antibakteri terhadap Bakteri Methicillin-Resistant Staphylococcus aureus. PHARMACON. 9(2):219-225. |
60
Discussion and feedback