EFEKTIVITAS JINTEN HITAM (Nigella sativa) DALAM UPAYA PENYISIHAN BAKTERI Escherichia coli PADA AIR DARI SUMBER MATA AIR DI KECAMATAN SELEMADEG BARAT KABUPATEN TABANAN
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 17 (1), JANUARI 2023 DOI: https://doi.org/10.24843/JCHEM.2023.v17.i01.p14
p-ISSN 1907-9850
e-ISSN 2599-2740
EFEKTIVITAS JINTEN HITAM (Nigella sativa) DALAM UPAYA PENYISIHAN BAKTERI Escherichia coli PADA AIR DARI SUMBER MATA AIR DI KECAMATAN SELEMADEG BARAT KABUPATEN TABANAN
K. Swandiyasa, I W. B. Suyasa* dan I G. A. K. S. P. Dewi
Program Studi Magister Kimia Terapan Fakultas Pascasarjana, Universitas Udayana, Jalan P.B. Sudirman, Denpasar-Bali, Indonesia
Email: budiarsa_suyasa@unud.ac.id
ABSTRAK
Telah dilakukan penelitian tentang uji daya hambat ekstrak air jinten hitam (Nigella sativa L.) terhadap penyisihan bakteri Escherichia coli pada air yang terdapat di sumber mata air Desa Tiying Gading Kecamatan Selemadeg Barat Kabupaten Tabanan. Penelitian ini bertujuan untuk mengetahui kemampuan alat penyaring air dengan kombinasi bahan alami (pasir halus, jinten hitam dan karbon aktif), mengetahui kemampuan daya hambat ekstrak air jinten hitam terhadap pertumbuhan bakteri E. coli, serta mengetahui dosis dan waktu kontak optimum ekstrak air jinten hitam dalam menghambat pertumbuhan bakteri E. coli. Metode yang digunakan adalah Plate Count Agar (PCA) dengan media pertumbuhan Cromocult Coliform agar (CCA). Didapatkan hasil bahwa ekstrak dan residu jinten hitam mampu menyisihkan berturut-turut sebesar 99,995% dan 88,095%, dengan dosis optimum 15 mL ekstrak jinten hitam pada waktu kontak 5 menit dan 15 mg residu jinten hitam pada waktu 10 menit. Laju kematian bakteri Escherichia coli tertinggi adalah 1,722/menit untuk ekstrak jinten hitam dan 1,423/menit pada residu jinten hitam. Ekstrak jinten hitam menunjukkan hasil yang lebih unggul dibandingkan dengan residu jinten hitam. Adanya senyawa seperti thymoquinone pada ekstrak jinten hitam dapat meningkatkan kemampuan mengeliminasi bakteri Escherichia coli.
Kata kunci: daya hambat, dosis, Escherichia coli, jinten hitam (Nigella sativa), waktu kontak.
ABSTRACT
Research has been conducted on the inhibition test of black cumin water extract (Nigella sativa L.) against the elimination of Escherichia coli bacteria in water found in the spring of Tiying Gading Village, Selemadeg Barat District, Tabanan Regency. This study aimed to determine the ability of water filters with a combination of natural materials (fine sand, black cumin and activated carbon) and the inhibition ability of black cumin water extract against the growth of E. coli bacteria, as well as the optimum dose and contact time of the black cumin water extract in inhibiting the growth of E. coli bacteria. The method used was Plate Count Agar (PCA) with Cromocult Coliform Agar (CCA) growth media. The results showed that black cumin extract and residue were able to remove 99.995% and 88.095%, respectively, with an optimum dose of 15 mL of black cumin extract at a contact time of 5 minutes, and 15 mg of black cumin residue at a contact time of 10 minutes. The highest death rate of Escherichia coli bacteria was 1.722/min for black cumin extract and 1.423/min for black cumin residue. The black cumin extract showed superior results compared to the black cumin residue. The presence of compounds such as thymoquinone in black cumin extract can increase the ability to eliminate Escherichia coli bacteria.
Keywords: black cumin, contact time, dosage, Escherichia coli, inhibition power, Nigella sativa (black cumin).
PENDAHULUAN
Air bagi kehidupan manusia merupakan salah satu sumber daya alam yang penting. Kebutuhan air untuk keperluan sehari-hari sangat kompleks antara lain untuk minum, mandi, masak, mencuci dan sebagainya. Sumber utama dari air adalah air permukaan dan air tanah, contohnya sumber mata air.
Kualitas sumber air ini sangat bervariasi, tergantung pada lokasi dan faktor lingkungan (Vilane dan James, 2016). Pemanfaatan sumber mata air di Pulau Bali sangat banyak terutama di daerah pedesaan salah satunya di Desa Tiying Gading Kecamatan Selemadeg Barat Kabupaten Tabanan. Sumber mata air ini digunakan sebagai pasokan utama air minum maupun sanitasi masyarakat.
Hasil uji pendahuluan yang telah dilakukan air pada sumber mata air di Desa Tiying mengandung bakteri total Coliform dan Fecal Coliform diatas baku mutu air minum. Tingginya aktifitas pertanian pada daerah sumber mata air berpotensi menyebabkan tingginya cemaran bakteri pada mata air. Rata-rata setiap pemukiman penduduk di Desa Tiying Gading memiliki kendang hewan ternak, dimana jarak antara kendang ternak dengan sumber mata air berdekatan.
Total Coliform adalah suatu kelompok bakteri yang digunakan sebagai indikator adanya polusi kotoran. Total Coliform dibagi menjadi dua golongan, yaitu Coliform Fecal, seperti Escherichia coli yang berasal dari tinja manusia dan hewan. Penyakit yang disebabkan oleh bakteri E. coli antara lain diare, muntaber, dan disentri. Hasil studi Luby et al. (2015) menyatakan bahwa kontaminasi E. coli dari sampel air berhubungan dengan peningkatan prevalensi diare. Pada tahun 2018 kasus diare ditemukan di Kabupaten Tabanan sebanyak 11,975 kasus (DINKES Kab. Tabanan, 2018). Dalam kurun waktu 10 tahun, Indonesia telah mengalami Kejadian Luar Biasa (KLB) sebanyak sepuluh kali, dan sebanyak dua kali terjadi di Kabupaten Tabanan.
Salah satu upaya yang dilakukan untuk menurunkan kontaminasi bakteri pada air dengan memanfaatkan bahan yang berasal dari alam seperti biji jinten hitam (Nigella sativa) yang dapat berperan sebagai antibakteri. Menurut Okwu, et al. (2020), jinten hitam memiliki potensi sebagai antibakteri Staphylococcus aureus, Escherichia coli dan Pseudomonas aeruginosa. Kandungan Thymohydroquinone yang terdapat pada biji jinten hitam dapat memberikan efek antimikroba terhadap mikroba gram negatif seperti E. coli (Aboul-Ela, 2002).
Salah satu pengelolaan air dapat dilakukan dengan penyaringan sederhana. Penelitian ini bertujuan untuk merancang alat pengolahan air dengan sistem penyaringan air tanah skala kecil dari kombinasi bahan alami pasir sungai halus, biji jinten hitam (Nigella sativa) dan karbon aktif.
Pasir sungai halus berfungsi untuk menyaring pengotor pada air tanah. Jinten hitam digunakan sebagai desinfektan bakteri E. coli. Karbon aktif berfungsi sebagai penyerap bau yang dihasilkan dari senyawa organik biji jinten hitam, karena karbon aktif mempunyai
daya serap yang tinggi sehingga air yang dihasilkan menjadi tidak berbau, berasa serta beracun (Novia, 2019).
Tujuan penelitian ini untuk membuat alat pengolahan air sederhana dengan bahan alami seperti pasir sungai halus, biji jinten hitam (Nigella sativa) dan karbon aktif. Uji waktu kontak ekstrak dan residu jinten hitam juga dilakukan agar mengetahui waktu kontak optimum bahan dalam mengeliminasi bakteri E. coli.
MATERI DAN METODE
Bahan
Sampel air sumber mata air Desa Tiying Gading, Aquades, H2SO4 pekat, K2Cr2O7, MnSO4, alkali iodide azida, indikator amilum, Na2S2O3, Iodida alkali (pereaksi Winkler), larutan Mangan sulfat / MnSO4 48 %, Natrium tiosulfat 0,025 N, pereaksi asam sulfat (Ag2SO4, H2SO4 pekat), asam sulfamat (NH2SO3H), dan larutan standar KHP/Kalium Hidrogen Phtalat (HOOCC6H4COOK), dry ice, agar Mueller Hinton, pasir sungai yang telah dihaluskan, biji jinten hitam kering, dan karbon aktif.
Peralatan
Wadah Sampel Air (Botol Sampel), DO-meter, pH-meter, conductivity meter, hygrometer, cool box, buret, pipet mikro, pipet tetes, gelas kimia, erlenmeyer, tabung reaksi, hot plate, pipet volume, cawan petri, bunsen spritus, kertas saring, inkubator, tabung kaca steril, oven, instrument Colony counter, UV-Vis, AAS, pompa tekanan 100 Psi 240 VDC, adaptor AC/DC, filter housing 10” ¼, filter kosong 10”.
Cara Kerja
Pengambilan dan Pemeriksaan Sampel Air
Metode yang digunakan dalam pengambilan sampel air yaitu dengan cara pengambilan sampel air pada satu titik pengukuran dengan menggunakan alat berupa botol sampel yang terbuat dari kaca kemudian disimpan dalam cooling box untuk pengujian parameter fisika, dan parameter kimia. Sementara itu, untuk parameter biologi digunakan botol kaca yang telah steril. Untuk parameter suhu dan pH, pengukuran dilakukan secara langsung pada titik pengambilan sampel (In situ). Pengukuran pH, BOD, COD, sulfat,
nitrat, nitrit, magnesium (Mg), besi (Fe), Tembaga (Cu), seng (Zn), kadmium (Cd), E. coli dan total Coliform dilakukan di Laboratorium Kesehatan Provinsi Bali.
Pembuatan ekstrak air jinten hitam
Biji jinten hitam sebanyak 800 gram di keringkan pada suhu 55 °C selama 72 jam. Biji jinten hitam yang telah dikeringkan selanjutnya dihaluskan dengan blender dan diayak dengan saringan berukuran 50 mesh. Proses ekstraksi jinten hitam dilakukan dengan melarutkan 40 gram jinten hitam halus dengan 200 ml aquades dan dimasukkan ke dalam wadah kaca gelap tertutup. Bahan yang telah dimasukkan ke wadah diaduk dengan kecepatan 200 rpm selama 10 menit kemudian diamkan pada suhu ruangan selama 48 jam. ekstrak yang telah didiamkan selama 48 jam selanjutnya disaring dengan kertas filter Whatman No. 1 dengan ukuran pori 11 μm. Tahapan terakhir adalah filtrat atau residu dimasukkan ke dalam oven pada suhu 40 oC selama 72 jam sehingga ekstrak siap digunakan pada pengujian daya hambat bakteri E. coli.
Pembuatan Alat Penyaring Air
Tahapan pembuatan alat penyaring air: pertama membuat rangka, penyangga alat, kemudian filter housing dipasangkan pada rangka lalu pasangkan slang pada masing-masing filter housing, hingga tersambung ke kran air keluar. Sumber air dialirkan melalui slang yang terhubung ke pompa yang telah dipasangi dengan adaptor. Bahan-bahan yang telah disiapkan kemudian dimasukkan ke masing-masing filter dengan rasio 1:1:1 dengan komposisi sebagai berikut: pasir sungai halus sebanyak 800 gram, 800 gram bubuk jinten hitam, dan 800 gram karbon aktif. Urutan pertama dimasukkan 800 gram pasir sungai halus, urutan kedua masukkan 800 gram bubuk jinten hitam yang sebelumnya telah dipanaskan pada oven dengan suhu 55 oC, dan urutan terakhir masukkan 800 gram karbon aktif. Spoon dimasukkan pada bagian atas dan bawah filter, spoon berfungsi agar bahan tetap berada di dalam filter. Slang disambungkan ke sumber air yang bertekanan, pompa akan hidup secara otomatis jika dialiri air yang bertekanan dan alat sudah siap beroperasi. Skema alat penyaringan air dapat dilihat pada Gambar 1.
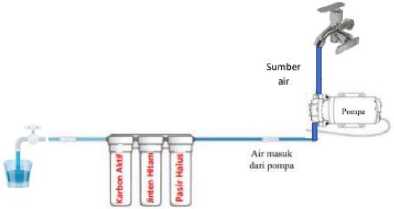
Gambar 1. Skema alat peyaring air
Uji Waktu Kontak
Pada tahap uji waktu kontak, sampel air yang dimasukkan biakan bakteri E. coli dengan jumlah yang telah ditentuk sesuai prosedur ISO 9308-1; 2014 tentang Enumeration of
Escherichia coli dan Coliform Bacteria menggunakan media CCA (Choromocult Coliform Agar). Masukkan sampel pada cawan petri dan inkubasi selama 24 jam pada suhu 37 oC, pengenceran dilakukan dari 10-0 hingga 105, akan terbentuk warna biru tua hingga ungu, selanjutnya hitung dengan instrument Colony counter.
Variasi dosis yang dipakai adalah 1, 5, 10 dan 15 mL untuk ekstrak jinten hitam, serta variasi dosis residu yaitu 1, 5, 10 dan 15 mg. Waktu kontak yang ditentukan 1, 5, 10 15, 30 dan 60 menit. Semua sampel digoyangkan pada kecepatan 200 rpm sesuai dengan waktu kontak tersebut.
Koloni E. coli dihitung menggunakan persamaan:
(CFU ∕ ∖ Jumlah Koloni
' 'TnL' (Pengenceran Sampel x Volume Sampel (mL)}
Penyisihan bakteri E. coli akibat penambahan ekstrak dan residu, untuk
memperoleh persentase penyisihan dan
perhitungan log reduksi menggunakan
persamaan:
. . . , . N0-N
Penyisihan Koloni Bakteri (P) = ---- X 100% Nq
Logreduksi = -(log10(-p∕100 + 1))
Kemampuan ekstrak air dan residu jinten hitam dalam proses penyisihan bakteri E. coli menggunakan persamaan:
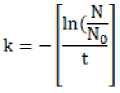
Dimana:
N :
N0 :
: Total E. coli pada waktu (t)
: Total E. coli pada waktu (t=0)
k : Laju kematian bakteri (1/menit)
t : Waktu kontak (menit)
(Hamdiyati, 2014)
Analisis Hasil
Data yang didapatkan dari penelitian adalah dosis dan waktu kontak jinten hitam. analisis statistik menggunakan uji Nonparametrik dengan Friedman test.
HASIL DAN PEMBAHASAN
Hasil Uji Pendahuluan Kualitas Air
Hasil pengukuran menunjukkan sumber mata air yang berada di Desa Tiying Gading dari aspek fisika dan kimia sudah memenuhi baku mutu. Pada aspek mikrobiologi belum memenuhi baku mutu karena bakteri total Coliform dan Fecal Coliform masih diatas baku mutu yang ditetapkan.
Penyisihan Bakteri Dengan Filtrasi Air
Hasil pengujian air sebelum penyaringan untuk parameter bakteri adalah 75 MPN/100 mL untuk total Coliform dan Fecal Coliform. Sehingga air belum memenuhi standar baku air minum karena pencemar mikrobiologi belum menunjukkan hasil 0 MPN/100 mL.
Selanjutnya air diolah pada alat selama ± 4 hari. Air hasil pengolahan selanjutnya diuji kembali untuk menguji kadar bakteri setelah filtrasi. Hasil dari uji air setelah filtrasi ± 4 hari adalah 0,545 MPN/100 mL untuk total Coliform dan
Fecal Coliform 0,328 MPN/100 mL. Pada tanggal 5 Oktober 2021 dilakukan pengujian air pada alat filtrasi kembali untuk melihat hasil setelah 2 bulan filtrasi, hasil yang didapatkan adalah 0,150 MPN/100 mL untuk total Coliform dan Fecal Coliform 0,112 MPN/100 mL. Dengan hasil ini bisa disimpulkan bahwa komposisi bahan yang terdapat dalam alat filtrasi efektif dalam mengurangi pencemaran bakteri dalam air, namun belum bisa secara total menghilangkan pencemaran bakteri sampai 0 MPN/100 mL.
Uji Penyisihan Bakteri Escherichia coli Menggunakan Ekstrak Air Jinten Hitam
Sampel yang diuji merupakan sampel hasil pengenceran dari 10-1 hingga 10-2, karena jumlah koloni belum diketahui secara pasti. Hasil pada sampel 10-3 hingga 10-5 tidak terlihat adanya koloni dikarenakan jumlah koloni bakteri pada sampel tidak banyak, sehingga pengenceran yang digunakan adalah 10-1 dan 10-2, selanjutnya dilakukan perhitungan hasil penyisihan bakteri E coli. Didapatkan penyisihan koloni E. coli sebagai berikut pada Tabel 1. Berdasarkan tabel tersebut, persentase penyisihan koloni E. coli tertinggi mencapai 99,995%. Kandungan senyawa yang terdapat pada jinten hitam adalah zat antibakteri thymoquinone yang dapat menghambat pertumbuhan bakteri E. coli (Hosseinzadeh et al., 2014).
|
Tabel 1. Variasi volume ekstrak air jinten hitam terhadap persentase penyisihan koloni E. coli | |||||
|
Waktu (menit) |
Volume Ekstrak (mL) | ||||
|
0 |
1 |
5 |
10 |
15 | |
|
1 |
0 |
37,864 |
61,165 |
54,368 | |
|
5 |
0 |
99,995 | |||
|
10 |
0 |
71,739 |
95,652 |
84,782 | |
|
15 |
0 |
94,531 |
37,5 |
68,75 | |
|
30 |
0 |
30,882 |
73,529 |
52,941 |
82,352 |
|
60 |
0 |
85 | |||
Tabel 2. Laju kematian bakteri E. coli setelah penambahan ekstrak air jinten hitam
Volume Waktu (menit)
|
(mL) |
1 |
5 |
10 |
15 |
30 60 |
|
1 |
0,476 |
0,014 |
0,012 0 | ||
|
5 |
0,126 |
0,194 |
0,044 | ||
|
10 |
0,946 |
0,314 |
0,031 |
0,025 | |
|
15 |
0,785 |
1,722 |
0,152 |
0,078 |
0,058 |
Laju kematian bakteri ditentukan untuk mengetahui kecepatan kematian sel bakteri dalam konsentrasi dimana bakteri berada. Laju kematian bakteri dari menit pertama hingga menit ke-60, didapatkan hasil laju kematian mengalami penurunan karena senyawa aktif yang terdapat dalam ekstrak air jinten hitam telah berkurang akibat berinteraksi dengan sel bakteri. Laju kematian tertinggi ekstrak air jinten hitam sebesar 1,722/menit pada volume ekstrak jinten hitam sebesar 15 mL di waktu kontak 5 menit. Ekstrak jinten hitam setiap 1 menit mampu menyisihkan 2 koloni bakteri.
Uji Penyisihan Bakteri Escherichia Coli Menggunakan Residu Jinten Hitam
Pengujian terhadap residu jinten hitam dilakukan pada pengenceran 10-1 dan 10-2. Pengenceran sampel tersebut digunakan karena melihat data pada pengujian ekstrak sebelumnya dan hasil yang didapatkan merupakan data pembanding, hasil dapat dilihat pada Tabel 3.
Tabel 3. Variasi massa residu jinten hitam terhadap persentase penyisihan koloni E. coli pada pengenceran sampel 10-1
|
Waktu (menit) |
Massa Residu (mg) | ||||
|
0 |
1 |
5 |
10 |
15 | |
|
1 |
0 |
48,785 |
52,632 |
53,846 |
75,911 |
|
5 |
0 |
57,116 |
67,041 |
66,854 |
71,161 |
|
10 |
0 |
30,27 |
54,054 |
35,946 |
60,811 |
|
15 |
0 |
41,081 |
38,498 |
35,915 |
39,437 |
|
30 |
0 |
8,867 |
37,172 |
56,976 |
73,535 |
|
60 |
0 |
63,226 |
70,107 |
77,419 |
77,419 |
Pada pengujian residu jinten hitam terhadap penyisihan koloni E. coli didapatkkan hasil pada massa 15 mg terjadi penyisihan koloni E. coli yang konsisten dari menit 1 hingga 60, namun pada menit ke 15 terjadi penurunan dan kembali meningkat pada menit 30. Penyisihan koloni pada massa 15 mg terjadi karena pada massa tersebut terdapat kelimpahan senyawa aktif untuk menyisihkan bakteri E. coli, hasil dapat dilihat pada Tabel 4.
Laju kematian bakteri E. coli pada pengenceran 10-1 berada dalam kisaran 0,003 – 1,423/menit. Pada saat menit 30 dengan massa residu 15 mg bakteri E coli mengalami fase adaptasi sedangkan pada menit 60 terjadi penurunan laju kematian bakteri hingga ke titik terendah. Hasil variasi massa residu jinten hitam terhadap persentase penyisihan koloni bakteri pada pengenceran sampel 10-2 dapat dilihat pada Tabel 5.
Pembacaan Tabel 5 dengan cara melihat waktu (menit) dan massa residu (mg), Hasil yang didapatkan menunjukkan aktivitas antibakteri tertinggi yang diperoleh adalah 88,09 % atau 0,924-log reduksi penyisihan koloni E. coli pada waktu kontak 10 menit dengan massa residu 15 mg pada pengenceran 10-2. Terjadi penurunan daya hambat pada menit 30 dengan massa residu 1 mg, dari 66,76% menjadi 25,82%. Bakteri E. coli memiliki waktu regenerasi pertumbuhan dari 15 hingga 30 menit, sehingga kenaikkan dan penurunan wajar terjadi (Lener dan Lerner, 2003).
Tabel 4. Laju kematian bakteri E. coli setelah penambahan
residu jinten hitam pada pengenceran 10-1
|
Massa Residu (mg) |
Waktu (menit) | |||||
|
1 |
5 |
10 |
15 |
30 |
60 | |
|
1 |
0,669 |
0,123 |
0,036 |
0,023 |
0,003 |
0,017 |
|
5 |
0,747 |
0,222 |
0,078 |
0,035 |
0,015 |
0,02 |
|
10 |
0,773 |
0,221 |
0,044 |
0,03 |
0,028 |
0,025 |
|
15 |
1,423 |
0,249 |
0,094 |
0,033 |
0,443 |
0,025 |
Tabel 5. Pengaruh variasi massa residu jinten hitam terhadap persentase penyisihan koloni E. coli pada pengenceran sampel 10-2
|
Waktu (menit) |
Massa Residu (mg) | ||||
|
0 |
1 |
5 |
10 |
15 | |
|
1 |
0 |
28,95 |
25,44 |
20,18 |
22,81 |
|
5 |
0 |
75,09 |
86,89 |
86,38 |
71,16 |
|
10 |
0 |
66,14 |
71,96 |
73,55 |
88,09 |
|
15 |
0 |
38,38 |
44,96 |
38,38 |
60,1 |
|
30 |
0 |
66,76 |
25,82 |
57,69 |
74,18 |
|
60 |
0 |
78,7 |
77 |
80 |
87,39 |
Tabel 6. Laju kematian bakteri E. coli setelah penambahan residu jinten hitam pada pengenceran sampel 10-2
|
Massa Residu (mg) |
Waktu (menit) 1 5 10 15 30 60 |
|
1 5 10 15 |
0,342 0,14 0,108 0,032 0,037 0,026 0,294 0,268 0,127 0,049 0,015 0,024 0,225 0,26 0,133 0,032 0,029 0,027 0,259 0,306 0,213 0,613 0,045 0,035 |
Laju kematian bakteri E. coli setelah penambahan residu jinten hitam pada pengenceran sampel 10-2 dapat dilihat pada Tabel 6.Tabel 6 menunjukkan laju kematian bakteri berada dalam kisaran 0,015 –
0,613/menit. Terjadi penurunan laju kematian pada menit 30 disebabkan pada menit tersebut karena bakteri mengalami regenerasi. Penyebab regenerasi bakteri karena nutrient pada medium masih melimpah dan mempercepat pertumbuhan bakteri, sehingga residu jinten hitam tidak mampu mengimbangi penghambatan pertumbuhan bakteri pada di menit 30 (Lerner dan Lerner, 2003).
Uji Statistik Nonparametrik (Uji Friedman) Hasil uji Friedman menunjukkan p=0,000 (p<0,05), dapat diartikan bahwa daya hambat ekstrak air dan residu jinten hitam terhadap bakteri E. coli untuk setiap perlakuan (volume ekstrak, massa residu dan waktu kontak) berbeda secara signifikan.
SIMPULAN
Alat penyaringan air dengan kombinasi bahan alami (pasir sungai halus, jinten hitam dan karbon aktif) dapat mengurangi pencemar bakteri E. coli dengan baik.
Kemampuan daya hambat ekstrak jinten hitam terhadap bakteri E. coli mencapai 99,995%. Dengan waktu kontak 5 menit dan volume ekstrak 15 mL, sedangkan untuk residu jinten hitam kemampuan daya hambatnya mencapai 88,095% di waktu kontak 10 menit dengan massa residu 15 mg.
DAFTAR PUSTAKA
Abou-Basha, L. I., Rashed, M. S., dan Enein, A.
1965. TLC assay of Thymoquinone in Black Seed Oil (Nigella sativa) And Identification of Di Thymoquinon And Thymol. J. Liq. Chromatogr.
18(1): 105-115.
Dinas Kesehatan Kota Tabanan. 2018. Data Dasar Puskesmas. In Data Dasar Puskesmas.
Hamdiyati, Y. 2011. Pertumbuhan dan
Pengendalian mikroba II. Bandung.
Hosseinzadeh, H., Bazzaz, B. & Forounzafar, F. 2014. Black Cumin (Nigella sativa) and its constituent (thymoquinone): a review on antimicrobial effects, Iranian Journal of Basic Medical Sciences, 17(12): 929-938
Lerner, K L., and Lerner, B. W. 2003. World of Microbiology and immunology. Gale.
Luby, S. P., Aeboatwalla, M., Bowen, A., Kenah, E., Sharker, Y., & Hoekstra, R. M. 2009. Difficulties in Maintaining Improved Handwashing Behavior, Karachi, Pakistan. American Journal of Tropical Medicine and Hygiene. 81(1): 140–145.
Novia, A. A., Nadesya, A., Harliyanti, D. J., Ammar, M., Arbaningrum, R. 2019. Alat Pengolahan Air Baku Sederhana Dengan Sistem Filtrasi. Widyakala. 6: 12 – 20.
Okwu, U. M., Odaro S. I. 2020. Comparative Evaluation of The Antibacterial Effectsf Moringa oleifera And Nigella sativa On Some Clinical Bacterial Isolates Obtained from Igbinedion University, Okada, Nigeria. Research Journal of Biology Sciences. 13(2): 2027.
Vilane, B. R. T. and Dlamini, T. L., 2016. An assessment of groundwater pollution from on-site sanitation in Malkerns, Swaziland. Journal of Agricultural Science and Engineering. 2(2): 11-17.
102
Discussion and feedback