PEMBENTUKAN ESTER BORAT TERKATALISIS ASAM UNTUK ANALISIS BORON SECARA SPEKTROFOTOMETRI
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 16 (2), JULI 2022 DOI: https://doi.org/10.24843/JCHEM.2022.v16.i02.p08
p-ISSN 1907-9850
e-ISSN 2599-2740
PEMBENTUKAN ESTER BORAT TERKATALISIS ASAM UNTUK ANALISIS BORON SECARA SPEKTROFOTOMETRI
R. E. Y. Adu1*, R. Roto2 dan A. Kuncaka2
1 Program Studi Kimia, Universitas Timor, Kefamenanu, Nusa Tenggara Timur, Indonesia 2 Program Studi Kimia, Universitas Gadjah Mada, Yogyakarta, Jawa Tengah Indonesia Email: adoe.risna@yahoo.com
ABSTRAK
Pembentukan ester borat menggunakan katalis asam pada penentuan boron secara spektrofotometri telah diteliti untuk meningkatkan sensitivitas metode analisis boron melaui optimasi jenis dan konsentrasi katalis asam. Boron dipisahkan dari matriks melalui reaksi esterifikasi dengan alkohol dan dehidrasi ester borat ke dalam kurkumin yang dilanjutkan dengan penentuan secara spektrofotometri pada λ 555 nm. Pengaruh jenis dan konsentrasi katalis asam terhadap laju esterifikasi asam borat diamati dengan menggunakan asam asetat, asam format, asam fosfat, asam sulfat dan asam klorida dengan konsentrasi 2,5; 4,5; 6,5; 8,5 dan 10,5 %. Kondisi optimum metode divalidasi untuk digunakan dalam analisis boron dan senyawa turunannya yang terdapat dalam sampel krupuk. Serapan kompleks boron-kurkumin maksimum pada penggunaan katalis H2SO4 dengan konsentrasi 2,5%. Analisis boron menggunakan spektrofotometri UV-Vis melalui distilasi ester borat memberikan persen perolehan kembali yang baik pada rentang 99,98-104,62% dengan nilai LOD dan LOQ secara berturut-turut sebesar 0,316 dan 1,056 mg L-1. Metode ini memiliki sensitivitas yang tinggi dengan nilai absorptivitas molar sebesar 4,7x105 Lmol-1cm-1 dan keterulangan yang dapat diterima yaitu ≤ 2%. Konsentrasi boron dalam sampel krupuk berada pada rentang 2,936-4,12 mgkg-1.
Kata kunci: boron, distilasi, ester borat, katalis asam, spektrofotometri.
ABSTRACT
The formation of borate ester catalyzed by acid for spectrophotometric analysis of boron was investigated. It was conducted to improve the sensitivity of the boron analysis method by optimizing the type and concentration of acid catalyst that can increase the quantity of esterified boric acid. Boron was separated from the sample matrices by dissolving the boric acid in alcohols, then dehydrated into curcumin followed by spectrophotometric determination at λ 555 nm. The influence of the type and concentration of acid catalyst against the esterification rate was observed by using acetic acid, formic acid, phosphoric acid, sulfuric acid, and hydrochloric acid with a concentration of 2.5; 4.5; 6.5; 8.5, and 10.5%. Method validation was carried out under the optimal conditions and used to measure boron and its derivatives in the crackers sample. Maximum absorbance of the boron-curcumin complex was obtained by using an H2SO4 catalyst at the concentration of 2.5%. Spectrophotometric analysis of boron through borate ester distillation gave a good recovery in the range of 99.98-104.62% and acceptable repeatability of ≤ 2%. The limit of detection and limit of quantification was found to be 0.316 and 1.056 mg L-1, respectively. This method has a high sensitivity level with a molar absorptivity value of 4.7x105 Lmol-1cm-1. Boron content in the cracker sample ranged from 2.936 to 4.912 mgkg-1.
Keywords: acid catalyst, boron, borate ester, distillation, spectrophotometry.
PENDAHULUAN
Foodborne disease merupakan penyakit akibat konsumsi pangan yang tidak aman karena mengandung senyawa beracun (intoksikasi) atau organisme patogen (infeksi). Senyawa beracun penyebab foodborne desease dapat berasal dari penggunaan bahan aditif
sintetik yang tidak sesuai dan tidak mengandung nutrisi dalam produk pangan (Adley & Ryan, 2016). Salah satu bahan aditif sintetik yang tidak bernutrisi sehingga dilarang penggunaannya sebagai Bahan Tambahan Pangan adalah asam borat dan senyawa turunannya (Permenkes Nomor 33 tahun 2012). Penggunaan asam borat dan senyawanya
sebagai bahan aditif dapat menimbulkan gangguan kesehatan kronis. Oleh karena itu keberadaan senyawa tersebut perlu diawasi secara berkala.
Pengawasan terhadap penggunaan asam borat dan senyawa turunannya membutuhkan faktor pendukung seperti ketersediaan metode analisis rutin yang cepat, akurat dan efisien. Beberapa metode terbaru seperti Inductively Coupled Plasma Optical Emission Spectrometry (ICP-OES) dan Inductively Coupled Plasma Mass Spectrometry (ICP-MS) sering digunakan pada analisis boron karena lebih sensitive, cepat dan memiliki nilai LOD yang rendah (Cezário dkk., 2020; Anonim, 2015; Wilschefski & Baxter, 2019). Di sisi lain kedua metode tersebut tidak praktis untuk digunakan pada analisis rutin karena lebih rumit dan mahal akibat konsumsi argon yang banyak serta terjadinya memory effects (Ozbek & Akman, 2015). Prosedur tambahan seperti ekstraksi sampel, purifikasi dan pengenceran perlu dilakukan sehingga membutuhkan waktu yang lebih lama serta dapat meningkatkan persen eror (Çetinkaya dkk., 2014). Analisis boron secara spektrofotometri dianggap lebih tepat untuk analisis senyawa boron secara rutin karena sensitive, lebih murah dan memberikan hasil yang hampir sama dengan menggunakan ICP-OES dan ICP-AES (Li dkk., 2016; Wang, 2017).
Analisis boron secara spektrofotometri membutuhkan perlakuan tertentu terhadap matriks sampel. Matriks sampel yang kompleks perlu dipisahkan melalui tahapan pemisahan yang tepat. Beberapa metode pemisahan yang dapat digunakan adalah ekstraksi pelarut dan distilasi. Ekstraksi pelarut dilakukan dengan mengekstraksi boron dalam bentuk kompleks organik seperti boron-2-etill-1,3-heksanadiol ke dalam pelarut seperti kloroform atau benzene, yang diikuti dengan penentuan secara spektrofotometri (Zhang dkk., 2016). Pelarut lain yang dapat digunakan dalam ekstraksi boron yaitu air (Khadka dkk., 2018), alcohol alifatik (Xu dkk., 2021) dan pelarut hidrofobik seperti mentol, timol, 1-decanol atau 2-methyl-2,4-pentanadiol (Almustafa dkk., 2020). Penggunaan pelarut organik yang masive dan bersifat toksik dalam ekstraksi pelarut perlu dipertimbangkan karena tidak efisien dan tidak ramah lingkungan. Pada pemisahan boron melalui distilasi, boron dikonversi melalui reaksi dengan alkohol menjadi alkil borat
[B(OCnH2n+1)3] yang volatil. Pemisahan melalui distilasi pada umumnya digunakan karena kondisi pembentukan alkil borat lebih mudah dikontrol serta lebih stabil terhadap kelembaban (Bao dkk., 2015).
Pemisahan boron secara in-situ melalui distilasi ester borat ke dalam kurkumin lebih efisien karena dapat menganalisis sejumlah sampel pada suhu ruang dalam satu waktu serta membutuhkan jumlah pelarut yang sedikit. Meskipun demikian efisiensi metode pemisahan secara distilasi tergantung pada konversi kuantitatif boron menjadi alkil borat. Thangavel dkk. (2004) melakukan distilasi ester borat secara in-situ dari berbagai macam matriks (air, bubuk boron, uranil nitrat dan uranium oksida) pasca esterifikasi asam borat menggunakan pelarut metanol tanpa katalis. Prosedur ini berhasil digunakan untuk memisahkan boron secara selektif dari matriks sampel tetapi nilai absorptivitas molar yang diperoleh menunjukkan sensitivitas pada kategori yang masih rendah. Pada penelitian ini dilakukan evaluasi dan pengembangan lanjutan pada metode Thangavel untuk mengoptimalkan pembentukan alkil borat. Optimalisasi pembentukan alkil borat dilakukan menggunakan katalis asam. Penggunaan katalis asam dianggap mampu mempercepat laju esterifikasi asam borat, sehingga kuantitas kompleks boron-kurkumin dan sensitivitas metode dapat ditingkatkan. Metode yang telah divalidasi, diterapkan pada analisis boron dalam sampel krupuk.
MATERIAL DAN METODE
Bahan
Material yang digunakan adalah kurkumin, etanol, asam oksalat, asam borat, methanol, propanol, aseton, asam sulfat, asam fosfat, asam klorida, asam asetat dan asam format (Pro Analisis, Merck).
Peralatan
Peralatan yang digunakan dalam penelitian ini yaitu chamber distilasi yang terbuat dari teflon, spektrofotometer UV-Vis (Spectronic 200), water bath, termometer, pH meter (Model HM-5B), oven, neraca analitik (Mettler Toledo ME204E), mortar serta sejumlah peralatan gelas.
Cara Kerja
Penelitian ini diawali dengan pembuatan larutan yang digunakan dalam penelitian. Larutan kurkumin dibuat dengan cara melarutkan kurkumin sebanyak 0,04 g ke dalam campuran etanol: air (3:1), kemudian ditambahkan asam oksalat sebesar 0,60 g. Selanjutnya diuji pengaruh jenis alcohol terhadap absorbansi kompleks kurkumin-boron. Asam borat sebanyak 100 mg dilarutkan dalam metanol 0,1 mL dan dimasukkan ke dalam botol distilasi bagian dalam. Larutan kurkumin 10 mL yang telah dipersiapkan dituang ke dalam botol distilasi bagian luar. Botol distilasi bagian luar ditutup dengan rapat kemudian dibiarkan berada pada suhu ruang selama 24 jam. Penutup botol luar dibuka kemudian botol yang di dalam dipindahkan, setelah dasar botol bagian dalam direndam dengan ~1 mL larutan kurkumin. Larutan kurkumin kemudian dipanaskan di dalam water bath pada suhu ~80 oC hingga mengering, kemudian diencerkan dengan aseton di dalam labu takar 25 mL. Hasil distilasi diencerkan dengan aseton dalam labu takar 25 mL kemudian diukur absorbansinya menggunakan spektrofotometer UV-Vis pada panjang gelombang 555 nm dan waktu optimum pembentukan kompleks terhadap blanko. Prosedur yang sama juga dilakukan terhadap pelarut sampel lain yakni etanol dan propanol.
Untuk menguji pengaruh jenis dan konsentrasi katalis asam maka digunakan asam borat sebanyak 100 mg yang dilarutkan dalam etanol 0.5 mL dan dimasukkan ke dalam botol distilasi bagian dalam kemudian ditambahkan katalis H2SO4 2,5% terhadap massa asam borat. Prosedur yang sama seperti sebelumnya dilakukan akan tetapi katalis asam sulfat diganti dengan H3PO4, HCl, CH3COOH dan HCOOH kemudian dianalisis dengan prosedur yang sama. Optimasi konsentrasi katalis asam dilakukan pada konsentrasi 4,5; 6,5; 8,5 dan 10,5 % terhadap massa asam borat.
Pengaruh rasio etanol: asam sulfat dtentukan dengan menggunakan prosedur yang sama terhadap larutan asam borat dengan rasio etanol-asam sulfat 2:1, 3:1, 4:1, 5:1, 6:1 dan 7:1. Untuk analisis kadar boron dalam sampel krupuk, masing-masing sampel krupuk sebanyak 10 g didistilasi sesuai prosedur sebelumnya dengan menggunakan kondisi optimum yang telah diperoleh. Hasil distilasi diencerkan dengan aseton dalam labu takar 25
mL kemudian diukur absorbansinya menggunakan spektrofotometer UV-Vis.
HASIL DAN PEMBAHASAN
Pengaruh Katalis Asam
Penggunaan berbagai jenis dan konsentrasi katalis asam pada pembentukan ester borat diteliti untuk mempelajari pengaruh katalis asam terhadap serapan kompleks boron-kurkumin. Hasil pengukuran setelah dilakukan variasi jenis dan konsentrasi katalis asam ditampilkan pada Gambar 1.
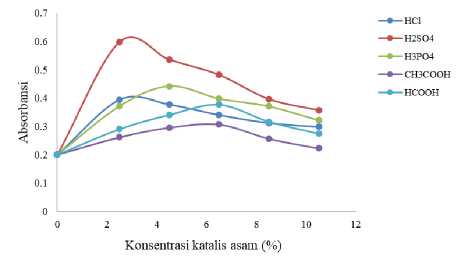
Gambar 1. Pengaruh katalis asam terhadap serapan boron-kurkumin
Katalis asam memberikan pengaruh berbeda terhadap absorbansi kompleks boron-kurkumin. Nilai absorbansi tertinggi dihasilkan oleh katalis H2SO4, sedangkan nilai terendah dihasilkan oleh katalis asam asetat. Penggunaan jenis katalis asam dengan kekuatan asam yang semakin tinggi semakin meningkatkan kuantitas ester borat. Urutan kekuatan asam berdasarkan nilai pKa untuk CH3COOH, HCOOH, H3PO4, H2SO4 dan HCl yang berturut-turut sebesar 4,75; 3,75; 2,1; -3 dan -6,3 adalah HCl > H2SO4 > H3PO4 > HCOOH > CH3COOH. Semakin tinggi kekuatan asam katalis, semakin banyak spesies H+ yang terlepas untuk memprotonasi gugus hidroksil pada asam borat sehingga elektrofilisitas pada atom boron dapat meningkat. Dengan demikian laju konversi asam borat menjadi alkil borat semakin cepat. Katalis H2SO4 memiliki kekuatan asam yang lebih tinggi dibandingkan dengan asam fosfat, asam format dan asam asetat. Selain kekuatan asam yang tinggi, H2SO4 merupakan dehidrator yang mampu mengabsorbsi produk air yang dihasilkan selama esterifikasi dengan baik sehingga kesetimbangan reaksi bergeser ke arah alkil borat (Sarica & Ertas, 2001). Asam sulfat dinyatakan sebagai katalis asam homogen yang
paling baik untuk reaksi esterifikasi asam lemak dibandingkan dengan beberapa asam seperti asam fosfat, asam trikloroasetat dan asam metanasulfonat (Aranda dkk., 2008). HCl merupakan jenis katalis asam terkuat menghasilkan nilai absorbansi (0,316) yang lebih rendah daripada absorbansi yang dihasilkan oleh H2SO4 dan H3PO4. Hal ini disebabkan oleh kemampuan mendehidrasi yang lebih rendah jika dibandingkan dengan kedua asam tersebut. Selain itu Thangavel dkk. (2004) mengemukakan bahwa sistem reaksi dengan pH sangat asam (matriks HCl, HF dan HNO3) dapat mengoksidasi kurkumin sehingga kuantitas kompleksasi boron hasil distilasi dengan kurkumin menjadi menurun. Oleh karena itu asam sulfat dinyatakan sebagai jenis katalis asam yang paling tepat untuk digunakan pada esterifikasi asam borat menjadi trietil borat karena menghasilkan serapan kompleks yang lebih tinggi.
Katalis asam sulfat dioptimasi konsentrasinya pada 2,5; 4,5; 6,5; 8,5 dan 10,5 % terhadap massa asam borat untuk mempelajari pengaruhnya terhadap kompleks boron-kurukumin. Konsentrasi katalis H2SO4 2,5; 4,5; 6,5; 8,5 dan 10,5 % memberikan
absorbansi berturut-turut sebesar 0,397; 0,531; 0,505; 0,476; 0,367 dan 0,345. Absorbansi optimum dicapai pada konsentrasi asam sulfat 2,5% terhadap massa asam borat. Pemakaian asam sulfat dengan konsentrasi yang lebih tinggi dari 2,5% (excess H2SO4) cenderung menurunkan serapan kompleks boron-kurkumin. Kelebihan H2SO4 dapat bereaksi dengan etanol membentuk dietil eter dan alkena melalui dehidrasi alkohol yang berakibat pada menurunnya absorbansi kompleks boron-kurkumin. Thangavel dkk. (2004) menyatakan bahwa prosedur distilasi isotermal ester borat ke dalam kurkumin dengan menggunakan volume H2SO4 atau H3PO4 pekat yang lebih besar dari 0,1 mL secara kuantitatif dapat menghambat distilasi metil atau etil borat, sebagai akibat dari terserapnya larutan alkoholik pada wadah luar oleh dehidrator asam yang sangat melimpah.
Berdasarkan reaksi asam borat dengan metanol menggunakan katalis asam sulfat yang dikemukakan oleh Sarica & Ertas (2001) maka mekanisme reaksi asam borat dengan etanol terkatalisis asam dianalogikan seperti yang ditunjukkan pada Gambar 2.

H2O + OC2H5 B OC2H5
OC2H5
Gambar 2. Mekanisme reaksi esterifikasi asam borat terkatalisis asam
Pengaruh Jenis Alkohol dan Rasio C2H5OH/H2SO4 (v/v)
Kajian terhadap jenis alkohol yang mampu menghasilkan serapan optimum dilakukan menggunakan metanol, etanol dan propanol. Jenis alkohol yang paling efektif dalam distilasi dioptimasi untuk mendapatkan rasio optimum. Absorbansi kompleks boron-kurkumin yang diperoleh setelah dilakukan
variasi jenis alkohol pada sistem distilasi in-situ ditunjukkan pada Gambar 3. Jenis alkohol yang paling efektif digunakan sebagai pelarut asam borat dalam konversi trialkil borat secara kuantitatif pada penelitian ini adalah etanol (nilai serapan 0,365). Meskipun ketiga jenis alkohol tersebut merupakan alkohol primer namun nilai asorbansi yang dihasilkan berbeda akibat perbedaan tekanan uap dari masing-
masing bentuk ester borat. Nilai titik didih untuk trimetil borat, trietil borat dan tripropil borat secara berturut-turut adalah 68, 118 dan 176 oC.
tidak ada perbedaan yang signifikan pada efisiensi pembentukan ester borat dengan menggunakan rasio MeOH:H2SO4 3; 3,3; 3,7 dan 4 (v/b).

Gambar 3. Pengaruh jenis alkohol terhadap absorbansi boron-kurkumin
Perbedaan titik didih mengkonfirmasi bahwa nilai absorbansi terkecil yang diperoleh pada penggunaan propanol merupakan akibat dari tekanan uap tripropil borat yang rendah (0,01 bar, 31 oC), serta rendemen yang lebih sedikit karena rintangan sterik pada intermediet yang lebih besar dibandingkan dengan penggunaan metanol dan etanol. Sedangkan nilai absorbansi boron-kurkumin pada penggunaan metanol lebih kecil dibandingkan dengan etanol, meskipun metil borat diketahui memiliki tekanan uap yang lebih tinggi pada suhu kamar (0,237 bar, 31 oC). Kondisi ini dipengaruhi oleh tingginya tekanan uap metanol pada suhu ruang yang menyebabkan terjadinya volatilisasi metanol lebih cepat sebelum bereaksi sempurna dengan asam borat. Tabel 1 menunjukkan adanya pengaruh rasio EtOH/H2SO4 terhadap nilai absorbansi kompleks boron-kurkumin. Hasil analisis pengaruh rasio EtOH/H2SO4 (v/v) terhadap absorbansi kompleks boron kurkumin menunjukkan bahwa rasio 1:1, 2:1, 3:1, 4:1, 5:1, 6:1 dan 7:1 menghasilkan absorbansi secara berturut-turut sebesar 0,389; 0,408; 0,419; 0,471; 0,549; 0,488 dan 0,456. Absorbansi optimum pada perbandingan volume etanol terhadap asam sulfat dihasilkan pada rasio 5:1 v/v. Castillo dkk. (1985) melakukan penentuan boron dalam air melalui pembentukan metil borat dengan mempelajari pengaruh rasio metanol terhadap asam sulfat, diperoleh perbandingan volume metanol-asam sulfat optimum pada rasio 3:1 v/v, sedangkan Park & Song (2003) mengemukakan bahwa
Tabel 1. Pengaruh rasio etanol:H2SO4 (v/v) terhadap serapan boron-kurkumin
|
Volume H2SO4 (mL) |
Volume EtOH (mL) |
Rasio EtOH: H2SO4 |
Absorbansi |
|
0,5 |
0,5 |
1:1 |
0,389 |
|
0,5 |
1 |
2:1 |
0,408 |
|
0,5 |
1,5 |
3:1 |
0,419 |
|
0,5 |
2 |
4:1 |
0,471 |
|
0,5 |
2,5 |
5:1 |
0,549 |
|
0,5 |
3 |
6:1 |
0,488 |
|
0,5 |
3,5 |
7:1 |
0,456 |
Validasi Metode Analisis Boron
Rentang konsentrasi boron 1,2-4,8 ppm menghasilkan suatu garis linear dengan koefisien korelasi (R2) sebesar 0,9995 dengan persamaan garis y=0,1081x + 0,024, sehingga dikategorikan ke dalam persamaan regesi linear yang baik (R2 ≥ 0,995). Analisis boron dapat dilakukan dengan baik pada rentang konsentrasi tersebut. Limit deteksi (LOD) dan limit kuantifikasi (LOQ) dihitung menggunakan model kurva kalibrasi, diperoleh nilai LOD dan LOQ berturut-turut sebesar 0,316 dan 1,056 mg L-1. Nilai absorptivitas molar sebesar 4,7x105 Lmol-1cm-1. Nilai ini lebih tinggi dibandingkan dengan penelitian sebelumnya menggunakan metanol untuk reaksi esterifikasi yang tidak terkatalisis (0,8x105 L mol-1cm-1) (Thangavel dkk., 2004). Nilai absorptivitas molar pada penelitian ini berada pada kategori sensitivitas yang tinggi yaitu ε > 6 x 104 L mol-1 cm-1 (Ratri, 2017). Nilai tersebut menunjukkan bahwa analisis boron dengan spektrofotometri melalui distilasi ester borat lebih sensitive menggunakan esterifikasi terkatalisis asam sulfat. Absorptivitas molar yang tinggi diinginkan dalam analisis kuantitatif karena mengarah pada sensitivitas analisis yang tinggi (Franca, A.S. & Nollet, L.M.L. ed., 2018).
Akurasi metode penentuan konsentrasi boron melalui distilasi ester borat dinyatakan dalam persen perolehan kembali (% recovery) dan ditentukan menggunakan metode penambahan baku (standard addition method). Pengukuran dilakukan menggunakan sampel uji krupuk. Persen perolehan kembali berada pada rentang 99,98-104,62% (Gambar 4).
PO 104,62 102.27 99,98
III
O --------------------------------------------- ABC
Sampel Kiiipiik
Gambar 4. Nilai persen perolehan kembali.
Nilai % perolehan kembali dapat diterima menurut Harmita (2004), bahwa nilai % perolehan kembali yang dapat diterima untuk 0,001 < [A] ≤ 0.1 (%) dalam matriks sampel adalah 90 -107%. Analisis boron menggunakan kurkumin memiliki keterulangan
(repeatability) yang terukur sebagai simpangan baku relatif (RSD) pada presisi intraday maupun presisi interday sebesar 0,44–1,50%. Nilai tersebut memenuhi kriteria presisi menurut Harmita (2004) yaitu kriteria seksama diberikan jika metode analisis memberikan nilai % RSD ≤ 2%.
Hasil Analisis Boron dalam Krupuk
Pengukuran boron secara
spektrofotometri UV-Vis melalui distilasi etil borat dilakukan dalam sampel krupuk. Sampel krupuk diperoleh dari pasar tradisional dan beberapa supermarket di Kota Yogyakarta. Sampel krupuk yang digunakan merupakan krupuk dengan bahan baku pembuatan yang berbeda (Krupuk A, B, C dan D). Gambar 5 menunjukkan konsentrasi boron pada sampel A, B, C dan D.

Gambar 5. Konsentrasi boron dalam krupuk
Konsentrasi boron secara berturut-turut untuk krupuk A, B, C dan D adalah 4,912; 4,095; 4,881 dan 2,936 mg kg-1. Tingginya konsentrasi boron dalam krupuk menunjukkan
bahwa masih terjadi penyalahgunaan boron dan senyawa turunannya sebagai bahan tambahan pangan. Batas level aman asam borat bagi manusia sebesar 1 g per hari (2,5 mg B kg-1 per hari). Level dimana teramati adanya gejala buruk akibat konsumsi asam borat yaitu sekitar 5 mg B kg-1 per hari, rentang asupan minimum asam borat untuk menyebabkan kematian pada orang dewasa, anak-anak dan janin secara berturut-turut adalah 5-20, 3-6 dan 0-5 g per kilogram berat badan (Rani & Meena, 2013). Hasil studi menunjukkan bahwa manusia normal memiliki rata-rata kadar boron dalam darah 241 g B/L dan urin 1130 g B/L dan konsentrasi dalam jaringan berkisar dari 0,06 hingga 1,2 mg B/kg (Hadrup dkk., 2021).
SIMPULAN
Penentuan boron secara spektrofotometri UV-Vis melalui distilasi ester borat lebih sensitive setelah menggunakan esterifikasi terkatalisis asam (H2SO4). Boron dapat dipisahkan secara optimum melalui reaksi esterifikasi dengan etanol pada rasio etanol/asam sulfat 5:1 v/v dan dehidrasi ester borat ke dalam kurkumin menggunakan katalis asam sulfat pada konsentrasi 2,5%. Penentuan boron melalui distilasi memiliki nilai absorptivitas molar sebesar 4,7x105 L mol-1cm-1 sehinga berada pada kategori sensitivitas tinggi. Penentuan boron secara
spektrofotometri setelah distilasi memberikan % recovery yang baik pada rentang 99,98104,62% dan nilai RSD ≤ 2%. Nilai LOD dan LOQ sebesar 0,316 dan 1,056. Konsentrasi boron terukur dalam sampel krupuk berada pada rentang 2,936-4,912 mg kg-1.
DAFTAR PUSTAKA
Adley, C. C. & Ryan, M. P. 2016. The Nature and Extent of Foodborne Disease. Antimicrobial Food Packaging. Elsevier. 1–10.
Almustafa, G., Sulaiman, R., Kumar, M., Adeyemi, I., Arafat, H. A. & Al Nashef, I. 2020. Boron extraction from aqueous medium using novel hydrophobic deep eutectic solvents. Chem. Eng. J. 395: 125173.
Anonim, 2015. Advanced Mass Spectrometry for Food Safety and Quality.
Comprehensive Analytical Chemistry. Oxford: Elsevier.
Aranda, D. A. G., Santos, R. T. P., Tapanes, N. C. O., Ramos, A. L. D. & Antunes, O. A. C. 2008. Acid-Catalyzed Homogeneous Esterification Reaction for Biodiesel Production from Palm Fatty Acids. Catal. Lett. 122(1–2): 20– 25.
Bao, Z., Zhang, W., Cui, X. & Xu, J. 2015. Theoretical Prediction and
Vapour-Liquid Equilibriumfor
Ternary Systems Trimethyl Borate-
Dimethylacetamide. Asian J. Chem.
27(8): 2883–2886.
Cezário, P. S. de O., do Nascimento, M. C. L., Luna, A. S. & de Gois, J. S. 2020. Application of a lab-made ternary Fe-Cr-Al coil vaporizer coupled to ICP OES for boron determination in powdered food after the sample preparation in alkaline media. Microchem. J. 157: 104875.
Franca, A. S. & Nollet, L. M. L. ed., 2018. Spectroscopic methods in food analysis. Boca Raton: CRC Press, Taylor & Francis Group.
Hadrup, N., Frederiksen, M. & Sharma, A. K. 2021. Toxicity of boric acid, borax and other boron containing compounds: A review. Regul. Toxicol. and Pharmacol. 121: 104873.
Harmita, H. 2004. Petunjuk Pelaksanaan Validasi Metode Dan Cara Perhitungannya. Majalah Ilmu Kefarmasian. 1(3): 117–135.
Khadka, D., Amgain, R., Joshi, S., Shrestha, G., Baral, B.R., Chaurisiya, V., Thapa, K.B., Shrestha, S. & Shrestha, S. R. 2018. Evaluation of different methods of boron extraction under plain deep soil domains of Nepal. J. Nep. Agric. Res.17: 192-199.
Ozbek, N. & Akman, S. 2015. Determination of boron in Turkish wines by microwave plasma atomic emission spectrometry.
LWT - Food Sci. Technol. 61(2): 532– 535.
Park, C. J. & Song, S. 2003. Determination of boron in high-purity sulfuric acid by ester generation and isotope dilution inductively coupled plasma mass spectrometry. J. of Anal. At. Spectrom. 18: 1248-1251.
Rani, M. & Meena, M. C. 2013. Multiple Organ Damage Due to Boric Acid Toxicity. Asia Pac. J. Med.Toxicol. (APJMT). 2(4): 157-159.
Ratri, M.C. 2017. Validasi Metode Analisis Surfaktan Anionik Natrium Dodesil Benzena Sulfonat (Sdbs) Dalam Ikan Lele Secara Spektrofotometri UV-Vis Menggunakan Acridine Orange.
ALCHEMY Jurnal Penelitian Kimia. 13(2): 147-165.
Sarica, D. Y. & Ertas, N. 2001. Flow Injection Analysis for Boron Determination by Using Methyl Borate Generation and Flame Atomic Emission Spectrometry. Turk. J. Chemistry. 25(3): 305-310.
Thangavel, S., Dhavile, S. M., Dash, K. & Chaurasia, S. C. 2004.
Spectrophotometric determination of boron in complex matrices by
isothermal distillation of borate ester into curcumin. Anal. Chim. Acta. 502(2): 265–270.
Wang, X. 2017. Boron quantitative analysis and imaging analysis in plants. Disertation. University of Missouri. Columbia.
Wilschefski, S. & Baxter, M. 2019. Inductively Coupled Plasma Mass Spectrometry: Introduction to Analytical Aspects. Clin. Biochem. Rev. 40(3): 115–133.
Zaijun, L., Zhengwei, C. & Jian, T. 2006. The determination of boron in food and seed by spectrophotometry using a new reagent 3,4-dihydroxyazomethine-H. Food Chem. 94(2): 310–314.
Zhang, R., Xie, Y., Song, J., Xing, L., Kong, D., Li, X.-M. & He, T. 2016. Extraction of boron from salt lake brine using 2-ethylhexanol. Hydrometallurgy. 160:
129–136.
188
Discussion and feedback