UJI TOKSISITAS EKSTRAK ETANOL DAUN BENALU JERUK (Scurrula ferrugenia (Jack) Danser) TERHADAP LARVA UDANG Artemia salina L. SERTA IDENTIFIKASI GOLONGAN SENYAWA METABOLIT SEKUNDER
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 17 (2), JULI 2023 DOI: https://doi.org/10.24843/JCHEM.2023.v17.i02.p3
p-ISSN 1907-9850
e-ISSN 2599-2740
UJI TOKSISITAS EKSTRAK ETANOL DAUN BENALU JERUK (Scurrula ferrugenia (Jack) Danser) TERHADAP LARVA UDANG Artemia salina L. SERTA IDENTIFIKASI GOLONGAN SENYAWA METABOLIT SEKUNDER
N. K. N. Yulandari*, W. S. Rita, N. L. Rustini
Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana Jalan Kampus Unud-Jimbaran, Jimbaran-Bali, Indonesia
*Email: novitayulandari99@gmail.com
ABSTRAK
Benalu jeruk, Scurrula ferrugenia (Jack) Danser, dapat dimanfaatkan untuk pengobatan kanker atau sitotoksik. Penelitian ini bertujuan untuk mengetahui toksisitas ekstrak etanol daun benalu jeruk (Scurrula ferruginea (Jack) Danser) terhadap larva udang Artemia salina serta kandungan golongan senyawa metabolit sekunder dengan metode skrining fitokimia. Ekstraksi dilakukan dengan metode maserasi dan partisi, Uji toksisitas dilakukan dengan metode Brine Shirmp Lethality Test (BSLT), dan skrining fitokimia dilakukan dengan menggunakan beberapa pereaksi pendekteksi golongan senyawa. Maserasi 1 kg serbuk daun benalu jeruk menghasilkan ekstrak pekat etanol sebesar 49,74 gram. Proses partisi 10 gram ekstrak pekat etanol menghasilkan 5,3838 gram ekstrak pekat n-heksana, 2,2239 gram ekstrak pekat etil asetat, 1,3012 gram ekstrak pekat n-butanol dan 1,0911 gram ekstrak air. Hasil uji toksisitas ekstrak etanol, n-heksana, etil asetat, n-butanol dan air secara berturut-turut dengan nilai LC50 162,7565; 83,3017; 147,0026; 660,2279; dan 921, 6679 ppm. Skrining fitokimia menunjukkan hasil positif terhadap metabolit sekunder alkaloid, saponin, steroid, flavonoid, dan tanin.
Kata kunci: benalu jeruk (Scurrula ferrugenia (Jack) Danser, toksisitas, uji fitokimia
ABSTRACT
The citrus parasite, Scurrula ferrugenia (Jack) Danser, can be used for the treatment of cancer or cytotoxic. This study aimed to determine the toxicity of the ethanol extract of citrus parasite leaves (Scurrula ferruginea (Jack) Danser) against shrimp larvae of Artemia salina and the content of secondary metabolite compounds using phytochemical screening methods. The extraction was carried out by the maceration and partitioning methods, the toxicity test by the Brine Shrimp Lethality Test (BSLT) and phytochemical screening by using several detection reagents. Maceration of 1 kg of citrus parasite leaves yielded a concentrated ethanol extract of 49.74 grams. The partition process of 10 grams of concentrated ethanol extract produced 5.3838 grams of concentrated n-hexane extract, 2.2239 grams of concentrated ethyl acetate extract, 1.3012 grams of concentrated n-butanol extract and 1.0911 grams of water extract. The toxicity test for ethanol, n-hexane, ethyl acetate, n-butanol and water extracts resulted in LC50 values of 162.7565; 83.3017; 147.0026; 660.2279; and 921.6679 ppm, respectively. Phytochemical screening showed positive results for secondary metabolites of alkaloids, saponins, steroids, flavonoids, and tannins.
Keywords: citrus parasite (Scurrula ferrugenia (Jack) Danser, toxicity, phytochemical test
PENDAHULUAN
Kematian akibat penyakit kanker yang diakibatkan Reactive Oxygen Species (ROS) atau radikal bebas berupa oksigen serta turunannya yang bersifat sangat reaktif (Towsend et al., 2015). Penyakit kanker berasal dari stress oksidatif. Stress oksidatif merupakan peningkatan jumlah radikal bebas yang melebihi dari batas maksimum kapasitas tubuh (Maruyama et al., 2014). Kanker timbul karena pertumbuhan dari beberapa sel yang tidak normal serta menyebar dengan cepat keseluruh
organ tubuh. Perawatan medis seperti pembedahan, radioterapi, dan kemoterapi terkadang dapat menimbulkan efek samping, sehingga perlu dilakukan pengobatan secara alami menggunakan tanaman obat yang dapat memberikan daya hambat terhadap pertumbuhan kanker (Rita et al., 2019). Salah satu tanaman obat yang berpotensi dalam pengobatan kanker yang digunakan secara tradisional adalah benalu.
Benalu termasuk suatu parasit yang menepel pada inang tempat tumbuhnya, benalu juga dapat dimanfaatkan sebagai obat. Benalu
secara umum dikembangkan oleh masyarakat untuk mengobati penyakit diantaranya sebagai obat amandel, batuk, campak, kanker, serta luka bakar. Efek klinis benalu diduga karena adanya senyawa bioaktif yang terkandung didalamnya. Senyawa tersebut adalah flavonoid, steroid, terpenoid, alkaloid, tanin, dan saponin yang dapat mengurangi kerusakan sel (Pitoyo, 1996).
Benalu dapat digunakan sebagai antikanker. Hasil penelitian yang dilakukan Risky et al, (2016) melaporkan bahwa ekstrak n-heksana batang benalu jeruk (Dendrophthoe pentandara (L.) Miq) mengandung golongan senyawa steroid dan bersifat toksik terhadap larva udang dengan nilai LC50 256,455 ppm. Rini et al, (2019) melaporkan bahwa ekstrak metanol daun benalu duku hijau (Dendrophthoe pentandara (L.) Miq) dan daun benalu duku merah (Scurrula ferruginea (Jack) Danser) bersifat toksik terhadap larva udang dengan nilai LC50 masing-masing 13,95 ppm dan 22,37 ppm.
Dari berbagai jenis benalu, terdapat daun benalu lain yang masih belum diteliti toksisitasnya yakni daun benalu jeruk (Scurrula ferruginea (Jack) Danser). Penelitian ini nantinya dapat memberikan informasi mengenai toksisitas terhadap ekstrak daun benalu jeruk terhadap larva udang serta kandungan golongan metabolit sekundernya dengan metode skrining fitokimia.
MATERI DAN METODE
Bahan
Bahan penelitian yang digunakan adalah daun benalu jeruk (Scurrula ferruginea (Jack) Danser) yang diperoleh di Desa Plaga, Kabupaten Badung, Bali. Bahan kimia yang digunakan adalah etanol 96%, akuades, n-heksana, etil asetat, n-butanol, air laut, dimetil sulfoksida (DMSO) konsentrasi 10%, ragi, asam sulfat pekat, asam asetat anhidrida, merkuri klorida, kalium iodida, iodin, bismut subnitrat, asam klorida, serbuk magnesium, dietil eter, asetat anhidrat, besi (III) klorida, dan Larva udang (Artemia salina Leach).
Peralatan
Peralatan yang digunakan dalam penelitian ini adalah pisau, gunting, blender, ayakan, kaca arloji, mortar, cawan penguap, gelas beaker, neraca analitik, spatula, kertas saring, plastik wrap, aluminium foil, corong, gelas ukur, batang pengaduk, corong pisah,
labu ukur, erlenmeyer, klem, statif, gelas beker, pipet tetes, pipet mikro, pipet ukur, plat tetes, kertas saring, penjepit, botol reagen, botol vial, botol untuk maserasi, aquarium khusus BSLT, aerator, tabung reaksi, penguap putar vakum (rotary vacuum evaporator).
Cara Kerja
Penyiapan Bahan
Daun benalu jeruk yang telah diperoleh selanjutnya dibersihkan dan dipotong kecil-kecil lalu dikering angin(tidak terpapar sinar matahari secara lagsung). Daun benalu yang sudah kering diblender hingga diperoleh serbuk halus.
Uji Kadar Air
Analisis kadar air dilakukan dengan menggunakan oven. Cawan porselin kosong dipanaskan pada suhu 105oC selama 60 menit dan ditimbang. Pemanasan diulang beberapa kali hingga mencapai berat konstan (A). serbuk daun benalu jeruk dimasukkan sebanyak 2 gram lalu ditimbang (B), kemudian dipanaskan kembali hingga berat konstan (C). Presentase kadar air maksimal pada sampel kering sebesar 10%.
B-C
% Kadar Air =--x 100% (1)
B-A
Keterangan:
A=Berat cawan kosong
B=Berat cawan + sampel sebelum dipanaskan C=Berat cawan + sampel setelah dipanaskan
Ekstraksi daun benalu jeruk (Scurrula ferrugenia (Jack) Danser)
Serbuk kering daun benalu jeruk 1 kg diekstraksi dengan teknik maserasi menggunakan 3 liter etanol 96%. Proses maserasi dilakukan selama 3 kali pengulangan selama 24 jam (3x24 jam) lalu disaring dengan kertas saring hingga residu dengan filtrat terpisah. Filtrat hasil maserasi kemudian diuapkan dengan vacum rotary evaporator pada suhu 40oC, hingga diperoleh ekstrak pekat etanol dan ditimbang. Ekstrak pekat etanol kembali dilarutkan menggunakan etanol:air (7:3) kemudian diuapkan kembali hingga etanol habis menguap. Ekstrak air dipartisi dengan n-heksana, etil asetat, dan n-butanol sehingga diperoleh empat ekstrak yakni ekstrak n-heksana, etil asetat, n-butanol dan air. Keempat ekstrak hasil partisi diuapkan kembali dan ditimbang.
Penetasan larva udang (Artemia salina Leach)
Penetasan telur Artemia salina Leach menggunakan akuarium yang telah diberi sekat. Sekat tersebut terdapat ruang gelap dan ruang terang, serta sekat dibuatkan lubang dengan diameter ± 2 mm. air laut sebanyak 5 liter yang telah disaring dimasukkan kedalam akuarium serta diaerasi. Larva udang ditaburkan pada ruang gelap, selanjutnya pada ruang terang diberikan pencahayaan lampu agar larva yang telah menetas dapat berpindah melalui lubang sekat. Larva udang didiamkan selama 48 jam untuk digunakan pada uji toksisitas.
Pembuatan larutan uji
Pembuatan larutan stok dibuat dengan cara melarutkan 20 mg ekstrak dalam pelarut sampai volume 2 mL sehingga diperoleh konsentrasi 10.000 ppm. Selanjutnya untuk membuat konsentrasi 1000, 100, 10 ppm dibuat dengan cara dipipet sebanyak 500, 50, 5 µL larutan stok dan ditambahkan air laut sampai volume 5 mL.
Uji toksisitas terhadap larva udang (Artemia salina Leach)
Uji toksisitas dilakukan dengan memasukkan 10 ekor larva udang Artemia salina Leach yang berumur 48 jam ke dalam tabung reaksi yang telah berisi DMSO 10%, larutan ekstrak, dan air laut serta ditambahkan ragi lalu ditutup dengan aluminium foil. Untuk setiap konsentrasi dilakukan pengulangan sebanyak 3 kali. Untuk kontrol tidak diberikan ekstrak sampel. Selanjutnya dilakukan pengamatan selama 24 jam, serta dicatat jumlah larva udang yang mati untuk dihitung presentase kematiannya. Data yang diperoleh diolah dengan analisis probit.
Skrining Fitokimia
Uji alkaloid
Sejumlah tertentu ekstrak ditambahkan 2 tetes ammonia serta 5 mL kloroform, selanjutnya ditambahkan 1 mL asam sulfat 2M. Larutan dibagi menjadi dua lalu ditambahkan pereaksi Meyer dan Wagner. Secara
pengamatan golongan alkaloid ditandai dengan adanya endapan berwarna putih dengan pereaksi Meyer dan endapan berwarna coklat dengan pereaksi Wagner (Harbone, 1996).
Uji saponin
Sejumlah tertentu ekstrak ditambah 10 mL akuades kemudian dikocok, apabila terbentuk buih maka ditambahkan 1 tetes asam klorida 2N dan dikocok kembali. Adanya busa yang stabil setelah penambahan asam klorida 2N menunjukkan adanya saponin (Harbone, 1996).
Uji steroid dan terpenoid
Sejumlah tertentu ekstrak ditambah 5 mL etanol kemudian dipindahkan ke plat tetes. Kemudian beberapa tetes asam asetat anhidrat dan asam sulfat pekat (Uji Leberman-Burchard). Warna merah atau ungu menunjukkan adanya terpenoid dan warna hijau atau biru menunjukkan adanya steroid (Harbone, 1996).
Uji flavonoid
-
1. Pereaksi Wilstater
Sejumlah tertentu ekstrak ditambah 2-4 tetes asam klorida pekat dan serbuk magnesium. Reaksi positif jika memberikan perubahan warna merah-orange (Harbone 1996).
-
2. Pereaksi Bate Smite-Metcalfe
Sejumlah tertentu ekstrak ditambahkan beberapa tetes asam sulfat pekat, kemudian dipanaskan. Reaksi positif ditandai dengan terbentuknya warna merah.
Uji tanin
Sejumlah tertentu ekstrak ditambah 5 mL akuades dan dikocok. Setelah itu larutan tersebut disaring dan filtratnya ditambahkan Besi (III) klorida 1%. Reaksi positif jika memberikan perubahan warna biru atau hitam kehijauan (Harbone, 1996).
HASIL DAN PEMBAHASAN
Uji kadar air
Berdasarkan SNI (Standar Nasional Indonesia) suatu bahan kering memiliki kadar air tidak melebihi 10%. Kadar air disyaratkan untuk proses ekstraksi tidak melebihi batas maksimum yang telah ditentukan. Berdasarkan hasil uji kadar air serbuk daun benalu jeruk, dengan pengulangan sebanyak 3 kali diperoleh kadar air rata-rata sebesar 7,72%. Hasil yang diperoleh sesuai dengan SNI yakni presentase kadar air kurang dari 10% yang mengindikasikan bahwa sampel tersebut sudah dapat digunakan untuk proses ekstraksi.
Ekstraksi daun benalu jeruk
Ektraksi daun benalu jeruk menggunakan metode maserasi. Serbuk benalu jeruk sebanyak 1 kg dimaserasi dengan 3 liter etanol (3 x 24 jam) menghasilkan 49,74 gram ekstrak pekat etanol. Proses maserasi dipengaruhi oleh beberapa faktor diantaranya jenis pelarut, ukuran simplisia, lama proses maserasi, serta proses pengadukkan. Saat maserasi zat aktif akan larut karena adanya perbedaan konsentrasi antara larutan zat aktif di dalam sel dengan yang di luar sel, sehingga larutan yang terpekat didesak keluar. Peristiwa tersebut berulang sehingga terjadi keseimbangan konsentrasi antara larutan di luar sel dan di dalam sel (Dadang dan Prijono, 2008). Ekstrak pekat etanol kembali dilarutkan menggunakan etanol:air (7:3) lalu etanol diuapkan. Hal ini bertujuan untuk mempermudah proses partisi, apabila saat partisi masih terdapat etanol maka tidak terjadi pemisahan pada saat dipartisi dengan etil asetat. Ekstrak n-Heksana diperoleh paling banyak karena mengandung senyawa non-polar, sedangkan Ekstrak air paling sedikit disebabkan oleh senyawa polar yang tersisa sangat sedikit.
Ekstrak air dipartisi dengan pelarut n-heksana, etil asetat dan n-butanol. Hasil partisi
|
ekstrak pekat etanol ditunjukkan pada Tabel 4.1. Tabel 4.1 Hasil Partisi Ekstrak Etanol Daun Benalu Jeruk | ||
|
Jenis Ekstrak |
Berat Ekstrak (g) |
Warna Ekstrak |
|
n-Heksana |
5,3838 |
Hijau Pekat |
|
Etil asetat |
2,2239 |
Kuning |
|
n-Butanol |
1,3012 |
Kuning |
|
kecokelatan | ||
|
Air |
1,0911 |
Merah Bata |
Uji toksisitas daun benalu jeruk
Uji toksisitas daun benalu jeruk dilakukan dengan Metode Brine Shirmp Lethality Test menggunakan larva udang Artemia salina Leach. Uji toksisitas akut dilakukan selama 24 jam untuk mendeteksi efek toksik setelah pemberian zat uji. Efek toksiksitas diukur dengan cara menghitung nilai LC50 (Lethal concentration 50%) atau kematian larva udang pada 50% hewan uji selama 24 jam pengamatan. Katagori toksisitas berdasarkan nilai LC50 yakni toksik tinggi 0-100 ppm, toksik sedang 100-500 ppm, toksik rendah 500-1000 ppm, dan tidak toksik >1000 ppm (Hamidi et al., 2014). Hasil uji toksisitas daun benalu jeruk ditunjukkan pada Tabel 4.2.
Tabel 4.2 Hasil Uji Toksisitas Daun Benalu Jeruk
|
Jenis Ekstrak |
Konsentrasi (ppm) |
Kematian (ekor) |
% Kematian |
Nilai LC50 (ppm) | ||
|
1 |
2 |
3 | ||||
|
Etanol |
0 |
0 |
0 |
0 |
0 |
162,7565 |
|
10 |
1 |
0 |
0 |
3 | ||
|
100 |
3 |
3 |
3 |
30 | ||
|
1000 |
9 |
9 |
10 |
93 | ||
|
n-Heksana |
0 |
0 |
0 |
0 |
0 |
83,3018 |
|
10 |
1 |
1 |
0 |
7 | ||
|
100 |
5 |
5 |
5 |
50 | ||
|
1000 |
9 |
10 |
10 |
97 | ||
|
Etil Asetat |
0 |
0 |
0 |
0 |
0 |
147,0026 |
|
10 |
0 |
1 |
1 |
7 | ||
|
100 |
4 |
5 |
5 |
47 | ||
|
1000 |
8 |
8 |
9 |
83 | ||
|
n-Butanol |
0 |
0 |
0 |
0 |
0 |
660,2279 |
|
10 |
0 |
1 |
0 |
3 | ||
|
100 |
3 |
3 |
2 |
27 | ||
|
1000 |
5 |
5 |
6 |
53 | ||
|
Air |
0 |
0 |
0 |
0 |
0 |
921,6679 |
|
10 |
1 |
0 |
0 |
3 | ||
|
100 |
2 |
2 |
2 |
20 | ||
|
1000 |
5 |
5 |
5 |
50 | ||
Berdasarkan uji toksisitas ini diketahui bahwa ekstrak daun benalu jeruk termasuk kategori toksik karena nilai LC50 kurang dari 1000 ppm. Sifat toksik diperkirakan disebabkan oleh senyawa aktif yang terdapat pada ekstrak daun benalu jeruk, namun hasil ekstrak n-heksana memiliki efek toksisitas lebih besar dibandingkan dengan ekstrak etanol diakibatkan aktifitas dari golongan senyawa kimia dari semua ekstrak.
Skrining fitokimia
Skrining fitokimia dilakukan dengan beberapa pereaksi guna mengetahui jenis
metabolit sekunder yang terdapat pada ekstrak pekat etanol dan hasil partisi daun benalu jeruk sebagai senyawa aktif toksik. Hasil skrining fitokimia disajikan pada Tabel 4.3 yang menunjukkan ekstrak pekat etanol daun benalu jeruk positif terhadap alkaloid, saponin, steroid, flavonoid, dan tanin. Tabel 4.4 yang menunjukkan hasil skrining fitokimia pada ekstrak hasil partisi daun benalu jeruk.
Berdasarkan skrining fitokimia, ekstrak etanol positif mengadung alkaloid. Reaksi uji alkaloid dengan pereaksi Meyer disajikan pada Gambar 1 dan reaksi uji alkaloid dengan pereaksi Wagner disajikan pada Gambar 2.
Tabel 4.3 Hasil Skrining Fitokimia Ekstrak Pekat Etanol
|
Jenis Metabolit sekunder |
Pereaksi |
Perubahan Warna |
Simpulan |
|
Alkaloid |
Mayer |
Endapan putih |
+ |
|
Wagner |
Endapan coklat |
+ | |
|
Saponin |
Akuades-HCl |
Busa stabil |
+ |
|
Steroid |
Lieberman-Burchard |
Hijau-biru |
+ |
|
Tepernoid |
Lieberman-Burchard |
Hijau-biru |
- |
|
Flavonoid |
Wilstater |
Hijau-kuning |
+ |
|
Bate Smite-Metcalfe |
Hijau-merah |
+ | |
|
Tanin |
FeCl3 |
Hijau-hitam |
+ |
Tabel 4.4 Hasil Skring Fitokimia Masing-Masing Ekstrak Partisi
|
Uji Fitokimia |
Jenis Ekstrak Pekat | |||
|
n-heksana |
Etil asetat |
n-butanol |
Air | |
|
Alkaloid |
- |
+ |
+ |
+ |
|
Saponin |
- |
- |
- |
+ |
|
Steroid |
+ |
+ |
+ |
+ |
|
Terpenoid |
- |
- |
- |
- |
|
Flavonoid |
- |
+ |
+ |
+ |
|
Tanin |
- |
+ |
- |
- |
Keterangan : (+)= Positif
(-) = Negatif

I3-Coklat
+ V
Coklat
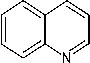
Gambar 1. Reaksi Identifikasi Golongan Alkaloid Dengan Pereaksi Meyer (Marliana et al., 2005)
Kalium-Alkaloid endapan
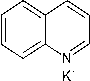
Gambar 2. Reaksi Identifikasi Golongan Alkaloid Dengan Pereaksi Wagner (Marliana et al., 2005)
Pereaksi Meyer merupakan pereaksi dengan kalium tetraiodomerkurat (II) yang dihasilkan dari larutan merkuri (II) klorida (HgCl2) yang ditambahkan dengan kalium iodida berlebih. Pasangan elektron bebas yang terdapat pada atom nitrogen yang terkandung dalam senyawa alkaloid akan membentuk ikatan kovalen koordinasi dengan ion logam K+ yang terdapat pada pereaksi Meyer yang menghasilkan senyawa kalium-alkaloid dalam membentuk endapan (Svehla,1985).
Pereaksi Wagner terbuat dari kalium iodida (KI) dan iodin (I2), sehingga pada saat ion Iodida (I-) bereaksi dengan iodin (I2) akan menghasilkan ion I3- yang berwarna cokelat. Ion kalium (K+) akan diikat oleh pasangan elektron bebas pada atom nitrogen yang terkandung dalam alkaloid membentuk ikatan kovalen koordinasi Kalium-alkaloid yang mengendap (Svehla,1985).
Uji saponin memberikan hasil yang positif dengan terbentuknya busa yang stabil setelah penambahan asam klorida. Busa yang dihasil merupakan gelembung udara yang terdapat dalam larutan. Senyawa saponin memiliki gugus polar dan gugus non-polar bersifat aktif pada permukaan sehingga saat dikocok air akan mengalami hidrolisis dan membentuk misel dan tampak seperti busa. Reaksi uji golongan saponin ditunjukkan pada Gambar 3.

l-Arabinopiriosil-3β-asetil oleanolat
Gambar 3. Reaksi Uji Golongan Saponin (Marliana et al., 2005)
Pemeriksaan golongan steroid dan terpenoid dapat digunakan dengan pereaksi Liebermann-Burchard. Jika terjadi perubahan warna hijau atau biru yang menandakan adanya steroid dan apabila perubahan yang terjadi berwarna merah ungu maka menunjukan positif terpenoid (Illing et al., 2017). Reaksi uji steroid dapat diamati pada Gambar 4.
Salah satu kandungan steroid yang ada pada ekstrak n-heksana batang benalu tanaman jeruk adalah stigmasterol yang efektifitas sebagai antikanker. Ekstrak tersebut bersifat toksik dengan nilai toksisitasnya sebesar 256,455 ppm (Rizky et al., 2016).
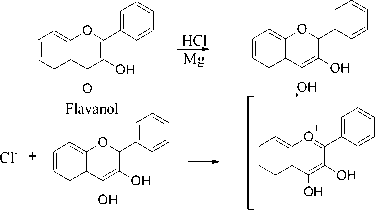
Hasil positif flavonoid ditandai dengan perubahan warna kuning setelah penambahan pereaksi serbuk magnesium dan asam klorida. Reaksi identifikasi flavonoid dengan menggunakan pereaksi Wilsatater dapat dilihat pada Gambar 5.
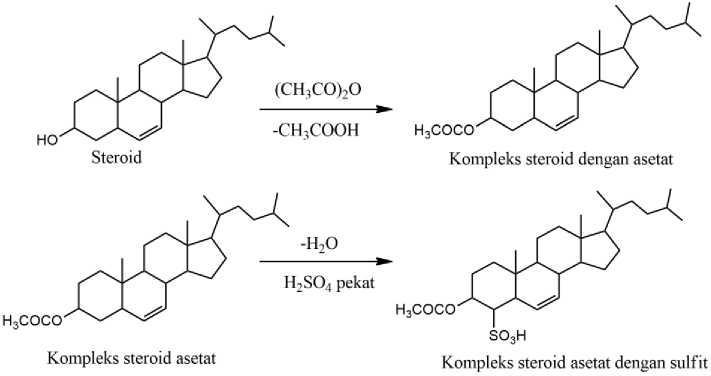
Gambar 4. Reaksi uji steroid dengan pereaksi Liebermann-Burchard (Setiabudi et al., 2017)
Cl-
+ Cl-
Garam flavilium merah tua
Gambar 5. Reaksi Uji Golongan Flavonoid Dengan Pereaksi Wilsatater (Maeliana et al., 2005)
Berdasarkan uji tanin menunjukkan hasil positif setelah terbentuknya warna hitam. Hal ini terjadi karena adanya reaksi besi (III) klorida melibatkan struktur tanin yang merupakan senyawa polifenol yang terdapat gugus fenol akan membentuk senyawa kompleks berwarna biru atau hitam kehijauan menunjukkan adanya tanin (Ikalinus et al., 2015). Reaksi antara tanin dengan besi (III) klorida dapat dilihat pada Gambar 6. Hasil uji fitokimia yang dilakukan oleh Rizky et al., 2016 pada batang benalu tanaman jeruk (Dendrophtoe pentandra (L.) Miq.) mengandung senyawa alkaloid, saponin, steroid, flavonoid dan tannin.
OH
FeCl +
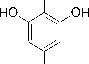
COOH
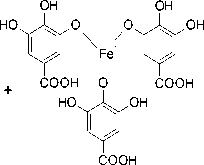
Gambar 6. Mekanisme Reaksi Uji Golongan Tanin Dengan Pereaksi Fecl3 (Simaremare, 2014).
SIMPULAN
Ekstrak etanol, n-heksana, etil asetat, n-butanol, dan air daun benalu jeruk bersifat toksik terhadap larva udang Artemia salina Leach dengan nilai LC50 berturut-turut 162,7565; 83,3018; 147,0026; 660,2279; dan 921,6679 ppm. Kandungan metabolit sekunder yang terdapat pada ekstrak daun benalu jeruk yakni alkaloid, saponin, steroid, flavonoid, dan tanin.
DAFTAR PUSTAKA
Dadang dan Prijono, D. 2008. Insektisida Nabati: Prinsip, Pemanfaatan, dan
Pengembangan. Departemen Proteksi Tanaman Fakultas Pertanian IPB. Bandung.
Hamidi, M. R., Jovanova, B., and Tatjana, K. P. 2014. Toxicological Evaluation of The Plant Product Using Brine Shrimp (Artemia salina L.) Model, Journal of Pharmaceutical. 60(1): 9-18.
Harbone, J. B. 1996. Metode Fitokimia Penuntun Cara Modern Menganalisis Tumbuhan, a.b. Kosasih Padmawinata dan Imam Sudiro, Edisi II, ITB, Bandung.
Ikalinus, R., Widyastuti, S. K., dan Setiasih, N.L. E. 2015. Skrining Fitokimia Ekstrak Etanol Kulit Batang Kelor (Moringa oleifera). Indonesia Medicus Veterinus. 4(1): 71-79.
Illing, I., Safitri, W., dan Erfiana. 2017. Uji Fitokimia Buah Dengen, Jurnal Dinamika. 1(8): 66-84.
Marliana, S. D., Suryanti, V., dan Suryono. 2005. Skrining Fitokimia dan Analisis Kromatografi Lapis Tipis Komponen Kimia Buah Labu Siam (Sechium edule Jack. Swaetz.) dalam Ekstrak Etanol, Jurnal Biofarmasi, Jurusan Kimia FMIPA, Universitas Sebela, Surakarta. 3(1): 26-33.
Mohsen M., Neda A., Eko S., Fadzilah A. A., Saravana K. J., Shajarahtunnur J., and Javad H. A. 2016. Antioxidant Activity and ROS-Dependent Apoptotic Effect of Scurrula ferruginea (Jack) Danser Methanol Extract in Human Breast Cancer Cell MDA-MB-23. Plos One. 136.
Muryama, K., and Iso, H. 2014. Overview of the role of antioxidant vitamins as protection against cardiovascular disease: Implication for aging. In aging: Oxidative Stress and Dietary Antioxidants, edited by Preedy, V.R. London, UK: Elsevier. pp 213-224.
Pitoyo. 1996. Benalu Holtikultura:
Pengendalian dan Pemanfaatan, Trubus, Agriwidaya.
Rini H., Lamek M., Adnyanac I. K., dan Partomuan S. 2019. Uji Fenolik Dan Toksisitas (Brine Shrimp Lethality Test) Ektrak Metanol Daun Benalu Duku Hijau (Dendrohtoe pentandara (L.) Miq) Dan Merah (Scurrula ferruginea (Jack) Danser), Talenta Conference Series: Science & Technology. 2(1): 8487.
Rita, W.S., Swantara, I.M.D., and Sugiantini, N.L. 2019. Anticancer Activity of Curcuma zedoaria (Berg.) Roscoe Essential Oils Against Myeloma Cell. Journal Himpunan Kimia Indonesia. 1(1): 23-28.
Rizky, M. A., Rudi, K., dan Partomuan, S. 2016. Isolasi dan Identifikasi Senyawa Kimia dari Ekstrak n-Heksana Batang Benalu Tanaman Jeruk (Dendrophtoe pentandra (L.)Miq.). Jurnal Kimia Mulawarman. 14(1): 36-41.
Setiabudi, D. A. Tukiran. 2017. Uji Skrining Fitokimia Ekstrak Metanol Kulit Batang Tumbuhan Klampok Watu (Syzygium litorale), Unesa Journal of Chemistry. 6(3): 155-160.
Simaremare, E. S. 2014. Skrining Fitokimia Ekstrak Etanol daun Gatal. Pharmacy, 11(1): 98-107.
SNI 01-2891-1992. 1992. Cara Uji Makanan dan Minuman. Pusat Standarisasi Industri. Departemen Perindustrian.
Svehla, G, 1985. Analisis Anorganik Kualitatif Mikro dan Semimikro, Edisi Kelima, Bagian I. Kalman Media Pusaka. Jakarta.
Townsend, N., Nocholas, M., Scarborought, P., and Rayner, M. 2015. Cardiovascular desease in Europe- epimiological update. European Heart Journal.
36(40): 2696-2705.
136
Discussion and feedback