PENENTUAN KONDISI OPTIMUM KROMATOGRAFI CAIR KINERJA TINGGI UNTUK PEMISAHAN ASAM LEMAK HIDROKSAMIK BERBASIS MINYAK INTI BUAH KETAPANG
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 16 (1), JANUARI 2022 DOI: https://doi.org/10.24843/JCHEM.2022.v16.i01.p11
p-ISSN 1907-9850
e-ISSN 2599-2740
PENENTUAN KONDISI OPTIMUM KROMATOGRAFI CAIR KINERJA TINGGI UNTUK PEMISAHAN ASAM LEMAK HIDROKSAMIK BERBASIS MINYAK INTI BUAH KETAPANG
A. Pujamada, D. Suhendra* dan E. R. Gunawan
Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Mataram, Mataram, Nusa Tenggara Barat, Indonesia *Email: dedysuhendra@unram.ac.id
ABSTRAK
Sintesis Asam Lemak Hidroksamik (ALH) telah dilakukan dengan mereaksikan minyak inti buah ketapang dan hidroksilamina secara enzimatis menggunakan lipase terimobilisasi (Lipozyme TL IM). ALH yang didapatkan masih berupa campuran asam-asam lemak penyusun trigliserida minyak inti buah ketapang. Tujuan dari penelitian ini untuk mengetahui kondisi optimum pemisahan campuran ALH menjadi komponen tunggalnya serta persentase komposisinya menggunakan Kromatografi Cair Kinerja Tinggi (KCKT). Kolom, detektor, dan panjang gelombang yang digunakan saat analisis masing-masing adalah kolom fase terbalik (reverse phase) SunFire C18 5 µm 4,6 x 150 mm, detektor Ultra Violet (UV), dan panjang gelombang 213 nm. Kondisi optimum pemisahan ALH yang diperoleh yaitu fase gerak metanol 100%, laju alir 0,25 mL/menit, konsentrasi sampel 10.000 ppm dan volume injeksi sampel 20 µL. Komposisi asam-asam lemak hidroksamik yang berhasil dipisahkan adalah asam palmitil hidroksamik (13-14%), asam stearil hidroksamik (3-4%), asam oleil hidroksamik (25-26%), dan asam linoleil hidroksamik (59-60%).
Kata Kunci: asam lemak hidroksamik, minyak ketapang, KCKT, lipozyme.
ABSTRACT
Fatty Hydroxamic Acid (FHA) synthesis was carried out by reacting ketapang kernel oil and hydroxilamine enzymatically using immobilized lipase enzymes (Lipozyme TL IM). The FHA obtained is still in the form of a mixture of fatty acids that make up the triglycerides of the ketapang kernel oil. The purpose of this study was to determine the optimum conditions for the separation of FHA mixture into its single component and the percentage of its composition using High Performance Liquid Chromatography (HPLC). Column, detector, and wavelength used in the analysis were SunFire C18 5µm 4.6 x 150 mm reverse phase column, Ultra Violet (UV) detector, and 213 nm wavelength. The optimum conditions for FHA separation were 100% methanol mobile phase, 0.25 mL/minutes flow rate, 10.000 ppm sample concentration, and 20 µL sample injection volume. The composition of the hydroxamic fatty acids that were successfully separated were palmithyl hydroxamic acid (13-14%), stearyl hydroxamic acid (3-4%), oleyl hydroxamic acid (25-26%), and linoleyl hydroxamic acid (59-60%).
Keywords: fatty hydroxamic acid, ketapang oil, HPLC, lipozyme.
PENDAHULUAN
Asam-asam hidroksamik (AH) adalah senyawa turunan dari hidroksilamina dan asam karboksilat yang salah satu kegunaannya adalah sebagai bioligan (Adewuyi, dkk., 2015). Asam hidroksamik merupakan salah satu objek kajian yang sangat perlu diteliti dan dieksploitasi lebih jauh karena kemampuannya membentuk chelates yang stabil dengan berbagai logam berat, sehingga dapat digunakan sebagai agen pengkhelat (chelating
agent) yang baik. Sebagai pengkhelat, AH banyak digunakan sebagai reagen pada penentuan logam secara spektrofotometri dan gravimetri (Suhendra, dkk., 2018) serta untuk pengekstrak ion-ion logam dari fase air (Suhendra dan Gunawan, 2012). Selain itu, aktivitas biologis dari turunan AH dapat digunakan sebagai antioksidan (Adewuyi, dkk., 2015), sebagai falcylysin inhibitors, sebuah protease malaria esensial (Chance, dkk., 2018), sebagai agen antituberkolosis (Majeewski, dkk., 2015), sebagai antitumor
(Nam, dkk., 2013), agen antiHIV (Human Immunodeficiency Virus) (Stranix, dkk., 2016) dan bermanfaat juga sebagai antileukimia (Najem, dkk., 2019).
Salah satu turunan AH yang dapat digunakan sebagai agen pengkhelat adalah ALH. Asam lemak hidroksamik merupakan AH rantai panjang, yang dapat diperoleh dari trigliserida yang terkandung di dalam minyakminyak nabati. Asam lemak hidroksamik tidak tersedia secara komersial, tetapi telah berhasil disintesis dari berbagai minyak nabati, di antaranya adalah minyak kelapa (Suhendra dan Gunawan, 2012), minyak kelapa sawit (Jahangirian, dkk., 2011), minyak jagung dan minyak kedelai (Jafar, dkk., 2015). Minyakminyak nabati tersebut merupakan minyak yang biasa digunakan sebagai bahan pangan. Oleh sebab itu, pada penelitian ini digunakan minyak nabati nonpangan dari bahan tidak terpakai dan ketersediaannya melimpah, yaitu minyak inti buah ketapang. Komposisi asam lemak penyusun trigliserida minyak ketapang adalah asam palmitat (28-29%), asam stearat (4-5%), asam oleat (29-30%) dan asam linoleat (32-33%) (Iha, dkk., 2014).
Sintesis ALH dari minyak nabati dapat dilakukan dengan cara kimiawi dan enzimatis. Sintesis ALH dari minyak nabati secara kimiawi dianggap kurang tepat karena dalam suasana basa dan pada suhu yang cukup tinggi dapat menyebabkan oksidasi ikatan rangkap asam lemak penyusun minyak (Suhendra, dkk., 2005). Sintesis ALH dari minyak nabati yang dianggap lebih baik adalah dengan cara enzimatis. Hal ini disebabkan karena enzim bekerja pada suasana netral dan suhu rendah, ramah lingkungan dan enzim lipase yang terimobilisasi dapat digunakan kembali (Suhendra dan Gunawan, 2012). Suhendra dkk. (2018), telah mensintesis ALH secara enzimatis dari minyak inti buah ketapang dengan persentase konversi maksimum sebesar 50%. Asam lemak hidroksamik hasil sintesis ini masih berupa campuran dari ALH trigliserida penyusun minyak. Oleh karena itu perlu dilakukan pemisahan menjadi ALH tunggal. Hal ini disebabkan perbedaan panjang rantai karbon alifatik dan kejenuhan dari asam lemak penyusun minyak menyebabkan perbedaan keselektifan ALH. Sebagai contoh, linoleate hydroxamic acid (LHA) memiliki kereaktifan dan selektifitas yang tinggi
terhadap logam Mn(II) dibandingkan ALH lainnya (Zhou, dkk., 2015).
Pemisahan ALH menjadi komponen-komponennya dilakukan menggunakan Kromatografi Cair Kinerja Tinggi (KCKT). Kromatografi cair kinerja tinggi dipilih disebabkan ALH merupakan senyawa yang memiliki tingkat volatilitas yang rendah dan memiliki berat molekul yang tidak jauh berbeda antar komponennya, sehingga ALH akan sukar terpisah jika menggunakan kromatografi kolom atau kromatografi gas. Selain itu, KCKT dapat digunakan untuk analisis kualitatif dan kuantitatif secara bersamaan, sehingga akan lebih mudah dan efisien (Murniati, dkk., 2019). Kromatografi cair kinerja tinggi telah digunakan oleh Dolowy dan Pyka (2015) untuk memisahkan long chain monounsaturated fatty acid dan polyunsaturated fatty acid. Berdasarkan uraian di atas, maka pada penelitian ini dilakukan pemisahan ALH berbasis minyak inti buah ketapang menggunakan KCKT.
MATERI DAN METODE
Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah bahan berkualitas p.a kecuali yang disebutkan demikian, inti buah ketapang, Na2SO4 anhidrat, HCl, NaOH, n-heksan, asetonitril, FeCl3, CuSO4, metanol, etanol, aseton, indikator PP, Na2S2O3 (Merck, German), enzim lipase (Lipozyme TL IM) (Novozymes 2A330045, Denmark), plat KLT, batu didih, silika gel, aquades, dan hidroksilamina hidroklorida (Sigma Aldrict, German).
Peralatan
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas yang biasa digunakan di laboratorium, seperangkat alat Kromatografi Cair Kinerja Tinggi (Waters 1525, USA), Detektor UV (Waters 2489, USA), kolom fase terbalik (SunFire C18 5 µm 4,6 x 150 mm, USA), spektrofotometer FT-IR (PerkinElmer Spectrum Two, USA), vaccum filtration, micro filter 0,2-0,45 µm, rotary evaporator (B-ONE RE-1000VN), desikator, freezer, statif dan klem, pH meter (PH-009(I)A), timbangan analitik (DC-600A), kolom kromatografi vakum, dan waterbath stirrer (Biosan WB-4MS).
Cara Kerja
Ekstraksi Minyak Ketapang
Ekstraksi minyak ketapang dilakukan dengan metode yang dikembangkan Suhendra, dkk. (2018) dengan beberapa modifikasi dan penyesuaian. Inti buah ketapang yang telah dihaluskan ditimbang sebanyak 50 g dan dimasukkan ke dalam soklet lalu diekstrak dengan n-heksana 200 mL pada suhu 70ºC selama 6 jam. Hasil ekstraksi kemudian diuapkan dengan rotary evaporator dengan kecepatan 120 rpm pada suhu 40ºC untuk menghilangkan pelarut n-heksana.Hasil ekstraksi kemudian diuapkan dengan rotary evaporator pada suhu 40°C dengan kecepatan 120 rpm untuk menghilangkan pelarut n-heksan. Kadar air dalam minyak yang telah diperoleh dihilangkan dengan penambahan (Na2SO4) anhidrat.
Sintesis Asam Lemak Hidroksamik
Asam lemak hidroksamik disintesis menggunakan metode yang dikembangkan oleh (Suhendra, dkk., 2018) dengan beberapa modifikasi dan penyesuaian. Ke dalam erlenmeyer 250 mL bertutup dimasukkan campuran reaktan yang terdiri dari 10 gram minyak ketapang, 75 mL n-heksan, 28,6 mmol hidroksilamina hidroklorida yang telah dinetralkan menggunakan NaOH. Kemudian ditambahkan 0,15 gram enzim komersial (Lipozyme TL IM). Campuran kemudian dimasukkan ke dalam waterbath stirrer dengan kecepatan 250 rpm pada suhu 40°C selama 25 jam. Kemudian ALH hasil sintesis dipisahkan melalui berbagai tahapan, yaitu pemisahan enzim dilakukan dengan filtrasi menggunakan kertas saring. Asam lemak hidroksamik berada di lapisan atas (organik) didinginkan di dalam freezer selama ±24 jam dan selanjutnya difiltrasi dengan vacuum filtration. Endapan yang diperoleh dibilas dengan n-heksan, kemudian disimpan dalam desikator.
Identifikasi Produk Sintesis
Identifikasi produk dilakukan menggunakan metode yang diembangkan oleh Suhendra dkk., (2018) dengan beberapa modifikasi dan penyesuaian. Uji warna dilakukan dengan cara ALH dilarutkan dalam metanol kemudian direaksikan dengan larutan FeCl3 dan CuSO4. Analisis gugus fungsi dilakukan menggunakan spektrofotometer
Infra Merah. Penentuan kadar nitrogen (N) dilakukan dengan menggunakan metode Semi Macro Kjeldahl.
Penentuan Kondisi Optimum KCKT
-
1. Penentuan Fase Gerak Optimum
Sebanyak 20 µL larutan sampel dengan konsentrasi 10.000 ppm diinjeksikan ke dalam sistem KCKT pada suhu ruang. Fase gerak yang digunakan adalah campuran metanol:air dan metanol:asetonitril dengan perbandingan (95:5), (90:10), (85:15) serta metanol 100% dengan laju alir 1,0 mL/menit.
-
2. Penentuan Laju Alir Optimum
Sebanyak 20 µL larutan sampel dengan konsentrasi 10.000 ppm diinjeksikan ke dalam sistem KCKT pada suhu ruang menggunakan fase gerak optimum yang telah diperoleh sebelumnya dengan variasi laju alir 1,5 mL/menit; 1,0 mL/menit; 0,5 mL/menit; 0,25 mL/menit; dan 0,1 mL/menit.
Pemisahan ALH Menggunakan Kondisi Optimum KCKT
Sebanyak 20 µL larutan sampel dan standar dengan konsentrasi 10.000 ppm diinjeksikan ke dalam sistem KCKT menggunakan kondisi optimum. Sampel kemudian diidentifikasi dengan cara membandingkan waktu retensi sampel dengan waktu retensi standar pada kondisi optimum.
HASIL DAN PEMBAHASAN
Minyak Ketapang
Minyak ketapang diperoleh menggunakan metode ekstraksi sokletasi dengan pelarut n-heksana. Metode ektraksi sokletasi digunakan karena simplisia bersifat relatif stabil terhadap pemanasan serta lebih cepat dan murah. Penggunaan n-heksana sebagai pelarut karena memiliki sifat nonpolar, sehingga n-heksan dapat mengekstrak trigliserida dalam minyak inti buah ketapang sesuai dengan prinsip like dissolve like.
Kadar minyak ketapang diperoleh sebesar 52,23%. Hasil ini tidak jauh berbeda dengan Suhendra, dkk., (2018) dengan metode yang sama yaitu sekitar 55%-60%. Perbedaan kadar minyak yang dihasilkan dapat dipengaruhi oleh kematangan buah ketapang
dan tempat hidup buah ketapang yang digunakan.
Asam Lemak Hidroksamik
Asam lemak hidroksamik yang berhasil disintesis berwujud padat dan semi padat berwarna putih. Pemurnian ALH diperlukan karena masih terdapat enzim dan gliserol sebagai produk sampingan. Gliserol dan sisa
hidroksilamina berada pada fase air sedangkan ALH dan sisa trigliserida berada pada pelarut organik (n-heksana). Lipozyme berada di antara fase air dan fase organik karena bekerja pada lapisan antarmuka. Adapun reaksi enzimatik pembentukan asam lemak hidroksamik dapat dilihat pada Gambar 1.
O Il
O H2C-O-C-R
R-C-O-CH O + nh2oh
I Il
H2C-O-C-R
Lipase
O
3 R-C-NHOH
H2C-OH
+ HO-CH i
H2C-OH
Trigliserida
Hidroksilamin


Gliserol
Gambar 1. Reaksi Enzimatik Pembentukan Asam Lemak Hidroksamik (Suhendra,2018)
Pemurnian ALH dilakukan dengan empat tahap. Tahap pertama, yaitu pemisahan Lipozyme dari campuran hasil sintesis. Lipozyme yang berbentuk serbuk akan tertinggal pada kertas saring pada proses penyaringan. Tahap kedua, yaitu pemisahan fase air dan fase organik. Fase organik berada di bagian atas dan fase air berada di bagian bawah karena n-heksana memiliki nilai massa jenis lebih kecil dibandingkan dengan air dengan nilai massa jenis berturut-turut, yaitu 0,66 g/cm3 dan 0,997 g/cm3 (Suhendra, dkk., 2018). Fase organik diambil karena mengandung ALH. Tahap ketiga, yaitu pemisahan ALH dari n-heksana dan sisa trigliserida. Fase organik dimasukkan ke dalam freezer selama ±24 jam untuk mengurangi kelarutan ALH agar tidak larut dalam n-heksana. Asam lemak hidroksamik yang berwujud padat tertinggal di kertas saring pada proses penyaringan menggunakan vacum filtration. Penyaringan dilakukan sebanyak tiga kali pengulangan untuk memastikan seluruh ALH telah tertinggal di kertas saring. Pelarut n-heksana dibiarkan menguap pada ruangan
terbuka untuk mendapatkan ALH dalam wujud semi padat (gel).
Asam lemak hidroksamik yang diperoleh memiliki persentase konversi sebesar 50,4%. Hasil ini tidak jauh berbeda jika dibandingkan dengan ALH berbasis minyak kelapa sebesar 49,59% (Suhendra dan Gunawan, 2012). Hal ini dikarenakan komposisi asam lemak penyusun trigliserida minyak ketapang dan minyak kelapa memiliki berat molekul yang tidak jauh berbeda.
Identifikasi Produk Sintesis
Uji Warna
Uji warna dilakukan dengan mengamati perubahan warna yang terjadi pada larutan logam Fe(III) dan Cu(II) setelah direaksikan dengan ALH secara kualitatif. Hasil dari uji warna yang telah dilakukan dapat dilihat pada Gambar 2, terjadinya perubahan warna larutan logam Fe(III) dari warna kuning menjadi coklat dan larutan logam Cu(II) berubah dari warna biru menjadi hijau. Hal ini menandakan bahwa ALH telah berhasil disintesis (Suhendra, dkk., 2018).

Analisis Gugus Fungsi Menggunakan FTIR
Hasil yang diperoleh menunjukkan adanya pergeseran vibrasi C=O ester pada spektrum trigliserida pada bilangan gelombang 1747,73 cm-1 bergeser ke bilangan gelombang 1706,92 cm-1. Hal ini menandakan bahwa gugus fungsi amida telah terbentuk. Terdapat pula serapan vibrasi O-H pada bilangan gelombang 3466,97 cm-1, serapan N-H
sekunder pada bilangan gelombang 3261,09 cm-1, serta didukung oleh serapan N-H sekunder pada bilangan gelombang 1567,76 cm-1 dan serapan C-N pada bilangan gelombang 941,4 cm-1. Serapan-serapan yang dihasilkan pada spektrum ALH menandakan bahwa ALH telah berhasil disintesis (Hoidy, dkk., 2010).
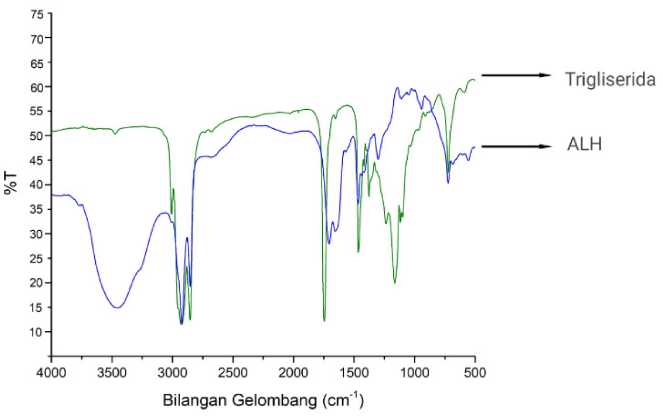
Gambar 3. Spektrum FTIR Gabungan Trigliserida dan ALH
Penentuan Kadar Nitrogen
Penentuan kadar nitrogen (N) total yang terkandung dalam ALH merupakan salah satu uji kuantitatif pada produk ALH hasil sintesis. Metode yang digunakan yaitu Metode Kjeldahl. Prinsip dari metode ini adalah pembentukan amonium sulfat oleh asam melalui proses destruksi. Selanjutnya, amonium sulfat yang terbentuk diubah menjadi amonia dengan penambahan basa. Amonia
yang terbentuk dipisahkan melalui proses destilasi dan ditampung dalam wadah yang berisi asam borat. Asam borat akan bereaksi dengan amonia membentuk ion amonium. Ion amonium yang terbentuk selanjutnya dititrasi dengan asam sehingga kadar N total yang terkandung dalam ALH dapat ditentukan (Bakhtra dkk., 2016). Reaksi yang terjadi pada penentuan kadar nitrogen dapat dilihat pada Gambar 4.
Proses Destruksi:
N-Organik(S) + 2 H2SO4 (1)
Proses Destilasi:
(NH4)2SO4 (aq) + 2 NaOH faq)
(NH4)2SO4 (aq) + CO2 (g) + H2O (1) + SO3 (g.
Na2SO4 (aq) + 2 H2 (g, 2 NH3 (aq)
NH3 (aq) + H3BO3 (aq) -
Proses Titrasi:
NH4H2BO3faq) +HCl (aq)
NH4H2BO3 (aq)
NH4Cltaq)+ H3BO3faq)
Gambar 4. Reaksi pada Proses Penentuan Kadar Nitrogen (N)
Hasil analisis menunjukkan jumlah N rata-rata yang terkandung dalam sampel ALH adalah 1,76%, yang berarti terdapat 0,0082 gram atau 0,58 mmol kadar nitrogen dalam 0,5 g sampel ALH. Hasil yang diperoleh lebih rendah dibandingkan dengan ALH yang berbasis minyak kelapa sawit yaitu sebesar 3,45% (Suhendra, dkk., 2005). Hal ini kemungkinan terjadi karena produk yang terbentuk memiliki rantai yang lebih panjang sehingga menyebabkan kadar N lebih rendah.
Penentuan Kondisi Optimum KCKT Penentuan Fase Gerak Optimum
Penentuan fase gerak optimum dilakukan dengan memvariasikan komposisi fase gerak metanol:air, metanol:asetonitril dan metanol 100% dengan perbandingan 85:15 (v/v); 90:10 (v/v); 95:5 (v/v) pada laju alir 1,0 mL/menit dan volume injeksi 20 µL. Kolom yang digunakan bersifat nonpolar, sehingga fase gerak yang digunakan bersifat polar agar bisa membawa sampel melewati kolom dan tidak merusak silika pada kolom. Metanol
diprioritaskan pada pemisahan ini karena sampel ALH larut sempurna dalam metanol. Kromatogram fase gerak optimum dapat dilihat pada Gambar 5.
Resolusi (Rs) adalah ukuran ukuran yang menunjukan bagaimana dua puncak yang dihasilkan terpisah dengan baik. Pada saat nilai Rs=1, menunjukkan bahwa pemisahan masing-masing puncak telah mencapai kemurnian 94%. Sedangkan untuk mencapai pemisahan yang sempurna yaitu nilai Rs≥1,5 (Kembaren dan Harahap, 2014). Berdasarkan Gambar 5, nilai resolusi fase gerak metanol 100% masih kurang dari nilai yang dianjurkan yaitu ≥1,5. Namun, fase gerak metanol 100% menunjukkan pemisahan empat puncak yang relatif lebih baik dibandingkan dengan fase gerak metanol:air dan metanol:asetonitril. Sehingga fase gerak optimum yaitu metanol 100% karena memiliki resolusi yang cukup baik dan tidak terjadi pelebaran puncak yang signifikan.
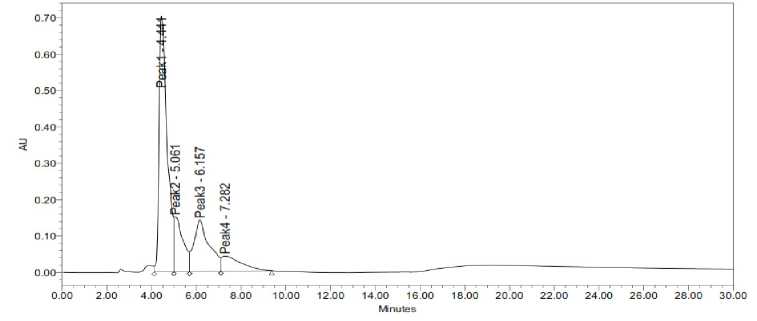
Gambar 5. Kromatogram Fase Gerak Optimum
Penentuan Laju Alir Optimum
Penentuan laju alir optimum dilakukan dengan memvariasikan laju alir 1,5; 1,0; 0,5; 0,25 dan 0,1 mL/menit menggunakan fase gerak metanol 100% dan volume injeksi 20µL. Kromatogram laju alir optimum dapat dilihat pada Gambar 6.
Waktu retensi merupakan waktu yang dibutuhkan oleh suatu komponen sejak awal
diinjeksikan sampai terbaca oleh detektor. Hasil optimasi laju alir yang dilakukan sesuai teori bahwa semakin lambat laju alir maka nilai waktu retensi senyawa semakin lama (Murniati, 2019). Laju alir optimum yaitu 0,25 mL/menit, karena menghasilkan pemisahan pada keempat senyawa yang lebih baik dan nilai resolusi yang lebih sesuai.
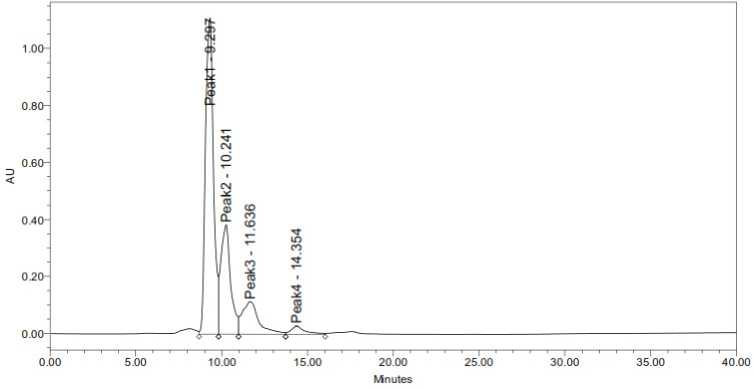
Gambar 6. Kromatogram Laju Alir Optimum
Pemisahan ALH Menggunakan Kondisi Optimum KCKT
Sampel ALH kemudian dipisahkan menggunakan kondisi optimum (fase gerak dan laju alir) kromatografi cair kenerja tinggi yang diperoleh sebelumnya. Kondisi optimum KCKT ditunjukkan pada Tabel 1.
Waktu retensi suatu zat akan selalu tetap pada kondisi pemisahan yang sama. Oleh sebab itu, identifikasi suatu puncak kromatografi dapat dilakukan dengan membandingkan waktu retensi sampel dengan waktu retensi standar (Mayer, dkk., 2002).
Asam lemak hidroksamik terdiri atas empat senyawa utama yang dapat dilihat sesuai empat puncak yang terbentuk pada kromatogram. Senyawa utama ini diharapkan sesuai dengan empat senyawa utama penyusun trigliserida pada minyak ketapang. Untuk membuktikan empat senyawa tersebut, dilakukan identifikasi melalui pengamatan nilai waktu retensi sampel dan nilai waktu retensi standar.
Tabel 1. Kondisi Optimum Sistem KCKT
|
Kondisi Optimum |
Keterangan |
|
Fase diam |
Sun Fire C18 5 µm |
|
4,6 x 150 mm | |
|
Fase gerak |
Metanol 100% |
|
Laju alir |
0,25 mL/menit |
|
Volume injeksi |
20µL |
|
Konsentrasi |
10.000 ppm |
|
Detektor |
UV 213 nm |
Berdasarkan hasil pengamatan waktu retensi sampel dan standar yang ditampilkan pada Tabel 2, senyawa asam linoleil hidroksamik terelusi lebih awal karena senyawa hidrokarbon dengan ikatan rangkap lebih polar dibandingkan dengan ikatan tunggal. Asam linoleil hidroksamik memiliki dua ikatan rangkap, sedangkan asam oleil hidroksamik memiliki satu ikatan rangkap. Sehingga asam linoleil hidroksamik memiliki kepolaran yang paling besar dibanding senyawa yang lain.
Tabel 2. Identifikasi ALH Berdasarkan Waktu Retensi Standar
|
Puncak ke- |
tR sampel (menit) |
tR standar (menit) |
Jenis asam lemak |
Persen komposisi (%) |
|
1 |
9,297 |
9,224 |
Asam Linoleil Hidroksamik |
59,42 |
|
2 |
10,241 |
10,225 |
Asam Oleil Hidroksamik |
25,39 |
|
3 |
11,636 |
11,737 |
Asam Palmitil Hidroksamik |
12,58 |
|
4 |
14,354 |
14,179 |
Asam Stearil Hidroksamik |
2,61 |
Senyawa asam stearil hidroksamik memiliki kepolaran yang paling rendah karena memiliki panjang rantai karbon alifatik terpanjang. Semakin panjang rantai karbon alifatik maka semakin kecil kepolarannya. Waktu retensi akan meningkat seiring dengan bertambahnya panjang rantai dan berkurangnya ikatan rangkap; 18:3<18:2<18:1<16:0<18:0 (Carvalho, dkk., 2012). Pemisahan menggunakan KCKT menganut prinsip utama yaitu “like dissolve like”, artinya senyawa polar menyukai senyawa polar dan sebaliknya. Dalam hal ini, fase diam yang digunakan adalah oktadesilsilan (ODS atau C18) yang bersifat nonpolar akan mengikat lebih kuat asam-asam lemak yang kepolarannya lebih rendah. Sehingga senyawa yang memiliki kepolaran paling rendah akan terakhir keluar dari kolom.
Berdasarkan kromatogram yang dihasilkan, diperoleh komposisi ALH yaitu, asam linoleil hidroksamik (59-60%), asam oleil hidroksamik (25-26%), asam palmitil hidroksamik (13-14%) dan asam stearil hidroksamik (3-4%). Komposisi ini sesuai dengan asumsi awal bahwa urutan persentase hasil sintesis kemungkinan asam linoleil hidroksamik > asam oleil hidroksamik > asam palmitil hidroksamik > asam stearil hidroksamik karena komposisi minyak ketapang mengandung asam palmitat (2829%), asam stearat (4-5%), asam oleat (2930%) dan asam linoleat (32-33%) (Iha, dkk., 2014).
SIMPULAN
Berdasarkan hasil penelitian dan kajian pustaka yang telah dilakukan, maka dapat disimpukan bahwa kondisi optimum sistem KCKT untuk memisahkan ALH adalah fase gerak metanol 100% dan laju alir 0,25
mL/menit. Komposisi ALH berdasarkan kondisi optimum KCKT adalah asam linoleil hidroksamik (59-60%), asam oleil hidroksamik (25-26%), asam palmitil hidroksamik (1314%) dan asam stearil hidroksamik (3-4%).
UCAPAN TERIMAKASIH
Terimakasih diucapkan kepada Direktorat Jenderal Pendidikan Tinggi (Dikti) atas pembiayaan penelitian melalui skim Penelitian Dasar Nasional 2019 dan Lembaga Penelitian dan Pengabdian kepada Masyarakat (LPPM) Universitas Mataram.
DAFTAR PUSTAKA
Adewuyi, A., Otuechere, C. A., Oteglolade, Z. O., Bankole, O., dan Unuabonah, E. I. 2015. Evaluation of The Safety Profile and Antioxidant Activity of Fatty Hydroxamic Acid From Underutilized Seed Oil of Cyperus esculentus. Journal of Acute Disease. 1-7.
Bakhtra, D. D., Rusdi, dan Mardiah, A. 2016. Penetapan Kadar Protein dalam Telur Unggas Melalui Analisis Nitrogen Menggunakan Metode Kjeldahl. Jurnal Farmasi Higea. 8(2): 143-150.
Carvalho, M. S., Mendonca, M. A., Pinho, D. M. M., Resck, I. S., dan Suarez, P. A. Z. 2012. Chromatographic Analyses of Fatty Acids Methyl Esters by HPLC-UV and GC-FID. J. Braz Chem Soc. 23(4): 763-769.
Chance, J. P., Fejzic, H., Hernandez, O., Istvan, E. S., Andaya, A., Maslov, N.,dan Goldberg, D. E. 2018. Development of Piperazine-based Hydroxamic Acid Inhibitors Against Falcilysin, an Essential Malarial
Protease. Bioorganic & Medical
Chemistry Latters. 28(1): 1846-1848.
Dolowy, M., dan Pyka, A.. 2015.
Chromatographic Methods in the Separation of Long-Chain Mono- and Polyunsaturated Fatty Acids. Journal of Chemistry. 1-20.
Hoidy, W.H., Ahmad, M.B., Al-Mulia, E. A. J., Yunus, W. M. Z. W., dan Ibrahim, N. A. B. 2010. Synthesis and Characterization of Fatty Hydroxamic Acids from Triacylglycerides. Journal of Oleo Science. 59 (1): 15-19.
Iha, O.K., Alves, F. C. S. C., Suarez, P.A.Z., Silva, C. R. P., Meneghetti, M. R., dan Meneghetti, S. M. P. 2014. Potential Application of Terminalia catappa L. and Carapa guianensis Oils for Biofuel Production: Physical-Chemical
Properties of Neat Vegetable Oils, Their Methyl-esters and Bio-oils (Hydrocarbons). Industrial Crops and Products. 52: 95-98.
Jafar, B. M., Hamadneh, I., Khalili, F. I., dan Al-Dujaili, A. H. 2015. Kinetic Study on Adsorption of Faty Hydroxamic Acids by Natural Clays. Jordan Journal of Earth and Environmental Sciences. 7(1): 11-17.
Jahangirian, H., Haron, M. J., Yusof, N. A., Silong, S., Kassim, A., Raflee-Moghaddam, R., dan Gharayebi, Y. 2011. Enzymatic Synthesis of Fatty Hydroxamic Acid Derivatives Based on Palm Kernel Oil. Molecules. 6634
6644.
Kembaren, A., dan Harahap, T. 2014. Validasi Metode Penentuan Sakarin Menggunakan Kromatografi Cair Kinerja Tinggi. Jurnal Pendidikan Kimia. 70-80.
Majeewski, M. W., Cho, S., Miller, P. A., Franzblau, S. G., dan Miller, M. J. 2015. Syntheses and Evaluation of Subtitued Aroamtic by Hydroxamates and Hydroxamic Acids that Target Mycobacterium Tuberculosis.
Bioorganic & Medicinal Chemistry Letters. 1-4.
Mayer Bernard X., Neckel U., Jauhcahadar C., Frossard M., Jager W., dan Muller M. 2002. Simultaneos Determination of
Levofloxatin and Ciprofloxxacin in Microdialysates and Plasma by High-Performance Liquid Chromatography. Analytica Chemica Acta. 199-206.
Murniati, Suhendra, D., Gunawan, E. R., Handayani, S. S., Kurniawati, L., dan Ayuliansari, Y. 2019. Identifikasi dan Isolasi Asam Lemak Essensial Ekstrak Minyak Belut Menggunakan Kromatografi Cair Kinerja Tinggi. Orbital Chemistry Journal. 1(1): 12-19.
Najem, S. A., Khawaja, G., Hodroj, M. H., Babikian, P., dan Rizk, S. 2019. Adjuvant Epigenetic Therapy of Decitabine and Suberoylanilide Hydroxamic Acid Exerts AntiNeoplastic Effect in Acute Myeloid Leukimia Cells. Cells. 8: 1-23.
Nam, N., Huong, T. L., Dung, D. T. M., Dung, P. T. P., Oanh, D. T. K., Quyen, D., Thao, L. T., dan Park, S. H. 2013. Novel Isatin-based Hydroxamic Acids as Histone Deacetylase Inhibitor and Antitumor Agents. European Journal of Medicinal Chemistry. 70: 477-486.
Stranix, B. R., Wu, J. J., Milot, G., Beaulieu, F., Bouchard, J.-E., Gouveia, K., dan Xiao, Y. 2016. Pyridoxine Hydroxamic Acids as Novel HIV-integrase Inhibitors. Bioorganic & Medicinal Chemistry Letters. 1-4.
Suhendra, D., Yunus, W. M. Z. W., Haron, M. J., Basri, M., dan Silong, S. 2005. Enzymatic Synthesis of Fatty Hydroxamic Acids from Palm Oil. Journal of Oleo Science. 54 (1): 33-38.
Suhendra, D., dan Gunawan, E. R. 2012 Sintesis Asam-Asam Lemak Hidroksamik dari Minyak Kelapa Menggunakan Lipase sebagai Katalis. Jurnal Natur Indonesia. 14(2): 160-164.
Suhendra, D., Gunawan, E. R., Yuanita, E., dan Nazili, M. 2018. Optimization of Lipase-Catalyzed Synthesis of Fatty Hydroxamic Acid from Terminalia Catappa L. Kernel Oil. Oriental Journal of Chemistry. 34(5): 2370-2377.
Zhou, F., Yan, C., Wang, H., Sun, Q., Wang, Q., dan Alshameri, A. 2015. Flotation Behavior of Four C18 Hydroxamic Acids as Collectors of Rhodochrosite. Minerals Engineering. 78: 15-20.
92
Discussion and feedback