ISOLASI DAN KARAKTERISASI SENYAWA SANTON PADA FRAKSI DIKLOROMETANA KULIT BUAH MANGGIS (Garcinia mangostana L.) ASAL KALIMANTAN BARAT
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 15 (1), JANUARI 2021 DOI: https://doi.org/10.24843/JCHEM.2021.v15.i01.p12
p-ISSN 1907-9850
e-ISSN 2599-2740
ISOLASI DAN KARAKTERISASI SENYAWA SANTON PADA FRAKSI DIKLOROMETANA KULIT BUAH MANGGIS (Garcinia mangostana L.) ASAL KALIMANTAN BARAT
I. Permatasari, M. A. Wibowo, Rudiyansyah dan A. H. Alimuddin*
Program Studi Kimia, Fakultas MIPA, Universitas Tanjungpura, Pontianak, Indonesia *Email: andi.hairil.alimuddin@chemistry.untan.ac.id
ABSTRAK
Manggis (Garcinia mangostana L.) merupakan tanaman yang memiliki manfaat terutama pada bagian kulit buah yaitu sebagai antioksidan, antikanker, antimalaria, antibakteri, antimikroba, antiprotozoal, antidiabetes dan larvasida. Senyawa metabolit sekunder yang paling sering ditemukan dalam kulit buah manggis adalah senyawa golongan santon. Penelitian ini menggunakan sampel kulit buah manggis yang tumbuh di Kalimantan Barat. Tahapan penelitian untuk memperoleh isolat adalah ekstraksi (maserasi dan partisi), uji fitokimia, kromatografi lapis tipis (KLT), kromatografi cair vakum (KCV), dan kromatografi kolom Flash (KKF). Hasil isolat G8M6L7 berupa kristal kuning sebanyak 27,6 mg diidentifikasi dengan metode KLT eluen n-heksana:etil asetat (7:3) menggunakan reagen semprot serium sulfat. Hasil yang diperoleh berupa bercak berwarna kuning yang mengindikasikan sebagai senyawa santon. Identifikasi lebih lanjut terhadap isolat G8M6L7 dengan metode spektroskopi UV-Vis, FT-IR dan 1H NMR. Isolat tersebut diperkirakan senyawa santon terprenilasi didukung dengan data spektrum UV-Vis pada panjang gelombang 297 nm menandakan adanya kromofor yang berkonjugasi ikatan rangkap. Interpretasi terhadap spektrum FT-IR menunjukkan adanya puncak serapan khas yang mengindikasikan sebagai senyawa santon, dimana adanya gugus karbonil terkhelat (1624,06 cm-1), gugus hidroksi –OH (3383,14 cm-1), gugus -C=C- allil sp2 (1463,97 cm-1), gugus C-O pada eter ataupun hidroksi (1284,59 cm-1) serta gugus C-H alifatik sp3 (2968,45 cm-1, 2922,16 cm-1, 2856,58 cm-1). Interpretasi spektrum 1H-NMR memperlihatkan geseran kimia rentang 6-8 ppm menunjukkan gugus aromatik, 13,69 (1H, s) dan 13,19 (1H, s) menunjukkan 2 hidroksi terkhelat, 6,73 (1H, d, J=10,05 Hz), 5,57 (1H, d, J=10,05 Hz) dan 1,46 (3H, s) menunjukkan gugus prenil tersiklisasi, serta 5,26 (2H, m), 4,09 (1H, d, J=6,4 Hz), 1,79 (3H, s) dan 1,69 (3H, s) menunjukkan gugus prenil. Berdasarkan data yang diperoleh dapat disimpulkan bahwa isolat G8M6L7 dari fraksi DCM kulit buah manggis merupakan golongan senyawa santon.
Kata kunci: Garcinia mangostana L., kulit buah manggis, santon
ABSTRACT
Mangosteen (Garcinia mangostana L.) is a plant that has benefits, especially in the rind of the fruit, namely as an antioxidant, anticancer, antimalarial, antibacterial, antiprotozoal, antidiabetic and larvicide. The secondary metabolite compounds most often found in mangosteen rind are xanthones. This study uses mangosteen rind sample that grow in West Kalimantan. Stages of research to obtain isolate were extraction (maceration and partition), phytochemical test, thin layer chromatography (TLC), vacuum liquid chromatography (VLC), and Flash column chromatography (FCC). The results of G8M6L7 isolate in the form of 27.6 mg yellow crystals were identified by the TLC method eluent n-hexane: ethyl acetate (7: 3) using serium sulfate spray reagent. The results obtained in the form of yellow spot that indicate a xanthone compound. Further identification of G8M6L7 isolates by UV-Vis, FT-IR and 1H NMR spectroscopic methods. The isolate was estimated to be prenylated xanthones compound supported by UV-Vis spectrum data at a wavelength of 297 nm indicating the presence of chromophore conjugated double bonds. Interpretation of the FT-IR spectrum shows that there is a characteristic absorption peak that indicates a xanthone compound, where there is a chelated carbonyl group (1624.06 cm-1), a hydroxy group -OH (3383.14 cm-1), -C=C- group allil sp2 (1463.97 cm-1), C-O groups on ether or hydroxy (1284.59 cm-1) and CH aliphatic sp3 groups (2968.45 cm-1, 2922.16 cm-1, 2856.58 cm-1). Interpretation of the 1H-NMR spectrum shows chemical shift of 6-8 ppm show aromatic groups, 13.69 (1H, s) and 13.19 (1H, s) show 2 chelated hydroxides, 6.73 (1H, d, J = 10 , 05 Hz), 5.57 (1H, d, J = 10.05 Hz) and 1.46 (3H, s) indicate the prenyl group cyclized, and 5.26 (2H, m), 4.09 (1H, d, J = 6.4 Hz), 1.79 (3H, s) and 1.69 (3H, s) indicate the prenyl group. Based on the data obtained it can be concluded that the isolate G8M6L7 from the DCM fraction of mangosteen rind is a group of xanthones compound.
Keywords: Garcinia mangostana L., mangosteen rind, xanthones
PENDAHULUAN
Tanaman manggis (Garcinia
mangostana L.) merupakan tanaman buah tropis tahunan atau musiman yang berasal dari wilayah Malaysia dan berkembang ke seluruh Asia Tenggara, termasuk Indonesia. Indonesia setiap tahunnya menghasilkan buah manggis rata-rata sekitar 60.000 ton (Putra, 2011). Buah manggis memiliki kandungan gizi yang cukup tinggi pada setiap bagiannya. Bagian daging buah mengandung vitamin C, sakarosa, dekstrosa, dan levulosa. Kulit buah manggis mengandung karbohidrat 82,50%, protein 3,02%, dan lemak 6,45% (Shabella, 2011). Tanaman manggis memiliki banyak manfaat pada bagian kulit buah yaitu sebagai antioksidan(Yu et al., 2007;Dungir et al., 2012; Chin et al., 2008; Pratiwi et al., 2016), antikanker(Ragasa et al., 2016; Moongkarndi et al., 2015), sitotoksik(Suksamrarn et al., 2006;Ramesh et al., 2017), antimalaria (Riscoe et al., 2005), antibakteri(Inas et al., 2014;Suzy et al., 2018), antimikroba(Al-Massarani et al., 2013), antiprotozoal(Al-Massarani et al., 2013), antidiabetes(Ryu et al., 2011), dan
aktivitas larvicidal(Larsonet al., 2010; Inas et al., 2014).
Kandungan senyawa kimia yang terdapat dalam kulit buah manggis diantaranya adalah golongan santon, flavonoid, dan tannin(Heyne, 1987). Chin et al. (2008) telah mengisolasi kulit buah manggis yang berasal dari China dan Asia Tenggara terdiri dari 2 senyawa santon, 1,2-dihidro-1,8,10-trihidroksi-2-(2-hidroksipropan-2-il)-9-(3-metilbut-2-enil)furo [3,2-a]xanten-11-one dan 6-deoksi-7-demetilmangostanin, dengan 3 senyawa yang dikenal, 1,3,7-trihidroksi-2,8-di- (3-metilbut-2-enil) xanton, mangostanin, dan α-mangostin serta γ-mangostin yang menunjukkan aktivitas antioksidan dengan IC50 0,20 μg/mL.Penelitian lain oleh Massarani et al. (2013) mengisolasi 5 turunan santon dan 1 flavanol dari kulit buah manggis yang berasal dari Riyadh (Arab Saudi) yaitu α-mangostin, β-mangostin, 1-hidroksi-3,6,7-trimetoksi-2,8-bis(3-metilbut-2-enil)xanton, 9-hidroksicalabaxanton, tovopillin A dan katekin.
Berdasarkan hasil penelitian
sebelumnya, senyawa metabolit sekunder yang paling sering ditemukan pada fraksi DCM kulit buah manggis (Garcinia mangostana L.) adalah senyawa golongan santon. Buah manggis merupakan salah satu buah lokal 84
Kalimantan Barat, dimana wilayahnya beriklim tropis dan umumnya memiliki tanah gambut. Perbedaan lokasi tumbuhnya suatu tanaman dapat berpengaruh pada proses metabolisme dalam tanaman tersebut sehingga kemungkinan dihasilkan suatu senyawa yang berbeda dengan senyawa lain meskipun jenis tanaman sama. Oleh karena itu, diperlukan penelitian lebih lanjut mengenai isolasi dan mengkaji karakteristik senyawa santon yang terkandung di dalam kulit buah manggis yang tumbuh di Kalimantan Barat.
MATERI DAN METODE
Bahan
Bahan-bahan yang digunakan pada penelitian ini adalah serbuk kulit buah manggis, metanol (CH3OH), etil asetat (C4H8O2), diklorometana (CH2Cl2), n-heksana (C6H12), asam sulfat (H2SO4), besi (III) klorida (FeCl3), reagen Meyer, reagen Wagner, serium (IV) sulfat (Ce(SO4)2), logam Mg, silika gel 60, silika gel G60, kloroform (CHCl3).
Peralatan
Alat-alat yang digunakan pada
penelitian ini adalah seperangkat alat gelas, rotatory evaporator, seperangkat alat
Kromatografi Cair Vakum, seperangkat alat Kromatografi Kolom Flash, lampu UV 254 nm, pipet kapiler, chamber, plat uji, pipet ukur, pipet tetes, neraca analitik, botol vial, spektrofotometer UV-Vis Shimadzu UV-1280, spektrofotometer FT-IR IRPrestige-21 Shimadzu, spektrometer NMR Agilent 500 Hz.
Cara Kerja
Preparasi sampel
Buah manggis yang digunakan adalah buah manggis yang sudah matang berasal dari Kota Pontianak, Kalimantan Barat. Buah manggis diambil kulitnya lalu dibersihkan dan dikeringanginkan. Kulit buah manggis yang kering dipotong dan dihaluskan sehingga diperoleh serbuk kulit buah manggis sebanyak 2,5 kg.
Ekstraksi dan Partisi
Ekstraksi kulit buah manggis menggunakan metode maserasi. Serbuk kulit buah manggis sebanyak 2,5 kg diekstraksi menggunakan pelarut metanol selama 3x24 jam pada suhu kamar. Ekstrak disaring sehingga mendapatkan filtrat dan residu.
Pelarut yang terdapat dalam filtrat diuapkan menggunakan rotatory evaporator pada suhu 40 ºC untuk menghasilkan ekstrak metanol.
Ekstrak metanol difraksinasi menggunakan metode partisi. Partisi dilakukan dengan caramenambahkan pelarut n-heksana kedalam ekstrak kental metanol untuk melarutkan komponen nonpolar sehingga terbentuk larutan dan endapan. Hasil tersebut disaring menghasilkan filtrat berupa fraksi n-heksana dan residu. Residu yang diperoleh dilanjutkan dengan langkah yang sama menggunakan masing-masing pelarut diklorometana (DCM) dan etil asetat untuk memperoleh masing-masing fraksi diklorometana (DCM) dan etil asetat serta residu yang selanjutnya disebut fraksi metanol. Hasil fraksi n-heksana, fraksi DCM dan fraksi etil asetat dipekatkan menggunakan rotatory evaporator pada suhu 40 ºC menghasilkan ekstrak kental setiap fraksi.
Uji Fitokimia
Hasil ekstrak dan fraksi diuji fitokimia untuk mengetahui kandungan senyawa metabolit sekunder berdasarkan perubahan warna dari penambahan reagen tertentu. Adapun uji yang dilakukan yaitu uji alkaloid, uji steroid dan terpenoid, uji flavonoid, serta uji fenolik.
Pemisahan dan Pemurnian
Sebanyak 36 g fraksi DCM difraksinasi menggunakan metode kromatografi cair vakum (KCV) yang terbagi dalam dua tahapan KCV. Masing-masing tahap digunakan 18 g fraksi DCM yang diimpregnasikanpada silika gel 60-70 mesh dengan perbandingan 1:1. Fraksi DCM yang sudah diimpregnasi dimasukkan ke dalam kolom berdiameter 4 cm dengan ketinggian 8 cm yang berisi fase diam berupa silika gel G60. Elusi dimulai dengan mengalirkan eluen kombinasi n-heksana:etil asetat dengan perbandingan 8:2, 6:4, 4:6, 2:8, etil asetat: metanol 1:1, dan metanol 100%. Sebanyak 24 vial yang diperoleh dari proses KVC dilanjutkan dengan proses identifikasi menggunakan metode KLT dengan eluen perbandingan n-heksana:etil asetat (6:4) sebagai dasar penggabungan vial. Vial yang memiliki pola noda dan Rf yang sama digabungkan, sehingga diperoleh 12 fraksi gabungan yaitu G1-G12. Fraksi G8 memiliki senyawa yang kompleks sebanyak 18,48 g
sehingga dilakukannya pemisahan kembali menggunakan KCV.
Hasil fraksi G8 diimpregnasi menggunakan silika gel 60-70 mesh dengan perbandingan 1:1. Elusi dimulai dengan mengalirkan eluen n-heksana 100%, kombinasi n-heksana : etil asetat dengan perbandingan 9:1, 8:2, 6:4, 4:6, 2:8, etil asetat : metanol 1:1, dan metanol 100%. Eluat yang dihasilkan sebanyak 40 fraksi, kemudian dilakukan KLT dengan eluen perbandingan n-heksana:etil asetat (6:4). Hasil fraksi yang memiliki pola noda dan Rf yang sama digabungkan, sehingga diperoleh 11 fraksi gabungan yaitu G8M1-G8M11. Hasil reagen semprot serium sulfat pada G8M6 menunjukkan bahwa spot noda yang dihasilkan mengandung golongan senyawa santon dan memiliki massa yang relatif banyak sehingga dipilih ke tahap pemurnian untuk memisahkan komponen senyawa yang terdapat dalam fraksi dengan menggunakan metode kromatografi kolom Flash (KKF).
Hasil fraksi G8M6 diimpregnasi menggunakan silika gel 60-70 mesh dengan perbandingan 1:1. Fase diam yang digunakan pada kromatografi kolom Flash berupa silika gel 60 (230-400 mesh). Kolom disiapkan dengan cara silika gel dibuat bubur dengan menambahkan pelarut n-heksana, diaduk sampai jenuh. Bubur silika gel dimasukkan ke dalam kolom yang berdiameter 4 cm dengan ketinggian 16 cm, kemudian dimasukkan n-heksana dan didiamkan selama 24 jam. Fraksi G8M6 kemudian dimasukkan ke dalam kolom yang sudah berisi bubur silika gel. Elusi dimulai dengan mengalirkan eluen kombinasi n-heksana : etil asetat dengan perbandingan 9:1, 8:2, 7:3, 6:4, 1:1, 4:6, 3:7, 2:8, 1:9, dan metanol 100%. Eluat yang dihasilkan sebanyak 525 vial, kemudian dilakukan KLT dengan eluen perbandingan n-heksana : etil asetat (4:6). Hasil fraksi yang memiliki pola noda dan Rf yang sama digabungkan, sehingga diperoleh 23 fraksi gabungan yaitu G8M6L1-G8M6L23. Isolat G8M6L7 menunjukkan pola noda yang cukup sederhana yaitu spot noda tunggal sehingga diuji kemurniannya.
Uji kemurnian isolat G8M6L7 dilakukan dengan menggunakan metode KLT dua dimensi. Eluen perbandingan yang digunakan pada KLT dua dimensi adalah n-heksana:etil asetat (7:3), kemudian dilanjutkan dengan eluen perbandingan n-heksana:etil asetat (6:4).
Hasil KLT akan menunjukkan spot noda tunggal yang berarti isolat tersebut cukup murni.
Karakterisasi Isolat G8M6L7 a. Spektrofotometer UV-Vis
Isolat G8M6L7 yang telah murni sebanyak 5 mg isolat dilakukan analisis menggunakan spektrofotometer UV-Vis yang dilakukan di Laboratorium Kimia FMIPA Universitas Tanjungpura. Analisis UV-Vis mengacu pada prosedur kerja Astutiningsihet al. (2012) yang dilakukan dengan beberapa modifikasi. Isolat G8M6L7 sebanyak 5 mg dilarutkan dalam 100 mL metanol. Larutan diukur nilai panjang gelombang maksimum pada rentang panjang gelombang 200-400 nm.
Isolat G8M6L7 yang telah murni sebanyak 1 mg dilakukan analisis menggunakan spektrofotometer FT-IR yang dilakukan di Laboratorium Terpadu Jurusan Kimia FMIPA Universitas Hassanudin. Spektrum yang diperoleh digunakan untuk mengetahui gugus fungsi pada senyawa dari hasil isolasi kulit buah manggis.
Isolat G8M6L7 yang telah murni sebanyak 6 mg dilakukan analisis menggunakan 1H-NMR dengan pelarut kloroform deuterasi (CDCl3) yang dilakukan di Laboratorium Kimia Organik Bahan Alam (KOBA) Departeman Kimia Institut Teknologi Bandung. Spektrum yang diperoleh digunakan untuk mengetahui jumlah proton pada senyawa dari hasil isolasi kulit buah manggis.
HASIL DAN PEMBAHASAN
Ekstrasi dan Partisi
Kulit buah manggis yang sudah kering dipotong dan dihaluskan untuk memperbesar luas permukaan dan membantu proses pemecahan membran sel sehingga proses ekstraksi berjalan maksimal. Ekstraksi kulit buah manggis menggunakan metode maserasi dimana perendaman sampel dilakukan pada
suhu kamar dalam keadaan tertutup menggunakan pelarut organik. Serbuk kulit buah manggis sebanyak 2,5 kg diekstraksi menggunakan pelarut metanol sebanyak 9 L. Proses maserasi terjadi peristiwa difusi, dimana pelarut metanol dapat masuk ke dalam membran sel tumbuhan dan dapat memecahkan dinding sel, kemudian membawa komponen yang terdapat didalam membran sel tumbuhan untuk berdifusi dari sel ke dalam pelarut. Maserasi dilakukan selama 3x24 jam agar senyawa metabolit sekunder pada kulit buah manggis dapat terekstrak secara maksimal.
Hasil maserasi disaring sehingga didapatkan filtrat berwarna merah tua, dan residu. Hasil maserasi diuapkan menggunakan rotatory evaporator pada suhu 40ºC sehingga menghasilkan ekstrak kering metanol sebanyak 138,87 g dengan rendemen 5,43 %.
Ekstrak metanol difraksinasi menggunakan metode partisi. Metode ini dilakukan pemisahkan campuran senyawa berdasarkan perbedaan kepolaran menggunakan prinsip like dissolves like dimana senyawa yang memiliki sifat polar akan terlarut dalam pelarut polar dan pelarut yang memiliki sifat nonpolar akan terlarut dalam pelarut nonpolar. Partisi dilakukan dengan kepolaran bertingkat dimana dimulai dari pelarut nonpolar, semi polar hingga polar.
Ekstrak kental metanol dipartisi dengan cara ditambahkan dengan n-heksana. Partisi menggunakan n-heksana bertujuan untuk memisahkan komponen senyawa nonpolar pada ekstrak metanol. Hasil partisi n-heksana membentuk larutan dan endapan yang kemudian disaring dan menghasilkan filtrat dan residu. Hasil filtrat merupakan fraksi n-heksana dan residu merupakan fraksi sisa metanol. Perlakuan diulang sampai larutan pudar, yang mengindikasi bahwa tidak ada lagi zat terlarut yang terkandung dalam n-heksana. Hasil residu selanjutnya dicampurkan kembali menggunakan diklorometana (DCM). Lakukan langkah yang sama menggunakan etil asetat dan metanol. Adapun hasil setiap fraksi dapat dilihat pada Tabel 1.
|
Tabel 1. Hasil rendemen setiap fraksi | ||
|
Fraksi |
Massa (g) |
Rendemen (%) |
|
n-heksana |
2,8513 |
4,93% |
|
DCM |
37,1600 |
64,19% |
|
Etil asetat |
11,5432 |
19,94% |
|
Metanol |
6,3348 |
10,94% |
Uji Fitokimia
|
Tabel 2 Hasil uji fitokimia setiap fraksi | |
|
Uji Uji Fraksi j j Fraksi Alkaloid Steroid |
Uji Uji Uji Terpenoid Flavonoid Fenolik |
|
n-heksana + + DCM + - Etil asetat + - |
- - -
|
|
Metanol + - |
- + + |
|
Keterangan : (-) tidak teridentifikasi (+) teridentifikasi |
(++) terindetifikasi banyak |
|
Pemisahan dan Pemurnian Hasil fraksi DCM selanjutnya dilakukan pemisahan dengan menggunakan metode kromatografi cair vakum (KCV). Fraksi DCM dilakukan orientasi terlebih dahulu menggunakan metode KLT dengan beberapa |
variasi perbandingan eluen. Tujuan perbandingan eluen untuk menentukan eluen yang digunakan pada saat elusi KCV. Hasil orientasi KLT fraksi DCM dapat dilihat pada Gambar 1. |

Gambar 1. KLT fraksi DCM eluen n-heksana:etil asetat (a) 8:2 (b) 6:4 (c) 4:6
Berdasarkan Gambar 1, hasil kromatogram menunjukkan banyaknya senyawa yang terdapat pada fraksi DCM, sehingga diperlukan kombinasi pelarut dengan peningkatan kepolaran secara bergradien untuk mendapatkan hasil pemisahan yang sesuai dengan tingkat kepolaran dari senyawa.Fraksi DCM sebanyak 36 g dimana dilakukan 2 kali tahapan KCV. Fraksi DCM diimpregnasi menggunakan silika gel 60-70 mesh dengan perbandingan 1:1 untuk menghomogenkan sampel. Fraksi DCM yang sudah diimpregnasi
kemudian dimasukkan ke dalam kolom yang sudah berisi fase diam. Fase gerak yang digunakan berupa eluen kombinasi n-heksana : etil asetat (8:2, 6:4, 4:6, dan 2:8), etil asetat : metanol (1:1), dan metanol 100%. Elusi diawali dengan eluen n-heksana : etil asetat (8:2) dengan tujuan untuk memisahkan senyawa nonpolar yang terdapat pada fraksi DCM. Hasil total fraksi pemisahan ditampung sebanyak 100 mL ke dalam botol vial sehingga diperoleh fraksi sebanyak 24 fraksi.
Hasil fraksi KCV kemudian dilakukan KLT menggunakan eluen n-heksana : etil asetat (6:4). Data KLT dapat digunakan sebagai acuan untuk menggabungkan fraksi yang memiliki pola noda dan Rf yang relatif sama. Fraksi yang memiliki pola noda dan Rf yang relatif sama dapat dikatakan merupakan
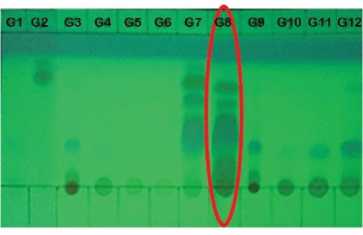
senyawa yang memiliki karakteristik yang relatif sama. Hasil gabungan dari 24 fraksi diperoleh 12 fraksi gabungan yaitu G1-G12.
Gambar 2. KLT hasil fraksi gabungan KCV fraksi DCM UV 254 nm
Hasil KLT gabungan pada Gambar 2 menunjukkan bahwa fraksi G8 memiliki senyawa yang kompleks sebanyak 18,4801 g sehingga dilakukannya pemisahan kembali menggunakan KCV. Fraksi G8 sebanyak 18,4801 g diimpregnasi menggunakan silika gel 60-70 mesh dengan perbandingan 1:1 untuk menghomogenkan sampel. Fraksi G8 yang sudah diimpregnasi kemudian dimasukkan ke dalam kolom yang sudah berisi fase diam. Fase gerak yang digunakan berupa eluen kombinasi n-heksana 100%, n-heksana:etil asetat (9:1, 8:2, 6:4, 4:6, dan 2:8), etil asetat:metanol (1:1), dan metanol 100%. Elusi diawali dengan eluen n-heksana 100% dengan tujuan untuk memisahkan senyawa nonpolar yang terdapat pada fraksi G8. Hasil total fraksi pemisahan ditampung sebanyak 100 mL kedalam botol vial sehingga diperoleh fraksi sebanyak 40 fraksi.
Hasil fraksi KCV kemudian dilakukan KLT dengan eluen perbandingan n-heksana:etil asetat (6:4) untuk menggabungkan fraksi yang memiliki pola noda dan Rf yang relatif sama. Fraksi dengan pola noda dan Rf yang relatif sama dapat dikatakan memiliki senyawa dengan karakteristik yang relatif sama. Hasil gabungan dari 40 fraksi diperoleh 15 fraksi gabungan yaitu G8M1- G8M11.
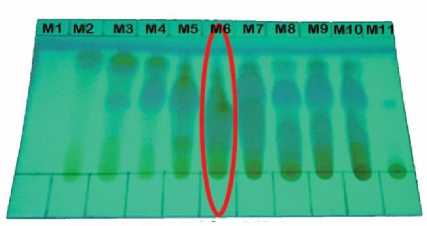
Hasil fraksi G8M6 sebelumnya dilakukan orientasi menggunakan metode KLT terlebih dahulu untuk menentukan eluen awal pada KKF. Hasil orientasi menggunakan metode KLT dipilih eluen n-heksana:etil asetat (9:1) yang digunakan sebagai eluen awal karena pola noda sudah terpisah walaupun jarak antar noda rapat, sehingga dibutuhkan elusi secara bergradien agar memisahkan senyawa satu dengan lainnya.
Fraksi G8M6 yang sudah diimpregnasi kemudian dimasukkan ke dalam kolom yang sudah berisi bubur silika gel. Fase gerak yang digunakan berupa eluen kombinasi n-heksana : etil asetat dengan perbandingan 9:1, 8:2, 7:3,
6:4, 1:1, 4:6, 3:7, 2:8, 1:9, dan metanol 100%. Elusi diawali dengan eluen n-heksana:etil asetat (9:1) dengan tujuan untuk memisahkan senyawa nonpolar yang terdapat pada fraksi G8M6. Hasil total fraksi pemisahan ditampung sebanyak 5 mL kedalam botol vial sehingga diperoleh fraksi sebanyak 525 vial.Hasil fraksi KKF diidentifikasi menggunakan metode KLT dengan eluen n-heksana:etil asetat (4:6) untuk menggabungkan fraksi yang memiliki pola noda dan Rf yang relatif sama. Fraksi gabungan yang diperoleh sebanyak 23 fraksi (G8M6L1-G8M6L23) dari 525 vial yang ditampung.
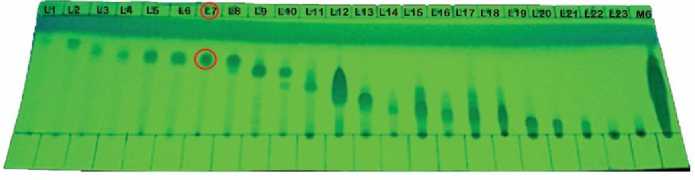
Gambar 5. KLT fraksi gabungan KKF n-heksana : etil asetat (4:6) UV 254 nm
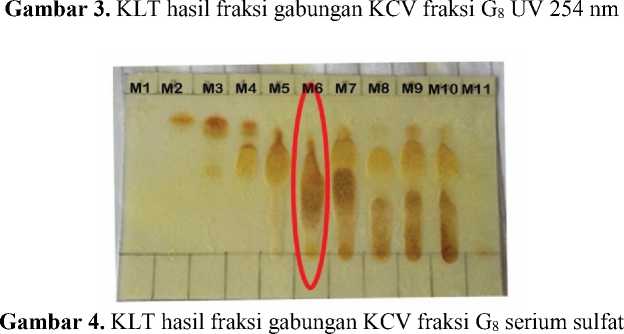
Hasil KLT pada setiap fraksi menunjukkan hasil pola noda yang cukup sederhana. Isolat G8M6L7 menunjukkan spot noda tunggal yang berarti isolat cukup murni sehingga tidak diperlukan pemurnian lebih lanjut. Hasil reagen semprot serium sulfat pada isolat G8M6L7 menunjukkan bahwa spot noda kuning merupakan golongan senyawa santonsesuai dengan penelitian Lukis dan Ersan (2011)dan memiliki massa yang relatif banyak sehingga dipilih untuk analisis menggunakan spektrofotometer UV-Vis,
spektrofotometer FT-IR dan spektrometer 1H-NMR.
Uji kemurnian isolat G8M6L7 dilakukan dengan menggunakan metode KLT dua dimensi yang bertujuan untuk mengetahui kemurnian dari isolat yang dihasilkan dari proses isolasi. Eluen perbandingan yang digunakan pada KLT dua dimensi adalah n-heksana : etil asetat (7:3), yang kemudian dilanjutkan dengan eluen perbandingan n-heksana : etil asetat (6:4). Hasil KLT dua dimensi isolat G8M6L7 dapat dilihat pada Gambar 6.

(a) (b)
Gambar 6. Kromatogram KLT dua dimensi terhadap isolat G8M6L7 Keterangan : (a) UV 254 nm (b) Serium sulfat
Hasil KLT dua dimensi pada Gambar 6 menunjukkan terdapatnya spot noda relatif tunggal pada plat KLT, sehingga dapat disimpulkan senyawa pada isolat G8M6L7 relatif murni. Massa yang didapatkan pada isolat G8M6L7 adalah 27,6 mg. Hasil KLT dua dimensi pada Gambar 6(b) menunjukkan bahwa isolat positif mengandung senyawa santon dikarenakan setelah disemprot dengan reagen serium sulfat spot noda berwarna kuning. Warna noda pada hasil uji KLT apabila disemprot dengan reagen serium sulfat berwarna kuning mengindikasikan adanya senyawa santon (Lukis dan Ersan, 2011).
Karakterisasi Isolat G8M6L7 Analisis Spektrum UV-Vis
Isolat G8M6L7 yang telah murni dianalisis menggunakan spektrofotometer UV-Vis. Analisis UV-Vis menggunakan panjang gelombang 200-400 nm.
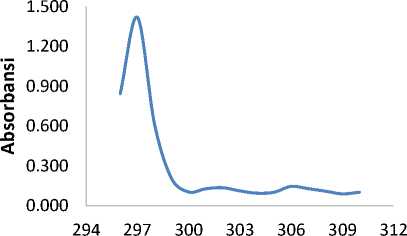
λ (nm)
Gambar 7. Spektrum UV dari G8M6L7
Berdasarkan Gambar 7, terdapat puncak pada λ 297 nm. Puncak pada λ 297 nm menandakan adanya kromofor yang berkonjugasi untuk sistem ikatan rangkap terkonjugasi (-C=C-C=C-) pada senyawa aromatik yang menunjukkan adanya eksitasi elektron dari π→π*. Puncak pada λ 306 nm menandakan adanya sistem terkonjugasi (-C=C-C=O) dari heteroatom dengan ikatan rangkap terkonjugasi yang menunjukkan adanya eksitasi elektron dari n→π*. Senyawa santon memiliki gugus aromatik dengan ikatan rangkap terkonjugasi pada panjang gelombang 200-400 nm, sehingga diduga isolat G8M6L7 yang dihasilkan merupakan senyawa santon.
Analisis Spektrum FT-IR
Isolat G8M6L7 yang telah murni dianalisis menggunakan spektrofotometer FT-IR pada bilangan gelombang 500-4000 cm-1. Hasil analisis FT-IR dapat dilihat pada Gambar 8.
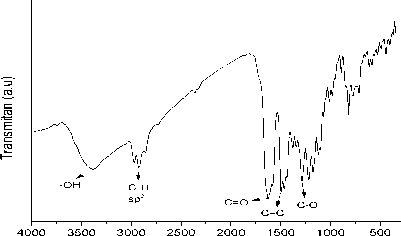
Bilangan Gelombang (cm-1)
Gambar 8. Spektrum FT-IR dari G8M6L7
Spektrum FT-IR pada Gambar 8 menunjukkan beberapa bilangan gelombang atau pita-pita serapan yang khas pada gugus fungsi senyawa santon. Pita serapan pada bilangan gelombang 1624,06 cm-1 menunjukkan adanya gugus karbonil terkhelat dengan didukung adanya bilangan gelombang 3383,14 cm-1 yang menandakan gugus hidroksi (-OH). Pita serapan pada bilangan gelombang 1463,97 cm-1 menandakan ciri khas dari (-C=C-) allil sp2 dan pada bilangan gelombang 1284,59 cm-1 menunjukkan gugus C-O pada eter ataupun hidroksi. Pita serapan pada bilangan gelombang 2968,45 cm-1, 2922,16 cm-1 dan 2856,58 cm-1 menandakan adanya gugus C-H alifatik sp3. Interpretasi FT-IR memperkuat dugaan bahwa isolat G8M6L7 memiliki kerangka dasar santon.
c. Analisis Spektrum 1H-NMR
Isolat G8M6L7 dilarutkan dalam pelarut kloroform deuterasi (CDCl3) kemudian dilakukan analisis menggunakan 1H-NMR pada frekuensi 500 MHz untuk mengetahui jumlah proton pada senyawa hasil isolasi. Spektrum 1H-NMR menunjukkan bahwa senyawa pada isolat G8M6L7 mengandung 20 geseran kimia. Dua proton pada geseran 13,69 (1H, s) dan 13,19 (1H, s) diduga menunjukkan adanya 2 hidroksi terkhelat yang dapat dilihat pada Gambar 9. Data spektrum ini dibandingkan dengan penelitian Mutiah (2017)
dimana pada geseran 13,53 (1H,s) menandakan adanya hidroksi khelat.
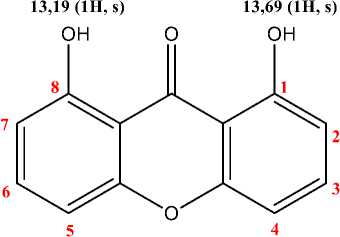
Gambar 9. Struktur senyawa santon
Tiga proton pada geseran 6,73 (1H, d, J=10,05 Hz), 5,57 (1H, d, J=10,05 Hz), dan 1,46 (3H, s) menandakan adanya sinyal pada gugus prenil tersiklisasi. Beberapa proton pada geseran 5,26 (2H, m), 4,09 (1H, d, J=6,4 Hz), 1,79 (3H, s), dan 1,69 (3H, s) menandakan adanya sinyal pada gugus prenil. Data spektrum ini dibandingkan dengan penelitian Yang et al. (2017), dimana pada geseran 6,61 (1H, d, J=9,9 Hz), 5,73 (1H, d, J=9,9 Hz), 1,43 (3H, s) menunjukkan adanya gugus prenil tersiklisasi, sedangkan pada geseran 5,18 (1H, t, J=6,8 Hz), 4,02 (2H, d, J=6,8 Hz), 1,78 (3H, s), dan 1,61 (3H, s) menunjukkan adanya gugus prenil.
6,73 (IH, d, J=IO,05 Hz)
1,69 (3H, s) 4
1'
5"1,79(3H, s)
2'5,57 (IH, d, J=IO,05 Hz)
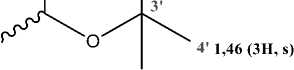
5' 1,46 (3H, s)
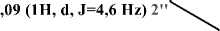
1"5,26(2H, m)
(a)

Gambar 10. Gugus (a) prenil tersiklisasi (b) prenil
Tabel 3. Data perbandingan spektrum 1H-NMR isolat G8M6L7 dengan mangostanin (santon
terprenilasi) menggunakan pelarut DMSO-d6 MHz penelitian Yang et al. (2017)
|
Proton |
Isolat G8M6L7 |
Mangostanin (santon terprenilasi)* |
|
H1’ |
6,73 (1H, d, J=10,05 Hz) |
6,77 (1H, d, J=10 Hz) |
|
H2’ |
5,57 (1H, d, J=10,05 Hz) |
5,62 (1H, d, J=10 Hz) |
|
H4’ |
1,46 (3H, s) |
1,43 (3H, s) |
|
H5’ |
1,46 (3H, s) |
1,43 (3H, s) |
|
H1” |
4,09 (1H, d, J=4,6 Hz) |
5,18 (1H, t, J=6,8 Hz) |
|
H2” |
5,26 (2H, m) |
4,02 (2H, d, J=6,8 Hz) |
|
H4” |
1,69 (3H, s) |
1,69 (3H, s) |
|
H5” |
1,79 (3H, s) |
1,78 (3H, s) |
Keterangan : (*) penelitian Yang et al. (2017)
Adanya beberapa proton pada geseran 7,76 (1H, d), 7,31 (1H, d, J=7,75 Hz), 7,24 (1H, d), 6,83 (1H, s), 6,68 (1H, d, J=8,8 Hz), 6,61 (1H, s), 6,54 (1H, s), 6,32 (1H, s) dan 6,24 (1H, s) diduga menunjukkan adanya proton pada gugus aromatik. Dua proton pada 12,36 (1H, s) dan 11,27 (1H, s) diduga menunjukkan adanya gugus hidroksi. Beberapa proton pada geseran 5,08 (1H, s), 3,80 (1H, s)
dan 3,52 (6H, s) menunjukkan adanya menunjukkan proton teroksigenasi atau proton yang terikat dengan karbon teroksigenasi. Beberapa proton pada geseran 1,87 (7H, ss), 1,83 (1H, s), 1,75 (3H, s) 1,59 (8H, s), 1,49 (1H, s) dan 1,25 (4H, s) menunjukkan adanya proton yang tidak memiliki elektronegatifitas.
Hasil dugaan proton pada setiap pergeseran merujuk pada hasil penelitian penelitian Mutiah (2017)dan Yang et al.
(2017)dimana adanya proton pada gugus aromatik, hidroksi khelat, dan gugus hidroksi yang merupakan ciri khas dari senyawa santon. Adanya 4 metil pada gugus prenil menunjukkan bahwa senyawa santon memiliki 2 gugus prenil yaitu gugus prenil dan prenil tersiklisasi. Interpretasi 1H-NMR menunjukkan bahwa senyawa pada isolat G8M6L7 diduga merupakan senyawa santon terprenilasi.
SIMPULAN
Hasil dari penelitian dapat disimpulkan bahwa isolat G8M6L7 berbentuk kristal berwarna kuning sebanyak 27,6 mg ditunjukkan dengan adanya spot noda berwarna kuning pada reagen semprot serium sulfat pada plat KLT. Interpretasi UV-Vis menunjukkan adanya kromofor yang berkonjugasi pada puncak 297 nm. Interpretasi FT-IR menandakan pita yang khas pada senyawa santon, pada 1624,06 cm-1 menunjukkan gugus karbonil terkhelat yang didukung bilangan gelombang 3383,14 cm-1 menandakan gugus hidroksi (-OH), 1463,97 cm-1 menandakan ciri khas dari (-C=C-) allil sp2, 1284,59 cm-1 menunjukkan gugus C-O
pada eter ataupun hidroksi serta pada 2968,45 cm-1, 2922,16 cm-1 dan 2856,58 cm-1 menandakan gugus C-H alifatik sp3. Interpretasi 1H-NMR menunjukkan
karakteristik dari senyawa santon terprenilasi pada geseran kimia rentang 6-8 ppm menunjukkan adanya gugus aromatik, 13,69 (1H, s) dan 13,19 (1H, s) menunjukkan adanya 2 hidroksi terkhelat, 6,73 (1H, d, J=10,05 Hz), 5,57 (1H, d, J=10,05 Hz) dan 1,46 (3H, s) menunjukkan adanya gugus prenil tersiklisasi, serta 5,26 (2H, m), 4,09 (1H, d, J=6,4 Hz), 1,79 (3H, s) dan 1,69 (3H, s) menunjukkan adanya gugus prenil. Berdasarkan data yang diperoleh dapat disimpulkan bahwa isolat G8M6L7 dari fraksi DCM kulit buah manggis merupakan golongan senyawa santon.
DAFTAR PUSTAKA
Al-Massarani, S. M., Gamal, A. A. E., Al-Musayeib, N. M., Mothana, R. A., Basudan, O. A., Al-Rehaily, A. J., Farag, M., Assaf, M. H., Tahir, K. H. E., and Maes, L. 2013. Phytochemical Antimicrobial and Antiprotozoal Evaluation of Garcinia mangostana Pericarp and α-Mangostin Its Major
Xanthone Derivative. Molecules. 18:
10599-10608.
Astutiningsih, C., Frida, N., dan Agus, S. 2012. Isolasi dan Identifikasi Senyawa Alkaloid Buah Mahkota Dewa (Phaleria macrocarpa (Scheff.) Boerl) Secara
Spektrofotometri UV-Vis dan IR serta Uji Toksisitas Akut Terhadap Larva Artemia Salina Leach. J. Farmasi Sains dan Komunitas. 9(2): 66-70.
Chin, Y. W., Jung, H. A., Chai, H., Keller, W. J., and Kinghorn, A. D. 2008. Xanthones With Quinone Reductase-Inducing Activity From The Fruits Of Garcinia Mangostana (Mangosteen).
Phytochemistry. 69: 754–758.
Dungir, S. G., Katja, D. G., dan Kamu, V. S. 2012. Aktivitas Antioksidan Ekstrak Fenolik dari Kulit Buah Manggis (Garcinia mangostana L.). Jurnal MIPA Unsrat Online, 1(1): 11-15.
Heyne, K. 1987. Tumbuhan Berguna
Indonesia III, Badan Penelitian dan Pengembangan Kehutanan. Jakarta:
Yayasan Sarana Wahajaya.
Inas, O. K., Abdel, K. M., and Cheng, L. G. E. 2014. Isolation Characterization and some Biological Activities of a Xanthone from Garcinia Mangostana. Journal of Forest Products & Industries, 3(5): 216-220.
Larson, R. T., Lorch, J. M., Pridgeon, J. W., Becnel, J. J., Clark, G. G., and Lan, Q. 2010. The Biological Activity of α-Mangostin, a Larvicidal Botanic Mosquito Sterol Carrier Protein-2 Inhibitor. J Med Entomol, 47(2): 249257.
Lukis, P. A., dan Ersam, T. 2011. Dua Senyawa Mangostin dari Ekstrak n-Heksana pada Kayu Akar Manggis (Garcinia mangostana, Linn.) Asal
Kab.Nganjuk, Jawa Timur. Prosiding Kimia FMIPA ITS:1-10.
Moongkarndi, P., Jaisupa, N., Kosem, N., Konlata, J., Samer, J., Pattanapanyasat, K., and Rodpai, E. 2015. Effect of Purified α-mangostin from Mangosteen Pericarp on Cytotoxicity, Cell Cycle Arrest and Apoptotic Gene Expression in Human Cancer Cells. World Journal of Pharmaceutical Sciences. 3(8): 14731484.
Muthiah, F. 2017. Tiga Santon Terprenilasi dari Akar Garcinia tetrandra
Pierre.Skripsi. Departemen Kimia.
Fakultas Matematika dan Ilmu Pengetahuan Alam. Institut Teknologi Sepeluh Nopember.
Pratiwi, L., Fudholi, A., Martien, R., dan Pramono, S. 2016. Ekstrak Etanol, Ekstrak Etil Asetat, Fraksi Etil Asetat, dan Fraksi n-heksan Kulit Manggis (Garcinia mangostana L.) Sebagai Sumber Zat Bioaktif Penangkal Radikal Bebas. Journal of Pharmaceutical Science and Clinical Research. 01: 7182.
Putra, S. R. 2011. Manggis Pembasmi Kanker. Yogyakarta: DIVA Press.
Ragasa, C. Y., Tabin, T. J., Reyes, J. M. A., Tan, M. C. S., and Shen, C. C. 2016. Xanthones from Garcinia mangostana Linn. Pulp. Der Pharmacia Lettre, 8(20): 188-190.
Ramesh, S. K., Priya, M., and Prabhu, S. 2017. Isolation of Garcinone E from Garcinia mangostana Linn and Its Cytotoxic Effect on sp2/0 cell lines. Journal of Phamacognosy and Phytochemistry. 6(5): 67-76.
Riscoe, M., Kelly, J. X., and Winter, R. 2005. Xanthones as Antimalarial Agents
Discovery Mode of Action and
Optimization. Curr. Med. Chem. 12(1): 2539-2549.
Ryu, H. W., Cho, J. K., Long, M. J. C., Yuk, H. J., Kim, Y. S., Jung, S., Kim, Y. S.,
Lee, B. W., and Park, K. H. 2011. α-Glucosidase Inhibition and
Antihyperglycemic Activity of
Prenylated Xanthones from Garcinia mangostana. Phytochemistry. 72: 21482154.
Shabella, R. 2011. Terapi Kulit Manggis. Klaten: Galmas Publishers.
Suksamrarn, S., Komutiban, O., Ratananukul, P., Chimnoi, N., Lartpornmatulee, N., and Suksamrarn, A. 2006. Cytotoxic Prenylated Xanthones from the Young Fruit of Garcinia mangostana. Chem. Pharm. Bull. 54(3): 301-305.
Suzy, S. A., Mieke, H., Warta, D., and Unang, S. 2018. Antibacterial Activity of Prenylated Xanthones from Pericarp of Garcinia mangostana against Persistent Dental Infection Microorganism Enterococcus faecalis. Research Journal of Chemistry and Environment. 22(2): 184-188.
Yu, L., Zhao, M., Yang, B., Zhao, Q., and Jiang, Y. (2007). Phenolics from Hull of Garcinia mangostana Fruit and Their Antioxidant Activities. Food Chemistry. 104: 176–181.
Yang, R., Li, P., Li, N., Zhang, Q., Bai, X., Wang, L., Xiao, Y., Yang, Q., and Yan, J. 2017. Xanthones from the Pericarp of Garcinia mangostana. Molecules.
22(683): 1-10.
93
Discussion and feedback