IDENTIFIKASI SENYAWA TOKSIK EKSTRAK KLOROFORM KULIT BIJI NYAMPLUNG (Calophyllum inophyllum L.)
on
JURNAL KIMIA 6 (2), JULI 2012 : 178-182
IDENTIFIKASI SENYAWA TOKSIK EKSTRAK KLOROFORM KULIT BIJI NYAMPLUNG (Calophyllum inophyllum L.)
Sri Rahayu Santi, I Wayan Suirta, dan Kadek Agus Andika Pratama
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran
ABSTRAK
Identifikasi senyawa toksik dari ekstrak kloroform kulit biji nyamplung (Chalohyllum inophyllum L.) telah dilakukan. Ekstraksi sekitar 1 kg kulit biji nyamplung secara maserasi menghasilkan ekstrak pekat n-heksana (2,85 g) berwarna kuning, ekstrak pekat kloroform (7,42 g) berwarna kuning, dan ekstrak pekat air (4,71 g) berwarna merah. Pemisahan 2 g ekstrak kloroform secara kromatografi kolom dengan fase diam silika gel 60 dan fase gerak kloroform-metanol (9,5:0,5 v/v) menghasilkan 4 fraksi, dimana fraksi berwarna kuning dengan noda tunggal sebanyak 0,473 g bersifat paling toksik terhadap larva udang (LC50 =8,241 ppm). Identifikasi isolat paling toksik dengan kromatografi gas-spektroskopi massa melalui pendekatan data base (WILEY229.LIB) diduga mengandung senyawa asam heksadekanoat (21,02%); asam 8-oktadekenoat (59,55%), dan asam oktadekanoat (19,43%).
Kata kunci : Calophyllum inophyllum L., Nyamplung, toksisitas
ABSTRACT
Identification of active toxic compounds from chloroform extract Nyamplung skin bean (Calophyllum inophyllum L) have been conducted. As much as 2,85 g n-hexane extract, 7,42 chloroform extract, and 4,71 water extract were resulted from 1 kg Nyamplung skin bean. Separation of 2 g chloroform extract using column chromatography (stationary phase: silica gel 60 and mobile phase chloroform-methanol 9,5:0,5) resulted in four fraction with yellowish fraction (0,473 g) as the most toxic fraction (LC50 8,241 ppm). Identification using GC-MS showed that the isolate was hexadecanoic acid (21,02%), 8-octadecenoic acid (59,55%), and oktadecanoic acid(19,43%).
Keywords : Calophyllum inophyllum L., Nyamplung, toxicity
PENDAHULUAN
Tanaman selain digunakan sebagai bahan pangan juga dimanfaatkan sebagai obat. Tanaman obat adalah tanaman yang bagian-bagiannya digunakan sebagai obat atau ramuan obat. Penggunaan tanaman sebagai obat telah dilakukan secara turun- temurun, dan hanya berdasarkan pengalaman saja sehingga masih banyak yang belum diketahui senyawa aktif yang terkandung didalamnya serta manfaat lainnya. Analisis pendahuluan, identifikasi struktur dan uji aktivitas terhadap komponen kimia aktif yang
diduga terkandung didalam tanaman obat harus dilakukan mengingat di era modern seperti saat ini penggunaan obat-obatan tradisional masih banyak dilakukan (Chairul, 2003; Elly, 1989).
Nyamplung (Calophyllum inophyllum L.) merupakan salah satu tanaman yang bijinya banyak digunakan sebagai obat karena memiliki beberapa aktivitas diantaranya berpotensi sebagai antivirus HIV, antibakteri dan antitumor (Dalimartha, 2000; Dalimartha, 2003; Heyne, 1987; Marie et al., 2004). Aktivitas senyawa-senyawa yang terdapat dalam suatu tanaman dapat dianalisis dengan metode-metode skrinning
tertentu. Salah satu metode skrinning awal aktivitas antitumor biasanya dilakukan dengan munguji toksisitasnya menggunakan metode Brine Shrimp Lethality Test (BSLT) yang merupakan salah satu metode yang banyak digunakan untuk pencarian senyawa antitumor baru yang berasal dari tanaman. Hasil uji toksisitas dengan metode ini telah terbukti memiliki korelasi dengan daya sitotoksik senyawa antitumor (Spino et al., 1998).
Berdasarkan pemanfaatannya secara tradisional yang salah satunya untuk mengobati pembengkakan dan tumor (Heyne, 1987; Friday and Okano, 2006) serta hasil uji toksisitas pendahuluan yang menunjukkan bahwa ekstrak kloroform kulit biji nyamplung bersifat toksik dengan LC50 = 142,81 ppm. maka dalam
penelitian ini akan dilakukan isolasi dan
identifikasi senyawa aktif toksik terhadap
Artemia salina L. dengan menggunakan
Kromatografi Gas Spektrometri Massa (GC-MS).
MATERI DAN METODE
Bahan
Bahan kimia yang digunakan dalam penelitian ini adalah kulit biji nyamplung yang diambil dari daerah pantai Pekutatan, Jembrana, metanol, n-heksana, klorofom, silika gel GF254, silika gel 60, Tween 80, pereaksi Meyer, Wagner, Dragendroff, Willstater, NaOH 10%, dan pereaksi Liebermann-Burchard.
Peralatan
Alat-alat yang digunakan dalam penelitian ini yaitu: seperangkat alat gelas, blender, pisau, rotary evaporator, timbangan elektronik, desikator, botol vial, bak kaca (akuarium), pipet tetes, pipet volum, seperangkat alat kromatografi lapis tipis (KLT) dan seperangkat alat kromatografi kolom. Identifikasi isolat aktif dilakukan dengan kromatografi gas-spektroskopi massa (GC-MS QP20105 SHIMADZU).
Cara Kerja
Bahan tumbuhan yang digunakan dalam penelitian ini diambil di daerah pantai Pekutatan,
Kabupaten Jembrana, Bali. Serbuk halus kulit biji nyamplung sebanyak ±1 kg diekstrak dengan cara maserasi menggunakan metanol sampai sampel terendam selama 24 jam. Ekstrak yang diperoleh kemudian disaring dan ampasnya dimaserasi lagi dengan metanol. Proses ekstraksi diulang sampai semua metabolit yang terkandung didalamnya terekstraksi. Ekstrak metanol kemudian dipekatkan dengan rotary vacuum evaporator sehingga diperoleh ekstrak pekat metanol. Ekstrak pekat metanol selanjutnya dilarutkan dengan metanol-air (7:3), kemudian dipartisi berturut-turut dengan n-heksana dan kloroform. Ketiga ekstrak kemudian diuapkan dengan rotary vacuum evaporator sehingga diperoleh ekstrak pekat.
Ekstrak kloroform dipisahkan dan dimurnikan dengan metode kromatografi kolom (silika gel) menggunakan eluen kloroform-metanol (9,5:0,5). Fraksi hasil pemisahan dengan kromatografi kolom kemudian diuji toksisitasnya dengan menggunakan larva udang Artemia salina Leach. Fraksi yang paling aktif selanjutnya diidentifikasi kandungan metabolit sekundernya dengan pereaksi fitokimia dan kromatografi gas-spektroskopi massa.
HASIL DAN PEMBAHASAN
Isolasi Senyawa Toksik dari Kulit Biji Nyamplung
Hasil maserasi dari ± 1000 g serbuk kering kulit biji nyamplung menggunakan 7,6 L pelarut metanol menghasilkan sekitar 16,65 g ekstrak pekat metanol yang berwarna merah. Ekstrak metanol yang diperoleh dilarutkan dalam metanol-air kemudian dipartisi dengan n-heksana dan kloroform sehingga diperoleh ekstrak pekat n-heksana (2,85 g) berwarna kuning, ekstrak pekat kloroform (7,42 g) berwarna kuning dan ekstrak pekat air (4,71 g) berwarna merah.
Hasil pemisahan 2 g ekstrak kloroform dengan kromatografi kolom menghasilkan 116 eluat, dan eluat yang memiliki pola pemisahan yang sama digabungkan, sehingga diperoleh empat kelompok fraksi (F –F4) yang selanjutnya diuji toksisitasnya terhadap larva Artemia salina Leach. Jumlah larva yang mati pada tiap konsentrasi untuk fraksi F 1 sampai F4
dipaparkan pada Tabel 1 . Menurut Meyer (1982), suatu bahan dikatakan bersifat toksik apabila mempunyai nilai LC50 < 1000 ppm. Jadi berdasarkan data pada Tabel 1 semua fraksi bersifat toksik karena mempunyai nilai LC dibawah 1000 ppm, dan fraksi 3 (F3) dengan
noda tunggal sebanyak 0,473 g memiliki toksisitas paling tinggi terhadap larva Artemia salina Leach dengan nilai LC 8,241 ppm sehingga fraksi F3 dilanjutkan pada proses identifikasi dengan kromatografi gas-spektroskopi massa (GC-MS).
Tabel 1. Hasil uji toksisitas fraksi hasil kromatografi kolom terhadap larva Artemia salina Leach.
|
Fraksi |
Konsentrasi (ppm) |
Jumlah Larva yang Mati |
Mortalitas (%) |
LC50 (ppm) | ||
|
1 |
2 |
3 | ||||
|
F1 (1-19) |
0 |
0 |
0 |
0 |
0 |
25,11 |
|
10 |
5 |
5 |
3 |
33,33 | ||
|
100 |
8 |
6 |
7 |
79,06 | ||
|
1000 |
10 |
10 |
10 |
100 | ||
|
F2 (20-32) |
0 |
0 |
0 |
0 |
0 |
17,78 |
|
10 |
5 |
4 |
4 |
4,33 | ||
|
100 |
9 |
9 |
10 |
9,33 | ||
|
1000 |
10 |
9 |
10 |
9,66 | ||
|
F3 (33-116) |
0 |
0 |
0 |
0 |
0 |
8,241 |
|
10 |
5 |
6 |
5 |
53,35 | ||
|
100 |
10 |
10 |
10 |
100 | ||
|
1000 |
10 |
10 |
10 |
100 | ||
|
F4 (sisa) |
0 |
0 |
0 |
0 |
0 |
65,46 |
|
10 |
3 |
4 |
3 |
20,84 | ||
|
100 |
5 |
5 |
3 |
56,12 | ||
|
1000 |
9 |
10 |
10 |
98,13 | ||
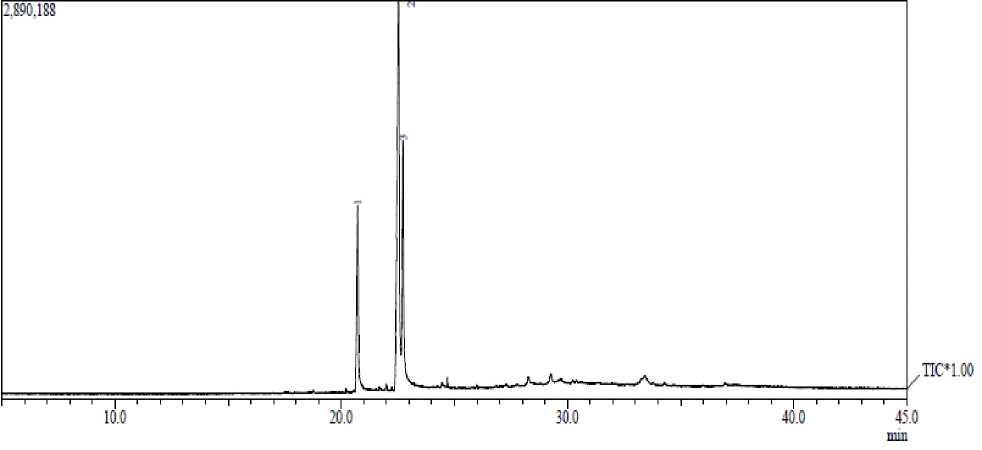
Gambar 1. Kromatografi gas isolat aktif
Identifikasi Isolat (Fraksi F3)
Hasil kromatografi gas dari isolat aktif menghasilkan 3 puncak dengan waktu retensi (tR) dan kelimpahan (%) berturut-turut sebagai berikut: puncak 1, tR 20,731 menit (21,02%); puncak 2, tR 22, 543 menit (59,55%); dan puncak 3, tR 22,726 menit (19,43%) seperti ditunjukkan pada Gambar 1.
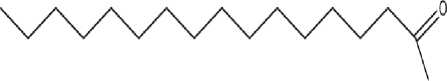
Spektrum massa senyawa pada puncak 1 memiliki ion molekuler pada m/z 256 (M+) dengan puncak-puncak penggalan pada m/z 213, m/z 199, m/z 185, m/z 171, m/z 157, m/z 143, m/z 129, m/z 115, m/z 73, dan m/z 60. Berdasarkan pendekatan data base (WILEY229.LIB) maka kemungkinan puncak 1 adalah senyawa asam palmitat dengan rumus molekul C16H32O2, berat molekulnya 256. dan rumus struktur seperti tampak pada Gambar 2.
OH
Gambar 2. Struktur asam palmitat
Spektrum massa senyawa pada puncak 2 memiliki puncak-puncak penggalan pada m/z 264, m/z 235, m/z 151, m/z 137, m/z 123, m/z 83, m/z 69, m/z 55. Tidak munculnya puncak ion molekuler kemungkinan disebabkan ion molekuler tersebut tidak stabil, karena adanya pelepasan molekul air pada m/z 264 Berdasarkan pendekatan data base (WILEY229.LIB) tampak pola-pola penggalan yang mirip dengan senyawa asam 8-oktadekenoat dengan rumus molekul C18H34O2. dan rumus struktur seperti tampak pada Gambar
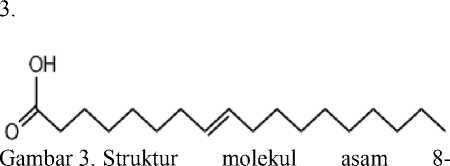
oktadekenoat
Spektrum massa senyawa pada puncak 3 memiliki ion molekuler pada m/z 284 (M+) dengan puncak-puncak penggalan pada m/z 241, m/z 227, m/z 213, m/z 199, m/z 185, m/z 171,
m/z 157, m/z 143, m/z 129, m/z 115, m/z 73, m/z 60. Berdasarkan pendekatan data base (WILEY229.LIB) maka kemungkinan puncak 3 adalah senyawa asam oktadekanoat atau asam stearat dengan rumus molekul C18H36O2, berat molekulnya 284 serta rumus struktur seperti tampak pada Gambar 4.
HO
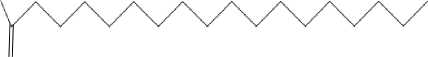
O
Gambar 4. Struktur molekul asam stearat
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan bahwa senyawa toksik (LC = 8,241 ppm) dari isolat diduga mengandung asam heksadekanoat atau asam palmitat (21,02%); asam 8-oktadekenoat (59,55%); asam oktadekanoat atau asam stearat (19,43%).
Saran
Perlu dilakukan penelitian lebih lanjut untuk mengidentifikasi isolat toksik terhadap larva udang Artemia salina L dengan menggunakan instrument lain seerti LC-MS atau LC-NMR sehingga dapat ditetapkan suatu struktur usulan dari isolat tersebut.
UCAPAN TERIMA KASIH
Melalui kesempatan ini, penulis mengucapkan terima kasih kepada Drs I Made Sukadana, M.Si., Staf Dosen, peneliti Jurusan Kimia FMIPA Universitas Udayana, dan DP2M DIKTI atas dukungan finansial melalui penelitian Fundamental tahun 2011.
DAFTAR PUSTAKA
Chairul, 2003, Identifikasi Secara Cepat Bahan Bioaktif pada Tanaman di Lapangan, Berita Biologi, Laboratorium Fitokimia,
Bidang Botani-Puslit Biologi LIPI, Bogor, 6 (4)
Dalimartha, S., 2000., Atlas Tanaman Obat
Indonesia., Jilid 1., Trubus Agriwidya, Jakarta
Dalimartha, S., 2003., Ramuan Tradisional untuk Pengobatan Kanker., Penerbit Swadaya, Jakarta
Elly Suradikusumah., 1989, Kimia Tanaman, Departemen Pendidikan dan
Kebudayaan Direktorat Jendral Pajak Pendidikan Tinggi Pusat Antar Universitas Ilmu Hayat, IPB, Bogor
Friday, J. B. and Okano, D., 2006,
Callophyllum inophyllum (kamani) Species Profiles for Pasific Island Agro
Forestry. http://www.traditionaltree.org, akses tanggal 23 September 2011
Heyne, K., 1987, Tanaman Berguna Indonesia II, a.b. Anonimous, Yayasan Sarana Warna Jaya, Jakarta
Marie C. Yimdjo, Anatole G. Azebaze, Augustin E. Nkengfack, A. Michele Meyer, Bernard Bodo, and Zacharias T. Fomum, 2004, Antimicrobial and Cytotoxic Agents from Calophyllum inophyllum, Phytochemistry, 65 : 2789-2795
Spino Claude, Marco Dodier, and Subramaniam Sotheeswaran, 1998, Anti-HIV
coumarins from calophyllum seed oil, Bioorganic & Medicinal Chemistry
Letters, 8 : 3475-3478
182
Discussion and feedback