MOLECULAR MODELING STUDY OF BORIC ACID IMPRINTED POLYMER FOR QUARTZ CRYSTAL MICROBALANCE APPLICATION
on
ISSN 1907-9850
PEMODELAN MOLEKUL POLIMER TERCETAK MOLEKUL ASAM BORAT UNTUK APLIKASI QUARTZ CRYSTAL MICROBALANCE
MOLECULAR MODELING STUDY OF BORIC ACID IMPRINTED POLYMER FOR QUARTZ CRYSTAL MICROBALANCE APPLICATION
Iqmal Tahir1,*), Mohd Noor Ahmad2), A.K.M. Shafiqul Islam2), dan Dahyar Arbain2)
1)Jurusan Kimia, Universitas Gadjah Mada, Sekip Utara, Yogyakarta, Indonesia 55293 2)University Malaysia Perlis, No 17 Taman Pengkalan Asam, Kangar Perlis, 01000 Malaysia *E-mail: iqmal@ugm.ac.id
ABSTRAK
Desain polimer tercetak molekul asam borat telah dikaji dengan menggunakan pendekatan pemodelan molekul dalam rangka pembuatan lapis tipis bahan sensor pada aplikasi quartz crystal microbalance. Kajian ini dilakukan dengan tujuan mencari rasio mol antara asam borat sebagai template yang dicetak secara molekular dan asam metakrilat sebagai monomer fungsional. Pemodelan molekul dilakukan dengan pendekatan perhitungan mekanika kuantum semi empirik AM1 pada perangkat lunak Hyperchem 8.0. Hasil penelitian menunjukkan kestabilan struktur pre kompleks asam borat – asam metakrilat pada rasio mol 1:3 dan 1:6. Sintesis molekul tercetak asam borat direkomendasikan pada rasio mol 1:3 tersebut.
Kata kunci : asam borat, quartz crystal microbalance, pemodelan molekul, polimer tercetak molekul
ABSTRACT
Design of boric acid imprinted polymer has been conducted using molecular modeling approach to fabricate thin film for sensor applications on quartz crystal microbalance. The study was carried out to find an optimum mole ratio between boric acid as the template and methacrylic acid as functional monomer. Molecular modeling was performed using AM1 semiempirical – quantum mechanics on Hyperchem 8.0 software. The result showed was stabilite of supramolecular structure between boric acid and methacrylic acid on ratios of 1:3 and 1:6. Recommendation of boric acid imprinted polymer is suggested to synthesize on mole ratio of 1:3.
Keywords : boric acid, quartz crystal microbalance, molecular modeling, molecular imprinted polymer
PENDAHULUAN
Senyawa-senyawa boraks seperti garam boraks (Na2B4O7.10H2O) dan asam borat (H3BO3) banyak digunakan untuk keperluan sehari-hari, seperti untuk deterjen, mengurangi kesadahan, dan antiseptik lemah. Namun saat ini juga banyak terjadi penyalahgunaan penggunaan
boraks sebagai aditif pangan dengan tujuan memperbaiki warna, tekstur dan flavor dari produk makan antara lain pada bakso, mie atau bahan makan lainnya. Menurut Peraturan Menteri Kesehatan no 7222/Menkes/Per/IX/88 tentang bahan tambahan makanan, boraks termasuk bahan yang berbahaya dan beracun (B3) sehingga tidak boleh digunakan sebagai
bahan tambahan dalam makanan. Dengan tujuan pemantauan kandungan asam borat dalam makanan atau sampel lain maka analisis rutin terhadap asam borat perlu rutin dilakukan. Mizura et al (1991) melaporkan beberapa teknik analisis asam borat yang sudah umum dilakukan yakni penggunaan prosedur kolorimetrik untuk analisis kualitatif dengan asam karminat atau kurkumin dan teknik titrasi volumetrik menggunakan mannitol untuk analisis kuantitatif. Penggunaan asam karminat dan kurkumin juga dapat dikembangkan secara kuantitatif dengan bantuan teknik spektroskopik.
Penggunaan teknik analisis tersebut memerlukan waktu preparasi dan reagen tertentu untuk keperluan analisis. Pada sisi lain analisis dilakukan hanya untuk satu analit yakni kandungan asam borat saja. Analisis di laboratorium pengujian pangan sering memerlukan analisis pada beberapa parameter kandungan aditif seperti asam borat, asam benzoat, formaldehid dan aditif bahan pangan lainnya. Untuk itu diperlukan satu analisis baru yang dapat bersifat secara simultan dan cepat. Hal ini dapat dilakukan dengan penggunaan sensor array berbasis Quartz Crystal Microbalance (QCM) yang dapat melakukan proses sensing atau pengukuran bahan-bahan tersebut secara serentak, selektif dan akurat (Xu et al, 2009).
Sensor QCM adalah satu teknologi yang cukup menjanjikan untuk keperluan identifikasi
analit karena relatif berharga murah, memiliki sensitivitas tinggi, dan berukuran kompak sehingga dapat bersifat portabel (Shafiqul et al, 2005). Selektivitas QCM dapat diatur dengan pelapisan permukaan elektroda emas dengan bahan tertentu (Gambar 1), misal dengan bahan pengisi kolom khromatografi (Shafiqul et al, 2005) atau saat ini dengan penggunaan bahan baru yang selektif dengan satu target analit yakni polimer tercetak molekul atau molecular imprinted polymer, MIP (Liu et al, 2006). Kombinasi QCM-MIP ini dapat menghasilkan sensor QCM yang didesain untuk setiap target aditif bahan pangan dan kemudian dirangkai dalam satu array.
MIP merupakan teknologi baru yang meniru kemampuan enzim untuk menangkap substrat secara selektif yakni dengan pembuatan situs pengenalan molekul secara selektif dengan pencetakkan molekul tersebut pada bahan polimer (Sellergren, 2001). Prosedur sintesis MIP dilakukan dengan pencampuran molekul target yang kemudian pada akhir proses dilepaskan kembali, sehingga meninggalkan bekas ruang berupa kaviti yang berbentuk molekul tadi. Polimer dibentuk dengan penambahkan ligan tersebut sehingga menghasilkan kaviti yang menyerupai molekul asal dari sisi ukuran, bentuk dan keberadaan situs fungsional (Kirsch et al, 2000).
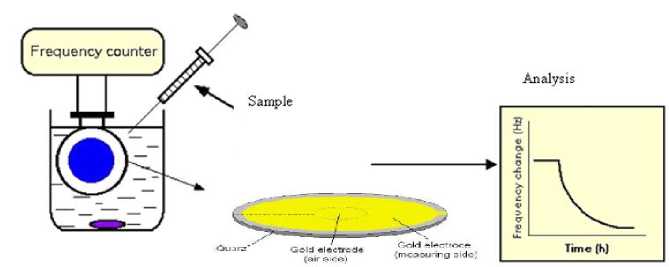
Gambar 1. Skema ilustrasi QCM dengan pelapisan MIP pada elektroda
MIP yang akan dilapiskan pada permukaan elektroda QCM dapat dibuat dengan cara sintesis MIP biasa. Sintesis tersebut dilakukan berdasarkan prinsip polimerisasi dengan melibatkan molekul target (templat), monomer fungsional, crosslinker, inisiator dan pelarut. Untuk keperluan optimasi komposisi tertentu dan kondisi proses sintesis MIP dapat dilakukan dengan langkah trial and error, desain eksperimen atau desain berbantuan komputer (computer aided design, CAD). Piletsky et al (2001) dan Davies et al (2004) telah melaporkan hasil desain MIP dengan pendekatan lebih rasional untuk memilih jenis monomer fungsional yang dapat mengikat molekul templat secara lebih baik. Desain berbantuan komputer untuk MIP relatif dapat membantu misal untuk penentuan rasio mol antara templat dan monomer fungsional yang digunakan. Kajian ini berdasarkan interaksi antara monomer dan templat untuk membentuk struktur komplek yang stabil dan hal ini dapat ditentukan dengan mengunakan parameter energi ikat untuk membentuk komplek tersebut (Yao et al, 2008). Pada aplikasi untuk bahan polimer tercetak molekul ini sendiri, kajian pemodelan molekul telah banyak dilaporkan di beberapa paper (Karim et al, 2005, Spivak 2005, Liu et al, 2007, Yao et al, 2008,) dan berhasil menghasilkan data teoritik yang bermanfaat untuk sintesis selanjutnya.
Dalam hal mengkaji interaksi monomer dan template ini dapat dilakukan penggunaan perhitungan mekanika kuantum ab initio atau semi empirik. Salah satu metoda semiempirik yang dapat digunakan untuk mempelajari interaksi antarmolekul adalah metoda AM1 (Austin Model 1). Paper ini menyajikan hasil pemodelan molekul interaksi antara asam borat dan asam metakrilat sebagai monomer fungsional dengan pendekatan metoda semiempirik AM1. Penelitian dilakukan dengan tujuan mengetahui kondisi rasio mol terbaik antara asam borat dan asam metakrilat sehingga dapat dipilih untuk keperluan sintesis MIP guna aplikasi pembuatan sensor asam borat berbasis QCM.
MATERI DAN METODE
Bahan
Pemodelan molekul yang dilakukan terhadap struktur molekul asam borat (Gambar 2(a)) sebagai templat dan asam metakrilat (Gambar 2(b)) sebagai monomer fungsional.
OH
HO B
OH
-
(a)
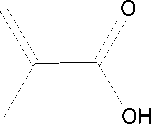
Gambar 2. Struktur molekul (a) asam borat dan
-
(b) asam metakrilat
Peralatan
Perhitungan dijalankan pada perangkat komputer dengan spesifikasi prosessor Intel® Core™2 quad CPU-Q9550 @2.83GHz, memori 4.00GB dan sistim operasi 32-bit. Perangkat lunak yang digunakan untuk menjalankan semua perhitungan adalah Hyperchem 8.0 (Hypercube).
Cara Kerja
Pemodelan molekul yang dilakukan pada penelitian ini dilakukan terhadap senyawa asam borat dan senyawa asam metakrilat. Pemodelan dilakukan pada keadaan fasa gas dan molekul terisolasi dari molekul lain. Selanjutnya dilakukan pemodelan beberapa struktur komplek yang terbentuk antara satu molekul asam borat dan variasi jumlah molekul asam borat.
Untuk mengetahui energi total hasil optimasi geometri dilakukan dengan mencari struktur dengan energi total terendah menggunakan metoda semiempirik AM1. Setiap model senyawa dibuat struktur 2D dengan paket perangkat lunak Hyperchem 8.0 selanjutnya dilengkapi dengan atom hidrogen pada setiap atom untuk melengkapi struktur sebenarnya dan kemudian dibentuk menjadi struktur 3D. Proses dilanjutkan dengan optimasi geometri struktur berupa minimisasi energi struktur untuk memperoleh konformasi truktur terstabil dengan menggunakan metoda semiempirik AM1. Batas konvergensi ditentukan berdasarkan batas gradien perubahan energi sebesar 0,005 kkal/(Å.mol) dengan menggunakan metoda Polak-Ribiere. Data hasil perhitungan yang meliputi data mengenai energi dan struktur elektronik senyawa direkam pada menu log.
Kajian interaksi antar molekul senyawa dilakukan dengan fokus pada interaksi intermolekular khususnya ikatan hidrogen yang terbentuk antara molekul asam borat-asam metakrilat. Konfigurasi komplek dari molekul-molekul tersebut dibentuk dengan cara penataan gugus-gugus fungsi yang berpotensi untuk membentuk ikatan hidrogen. Selanjutnya dilakukan optimasi geometri seperti halnya pada struktur tunggal. Model komplek yang dihitung diasumsikan berupa interaksi molekul monomer pada sisi paling aktif di struktur asam borat. Langkah ini diterapkan pada kombinasi komplek yang terbentuk dari satu molekul asam borat dan n molekul asam metakrilat dengan n= 1-6.
Analisis kestabilan komplek tersebut ditentukan berdasarkan nilai energi interaksi asam borat-asam metakrilat yang ditentukan dari persamaan berikut :
HASIL DAN PEMBAHASAN
Analisis Struktur Elektronik Asam Borat
Interaksi antarmolekul selalu melibatkan sisi-sisi aktif yang terdapat dalam molekul-molekul tersebut. Pada pembentukan MIP interaksi antarmolekul ini ditujukan untuk menaikkan tingkat selektivitas pada kaviti yang terbentuk sehingga dapat mengikat molekul target yakni asam borat dengan baik dan selektif. Interaksi yang dirancang berupa interaksi non kovalen yang umum melibatkan ikatan hidrogen atau interaksi dipol-dipol maka hal ini mudah untuk dipelajari dengan menggunakan pemodelan molekul yang berdasarkan metoda mekanika kuantum. Gambaran yang diperoleh berupa keadaan struktur elektronik senyawa dan pada awal pembahasan ini disajikan untuk menunjukkan sisi aktif dari molekul asam borat. Data ini berupa peta kontur potensial elekstrostatik dan kerapatan muatan elektronik.
ΔE = [Ekomplek – Easam borat – n.Easam metakrilat]
Perhitungan ini mengacu pada referensi dari Farrington et al (2006) dengan nilai n pada kasus ini adalah n = 1-6.
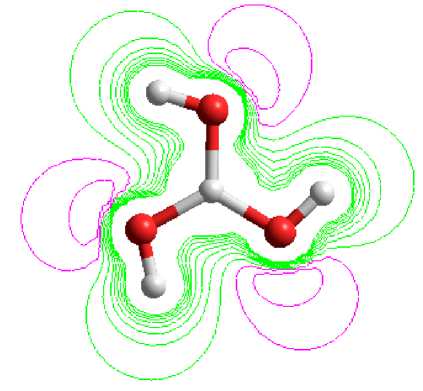
Gambar 3. Proyeksi kontur potensial
elektrostatik asam borat

Gambar 4. Proyeksi kerapatan muatan total asam borat
Penentuan sisi aktif dapat dikonfirmasi dengan melihat gambaran kontur potensial elektrostatik yang dapat membantu menuntun pada daerah interaksi non kovalen antar molekul. Peta kontur potensial elektrostatik untuk asam borat dapat dilihat pada Gambar 3. Bentuk molekul asam borat memiliki struktur sederhana dengan bentuk simetri bidang tiga. Pada gambar terlihat beberapa sisi aktif yang ditunjukkan dengan warna merah yakni pada pada atom-atom oksigen yang terikat atom boron. Daerah tersebut memungkinkan sebagai sisi yang berpotensi untuk interaksi dengan molekul lain.
Gambar 4 menunjukkan peta kerapatan muatan elektronik asam borat. Dari sini tampak kerapatan elektron yang tinggi yang ditunjukkan dengan garis-garis berwarna hijau. Pada atom oksigen kerapatan elektron akan semakin tinggi untuk menunjukkan muatan parsial yang lebih bersifat elektronegatif pada area tersebut. Hal ini membantu untuk melihat daerah yang memungkinkan pembentukan interaksi hidrogen. Secara tidak langsung kerapatan elektron ini mengindikasikan sisi aktif yang ada pada molekul asam borat.
Interaksi Asam Borat dan Asam Metakrilat
Analisis kestabilan struktur komplek yang terbentuk antara asam borat dan asam metakrilat selanjutnya dipelajari berdasarkan harga energi ikat (ΔE) seperti disajikan pada Tabel 1.
Data ini diperoleh dengan menggunakan persamaan (1) yang merupakan selisih antara energi total pembentukan kompleks dan masing-masing molekul. Semakin tinggi nilai negatif dari energi ikat ini memiliki korelasi dengan kestabilan komplek atau menunjukkan bahwa komplek tersebut lebih eksis untuk terbentuk. Dengan kata lain struktur komplek yang memiliki nilai ΔE tinggi maka berarti akan menghasilkan MIP yang relatif lebih selektif. Data ΔE ini ditunjukkan pada Gambar 5.
Tabel 1. Data energi interaksi antara asam borat dengan n molekul asam metakrilat.
|
Jumlah asam metakrilat |
Energi (kkal/mol) |
ΔE (kkal/mol) |
Δ(ΔE) | ||
|
Asam borat |
Asam metakrilat |
Komplek | |||
|
1 |
-1198,20 |
-1925,63 |
-5,07 |
-5,07 | |
|
2 |
-2396,39 |
-3129,06 |
-10,30 |
-5,24 | |
|
3 |
-722,36 |
-3594,58 |
-4332,71 |
-15,75 |
-5,45 |
|
4 |
-4792,77 |
-5532,16 |
-17,00 |
-1,25 | |
|
5 |
-5990,95 |
-6733,88 |
-20,53 |
-3,53 | |
|
6 |
-7189,13 |
-7941,68 |
-30,14 |
-9,60 | |
Catatan : n = 1-6
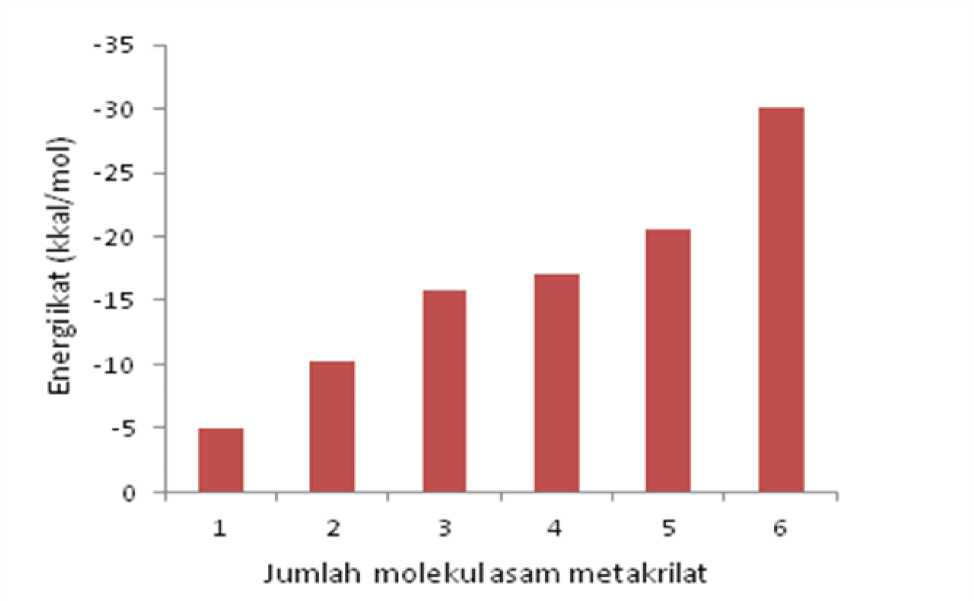
Gambar 5. Histogram energi interaksi satu molekul asam borat dan n molekul asam metakrilat
Pada Gambar 5 terlihat kenaikan nilai energi ikat dari seluruh komplek yang terbentuk dari pengaruh kenaikan jumlah monomer asam metakrilat yang berinteraksi dengan asam borat. Variasi jumlah monomer asam metakrilat ini memang dibatasi sampai 6 saja karena dari pemodelan diketahui konformasi menjadi sangat tidak stabil. Pembatasan ini juga dipertimbangkan dari aspek sintesis dengan pertimbangan efek interaksi asam metakrilat pada molekul crosslinker dan pelarut yang digunakan.
Pada Gambar 5 terlihat kenaikan energi ikat yang relatif sama ditunjukkan dari nilai Δ(ΔE) dari Tabel 1 yang berkisar pada besaran -5~-5,5 kkal/mol. Interaksi antarmolekul yang diharapkan dari komplek untuk aplikasi sintesis MIP ini berupa ikatan hidrogen. Apabila kita lihat dari besaran energi untuk eksistensi ikatan hidrogen ini yang berkisar pada kisaran 4~8 kkal/mol maka nilai tersebut sudah menunjukkan kesesuaian. Dengan demikian dapat dipahami
kalau asam borat dan asam metakrilat telah berinteraksi secara non kovalen menggunakan jenis ikatan hidrogen.
Pada Gambar 6 disajikan ilustrasi model komplek yang terbentuk antara asam borat dengan asam metakrilat. Pada gambar tersebut terlihat interaksi juga terlihat jelas melibatkan ikatan hidrogen yang diindikasikan dengan keberadaan garis putus-putus pada gambar. Ikatan hidrogen tersebut terbentuk dari atom hidrogen dari monomer dengan atom oksigen pada asam borat. Perbedaan elektronegavitas yang tinggi dari kedua atom tersebut serta tidak ada halangan sterik yang ada mengakibatkan pembentukan ikatan hidrogen pada daerah tersebut. Pada saat sintesis nantinya, rantai vinil dari monomer akan mengalami reaksi adisi dengan efek penambahan inisiator dan kemudian terjadi reaksi polimerisasi dengan tersambung oleh molekul-molekul crosslinker yang ditambahkan.
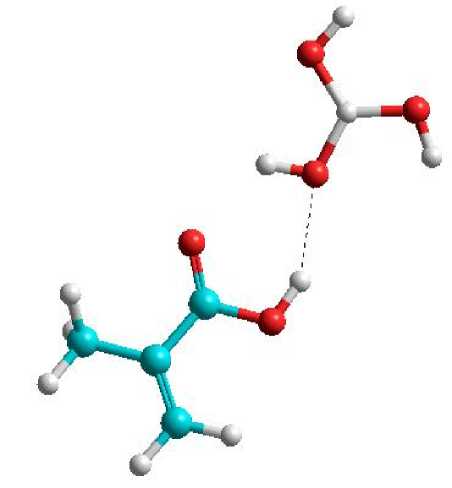
Gambar 6. Ikatan hidrogen yang terbentuk
antara molekul asam borat dan asam metakrilat
Harga Δ(ΔE) yang relatif kecil dengan penambahan monomer asam metakrilat berikutnya pada rasio 1:4 dan 1:5 menunjukkan bahwa kestabilan struktur komplek ini menjadi
relatif rendah. Energi ikat yang diperlukan untuk menahan interaksi masing-masing asam metakrilat menjadi kecil. Dengan demikian rasio ini tidak perlu untuk dipertimbangkan.
Selanjutnya fakta yang menarik adalah untuk struktur dengan rasio 1:6 yang menunjukkan nilai energi ikat yang tinggi yakni -30,14 kkal/mol. Hal ini berarti terdapat kestabilan struktur dari komplek yang terbentuk seperti halnya pada rasio 1:3. Fakta ini dipahami karena masih terkait dengan bentuk simetri dari struktur asam borat yang memiliki bidang tiga. Dengan demikian interaksi yang dimungkinkan juga melibatkan kesesuian dengan bidang simetri tersebut. Pada Gambar 7 disajikan ilustrasi model komplek yang terbentuk antara asam borat dengan asam metakrilat untuk rasio 1:3 dan 1:6.
Pada gambar terlihat kalau pada rasio 1:6 tidak terlihat lagi ikatan hidrogen yang terbentuk antara asam borat dan asam metakrilat. Hal ini sebenarnya juga sudah tampak pada komplek dengan rasio 1:4 dan 1:5. Ikatan hidrogen menjadi tidak eksis lagi karena adanya pengaruh sterik serta efek tarikan dari molekul-molekul asam metakrilat sendiri.
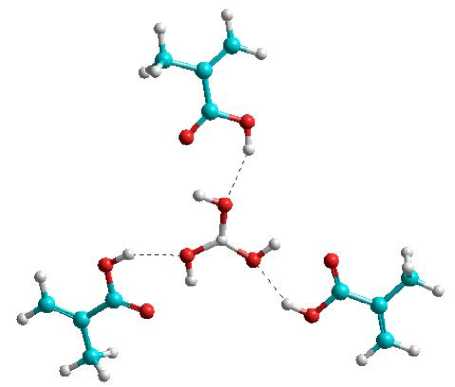
(a)
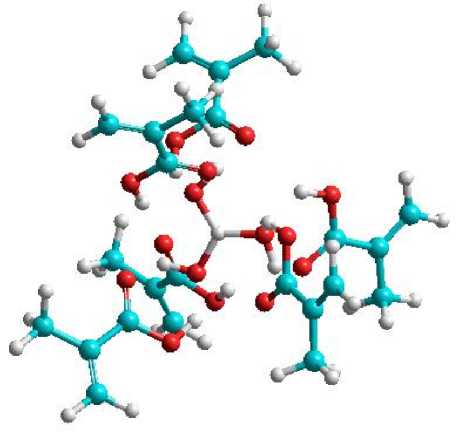
(b)
Gambar 7. Model interaksi antara asam borat dan monomer
asam metakrilat (a) tiga monomer dan (b) enam
Komplek dengan nilai ΔE yang rendah maka akan memberikan konsekuensi selektivitas pada asam borat yang rendah. MIP yang akan dihasilkan hanya menghasilkan kaviti dengan bentuk menyerupai asam borat namun tidak ada situs aktif yang mengikat secara khusus. Dengan demikian apabila MIP digunakan tentunya tidak dapat mengenali molekul asam borat dengan molekul-molekul yang menyerupai asam borat. Dengan demikian rasio 1:1 dan 1:2 tidak direkomendasikan untuk sintesis MIP asam borat karena alasan selektivitas yang rendah.
Pada komplek dengan nilai ΔE tinggi maka asam borat akan dapat bereaksi cukup kuat dengan molekul monomer. Hal ini tentunya meningkatkan selektivitas, namun pada prakteknya akan menyulitkan pada proses pelepasan kembali molekul asam borat dari MIP. Dengan demikian hal ini juga harus dihindari, sehingga rasio 1:6 juga tidak dipilih. Pada aplikasi sebagai sensor kemudahan molekul target untuk menempel pada permukaan elektroda QCM menjadi pertimbangan utama dan demikian juga setelah respon frekuensi QCM terbaca maka molekul hendaknya juga dapat meninggalkan permukaan kembali. Pada akhirnya sensor QCM dapat digunakan berulang dengan tingkat reproduksibilitas yang tinggi.
SIMPULAN
Berdasarkan Rancangan berbantuan komputer untuk bahan polimer tercetak asam borat telah berhasil dilakukan dengan memberikan rekomendasi nisbah mol antara asam borat dan asam metakrilat sebesar 1 : 3. Nisbah antara molekul tercetak dan monomer fungsional tersebut selanjutnya dapat digunakan sebagai komposisi molar untuk sintesis polimer tercetak asam borat. Polimer tercetak asam borat ini selanjutnya dapat digunakan untuk aplikasi sensor berbasis QCM.
DAFTAR PUSTAKA
Davies, M. P., Biasi, V. D., and Perrett, D., 2004, Approaches to the rational design
of molecularly imprinted polymers, Anal. Chim. Acta, 504 (1) : 7-14
Farrington, K., Magner, E., and Regan, F., 2006, Predicting the Performance of Molecularly Imprinted Polymers: Selective Extraction of Caffeine by Molecularly Imprinted Solid Phase Extraction, Anal. Chim. Acta, 566 : 6068
Karim, K., Breton, F., Rouillon, R., Piletska, E. V., Guerreiro, A., Chianella, I., and Piletsky, S. A., 2005, How to Find
Effective Functional Monomers for Effective Molecularly Imprinted Polymers?, Advanced Drug Delivery Reviews, 57 : 1795-1808
Kirsch, N., Alexander, C., Lubke, M., Whitcombe, M. J., and Vulfson E. N., 2000, Enhancement of selectivity of imprinted polymers via post-imprinting modification of recognition sites, Polymer, 41 : 5583-5590
Liu, F., Liu, X., Choon-Ng, S., and Chan, H. S., 2006, Enantioselective molecular
imprinting polymer coated QCM for the recognition of l-tryptophan, Sensors and Actuators B: Chemical, 113 (1) : 234240
Liu, Y., Wang, F., Tan, T., and Lei, M., 2007, Study of the properties of molecularly imprinted polymers by computational and conformational analysis, Anal. Chim Acta, 581 (1) : 137-146
Mizura, S., Tee, E. S., and Ooi, H. E., 1991, Determination of Boric Acid in Foods: Comparative Study of I'hree Methods, J Sci Food Agric, 55 : 261-268
Piletsky, S. A., Karim, K., Piletska, E. V., Day, C. J., Freebairn, K. W., Legge, C., and Turner, A. P .F., 2001, Recognition of ephedine enantiomers by molecularly imprinted polymers designed using a computational approach, Analyst, 126 : 1826-1830.
Sellergren, B., 2001, Molecularly Imprinted
Polymers: Man-made mimics of
antibodies and their applications in analytical chemistry, Elsevier,
Amsterdam.
Shafiqul, A. K. M., Ismail, Z., Ahmad, M. N., Saad, B., Othman, A. R., and Shakaff, A. Y., 2005, Transient parameters of a
coated quartz crystal microbalance sensor for the detection of volatile organic compounds (VOCs), Sensors and Actuators B – Chemical, 109 : 238243
Spivak, D. A., 2005, Optimization, Evaluation, and Characterization of Molecularly Imprinted Polymers, Advanced Drug Delivery Reviews, 57 : 1779-1794
Xu, X., Cang, H., Li, C., Zhao, Z., and Li, H., 2009, Quartz crystal microbalance sensor array for the detection of volatile organic compounds, Talanta, 78 : 711716
Yao, J., Li, V., and Qin, W., 2008,
Computational design and synthesis of molecular imprinted polymers with high selectivity for removal of aniline, Anal. Chim Acta, 610 (2) : 282-288
109
Discussion and feedback