STUDI ADSORPSI ION FOSFAT OLEH BATU KAPUR BUKIT JIMBARAN
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 14 (1), JANUARI 2020 DOI: https://doi.org/10.24843/JCHEM.2020.v14.i01.p17
p-ISSN 1907-9850
e-ISSN 2599-2740
STUDI ADSORPSI ION FOSFAT OLEH BATU KAPUR BUKIT JIMBARAN
P. Suarya*, A. A. B. Putra, N. L. P. Mahadewi
Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana, Bukit Jimbaran, Bali
*Email:suaryadala@yahoo.com
ABSTRAK
Keberadaan ion fosfat dalam lingkungan perairan dapat menimbulkan gangguan keseimbangan perairan yakni meningkatnya jumlah kesuburan tumbuhan air yang berakibat pada penutupan permukaan air. Sinar matahari akan terhalang dan pertukaran oksigen dalam air juga terganggu. Berbagai upaya untuk penghilangan ion phosfat telah dilakukan,adsorpsi merupakan salah satu metode alternatif yang menjanjikan untuk mengurangi ion-ion tersebut dari perairan karena efektivitas tinggi dan biaya yang diperlukan untuk penyiapan adsorbennya cukup murah. Penelitian ini bertujuan mempelajarai selektifitas adsorpsi batu kapur terhadap ion fosfat.. Hasil yangdiperoleh dapat melengkapi data penggunaan batu kapur yang pada akhirnya dapat dijadikan acuan dalam pengelolaan air limbah yang terkontaminasi oleh ion fosfat. Parmeter ujibatu kapur untuk menyerap ion fosfat, diuji dengan kajian variasi waktu adsorpsi dan variasi konsentrasi ion phosfat. Hasil uji karakterisasi batu kapur sebelum dan sesudah aktivasi menunjukkan adanya peningkatan karakter batu kapur ditinjau dari : keasaman permukaan terjadi peningkatan dari 0,50 menjadi 1,40 mmol/g dan dari luas permukaan spesifik dari 12,66 menjadi 25,61 m2/g. Banyaknya fosfat yang teradsorpsi terhadap adsorben batu kapur teraktivasi pada waktu kontak optimum 15 menit sebesar 3,125 mg/g, dan konsentrasi optimum fosfat 70 ppm sebesar 3,094 mg/g. Pola isotermnya adalah Langmuir dengan hasil perhitungan nilai R2 = 0,9981.
Kata Kunci: batu kapur, adsorpsi, ion fosfat,aktivasi, karakterisasi
ABSTRACT
The presence of phosphate ions in the aquatic environment can cause disturbance of water balance, such as the increase of fertility of quatic plants resulting in water surface closure. Sunlight will be obstructed and the exchange of oxygen in water is also disrupted. Various attempts to remove phosphate ions have been carried out, adsorption is one of the promising alternative methods to reduce these ions from the waters because of the high effectiveness and the cost required for the preparation of the adsorbent is quite cheap. The general objective of this research was to study the selectivity of limestone in adsorpting phosphate ions. The results obtained can complement the data on the use of limestone which in turn can be used as a reference in the management of wastewater contaminated by phosphate ions. The ability of limestone in adsorping phosphate ions was tested using the Batch method with an investigation on the variations of the adsorption time and the concentration of phosphate ions. Limestone characterization test results before and after activation showed an increase in limestone characteristics as follows: surface acidity increased from 0.50 to 1.40 mmol/g and the specific surface area increased from 12.66 to 25.61 m2 /g. The amount of phosphate adsorped to the activated limestone at the optimum contact time of 15 minutes was of 3.125 mg/g, and at the concentration of 70 ppm was of 3.094 mg/g following the Langmuir adsorption isotherm pattern with an R2 value of 0.9981.
Keywords: activation, adsorption, characterization, limestone, phosphate ion
PENDAHULUAN
Upaya untuk menurunkan konsentrasi fosfat dalam air limbah telah banyak dilakukan diantaranya dengan teknologi biofilm (Dennys et al., 2010), selain itu dengan teknologi membran kithosan dari kulit udang galah (Yunarsih et.al., 2013), selanjutnya fitoremediasi fosfat
dengan menggunakan tumbuhan enceng gondok (Stefhany et al., 2013). Pengurangan kadar fosfat dengan metode adsorpsi juga telah dilakukan yaitu dengan menggunakan lempung aktif (Auliah, 2009) dan tanah haloisit (Masduqi, 2004). Hasil penelitian beberapa tahun terakhir, terfokus pada proses adsorpsi karena dinilai lebih efektif,
preparasinya mudah dan biaya yang relatif murah dibanding metode lainnya.
Berdasarkan penelitian Budi (2006), kalsit yang terdapat pada batu kapur dapat mengadsorpsi dan menurunkan kadar fosfat dalam limbah cair rumah sakit hingga 97,92%, selain itu penelitian Millero et al., (2000) mengatakan, kalsit (CaCO3) dapat mengadsorpsi fosfat dalam air laut mencapai 80% dalam waktu kurang dari 30 menit karena adanya interaksi kuat antara Ca2+ dan PO43-. Winarso et al., (2009) dalam penelitiannya, mengatakan bahwa kelebihan pemberian kapur (Ca) menyebabkan banyaknya fosfat terlarut diikat oleh Ca menjadi endapan kalsium phosfat. Penelitian Triyoko (2003) juga mengatakan bahwa larutan kapur efektif dalam menurunkan fosfat dalam limbah cair pada unit proses pengolahan limbah cair dengan dosis efektif 30 mL/L.
Pada penelitian ini akan dilakukan studi adsorpsi ion fosfat oleh batu kapur (CaCO3) Bukit Jimbaran, dengan mempelajari mempelajari waktu adsorpsi dan kajian konsentrasi adsorbat.
MATERI DAN METODE
Bahan
Batu kapur yang diambil di daerah Bukit Jimbaran, Na2HPO4, H2SO4, ammonium molibdat, metilen biru, asam askorbat.
Peralatan
Timbangan analitik, ayakan 250 µm, oven, desikator, penggerus porselin, penangas air, hotplate, magnetik stirer, termometer, gelas ukur, gelas beaker, labu Erlenmeyer, labu ukur, pipet volume, pipet mohr, pipet tetes, bola hisap, spatula, stopwatch, dan spektofotometer UV-Vis.
Cara kerja
Aktivasi Batu Kapur
Batu Kapur yang diperoleh di daerah Bukit Jimbaran, dibersihkan di air yang mengalir dan bagian membrannya dipisahkan, dibilas dengan akuades, kemudian dikeringkan di udara bebas. Setelah kering, batu kapur ini digerus dan diayak dengan ayakan 250 µm selanjutnya dioven dengan suhu 110-120 oC hingga
berat konstan. Sampel tersebut diberi kode (Ao). Serbuk adsorben batu kapur (Ao) sebagian dikalsinasi dengan suhu 1200 oC selama 5 jam. Setelah dingin sampel disimpan dalam desikator dan diberi kode (AA).
Karakterisasi Batu Kapur
Penentuan Keasaman Permukaan
Keasaman permukaan batu kapur ditentukan dengan menimbang masing – masing sebanyak 0,1 gram batu kapur A0 dan AA kemudian dimasukkan masing – masing ke dalam erlenmeyer dan ditambahkan larutan NaOH 0,5 M sebanyak 10 mL sambil diaduk menggunakan pengaduk magnetik. Larutan tersebut kemudian ditambahkan 1-2 tetes indikator phenolphtalein hingga larutan menjadi berwarna merah muda. Larutan dititrasi menggunakan larutan HCl 0,5 M hingga titik ekivalen. Keasaman permukaan batu kapur dihitung menggunakan persamaan sebagai berikut:
mmol NaOHawal - mmol NaOHbebas
K_a = -------------;-----:--------;--------------
berat sampel
(Kumar et al, 1995)
Penentuan Luas Permukaan
Sebanyak 0,1 gram serbuk batu kapur Ao dan AA ditambahkan ke dalam 20,0 mL larutan metilen biru 50 ppm, diaduk dengan waktu yang bervariasi: 5; 10; 15; 20,;30, 40; 50 dan 60 menit. Larutan hasil pengocokan disaring dan diukur absorbansinya untuk mendapatkan berat teradsorpsi maksimum (mg/g) dan dimasukkan ke dalam persamaan berikut :
^ _ Wads.N.a Mr
(Lowell and Shields, 1984)
Adsorpsi ion fosfat
Penentuan waktu kontak optimum
Serbuk 0,5 g adsorben Ao dan AA masing-masing dimasukkan kedalam gelas Erlenmeyer yang berisi 25 mL larutan standar fosfat 70 ppm. Campuran ini diaduk dengan variasi waktu pengadukan:0; 15; 30; 45 dan 60 menit. Pengukuran konsentrasi fosfat dengan menggunakan spektrofotometer UV-Vis.
Penentuan kapasitas adsorben
Adsorben Ao dan AAsebanyak berat 0,5 gramdicampur dengan 25 mL larutan standar fosfat dan diaduk selama 30 menit.Konsentrasi larutan standar fosfat berturut-turut alalah:10; 20; 30,; 40; 50; 60; 70; 80,;90 dan 100 ppm. Filtrat yang diperoleh diukur dengan soektrofotometer UV Vis.
Data pola isoterm adsorpsi diterapkan ke persamaan linier isoterm adsorpsi Langmuir dan dengan memplot C terhadap C/m, sehingga dapat ditentukan kapasitas adsorpsinya.
HASIL DAN PEMBAHASAN
Aktivasi Batu Kapur
Aktivasi batu kapur dapat meningkatkan fungsinya sebagai adsorben yaitu dapat meningkatkan luas permukaan spesifik dan keasaman permukaansehingga daya adsorpsinyaakan semakin meningkat. Aktivasi yang dilakukan dalam penelitian ini adalah aktivasi kimia dan fisika. Aktivasi kimia dengan asam sulfat dengan tujuan dapat melarutkan pengotor pada material tersebut sehingga mulut pori menjadi terbuka.Aktivasi fisika dengan kalsinasi 1200 0C bertujuan untuk memmbuka pori dan mengubah CaCO3 menjadi CaO.
Proses karbonasi adalah adalah proses pirolisis pada temperatur 400 – 900ᴼC, dimana tujuan karbonasi adalah untuk menghilangkan zat – zat yang mudah menguap yang terkandung dalam bahan dasar. Adapun reaksi karbonasi eksotermik sebagai berikut :
CaO(s) + CO2(g) ↔ CaCO3(s)
Sedangkan aktivasi menurut Lowell (1984) adalah bagian dari proses pembuatan adsorben yang bertujuan untuk memperbesar ukuran dan distribusi pori serta memperluas permukaan adsorben dengan proses heat treatment pada temperatur 800 – 1200ᴼC.Adapun reaksi dari proses kalsinasi endotermik sebagai berikut:
CaCO3(s) ↔ CaO(s) + CO2(g)
Karakterisasi Batu Kapur
Penentuan keasaman permukaan dengan metode titrasi asam basa
Nilai keasaman permukaan ditunjukkan pada Tabel 1. Keasaman permukaan batu kapur tanpa aktivasi adalah 0,5054 mmol/g dan meningkat menjadi 1,4047 mmol/g . Keasaman permukaan batu kapur meningkat dengan adanya aktivasi asam sulfat. Peningkatan keasaman permukaan disebabkan oleh terjadinya pembentukan situs aktif pada pori batu kapur. Pemanasan 12000C berfungsi membuka pori-pori batu kapur dan merubah CaCO3 menjadi CaO sehingga dapat mempermudah proses pelarutan pengotor-pengotor yang terperangkap di dalam pori batu kapur.Proses pemanasan juga akan a akan membantu terbentuknya asam Bronsted dan asam Lewis. Terbentuknya situs asam Bronsted dapat disebabkan oleh adanya serah terima proton di dalam batu kapur karena berkurangnya jumlah molekul air pada CaO dan sebagian molekul air telah mengalami dehidrasi pada proses pemanasan. Pada pemanasan tinggi, permukaan batu kapur akan mengalami dehidroksilasi sehingga situs asam Bronsted berubah menjadi asam Lewis (Lowell,1984).
Tabel 1. Nilai keasaman permukaan batu
kapur (Ka)
|
Jenis adsorben |
Ka (mmol/g) |
Situs Asam (1020atom/g) |
|
A0 |
0,5054 ± 0,0154 |
3,0435 |
|
AA |
1,4047 ± 0,0258 |
8,4591 |
Keterangan :AO = batu kapur alam
AA = batu kapur setelah aktivasi
Penentuan luas permukaan dengan metilen biru
Hasil pengukuran luas permukaan ditunjukkan pada Tabel 2.
Tabel 2. Nilai Luas Permukaan Spesifik Batu
kapur
|
Sampel |
Luas Permukaan (S m2/g) |
|
A0 |
12,6602 |
|
AA |
25,6101 |
Pada Tabel 2 menunjukkan batu kapur yang teraktivasi H2SO4 2 M dan pemanasan 12000C memiliki luas permukaan yang lebih tinggi dari pada batu kapur tanpa aktivasi. Luas permukaan batu kapur dengan aktivasi H2SO4 2 M dan pemanasan 12000C yaitu sebesar 25,6101 m2/g. Luas permukaan pada batu kapur setelah diaktivasi meningkat dikarenakan adanya pembukaan pori batu kapur dan perubahan struktur batu batu kapur dari CaCO3 menjadi CaO yang disertai terikatnya kation H+. Disamping itu fungsi penambahan asam sulfat dapat melepaskan pengotor-pengotor lainnya dari kisi-kisi struktur. Peningkatan luas permukaan berpeluang untuk memperbesar kemampuan adsorpsinyaterhadap ion fosfat.
Uji Daya Serap Batu Kapur Terhadap Fosfat
Penetuan waktu kontak optimum
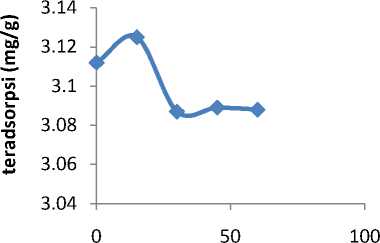
Pengaruh waktu interaksi adsorpsi banyaknya fosfat yang terserap oleh adsorben dengan berbagai variasi waktu disajikan pada Gambar 1.
waktu (menit)
Gambar 1. Kurva pengaruh waktu kontak terhadap adsorpsi banyaknya fosfat yang terserap
Berdasarkan gambar 1 di atas, dapat dilihat bahwa sampel batu kapur teraktivasi dengan adsorbat fosfat memiliki waktu setimbang sebesar 15 menit terhadap ion fosfat. Hal ini terlihat pada saat batu kapur diinteraksikan dengan anion fosfat dengan waktu lebih 15 menit terjadi penurunana banyaknya fosfat yang teradsorpsi.Batu kapur tidak mampu lagi mengadsorpsifosfat.dan terjadi pelepasan fosfat yang sudah terikat.
Dari Gambar1 diperlihatkan bahwa sampel batu kapur teraktivasi dalam
mengadsorpsi anion fosfat interaksi selama 15 menit terjadi peningkatan adsorpsi relative tajam, pada menit berikutnya adsorpsi terjadi menurun secara konstan. Hal ini menujukkan bahwa waktu mengadsorpsi anion fosfat dalam jumlah maksimum diperkukan waktu 15 menit. Hasil ini cukup relevan dengan hasil penelitian (Agnestisia R et al,2012) walupun adsorben yang digunakan berbeda. Dari hasil penelitian (Agnestisia R et al,2012), menunjukkan bahwa waktu kontak optimum adsorpsi fosfat pada adsorben selulosa termodifikasi tercapai pada waktu 15 menit. Hal yang sama dengan penelitian (Sinta, I.N., 2015) menyatakan bahwa adsorpsi fosfat dengan lempung diaktivasi asam sulfat menghasilkan waktu kontak optimum yaitu 15 jam.
Konsentrasi optimum fosfat
Data pengaruh konsentrasi fosfat terhadap banyaknya fosfat yang teradsorpsi tiap gram lempung aktif (x/m) ditunjukkan Gambar 2.
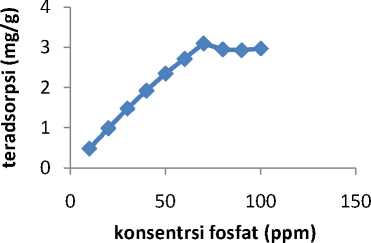
Gambar 2. kurva fosfat terhadap kapasitasvariasi konsentrasi adsorpsi
Dari Gambar 2 dapat dilihat bahwa pada konsentrasi 10 ppm sampai 70 ppm terjadi kenaikan adsorpsi. Hal ini dikarenakansemakin besar konsentrasi larutan fosfat maka semakin banyak partikel-partikel lempung yang bertumbukan dan berinteraksi dengan fosfat, sehingga kemampuan adsorpsinya meningkat. Konsentrasi fosfat optimum terjadi pada konsentrasi 70 ppm dengan kapasitas adsorpsi sebesar 3,094 mg/g. sedangkan pada konsentrasi diatas 70 ppm terjadi penurunan kemampuan adsorpsi. Hal ini dikarenakan permukaan batu kapur telah jenuh/penuh dengan fosfat, sehingga ada fosfat yang tidak terserap oleh batu kapur. Hal ini berbeda
yang hasilkan pada penelitian (Auliah, 2009) menyatakan bahwa konsentrasi optimum fosfat sebesar 20 ppm.
Penentuan kapasitas adsorpsi
Pada penelitian ini digunakan model teori Langmuir dan isotherm Freundlich untuk menyatakan pola adsopsi yang terjadi. Berdasarkan data yang diperoleh kurva pola isotherm yang didapatkan mengikuti isothermLangmuir seperti yang disajikan pada Gambar 3.
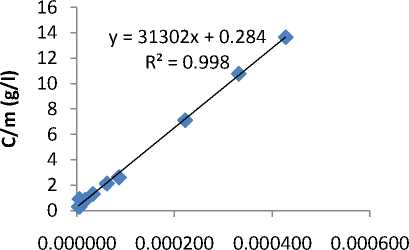
C (mol/l)
Gambar 3 Kurva isotherm Langmuir
Berdasarkan Gambar 3 menunjukkan bahwa adsorpsi fosfat terhadap batu kapur mengikuti persamaan Langmuir karena koefisien liniernya (R2) = 0,9981. Sehingga dapat diasumsikan bahwa situs aktif pada permukaan adsorben bersifat homogen yang berarti bahwa sebuah molekul fosfat menempati satu situs aktif dan tidak ada adsorpsi lebih lanjut yang dapat dilakukan pada situs tersebut. Semakin tinggi koefisien korelasi untuk model Langmuir memprediksi bahwa cakupan senyawa fosfat mungkin monolayer. Hal ini sama yang dihasilkan pada penelitian (Auliyah, 2009) menyatakan bahwa kapasitas adsorpsi lempung aktif sebesar 0,8197 mg/g yang mengikuti pola isotherm Langmuir dengan nilai R2 = 0,861.
SIMPULAN DAN SARAN
Simpulan
Waktu kontak optimum adsorpsi ion phosfat oleh adsorben batukapur. Bukit Jimbaran teraktivasi terjadi pada waktu 15 menit. Konsentrasi optimum adsorpsi ion phosfat terjadi pada konsentrasi phosfat 70 ppm dengan
jumlah phosfat yang teradsorpsi 3,094 mg/g adsorben.
Saran
Berdasarkan hasil penelitian, maka dapat disarankan untuk melalukan penelitian lebih lanjut untuk mempelajari pengaruh pH dan suhu.
UCAPAN TERIMAKASIH
Terima kasih kepada semua teman-teman, keluarga, dosen dan staff di program studi Kimia FMIPA Universitas Udayana yang telah membantu dan membimbing selama pengerjaan penelitian ini.
DAFTAR PUSTAKA
Agnestisia, R, Komari, N., Sunardi 2012,Adsorpsi fosfat menggunakan selulosa Purun Tikus (Eleocharis dulcis) termodifikasi
heksadesiltrimetilamonium
Bromida(HDTMABr), Jurnal sains dan Terapan Kimia ,6 (1): 71-86
Auliah, A., 2009, Lempung Aktif sebagai Adsorben Ion Fosfat dalam Air, Jurnal Chemicha, 10(2): 14-23
Hanrahan, G., Paulo, G., Matha, G., and Paul, W., 2002, Environmental Monitoring of Nutrients, Mc Graw-Hill, New York
Hutagalung, Horas P, Dedi Setyapermana, dan Hadi Riyono, 1997, Metode Analisis Air Laut, Sedimen, dan Biota, LIPI, Jakarta
Kumar, P., Jasra, R.V., and Bhat, T.S.G., 1995, Evolution of Porosity and Surface Acidity in Montmorilonit Clay on Acid Activation, J. Ind. Eng. Chem. Res., 34 (4) : 298-307.
Lowell, S, and Shields, J.E., 1984, Powder Surface Area and Porosity, Powder Technology Series, 2nd, Chapmand and Hall, New York.
Millero F., Huang F., Xiaorong Z, Xuewu L, and Jia Z Z, 2000, Adsoption and Desorption of Phosphate on Calcite and Arogonit in Seawater, Aquatic Geochemistry, 7, : 33-56
Muhammad, M. dan Achmad, S., 1990, Aplikasi Analisis Spektrofotometer UVVis, Mecphiso Grafika, Jakarta
Norma, I.N., Suarya,P., Santi, S.R., 2015, Adsorpsi Ion Fosfat oleh Lempung Teraktivasi Asam Sulfat, Jurnal Kimia, 9(2): 217-225
Sastrohamidjojo, H., 1985, Spektrofotometri, Cetakan Kedua, Angkasa, Jakarta
Stefhany C. A., Sutisna M., Pharmawati K., 2013, Fitoremediasi Phospat dengan Menggunakan Tumbuhan Enceng Gondok (Eichhornia crassipes) pada Limbah Cair Industri Kecil Pencucian Pakaian (Laundry), Teknik Lingkungan Itenas, 1(1)
Triyoko S., 2003, Efektifitas Larutan Kapur [Ca(OH)2] terhadap Penurunan Kadar Phosphat Limbah Cair pada Unit Proses Pengolahan Limbah Cair (IPLC) RSUP Dr. Soeraoji Tirto Negoro Klaten, Skripsi, Klaten
Yunarsih N. M., Manuntun M., Dharma Putra K. G., 2013, Efektifitas Membran Khitosan, dari Kulit Udang Galah (Macrobanchium rosenbergii) untuk Menurunkan Fosfat dalam Air Limbah Laundry, Cakra Kimia (Indonesian E-Journal of Applied Chemistry), 1(2)
106
Discussion and feedback