AKTIVITAS ANTIBAKTERI SENYAWA FLAVONOID DARI KULIT AKAR AWAR-AWAR (Ficus septica Burm F)
on
ISSN 1907-9850
AKTIVITAS ANTIBAKTERI SENYAWA FLAVONOID DARI KULIT AKAR AWAR-AWAR (Ficus septica Burm F)
I M. Sukadana
Kelompok Studi Bahan Alam, Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran
ABSTRAK
Telah dilakukan isolasi senyawa antibakteri dari kulit akar Awar-awar (Ficus septica Burm f..). Sebanyak 120,0 g ekstrak kental metanol diperoleh dari maserasi 3,9 kg serbuk kering kulit akar Awar-awar. Sekitar 60,0 g ekstrak ini dilarutkan dalam asam klorida 2 N kemudian dipartisi dengan kloroform. Ekstraksi ekstrak asam menggunakan klorofrom menghasilkan 0,82 g ekstrak kental kloroform yang positif mengandung flavonoid. Selanjutnya pemisahan ekstrak ini menggunakan teknik kromatografi kolom menghasilkan 8 fraksi yaitu F1, F2, F3, F4, F5, F6, F7 dan F8 yang mempunyai profil yang berbeda. Hasil uji flavonoid dari kedelapan fraksi menunjukkan fraksi F2, F5, dan F6 positif mengandung senyawa flavonoid. Permurnian fraksi F2 dengan cara melarutkannya kedalam n-heksana diperoleh 2 fraksi yaitu fraksi F2.1 dengan berat 0,13 g dan fraksi F2.2 sebanyak 0,01 g. Spektroskopi inframerah dan ultra violet-visible digunakan untuk nmengidentifikasi fraksi F2.1 (isolat). Berdasarkan spektra inframerah menunjukkan isolat mempunyai gugus-gugus dengan ikatan –OH, C=O, C=C dan C-H aromatik serta ikatan C-H alifatik. Sedangkan dari spektra ultra violet-visible menunjukkan 2 pita serapan pada panjang gelombang 328,6 nm (pita I) dan 281,5 nm (pita II) yang mengindikasikan isolat termasuk flavonoid golongan flavanon atau dihidroflavonol. Dengan menggunakan pereaksi geser isolate flavonoid termasuk golongan flavanon dengan kemungkinan substituen gugus hidroksi terletak pada atom C-2’, C-5’ atau C-6’ dan C-8, gugus metil atau glikosilasi pada atom C-5 dan C-7. Isolat flavanon menunjukkan aktif antibakteri terhadap Vibrio cholera dan Eschericia coli.
Kata Kunci : Ficus septica Burm f., flavanon, Antibakteri, Isolasi, Identifikasi
ABSTRACT
Isolation of flavonoid antibacterial compounds from Awar-awar root skin (Ficus septica Burm.f) has been carried out. As much as 120.0 g of concentrated methanol extract was resulted from 3.9 kg dry powder of Awar-awar root skin. About 60.0 g of this extract was dissolved into 2 N hydrochloride acid and then partitioned with chloroform. Extraction of the acid extract using chloroform resulted in 0.82 g of chloroform concentrated extract which contained flavonoids. Further, the separation of this extract using column chromatography resulted in 8 fractions namely F1, F2, F3, F4, F5, F6, F7 and F8 fraction. The result of flavonoid test of the eight fractions suggested that F2, F5, and F6 fractions contained flavonoid compounds. The purification of F2 fraction using n-hexane obtained 2 fraction F2.1 and F2.2 (0.13 gand 0.01 g respectively). Infra red and ultra violet-visible spectroscopy were employed in order to identify the F2.1 fraction. From infra red spectra, it was identified that the isolate had –OH, C=O, C=C and C-H aromatic and C-H aliphatic. The ultra violet-visible spectra showed 2 peaks at 328.6 nm (band I) and 281.5 nm (band II) which indicated flavonoid class compounds flavanon or dihidroflavonol. By using ”shitting” reagent the isolate was suggested to contain flavanon group with hydroxy groups at C-2’, C-5’ or C-6’ and C-8, and methyl or glycosilacy goups at C-5 and C-7 atom. The isolate flavanon showed antibacterial activity toward Vibrio cholera and Eschericia coli.
Keywords : Ficus septica Burm f., flavanon, antibacterial, isolation, identification
PENDAHULUAN
Awar-awar (Ficus septica Burm. F) merupakan salah satu tumbuhan obat yang sering dimanfaatkan dalam pengobatan tradisional di Bali. Kulit akar atau semua bagian akar dari tumbuhan ini dapat digunakan sebagai ramuan obat untuk menyembuhkan penyakit perut seperti disentri dan kolera (Segatri, 1995), sedangkan Perry dan Metzger (1980) serta Heyne (1987) menyatakan seluruh bagian akar dapat digunakan sebagai penangkal racun, perangsang muntah (emetic), dan peluruh kencing (diuretic). Melalui pendekatan etnobotani ini memberikan suatu asumsi bahwa dalam bagian kulit akar tumbuhan Awar-awar terkandung senyawa antibakteri khususnya terhadap bakteri penyebab disentri dan kolera. Senyawa metabolit sekunder yang telah diisolasi dari bagian kulit akar tumbuhan Awar-awar adalah fikusin A dan fikusin B yaitu suatu senyawa monoterpen-siklik-tersubstitusi isoflavon, serta senyawa genistein (Aida et al., 1995) yang mana ketiga senyawa ini merupakan senyawa golongan flavonoid. Senyawa fikusin A dan fikusin B belum diketahui memiliki aktivitas fisiologis, sedangkan genistein telah diketahui sebelumnya mempunyai aktivitas sebagai penghambat protein-tirosin-kinase, yaitu suatu senyawa yang potensial sebagai agen antikanker (Geahlen et al., 1989).
Hasil uji fitokimia pendahuluan terhadap ekstrak kental metanol kulit akar Awar-awar diketahui mengandung senyawa metabolit sekunder golongan flavonoid, alkaloid, dan triterpenoid (Sukadana, 2000; Sukadana, 2001; Sukadana, 2004). Berdasarkan pendekatan informasi etnobotani (Farnsworth, 1996) yang diasumsikan kulit akar tumbuhan Awar-awar mengandung senyawa antibakteri, kandungan senyawa flavonoid yang belum diketahui aktivitasnya, serta hasil uji fitokimia pendahuluan terhadap ekstrak kental metanol yang menunjukkan salah satunya mengandung senyawa flavonoid, maka dalam penelitian ini dilakukan isolasi senyawa golongan flavonoid dan uji aktivitasnya terhadap bakteri Vibrio cholera (V.cholera) dan Eschericia coli (E.coli).
MATERI DAN METODE
Bahan
Bahan yang digunakan dalam penelitian adalah kulit akar tumbuhan Awar-awar (Ficus septica Burm. f) yang diperoleh dari daerah Gianyar Bali. Identifikasi tentang taksonomi tumbuhan dilakukan di LIPI-UPT. Balai Konservasi Tumbuhan Kebun Raya “Eka Karya” Bali. Bahan kimia yang digunakan adalah metanol (teknis dan p.a), etanol, kloroform, etilasetat, n-heksana, asam kolrida pekat, natrium hidroksida, serbuk magnesium, natrium asetat, asam, borat, aluminium klorida, kalium bromida yang semuanya berderajat p.a, akuades, silika gel 60, silika gel GF254, media nutrien broth, metra Mueller Hilton, serta bahan uji bakteri Vibrio cholera dan Eschericia coli. Uji aktivitas antibakteri dilakukan di Laboratorium Mikrobiologi Jurusan Biologi FMIPA Unud.
Peralatan
Peralatan yang digunakan meliputi: seperangkat alat gelas, neraca analitik, blender, pisau, penguap putar vakum, lampu UV, seperangkat alat kromatografi lapis tipis dan kolom, desikator, tabung reaksi, plat tetes, pipet tetes, pipet ukur dengan berbagai ukuran, cawan petri, paper disc, spektrofotometer UV-Vis Secoman S 1000 PC dan spektrofotometer FTIR-8201 PC. Analisis spektrofometri UV-vis dilakukan di Laboratorium Instrumentasi Jurusan Kimia FMIPA Unud, sedangkan analisis spektrofotometri IR dilakukan di Laboratorium Kimia Organik FMIPA UGM Yogyakarta.
Cara Kerja
Sekitar 3,9 kg serbuk kering kulit akar Awar-awar dimaserasi berulang kali dengan pelarut metanol teknis (MeOH) sampai semua komponen terekstraksi. Ekstrak MeOH dipekatkan dengan penguap putar vakum sampai diperoleh ekstrak kental MeOH. Ekstrak kental MeOH ditriturasi berulangkali dengan asam klorida 2 N hingga diperoleh ekstrak asam dan residu. Ekstrak asam dipartisi dengan pelarut kloroform beberapa kali kemudian dipisahkan bagian ekstrak asam dan bagian ekstrak kloroform. Ekstrak asam dibiarkan, sedangkan ekstrak kloroform diuapkan pelarut
kloroformnya hingga diperoleh ekstrak kental kloroform dan diuji kandungan flavonoidnya. Ekstrak kental kloroform positif flavonoid dilanjutkan untuk dipisahkan dengan teknik kromatografi kolom menggunakan silika gel 60 dan fase gerak kloroform-metanol (3:2). Tiap fraksi hasil pemisahan kromatografi kolom diuji flavonoid. Fraksi positif flavonoid yang relatif belum murni dimurnikan dengan teknik pencucian menggunakan pelarut n-heksana sampai diperoleh isolat yang relatif murni. Isolat ini selanjutnya dianalisis fisikokimia menggunakan alat spektrofotometer UV-vis dan Inframerah serta diuji aktivitas antibakteri terhadap Vibrio cholera dan Eschericia coli.
HASIL DAN PEMBAHASAN
Hasil maserasi dari 3,9 Kg serbuk kering kulit akar Awar-awar (Ficus septica Burm f.) menggunakan pelarut metanol diperoleh ± 120 g ekstrak kental metanol. Sebanyak 60 g ekstrak kental metanol ditriturasi dengan larutan 2 N asam klorida dalam mortar dengan cara digerus. Ekstrak asam klorida yang berwarna jingga ini kemudian dipartisi berulang kali dengan menggunakan pelarut kloroform diperoleh ekstrak kloroform yang mana setelah diuapkan pelarutnya diperoleh ekstrak kental kloroform yang berwarna coklat sebanyak 0,82 g dan positif flavonoid.
Pemisahan ekstrak kental kloroform menggunakan kromatografi kolom diperoleh 8 (delapan) fraksi dengan pola pemisahan yang berbeda serta hasil uji kandungan flavonoidnya dipaparkan pada Tabel 1 berikut :
Tabel 1. Fraksi hasil pemisahan kromatografi kolom, berat masing-masing fraksi dan uji kandungan flavonoid dari ekstrak kental kloroform
|
Fraksi |
Warna |
Jumlah Noda |
Berat (g) |
Uji Flavonoid |
|
F1 |
Coklat hitam |
2 |
0,06 | |
|
F2 |
Coklat |
1 |
0,26 |
+ |
|
F3 |
Merah orange |
2 |
0,22 |
- |
|
F4 |
Coklat hitam |
2 |
0,15 |
- |
|
F5 |
Kuning |
2 |
0,09 |
+ |
|
F6 |
Kuning |
1 |
0,01 |
+ |
|
F7 |
Kuning pucat |
2 |
0,01 |
- |
|
F8 |
Kuning pucat |
2 |
0,01 |
- |
Fraksi-fraksi yang positif mengandung senyawa flavonoid adalah fraksi F2, F5, dan F6. Berdasarkan jumlah noda yang mengindikasikan relatif kemurnian fraksi dan mempertimbangkan berat fraksi, maka fraksi F2 dilanjutkan untuk dimurnikan dengan teknik pencucian menggunakan pelarut n-heksana. Hasil pencucian berulang kali diperoleh fraksi F2.1
yang tidak larut n-heksana sebanyak 0,13 g dan fraksi F2.2 yang larut dalam n-heksana yang mana setelah diuapkan pelarutnya diperoleh berat 0,01 g. Kedua fraksi ini positif flavonoid, namun demikian fraksi F2.2 jumlahnya sedikit, maka fraksi F2.1 dilanjutkan untuk dianalisis. Secara kromatografi lapis tipis (KLT) fraksi F2.1 ini relatif murni dengan tetap memberikan satu
noda pada berbagai fase gerak yang digunakan seperti: kloroform-metanol (3:2); etanol-etilasetat (1:1), etanol-butanol (1:1), kloroform-n-heksana (3:4), etilasetat-etanol (1:3), metanol-etilasetat (7:3), etilasetat-metanol-air (2:5:1), kloroform-metanol-etilasetat (6:2:1), dan etilasetat-etanol (5:1).
Hasil spektrum inframerah menunjukkan bahwa isolat (fraksi F2.1) kemungkinan mengandung beberapa gugus fungsi seperti –OH (3409 cm-1) yang didukung juga oleh munculnya serapan pada daerah bilangan gelombang 1361 cm-1 untuk ikatan C-O alkohol. Gugus C-H aromatik dengan serapan tajam yang muncul pada daerah bilangan gelombang 3083,7 cm-1
dan diperkuat dengan munculnya serapan tajam pada daerah bilangan gelombang 821,6 cm-1. Adanya cincin aromatik juga ditunjukkan adanya serapan C=C aromatik pada daerah bilangan gelombang 1600,8-1515,9 dan 1423,4 cm-1. Selain ikatan C-H aromatik kemungkinan dalam isolat juga mengandung ikatan C-H alifatik yang ditandai dengan munculnya serapan pada daerah bilangan gelombang 2931,6 cm-1 dan 2858,3 cm-1. Adanya gugus karbonil (C=O) sebagai ciri umum senyawa golongan flavonoid ditunjukkan dengan serapan tajam pada daerah bilangan gelombang 1712,7 cm-1. Spektrum inframerah dari isolat dipaparkan pada Gambar 1 dan analisisnya pada Tabel 2 berikut :
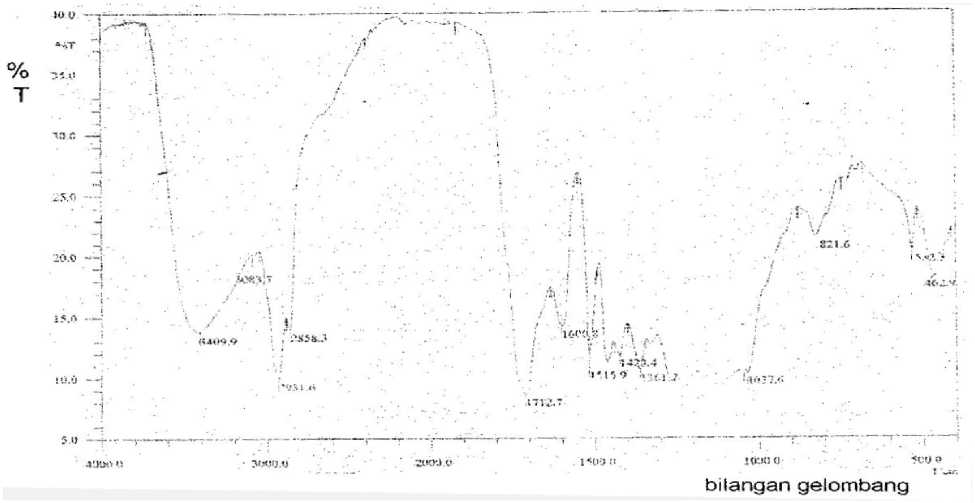
Gambar 1. Spektrum inframerah isolat (fraksi F2.1)dengan pelet KBr
Tabel 2. Analisis spektrum inframerah senyawa isolat (fraksi F2.1)
|
No |
Bilangan Gelombang (cm-1) |
Bentuk Pita |
Kemungkinan Gugus Fungsi | |
|
Pada Spektra |
Pada Pustaka (Sastrohamidjojo, 1997; Silverstein et al., 1991) | |||
|
1 |
3409,9 |
3500-3000 |
melebar |
-OH |
|
2 |
3083,7 |
3150-3050 |
tajam |
-CH aromatik |
|
3 |
2931,6 |
2950-2800 |
tajam |
-CH alifatik |
|
4 |
2858,3 |
2950-2800 |
tajam |
-CH alifatik |
|
5 |
1712,7 |
1850-1730 |
tajam |
-C=O |
|
6 |
1600,8 1515,9 1423,4 |
1650-1400 |
tajam |
-C=C aromatik |
|
7 |
1361,7 |
1300-1000 |
tajam |
-C-O alkohol |
|
8 |
821,6 |
840-800 |
tajam |
-CH aromatik |
Hasil analisis menggunakan spektrofotometri UV-vis isolat (fraksi F2.1) memberikan 2 pita serapan yang karakteristik untuk senyawa flavonoid kemungkinan golongan flavanon atau dihidroflavonol, yaitu serapan pada panjang gelombang 281,5 nm (pita II), dan 328,6 nm (pita I). Menurut Markham (1988), Geissman (1962), serta Tempesta dan Michael (2007) senyawa flavonoid golongan flavanon dan dihidroflavonol mempunyai serapan maksimum pita II pada panjang gelombang 275295 nm dan serapan pita I pada panjang gelombang 300-330 nm. Dugaan golongan flavanon dan dihidroflavonol dari isolat juga didukung dengan data spektrum inframerah yang menunjukkan adanya serapan gugus C=O pada daerah bilangan gelombang 1712,7 cm-1 dan gugus OH pada 3409,9 cm-1. Pola oksigenasi
atau kemungkinan letak substituen gugus hidroksi (OH) pada kerangka flavanon atau dihidroflavonol diperoleh dari beberapa pereaksi diagnostik/ pereaksi geser seperti: NaOH, NaOAc, NaOAc-H3BO3, AlCl3, dan AlCl3-HCl. Hasil pergeseran panjang gelombang setelah penambahan tiap-tiap pereaksi geser tersebut dapat disimpulkan bahwa senyawa flavonoid yang lebih mungkin adalah golongan flavanon dengan kemungkinan letak substituen gugus hidroksi pada posisi atom C-2’, C-5’ atau C-6’ dan C-8, gugus metil atau glikosilasi pada atom C-5 dan C-7. Spektrum UV-vis sebelum penambahan pereaksi geser dan data tabulasinya sebelum dan sesudah penambahan pereaksi geser dipaparkan pada Gambar 2 dan Tabel 3 sebagai berikut :
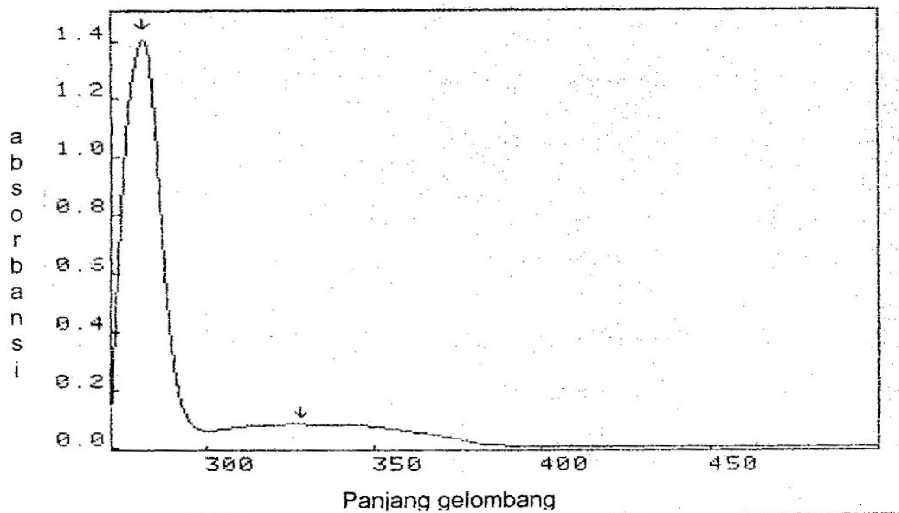
Gambar 2. Spektrum spektrofotometri UV-vis isolat (UV-vis Secoman S 1000 PC)
Tabel 3. Data spektrum UV-vis dari isolat (fraksi FB) sebelum dan sesudah penambahan pereaksi geser
|
Isolat (fraksi FB) |
Panjang Gelombang λmaks (nm) |
Geseran Panjang Gelombang λmaks (nm) | ||
|
Pita I |
Pita II |
Pita I |
Pita II | |
|
+ Metanol + Metanol + NaOH + Metanol + NaOH (5 menit) |
328,6 |
281,5 | ||
|
347,8 |
281,6 |
+ 19,8 |
+ 0,1 | |
|
347,8 |
281,6 |
+ 19,8 |
+ 0,1 | |
|
+ Metanol + Metanol + NaOAc + Metanol + NaOAc + H3BO3 |
328,6 |
281,5 | ||
|
- |
267,9 |
- |
-13,6 | |
|
- |
267,9 |
- |
-13,6 | |
|
+ Metanol + Metanol + AlCl3 + Metanol + AlCl3 + HCl |
328,6 |
281,5 | ||
|
- |
276,5 |
- |
- 5,0 | |
|
- |
276,5 |
- |
- 5,0 | |
Uji Aktivitas Antibakteri
Hasil uji antibakteri menunjukkan bahwa isolat mampu menghambat pertumbuhan bakteri Vibrio cholera dan Eschericia coli dengan
memberikan diameter zona hambat untuk masing-masing bakteri uji seperti dipaparkan pada Tabel 4 sebagai berikut :
Tabel 4. Hasil uji aktivitas antibakteri isolat pada berbagai konsentrasi
|
No |
Konsentrasi Isolat (ppm) Kontrol pelarut |
Diameter zona hambat (mm) | |
|
Bakteri (V. cholera) |
Bakteri (E.coli) | ||
|
1 |
Kontrol metanol |
5,5 |
5,5 |
|
2 |
100 |
6,0 |
8,0 |
|
3 |
500 |
6,2 |
8,3 |
|
4 |
1000 |
6,2 |
8,0 |
Pada konsentrasi 100 ppm isolat telah mampu menghambat pertumbuhan bakteri dan sangat aktif pada bakteri Eschericia coli (E.coli).
SIMPULAN DAN SARAN
Simpulan
Simpulan yang dapat diambil dari penelitian yang telah dilakukan adalah sebagai berikut:
-
1. Isolat flavonoid yang berhasil diisolasi adalah golongan flavanon dengan gugus hidroksi bebas kemungkinan terikat pada atom C-2’, C-5’ atau C-6’ dan C-8, gugus metil atau glikosilasi pada atom C-5 dan C-7, serta memiliki gugus OH, C=O, C=C dan C-H aromatik, serta C-H alifatik.
-
2. Isolat flavanon mempunyai aktivitas sebagai antibakteri terhadap Vibrio cholera dan Eschericia coli.
Saran
Perlu dilakukan penelitian lebih lanjut untuk mengidentifikasi isolat aktif dengan menggunakan analisis NMR, dan GC-MS sehingga dapat ditetapkan suatu struktur usulan dari isolat aktif tersebut.
UCAPAN TERIMA KASIH
Pada kesempatan ini penulis mengucapkan terimakasih kepada Dra. Ida Ayu Raka Astiti Asih, M.Si dan Wahyu Lastiyanto, S.Si serta kepada semua pihak yang telah membantu penelitian ini.
DAFTAR PUSTAKA
Aida, M., Hano, Y., and Nomura, T., 1995, Ficusins A and B. Two New Cyclic-monoterpene-substituted Isoflavones from Ficus septica Burm. F., Heterocycles, 41 (12) : 2761-2768
Farnsworth, N. R., 1996, Biological and Phytochemical Screening of Plant, J. Pharm. Science, 55 (3) : 225-276
Geahlen, R. L., Koonchanok, N. M., McLaughlin, J. L., and Pratt, D. E., 1989, Inhibitition of Protein-Tyrosine kinase Activity by Flavonoids and Related Compounds., J. Nat. Prod., 52 : 982-986
Geissman, T. A., 1962, The Chemistry of Flavonoid Compounds, Pergamon Press, Inc., New York
Heyne, K., 1987, Tumbuhan Berguna Indonesia II, a.b. Anonimous, Yayasan Sarana Warna Jaya, Jakarta
Markham, K. R., 1988, Cara Mengidentifikasi Flavonoid, a.b. Padmawinata, K., ITB, Bandung
Perry, L. M. and Metzger, J., 1980, Medical Plants of East and Southeast Asia Attributed Properties and Uses, The Mitt Press Cambridge, Massachusetts, 273274
Sastrohamidjojo, H., 1997, Spektroskopi,
Liberty, Yogyakarta
Segatri, P., 1995, Taru Premana Khasiat Tanam-tanaman untuk Obat Tradisional, Upada sastra, Denpasar, 20
Silverstin, R. M., Bassler, G.C., and Morrill, T. C., 1991, Spectrometric Identification of
Organic Coumpounds, Fifth edition, Jhon Wiley &Sons, Inc., New York
Sukadana, I M., 2000, Isolasi dan Identifikasi Senyawa Alkaloid dari Kulit Akar Awar-awar (Ficus septica Burm.f), Chemical Reviews, 3 (2) :40-45
Sukadana, I M., 2001, Alkaloid Oksindol pada Kulit Kulit Akar Awar-awar (Ficus septica Burm.f), Chemical Reviews, 4 (3) : 70-74
Sukadana, I M., 2004, Metabolit Sekunder Tumbuhan Awar- awar (Ficus septica Burm.f), Chemical Reviews, 7 (1) : 3442
Tempesta, Michael, S., 1993, Proanthocyanidin Polymers Having Antiviral Activity and Methods of Obtaining Same, http://www. freepatentsonline.com/ 5211944.html, 23 April 2009
70
Discussion and feedback