ISOLASI DAN IDENTIFIKASI SENYAWA TOKSIK PADA SPONS DARI PERAIRAN GILI SULAT-LOMBOK
on
ISSN 1907-9850
ISOLASI DAN IDENTIFIKASI SENYAWA TOKSIK PADA SPONS DARI PERAIRAN GILI SULAT-LOMBOK
I M. Dira Swantara1), Agus Supriyono2), dan Mila Trinoviani1)
-
1) Jurusan Kimia FMIPA Universitas Udayana, Bukt jimbaran
-
2) Laboratorium Teknologi Farmasi dan Medika, BPPTeknologi, Jakarta
ABSTRAK
Telah dilakukan isolasi dan identifikasi senywa toksik pada spons koleksi BPPT bagian P3-TFM yang berasal dari perairan Gili Sulat, Lombok. Ekstraksi menggunakan metode maserasi dilakukan secara total menggunakan tiga jenis pelarut yaitu berturut-turut metanol, diklorometana, dan n-heksana. Ekstrak total yang diperoleh kemudian dipartisi cair-cair berturut-turut dengan etil asetat dan n-butanol. Ekstrak yang paling toksik dipisahkan dengan kromatografi kolom dengan fase diam sephadex LH-20 dan fase geraknya metanol. Identifikasi isolat aktif dilakukan dengan kromatografi gas-spektroskopi massa dengan bantuan database Wiley 275. L.
Uji toksisitas pada sepuluh spons koleksi BPPT bagian P3-TFM menunjukkan bahwa spons SL2 terbukti paling toksik. Fraksi yang paling toksik pada spons SL2 dengan harga LC50 sebesar 100 ppm diduga gabungan 7 senyawa yaitu asam benzena asetat (8,9%), dioktil heksadioat (4,5%), bis (2etilheksil) 1,2-benzenkarboksilat (53,1%), 2, 6, 10, 15, 19, 23 heksametil 2, 6, 10, 14, 18, 22 – tetrakosaheksena, (17,1%), nonakosana (7,8%), kolesterol (3,8%), dan eikosana (4,8%).
Kata kunci: isolasi, identifikasi, senyawa toksik, spons
ABSTRACT
The isolation and identification of toxic compound on sponge from BPPT collection sub P3-TFM derived from Gili Sulat, Lombok waters has been conducted. The extraction applied was maceration method, which was totally conducted using three kinds of solvents namely, methanol, dichloromethane, and n-hexane. The total extract obtained was then partitioned into liquid using ethyl acetate and n-butane respectively. The most toxic extraction was separated by chromatography column with sephadex LH-20 as the stationary phase and methanol as the mobile phase. Identification of the active isolate was conducted by gas chromatography - mass spectroscopy with the aim of Wiley 275.L. database.
Toxin test to sponge of BPPT collection sub P3-TFM showed that SL2 sponge was proved to be the most toxic one. The most toxic fraction of SL2 sponge at LC50 at 100 ppm was assumed to be the combination of 7 compounds, namely benzene acetatic acid (8.9%), dioktil hexadioate (4.5%), bis (2etilheksil) 1.2-benzeneboksilat (53.1%), 2, 6, 10, 15, 19, 23 hexamethyl 2, 6, 10, 14, 18, 22-tetracosahexene, (17.1%), nonacosane (7.8%), cholesterol (3.8%) and eicosane (4.8%).
Keywords: isolation, identification, toxic compounds, sponge
PENDAHULUAN
Berbagai jenis penyakit akhir-akhir ini muncul dengan tingkat keganasan yang berbeda dan cenderung meningkat. Saat ini upaya kebutuhan obat baru dipenuhi melalui kerja eksploratif yaitu pencarian dengan memvariasi struktur senyawa obat yang secara klinis masih digunakan dan dengan memanfaatkan sumber daya alam. Salah satu sumber daya alam yang belum dikembangkan secara maksimal adalah sumber alam kelautan (Wahyono, 2003). Indonesia dikenal sebagai negara bahari dengan luas 75% berupa lautan, memiliki kekayaan sumber daya hayati yang melimpah(Rosmiati dan Suryati (2001).
Salah satu jenis organisme yang berpotensi cukup besar dan berpeluang mengandung senyawa aktif adalah spons. Spons merupakan binatang laut yang hidup di kedalaman sampai dengan 50 meter di bawah permukan laut. Di dunia diduga terdapat sekitar 10.000 spesies spons dan diperkirakan sekitar 200 spesies hidup di ekosistem terumbu karang Asia Tenggara (Dahuri, 2003). Jumlah spesies spons di Indonesia diperkirakan sebanyak 830 spesies (Sujatmiko, 2000).
Sejumlah senyawa metabolit pada spons yang mempunyai bioaktivitas telah diisolasi dan diidentifikasi. Dua alkaloid baru yaitu hyrtiosins A dan B telah diisolasi dari Hyrtios erecta. Alkaloid yang bersifat toksik dari spons Xestopongia caycedoi yaitu reneiramycin G juga telah diisolasi bersama dengan mimosamycin. Dari spons lain, Cribrocholina sp. diperoleh cribostatins 1 dan 2 yang merupakan metabolit toksik. Metabolit toksik dari spons Axinella sp. yaitu (+)- herbindoles A, B, C, telah juga diidentifikasi. Niptharesines E-H merupakan empat senyawa toksik derivat dari piridin yang bersifat antimikroba terdapat dalam spesies niphates (Lewis, 1994, Faulkner,
1993, Faulkner, 1992). Tiga alkaloid napthridine yaitu aaptamine, 9-demetilaaptamine dan isoaaptamine telah diisolasi dari spons Aaptos sp. yang berasal dari Taman Laut Bunaken, Sulawesi Utara (Rombang et al., 2004). Terpenoid dalam jumlah besar telah ditemukan dalam spons. Beberapa diantaranya mempunyai aktivitas biologis yaitu empat diterpen bersifat toksik terhadap larva udang. Senyawa ini berasal dari Myrmekioderma styx. Isometachromin adalah seskuiterpenoid toksik dari spons Hippospongia metachromia (Faulkner, 1993, Faulkner 1992). Beberapa spons Pasifik Barat, axinella dan hymeniacidon diketahui mengandung metabolit toksik hymenialdisine dan debromohymenialdisine (Faulkner, 1994, Faulkner 1993). Senyawa discodermolide merupakan metabolit dari spons Discodermia dissoluta yang aktif sebagai antikanker. Halichondrin B yang diisolasi dari spons Halichondria okadai terbukti aktif melawan leukimia (Faulkner, 1994). Dari spons Stylissa flabeliformis, berhasil diisolasi senyawa jaspamida yang berpotensi sebagai antikanker (Wahyono, 2003).
Pada saat ini bagian P3-TFM BPPT menginventarisasi berbagai spesies spons yang berasal dari berbagai perairan di Indonesia. Spesies yang berasal dari perairan Gili Sulat, Lombok terinventarisasi sebanyak 38 spesies (Sujatmiko, 2000). Pada penelitian ini spesies spons yang berasal dari perairan Gili Sulat akan diskrining toksisitasnya menggunakan bioindikator larva Artemia salina Leach. Spesies spons yang paling toksik dari hasil skrining tersebut dan masih relevan untuk diteliti selanjutnya diisolasi untuk menentukan senyawa yang bersifat toksik tersebut.
MATERI DAN METODE
Bahan
Bahan yang digunakan dalam penelitian ini adalah spons koleksi BPPT bagian P3-TFM yang diperoleh dari perairan Gili Sulat, Lombok. Disamping iu digunakan bahan kimia seperti metanol, diklorometana, n-heksana, etilasetat, n-butanol, silika gel GF254, sephadex LH-20, DMSO, asam asetat glasial, asam formiat, aseton, NaOH 2%, asam sulfat pekat, asam klorida pekat dan 2 N, benzena, pereaksi Liebermann-Burchard, pereaksi Dragendorff, pereaksi Meyer, natrium klorida, etanol 95%.
Peralatan
Alat-alat yang digunakan dalam penelitian ini adalah: seperangkat alat gelas laboratorium, penguap putar vakum, seperangkat alat Kromatografi Lapis Tipis (KLT), seperangkat alat kromatografi kolom, seperangkat alat Kromatografi Cair Kinerja Tinggi (KCKT), seperangkat alat Kromatografi Gas-Spektroskopi Massa (KG-MS), lampu UV 254 dan 366 nm, kertas saring, pipet mikro, timbangan elektronik, oven, dan blender.
Cara Kerja
Skrining Sampel
Sepuluh spesies spons koleksi P3-TFM BPPT yang berasal dari perairan Gili Sulat, Lombok yaitu SL1, SL2, SL5, SL6, SL12, SL15, SL16, SL17, SL28, dan SL35, masing-masing seberat 100 gram diekstraksi dalam pelarut metanol. Ekstrak ini diuji toksisitasnya menggunakan bioindikator Artemia salina Leach. Spesies spons yang menunjukkan sifat toksik paling besar diteliti lebih lanjut.
Penyiapan Bahan dan Ekstraksi Metabolit
Spons koleksi BPPT yang paling toksik dipotong-potong kemudian diblender. Spons yang telah dihaluskan diambil ±1000
gram lalu dimaserasi berturut-turut dengan metanol (3x750 mL), diklormetan (3x750 mL), dan n-heksana (3x750 mL). Masing-masing filtrat yang diperoleh dipekatkan kemudian digabungkan sehingga menjadi ekstrak kental spons. Ekstrak kental ini ditambahi 250 mL air dan diaduk sehingga terbentuk emulsi. Emulsi ini dipartisi berturut-turut dengan etilasetat (8x250 mL) dan n-butanol (8x250 mL). Lapisan etilasetat dan lapisan n-butanol yang diperoleh masing-masing dipekatkan sehingga dihasilkan ekstrak etilasetat dan ekstrak n-butanol. Terhadap kedua ekstrak tersebut dilakukan uji toksisitas dengan menggunakan bioindikator larva A. salina. Ekstrak yang menunjukkan toksisitas lebih tinggi selanjutnya dipisahkan dan dimurnikan.
Pemisahan dan Pemurnian
Ekstrak yang menunjukkan toksisitas lebih tinggi, selanjutnya difraksinasi menggunakan kromatografi kolom. Eluat ditampung setiap 2 mL dari wadah (tabung reaksi) yang telah disediakan. Proses kromatografi kolom dihentikan setelah semua metabolit diperkirakan keluar dari kolom. Masing-masing eluat dalam tabung reaksi dipisahkan dengan KLT. Kemudian pelat KLT dideteksi nodanya dibawah sinar lampu UV pada panjang gelombang 254 dan 366 nm. Eluat yang menunjukkan pola noda sama digabungkan sehingga diperoleh beberapa fraksi. Fraksi-fraksi tersebut kemudian diuji toksisitasnya sehingga diketahui fraksi yang paling toksik. Fraksi yang paling toksik ini kemudian diuji kemurniannya menggunakan cara KLT dan KCKT dan diidentifikasi.
Uji Toksisitas terhadap Larva A. salina
Sampel yang akan diuji toksisitasnya terhadap larva A. salina dikerjakan dengan tahap-tahap sebagai berikut :
-
1. Dibuat media larva udang dengan salinitas 30-34‰. pH larutan diatur pada 7-8.
-
2. Media selanjutnya dimasukkan ke dalam wadah kaca dilengkapi dengan aerator. Telur A. salina dimasukkan secukupnya dan disimpan pada tempat yang memiliki penerangan yang cukup selama 24 jam sehingga telur tersebut menetas dan siap digunakan untuk pengujian.
-
3. Disiapkan vial untuk pengujian masing-masing sampel. Sampel ditimbang sebanyak 20 mg dan dilarutkan dalam 2 mL metanol. Larutan tersebut kemudian diambil sebanyak 500 μL, 50μL, 5 μL, masing-masing dimasukkan kedalam vial yang telah disiapkan dan pelarutnya diuapkan selama 24 jam. Ke dalam masing-masing vial ditambahi air laut buatan, 30 μL DMSO, dan 20 ekor larva A. salina. Terakhir, ditambahi air laut buatan sampai volumenya 5 mL sehingga dicapai konsentrasi 1000 ppm, 100 ppm, 10 ppm.
-
4. Pengamatan terhadap kematian larva A. salina dilakukan setelah 24 jam.
-
5. Data kematian larva A.salina dianalisis untuk menentukan LC50.
Kromatografi Kolom
Pembuatan kolom kromatografi untuk pemisahan dan pemurnian sampel dilakukan dengan melarutkan sephadex LH-20 ke dalam metanol sehingga menjadi bubur. Bubur sephadex dimasukkan ke dalam kolom dengan kecepatan tertentu sampai sephadex mencapai tanda batas. Kemudian kolom dielusi sampai terjadi kerapatan yang homogen. Kemudian sampel ditambahkan di atas sephadex dan dielusi dengan fase gerak. Eluat ditampung pada botol penampung.
Uji Kemurnian
Uji kemurnian fraksi toksik menggunakan KLT dan KCKT. Uji kemurnian dengan KLT dilakukan dengan berbagai jenis eluen. Uji kemurnian menggunakan KCKT dilakukan dengan menginjeksikan sampel ke dalam sistem KCKT yang sudah siap untuk digunakan.
Identifikasi Isolat Aktif
Isolat toksik yang relatif murni diidentifikasi dengan cara uji fitokimia dan dengan kromatografi gas-spektroskopi massa.
HASIL DAN PEMBAHASAN
Skrining Spons
Skrining dilakukan pada 10 spesies spons yang berasal dari perairan Gili Sulat-Lombok yaitu spons SL1, SL2, SL5, SL6, SL12, SL15, SL16, SL17, SL28, dan SL35. Skrining ini dilakukan dengan cara uji toksisitas ekstrak sampel terhadap larva A. salina.
Berdasarkan hasil uji toksisitas ke 10 sampel di atas menunujukkan bahwa spons SL2 mempunyai nilai persentase kematian paling besar yaitu pada konsentrasi 250 ppm, 500 ppm, dan 750 ppm berturut-turut 13%, 46%, dan 84%.
Ekstraksi Spons SL2
Hasil ekstraksi total 1000 gram sampel spons SL2 yaitu menggunakan tiga macam pelarut yaitu metanol, diklorometana, dan n-heksana diperoleh ekstrak kental seberat 50 gram. Selanjutnya ekstrak kental ini dipartisi berturut-turut dengan etilasetat dan n-butanol. Ekstrak kental yang diperoleh kemudian diuji toksisitasnya menggunakan bioindiaktor larva A. salina.
Hasil uji toksisitas di atas menunjukkan bahwa ekstrak n-butanol lebih toksik dibandingkan dengan ekstrak etilasetat. Selanjutnya dilakukan pemisahan dan pemurnian terhadap ekstrak n-butanol.
Pemisahan dan Pemurnian Metabolit
Pemisahan awal ekstrak n-butanol dilakukan dengan melarutkan ekstrak dalam metanol. Endapan yang terbentuk pada proses pemisahan ini dipisahkan dari cairannya. Setelah dilakukan uji toksisitas terhadap endapan dan cairannya, diperoleh bahwa hanya cairannya yang bersifat toksik sehingga pemisahan dilanjutkan pada cairannya.
Pemisahan selanjutnya menggunakan kromatografi kolom. Sebanyak 1 gram ekstrak kental dipisahkan dengan kromatografi kolom menggunakan fase diam sephadex LH-20 dan fase gerak metanol. Terhadap hasil kromatografi kolom dilakukan KLT dengan eluen campuran etilasetat : air : asam formiat : asam asetat (100:27:11:11). Berdasarkan pola noda pada KLT, diperoleh 3 fraksi yaitu fraksi I, fraksi II dan fraksi III. Uji toksisitas dilakukan terhadap ketiga fraksi tersebut dan menunjukkan fraksi II bersifat paling toksik.
Fraksi II diuji kemurniannya dengan KLT dan KCKT. Uji kemurnian secara KLT menggunakan 3 jenis eluen menunjukkan pola noda tunggal. Uji kemurnian dengan KCKT menunjukkan adanya 4 puncak pada kromatogram. Hal ini menunjukkan bahwa fraksi II belum cukup murni.
Identifikasi Senyawa Fraksi Toksik
Uji Fitokimia
Uji fitokimia terhadap fraksi II menunjukkan adanya senyawa golongan triterpenoid.
Identifikasi dengan Kromatografi Gas-Spektoskopi Massa
Fraksi II diperoleh berupa padatan berwarna coklat seberat 0,38 gram. Kromatogram gas fraksi II ditampilkan pada Gambar 1 yang memperlihatkan adanya 7 puncak dengan waktu retensi (tR) dan kelimpahannya berturut-turut sebagai berikut : puncak 1 tR 5,52 menit (8,9%), puncak 2 tR 26,09 menit (4,5%), puncak 3 tR 28,83 menit (53,1%), puncak 4 tR 33,06 menit (17,1%), puncak 5 tR 34,17 menit (7,8%), puncak 6 tR 36,33 menit (3,8%), puncak 7 tR 36,73 menit (4,8%). Berdasarkan data di atas, diduga fraksi II mengandung 7 senyawa.
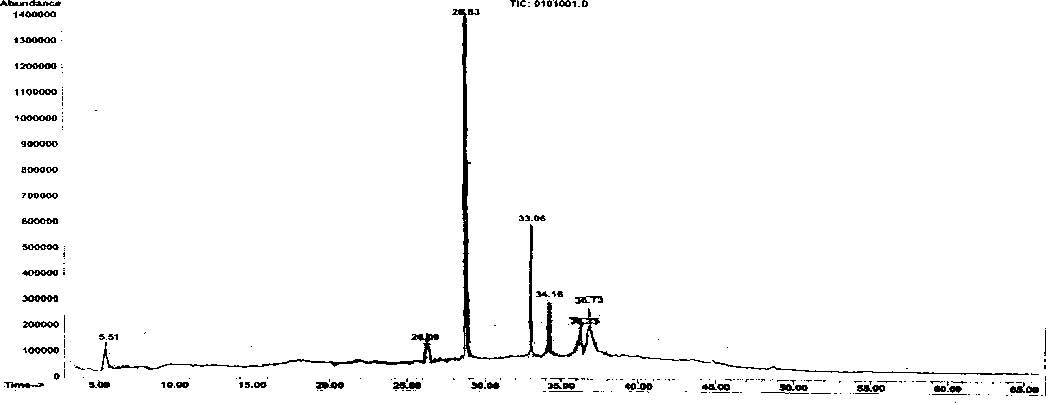
Gambar 1. Kromatogram gas fraksi II
Identifikasi Senyawa Dari Puncak 1 tR 5,52 menit (8,9%)
Spektrum massa senyawa dari puncak 1 dan spektrum massa senyawa yang identik (Wiley 275. L) yaitu asam benzena asetat ditampilkan pada Gambar 2. Pada spektrum
tersebut terlihat adanya ion-ion pada m/z 136 (M+) dan m/z 91 (puncak dasar). Ion molekul pada m/z 136 mengindikasikan bahwa senyawa ini memiliki berat molekul 136.
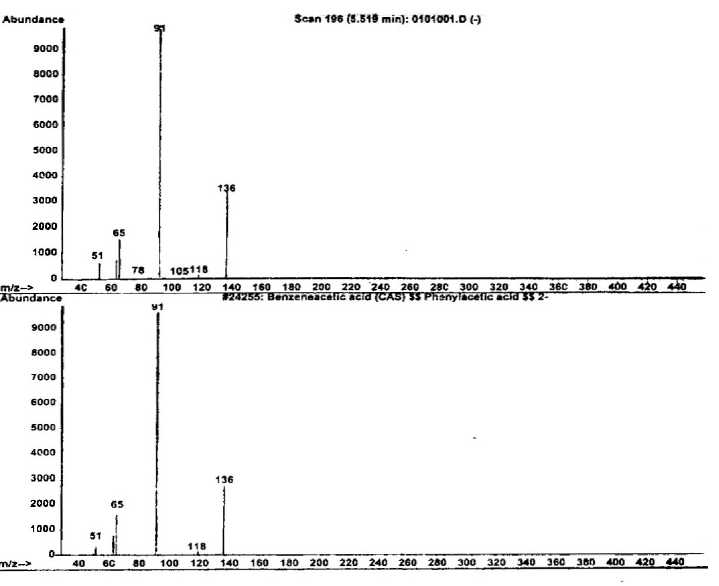
Gambar 2. Spektrum massa senyawa pada puncak 1 dan senyawa asam benzena asetat
Pola pemenggalan spektrum massa senyawa ini memperlihatkan adanya penggalan pada m/z 91 (puncak dasar) yang merupakan penggalan ion tripolium (C7H7+). Penggalan ini merupakan hasil pemecahan dan penataan ulang benzena (Silverstein, 1991). Dengan demikian adanya ion tripolium merupakan ciri khas adanya senyawa benzena. Ion pada m/z 91 ini juga kemungkinan merupakan pelepasan gugus asam (M+-COOH). Adanya penggalan pada m/z 65 merupakan penggalan hasil pelepasan gugus asetilen dari ion tripolium (Silverstein, 1991).
Berdasarkan data di atas dapat diindikasikan bahwa senyawa dari puncak 1 identik dengan asam benzena asetat (C8H8O2) dengan struktur molekul seperti Gambar 3.
HO

Gambar 3. Struktur molekul asam benzena asetat
Identifikasi Senyawa Dari Puncak 2 tR 26,092 menit (4,5%)
Spektrum massa senyawa dari puncak 2 dan spektrum massa senyawa yang identik (Wiley 275. L) yaitu dioktil heksadioat ditampilkan pada Gambar 4. Berdasarkan data dari library (Wiley 275. L) berat molekul senyawa dioktil heksadioat adalah 370. Oleh karena itu ion molekul
senyawa dari puncak 2 adalah m/z 370 dan puncak dasar pada m/z 129. Pola pemenggalan dari spektrum massa senyawa ini menunjukkan 2 kali pemenggalan gugus OR (M+ - C8H17O) pada rantai diester yaitu pada m/z 241 dan m/z 112. Penggalan pada m/z 129 yang merupakan puncak dasar adalah penggalan dioktil (C16H34O2).
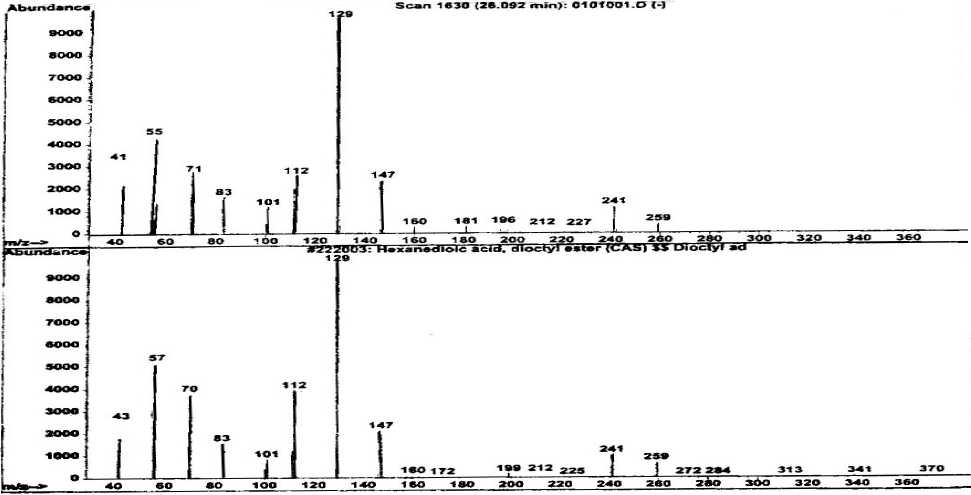
Gambar 4.Spektrum massa senyawa pada puncak 2 dan senyawa dioktil heksadioat
Dengan demikian berdasarkan hasil pemenggalan, dapat diindikasikan bahwa senyawa pada puncak 2 identik dengan dioktil heksadioat (C22H42O4) yang struktur molekulnya seperti Gambar 5.
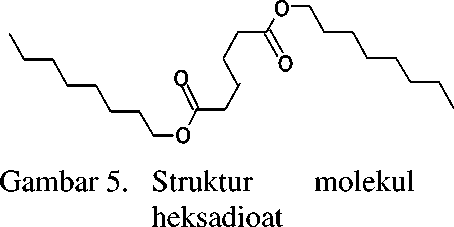
dioktil
Identifikasi Senyawa Dari Puncak 3 tR 28,832 menit (53,1%)
Spektrum massa senyawa dari puncak 3 dan spektrum massa senyawa yang identik (Wiley 275. L) yaitu bis (2-etilheksil) asam 1,2- benzenkarboksilat ditampilkan pada Gambar 6. Berdasarkan data dari library (Wiley 275. L) berat molekul senyawa bis (2-etilheksil) 1,2-benzenkarboksilat adalah 390. Oleh karena itu ion molekul senyawa dari puncak 3 adalah m/z 390 dan puncak dasar pada m/z 149.
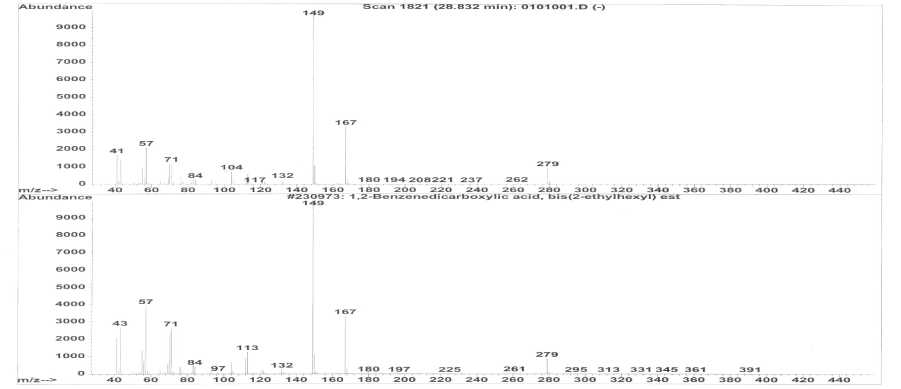
Gambar 6. Spektrum massa senyawa dari puncak 3 dan senyawa bis (2-etilheksil) 1,2-
benzenkarboksilat
Pola pemenggalan dari spektrum massa senyawa ini menunjukkan 2 kali pemenggalan gugus alkil yaitu pada m/z 279 dan m/z 167. Pemenggalan pada gugus alkil ini merupakan ciri khas dari ester aromatik (Silverstein, 1991). Pemenggalan pada m/z 149 merupakan puncak kuat yang ada pada semua ester asam ftalat (Silverstein, 1991).
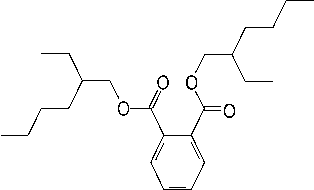
Gambar 7. Struktur molekul bis(2-
etilheksil)1,2- benzenkarboksilat
Dengan demikian berdasarkan pola pemenggalannya, dapat diindikasikan bahwa senyawa dari puncak 3 identik dengan bis (2-etilheksil) 1,2- benzenkarboksilat (C24H38O4) yang struktur molekulnya seperti Gambar 7.
Identifikasi Senyawa dari Puncak 4 tR 33.06 menit (17,1%)
Spektrum massa senyawa dari puncak 4 dan spektrum massa senyawa yang identik (Wiley 275. L) yaitu 2, 6, 10, 15, 19, 23 – heksametil 2, 6, 10, 14, 18, 22 -tetrakosaheksena ditampilkan pada Gambar 8. Pada spektrum tersebut terlihat adanya ion-ion pada m/z 410 (M+) dan puncak dasar pada m/z 69. Ion molekul pada m/z 410 mengindikasikan berat molekul 410

Gambar 8. Spektrum massa senyawa pada puncak 4 dan senyawa 2, 6, 10, 15, 19, 23 – heksametil 2, 6, 10, 14, 18, 22 - tetrakosaheksena
Pola pemenggalan dari spektrum massa senyawa pada puncak 4 menunjukkan adanya pemenggalan pada m/z 341 (M+ – C5H9). Selain itu adanya pemenggalan gugus C5H8 yang terjadi secara berurutan yaitu pada m/z 273, 205, 137 dan 69 mengindikasikan senyawa pada puncak 4 yaitu senyawa polimircen (Silverstein, 1991). Adanya ion-ion pada m/z 41, 55 dan 69 merupakan ciri khas terpenoid dengan rumus molekul CnH2n-1 dengan n = 3, 4 dan 5 (Silverstein,1991).
Berdasarkan pola pemenggalan di atas dapat diindikasikan bahwa senyawa pada puncak 4 identik dengan 2, 6, 10, 15, 19, 23 - heksametil 2, 6, 10, 14, 18, 22 – tetrakosaheksena (C30H50) dengan struktur molekul seperti pada Gambar 9. Indikasi ini didukung juga dengan hasil uji fitokimia fraksi II yang positif mengandung triterpenoid.

Gambar 7. Struktur molekul 2, 6, 10, 15, 19, 23 – heksametil 2, 6, 10, 14, 18, 22 –tetrakosaheksena
Identifikasi Senyawa Pada Puncak 5 tR 34,168 menit (7,8%)
Spektrum massa senyawa pada puncak 5 dan spektrum massa senyawa yang identik (Wiley 275. L) yaitu nonakosana ditampilkan pada Gambar 10. Pada spektrum tersebut terlihat adanya ion-ion pada m/z 408 (M+) dan puncak dasar pada m/z 57. Ion molekul pada m/z 408 mengindikasikan berat molekul 408.

Gambar 10. Spektrum massa senyawa pada puncak 5 dan senyawa nonakosana
Pola pemenggalan spektrum massa senyawa ini menunjukkan adanya penggalan pada m/z 351 yang merupakan pelepasan gugus butil ( M+ – C4H9). Selain itu juga terlihat pelepasan gugus metilen ( M+ – 14) secara berurutan yang merupakan ciri khas senyawa hidrokarbon jenuh (Silverstein, 1991).
Berdasarkan data di atas dapat diindikasikan bahwa senyawa pada puncak 5 identik dengan nonakosana (C29H60) dengan struktur molekul seperti pada Gambar 11.

Gambar 11. Struktur molekul nonakosana
Identifikasi Senyawa Dari Puncak 6 tR 36,33 menit (3,8%)
Spektrum massa senyawa pada puncak 6 dan spektrum massa senyawa yang identik (Wiley 275. L) yaitu kolest-5-en-3β-ol ditampilkan pada Gambar 12. Pada spektrum
tersebut terlihat adanya ion-ion pada m/z 386 (M+) dan puncak dasar pada m/z 43. Ion molekul pada m/z 386 mengindikasikan berat molekul 386.
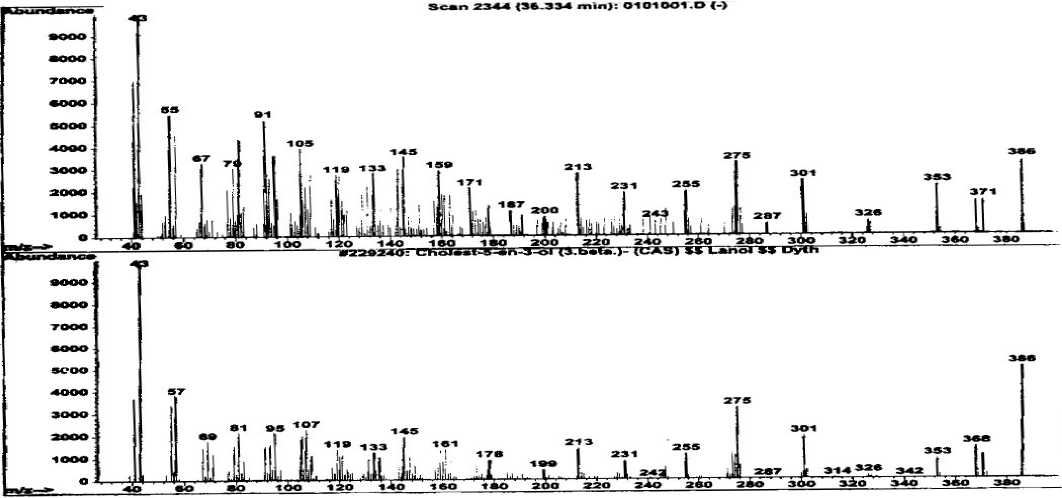
Gambar 12. Spektrum massa senyawa pada puncak 6 dan senyawa kolest-5-en-3β-ol
Pola pemenggalan dari spektrum massa senyawa ini menunjukkan adanya pelepasan molekul H2O yaitu pada m/z 353 (M+- CH3-H2O) mengindikasikan senyawa pada puncak 6 mengandung 1 gugus 3β hidroksi (Gold & Akihisa, 1997). Adanya penggalan pada m/z 301 (M+-85) dan m/z 275 (M+-111) umumnya mencirikan suatu turunan sterol dengan ikatan rangkap pada C-5 (Gold & Akihisa, 1997).
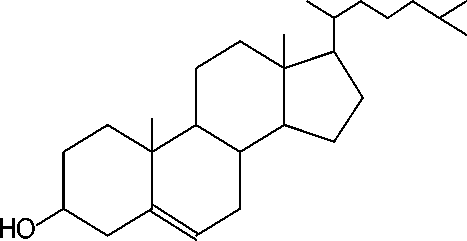
Berdasarkan data di atas dapat diindikasikan bahwa senyawa dari puncak 6 identik dengan kolesterol atau kolest-5-en-3β-ol (C27H46O) dengan struktur molekul ditampilkan pada Gambar 13.
Identifikasi Senyawa Dari Puncak 7 tR 36,73 menit (4,8%)
Spektrum massa senyawa dari puncak 7 dan spektrum massa senyawa yang identik (Wiley 275. L) yaitu eikosana ditampilkan pada Gambar 14. Pada spektrum tersebut terlihat adanya ion-ion pada m/z 282 (M+) dan puncak dasar pada m/z 57. Ion molekul pada m/z 282 mengindikasikan berat molekul 282. Berat molekul senyawa dari puncak 7 dibandingkan dengan berat molekul senyawa pada puncak 5 berselisih 126 satuan massa atom (sma). Selain itu pola pemenggalan senyawa dari puncak 7 mirip dengan pola pemenggalan senyawa dari puncak 5, sehingga senyawa dari puncak 7 diindikasikan suatu senyawa hidrokarbon jenuh yang berselisih (CH2)9 dengan senyawa dari puncak 5.
Gambar 13. Struktur molekul kolesterol
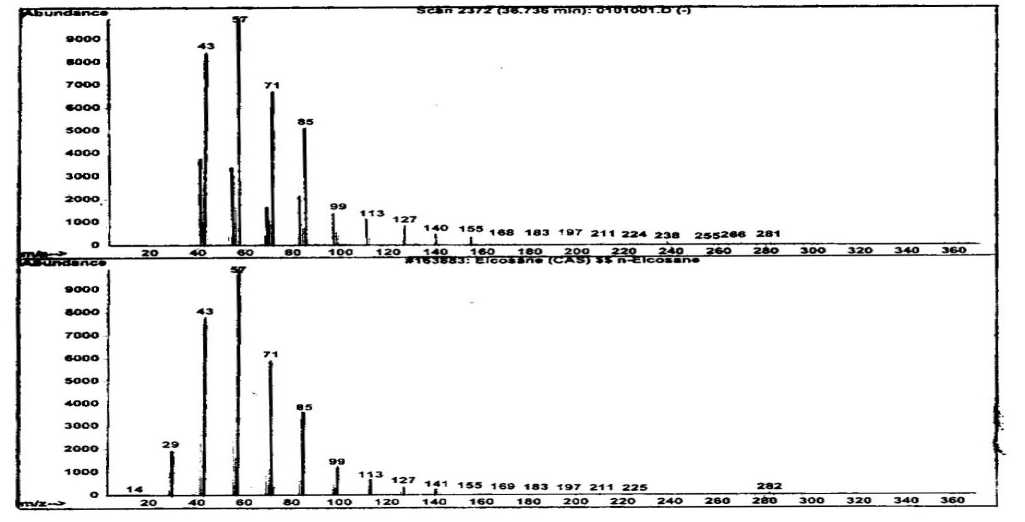
Gambar 14. Spektrum massa senyawa pada puncak 7 dan senyawa eikosana
Berdasarkan data di atas dapat diindikasikan bahwa senyawa dari puncak 7 identik dengan eikosana (C20H42) dengan struktur molekul seperti pada Gambar 15.
Gambar 15. Struktur molekul eikosana
SIMPULAN DAN SARAN
Simpulan
Dari hasil penelitian yang telah dilakukan diperoleh simpulan sebagai berikut :
-
1. Dari 10 spesies spons koleksi bagian P-3 TFM BPPT yang diskrining pada penelitian ini, spons SL2 mempunyai sifat toksik yang paling kuat terhadap Artemia salina Leach.
-
2. Fraksi paling toksik hasil isolasi spons SL2 terhadap larva A.salina dengan harga LC50 sebesar 100 ppm merupakan gabungan dari 7 senyawa yaitu asam benzen asetat (8,9%), dioktil heksadioat (4,5%), bis (2etilheksil) 1,2
benzenkarboksilat (53,1%), 2, 6, 10, 15, 19, 23 heksametil 2, 6, 10, 14, 18, 22 – tetrakosaheksena, (17,1%), nonakosana (7,8%), kolesterol (3,8%), dan eikosana (7,8%).
Saran
-
1. Sehubungan dengan sudah diketahuinya gabungan senyawa yang toksik terhadap A. salina maka perlu dilakukan pemisahan terhadap gabungan senyawa tersebut sehingga diperoleh senyawa tunggal yang toksik.
-
2. Perlu juga diteliti lebih lanjut senyawa yang bersifat toksik ini dengan menggunakan bioindikator lain seperti antimakan, antiradikal, dan antibakteri
UCAPAN TERIMA KASIH
Melalui kesempatan ini penulis mengucapkan terima kasih yang setulusnya kepada semua pihak yang telah mendukung penelitian ini terutama kepada Dr. Jana T. Anggadiredja, APU., dan staf di laboratorium TFM-BPPT.
DAFTAR PUSTAKA
Dahuri, R., 2003, Keanekaragaman Hayati Laut, Penerbit PT Gramedia Pustaka Utama, Jakarta.
Faulkner, D. J., 1994, Marine Natural Product, Natural Product Report Vol 10, p.497
Faulkner, D. J., 1993, Marine Natural Product, Natural Product Report, Vol 8, p.97.
Faulkner, D. J., 1992, Marine Natural Product, Natural Product Report, Vol 9, p.323.
Goad, L. J. & Akihisa, T., 1997, Analysis of Sterol, Blackie Academic &
Professional, London.
Lewis, J. R., 1994, Muscarine, Oxazole, Imidazole, Thiazole, and Peptides Alkaloid, and other Miscellaneous Alkaloid, Natural Product Report, Vol 11, p.395.
Rombang, W. A. R ; Rymond J. R ; Ponis T ; Anthony J. H ; dan Lewis N. M., Chemical Constituents of Indonesisn Marine Sponges:
Bisdemethylaaptamine, a
Napthyridine Alkaloid from Aaptos sp. Buletin of The Indonesian Society of Natural Products
Chemistry, Vol. 4, No. 1, January-june 2004, Himpunan Kimia Bahan Alam Indonesia.
Rosmiati dan Suryati, 2001, Isolasi Identifikasi dan Pengaruh Senyawa Bioaktif Spons Callyspongia pseudoreticulata terhadap Bakteri patogen dari Udang: Jurnal Bioteknologi Pertanian, Vol 6 no 1, Balai Penelitian Perikanan Pantai, Maros, Indonesia.
Silverstein, R.M., Bassler, GC. & Morril, T.C., 1991, Spectrometric
Identification of Organic Compound, John Willey & Sons, Inc., Singapore.
Sujatmiko, W., 2000, Inventarisasi Jenis Spon Disekitar Perairan Pulau Lombok dan Garam Di Pulau Sumbawa Nusa Tenggara Barat, Kerjasama : Yayasan Rinjani Bahari, Badan Pengkajian dan Penerapan Teknologi, Badan Perencanaan dan Pembangunan Propinsi Nusa Tenggara Barat.
Wahyono, S., 2003, Mencari Obat
Antikanker dari Spons Perairan Indonesia, http://www.pikiran-rakyat.com, 23 Mei 2003.
79
Discussion and feedback