UJI AKTIVITAS ANTIOKSIDAN SENYAWA FLAVONOID PADA KULIT BATANG TUMBUHAN GAYAM (Inocarpus fagiferus Fosb.)
on
ISSN 1907-9850
UJI AKTIVITAS ANTIOKSIDAN SENYAWA FLAVONOID PADA KULIT BATANG TUMBUHAN GAYAM (Inocarpus fagiferus Fosb.)
Made Hany Anastasia*, Sri Rahayu Santi, dan Manuntun Manurung
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran, Bali *E-mail : hany.anastasia@yahoo.com
ABSTRAK
Gayam (Inocarpus fagiferus Fosb.) merupakan tumbuhan tropis yang kulit batangnya telah dimanfaatkan sebagai obat tradisional. Penelitian ini dilakukan untuk mengetahui kemampuan senyawa flavonoid dalam menangkal radikal bebas dan mengidentifikasi golongan flavonoidnya. Ekstraksi 1000 g kulit batang gayam menggunakan etanol 96% menghasilkan ekstrak kental etanol sebanyak 30 g. Partisi 15 g ekstrak etanol-air (7:3) dengan menggunakan kloroform dan n-butanol menghasilkan berturut-turut 1,5 g ekstrak kental kloroform, 5,87 g ekstrak kental n-butanol dan 5,63 g ekstrak air. Uji flavonoid dengan pereaksi Wilstatter dan Bate-Smith Matcalf menunjukkan bahwa ekstrak n-butanol dan ekstrak air positif mengandung flavonoid. Aktivitas antioksidan flavonoid tersebut diuji dengan metode DPPH dan metode lipid peroksida ammonium tiosianat menunjukkan bahwa ekstrak n-butanol memiliki aktivitas sebagai antioksidan dengan nilai IC50 sebesar 24 ppm dan ekstrak n-butanol memiliki kemampuan dalam menghambat terbentuknya lipid peroksida dengan daya hambat sebesar 63,04 %. Pemisahan ekstrak n-butanol menggunakan kromatografi lapis tipis (KLT) preparatif dengan fase gerak kloroform dan fase diam silika gel GF254 menghasilkan 4 fraksi dan uji flavonoid menunjukkan hanya fraksi F3 saja yang positif mengandung flavonoid. Analisis dengan FTIR menunjukkan isolat mengandung gugus fungsi -OH, C=O, CO alkohol, C=C aromatik, CH aromatik dan CH alifatik. Hasil analisis dengan spektrofotometer UV-visible mengidentifikasi bahwa isolat memiliki serapan maksimum pada panjang 310,60 nm serta 261 nm yang diduga merupakan serapan dari senyawa flavonoid golongan isoflavon dan diperkirakan mempunyai gugus hidroksi pada atom C-5 dan C-7. Uji aktivitas antioksidan menunjukkan isolat flavonoid mampu meredam radikal bebas DPPH dengan nilai IC50 sebesar 1 ppm.
Kata kunci : Gayam, flavonoid, antioksidan
ABSTRACT
Gayam (Inocarpus fagiferus Fosb) is a tropical plant whose stem bark has been used as traditional medicine. This research aims to identify the flavonoides isolate from stem bark of gayam and identify the class of flavonoids compound as antioxidant. Extraction of 1000 g stem bark powder with 8500 mL of 96 % ethanol to yield 30 g concentrated ethanol extract. Partition of 15 g extract ethanol-water (7:3) with chloroform and n-buthanol to yield 1,5 g concentrated chloroform extract, 5,87 g concentrated n-buthanol extract and 5,63 g concentrated water extract. The flavonoids test using Wilstatter and Bate-Smith Matcalf reagent showed that n-buthanol and water extract contain flavonoids compounds. Antioxidant activity of flavonoids tested with DPPH method and lipid peroxide ammonium thiocyanate method showed that n-buthanol extract had antioxidant activity with IC50 of 24 ppm and n-buthanol extract has ability to inhibit the formation of lipid peroxide with inhibition value of 63,04 %. Separation of n-buthanol extract using thin layer chromatography preparative with chloroform as mobile phase and silica gel GF254 as stationary phase obtained four fractions. Flavonoids test showed that fraction F3 contained flavonoids compounds. FTIR analysis indicated that isolate had functional groups such as -OH , C=O, C-O alcohol, C=C aromatic, C-H aromatic and C-H aliphatic. UV-vis spectra showed 2 peaks at λ 310 nm and 261 nm which indicated flavonoids group of isolfavone with hydroxyl groups at C-5 and C-7. Antioxidant activity test with DPPH method showed that the isolate had antioxidant activity with IC50 of 1 ppm.
Keywords : Gayam, flavonoids, antioxidant
PENDAHULUAN
Indonesia merupakan Negara tropis dengan keanekaragaman hayati yang melimpah. Tanaman yang tumbuh di daerah ini merupakan sumber dari bahan-bahan kimia alami yang diketahui berpotensi sebagai obat dan sebagian telah dimanfaatkan sebagai obat tradisional.
Bahan-bahan kimia alami yang terkandung di dalam tumbuhan dapat berupa metabolit primer dan sekunder. Metabolit primer merupakan senyawa yang dihasilkan oleh tanaman yang berperan sebagai sumber kelangsungan hidup tanaman tersebut. Contoh dari senyawa metabolit primer yaitu karbohidrat, protein, lipid dan asam nukleat, sedangkan metabolit sekunder merupakan senyawa organik yang dihasilkan dari biosintesis metabolit primer dan dapat memberikan efek fisiologis terhadap mahkluk hidup. Salah satu senyawa metabolit sekunder yang terdapat pada tumbuhan adalah flavonoid. Flavonoid merupakan senyawa golongan fenol terbesar di alam dengan struktur dasar yang terdiri dari 15 atom karbon membentuk susunan C6-C3-C6 yaitu dua cincin aromatik yang dihubungkan dengan tiga atom karbon yang dapat atau tidak membentuk cincin ketiga. Senyawa ini di alam tersebar pada tumbuhan tingkat tinggi (Angiospermae) khususnya pada famili lilinacea, moraceae, astaceae dan leguminosae (Markham, 1988).
Senyawa-senyawa golongan flavonoid diketahui memiliki berbagai aktivitas fisiologis antara lain sebagai antibakteri, antiinflamasi, antibiotik, antiinsektisida, antialergi dan antioksidan (Harborne, 1987). Antioksidan adalah senyawa yang memiliki kemampuan dalam menghambat reaksi oksidasi yang disebabkan dari suatu radikal bebas. Antioksidan akan bereaksi dengan radikal bebas dan membentuk suatu senyawa yang tidak reaktif dan stabil. Keaktifan senyawa flavonoid sebagai antioksidan dipengaruhi oleh adanya gugus hidroksi dan gugus 4-oxo pada kerangka flavonoid (Robak and Gryglewski, 1998).
Berdasarkan uji pendahuluan terhadap ekstrak etanol kulit batang gayam menunjukkan bahwa ekstrak etanol kulit batang gayam mengandung senyawa flavonoid serta mempunyai aktivitas sebagai antioksidan dengan nilai IC50 sebesar 70 ppm. Kandungan senyawa flavonoid
pada ekstrak etanol kulit batang gayam dan kemampuannya dalam menangkal radikal bebas menyebabkan dilakukan penelitian ini dengan mengisolasi, mengidentifikasi dan menguji aktivitas antioksidan senyawa flavonoid yang terkandung pada kulit batang gayam.
MATERI DAN METODE
Bahan
Bahan yang digunakan untuk penelitian ini adalah kulit batang gayam, etanol, kloroform, n-butanol, silika gel GF254 untuk kromatografi lapis tipis preparatif, difenilpikril hidrazil (DPPH), tween 20, asam linoleat, amonium tiosianat, FeCl2, akuades, NaOH, CH3COONa, H3BO3, AlCl3, HCl, H2SO4, KBr dan serbuk Mg.
Peralatan
Peralatan yang digunakan dalam penelitian ini yaitu pisau, gunting, blander, ayakan, erlenmeyer, gelas beker, neraca analitik, batang pengaduk, labu ukur, pipet volume, pipet tetes, pipet mikro, kertas saring, aluminium foil, tabung reaksi, corong gelas, corong pisah, penguap putar vakum (rotary vacum evaporator), lampu UV, seperangkat alat kromatografi lapis tipis (KLT), kromatografi lapis tipis (KLT) Preparatif, seperangkat alat spektrofotometer UV-vis dan spektrofotometer FTIR.
Cara Kerja
Isolasi dan Identifikasi Senyawa Flavonoid Kulit Batang Gayam
Maserasi 1000 g serbuk kering kulit batang gayam dengan menggunakan sebanyak 1700 mL etanol 96% selama ± 24 jam. Filtrat yang diperoleh disaring dan ampasnya kembali dimaserasi dengan menggunakan etanol 96% dilakukan sebanyak 5 kali pengulangan. Filtrat yang diperoleh digabungkan dan pelarutnya diuapkan menggunakan penguap putar vakum sehingga diperoleh ekstrak kental etanol (Harbone, 1987). Ekstrak kental etanol dilarutkan dengan campuran etanol-air (7:3) kemudian etanol yang terdapat pada campuran diuapkan sehingga diperoleh ekstrak air. Ekstrak air ini selanjutnya dipartisi menggunakan kloroform, sehingga diperoleh ekstrak kloroform dan ekstrak air.
Ekstrak air yang diperoleh kembali dipartisi menggunakan n-butanol. Partisi dengan menggunakan kloroform bertujuan untuk mengikat senyawa yang bersifat semi polar yang terkandung di dalam ekstrak air dan pelarut n-butanol digunakan untuk mengikat senyawa yang bersifat polar. Proses partisi ini menghasilkan tiga ekstrak yaitu ekstrak kloroform, n-butanol dan air. Masing-masing ekstrak yang diperoleh selanjutnya diuapkan, ditimbang dan diuji flavonoid dengan menggunakan pereaksi Wilstatter dan pereaksi Bate-Smith Matcalf serta diuji aktivitas antioksidannya. Ekstrak yang positif mengandung flavonoid dan bersifat aktif sebagai antioksidan selanjutnya dipisahkan dan dimurnikan dengan teknik kromatografi lapis tipis preparatif. Fraksi yang diperoleh dari proses pemisahan secara kromatografi lapis tipis preparatif selanjutnya diuji flavonoid dan diuji kemurnian dengan teknik kromatografi lapis tipis. Fraksi (Isolat flavonoid) yang relatif murni secara KLT kemudian dianalisis menggunakan FTIR dan UV-vis, serta diuji aktivitas antioksidannya.
Uji Aktivitas Antioksidan
Metode DPPH
Uji aktivitas antioksidan pada ekstrak dilakukan dengan membuat larutan induk sampel 1000 ppm dengan menimbang 50 mg ekstrak yang kemudian dimasukan ke dalam labu ukur dan ditambahkan etanol hingga tanda batas. Larutan sampel dengan konsentrasi 20, 40, 60, 100, 200 dan 500 ppm dibuat dengan mengambil larutan induk sampel sebanyak 200 µL, 400 µL, 600 µL, 2000 µL dan 5000 µL. Sedangkan uji aktivitas antioksidan pada isolat dilakukkan dengan membuat larutan induk sampel 100 ppm dengan menimbang sebanyak 1 mg isolat yang selanjutnya dimasukan ke dalam labu ukur 10 mL, kemudian ditambahkan etanol p.a hingga tanda batas. Larutan sampel 2, 4,6 dan 8 ppm dibuat dengan mengambil larutan induk sebanyak 200 μL, 400
μL, 600 μL dan 800 μL yang kemudian dimasukkan ke dalam labu ukur 10 mL. Larutan sampel pada ekstrak dan isolat dengan berbagai konsentrasi yang akan dibuat dimasukkan ke dalam labu ukur 10 mL. Ke labu ukur masing-masing ditambahkan 2 mL larutan DPPH 1 mM dan diencerkan dengan etanol sampai tanda batas. Campuran tersebut dikocok hingga homogen kemudian dimasukan ke dalam wadah gelap dan didiamkan selama kurang lebih 30 menit. Pengukuran serapan DPPH menggunakan spektrofotometer UV-vis dilakukan pada panjang gelombang 517 nm.
Metode Lipid Peroksida Amonium Tiosianat
Sebanyak 1 mg/ mL sampel dalam etanol 99,5 % dilarutkan dalam 4,1 mL emulsi asam linoleat, 8 mL buffer fosfat 0,02 M pH 7,8 dan 7,9 mL air. Campuran tersebut selanjutnya diinkubasi pada suhu 40oC selama ± 30 menit. Sebanyak 0,1 mL campuran ditambahkan 9,7 mL ammonium tiosianat 75 %, 0,1 mL ammonium tiosianat 30% dan 0,1 mL FeCl2 0,02 M dalam HCl 3,5 %. Tingkat peroksida dari ekstrak ditentukan dengan mengukur serapannya pada panjang gelombang 500 nm.
HASIL DAN PEMBAHASAN
Isolasi dan Identifikasi Senyawa Flavonoid
Maserasi 1000 g serbuk kulit batang gayam dengan 8500 mL etanol 96% (5x1700 mL) menghasilkan ekstrak kental etanol sebanyak 30 g yang berwarna cokelat kekuningan. Sebanyak 15 g ekstrak etanol-air (7:3) dipartisi dengan menggunakan kloroform dan n-butanol. Hasil partisi mengahasilkan 1,5 g ekstrak kental kloroform, 5,87 g ekstrak kental n-butanol dan 5,63 g ekstrak kental air. Masing-masing ekstrak kental kemudian diuji kandungan flavonoid dengan pereaksi Wilstatter dan pereaksi Bate-Smith Matcalf.
Tabel 1. Hasil Uji Flavonoid Ekstrak Hasil Partisi
|
Fraksi Pekat |
Pereaksi |
Perubahan Warna |
Keterangan |
|
Kloroform |
Mg-HCl |
Kuning menjadi kuning bening |
- Flavonoid |
|
H2SO4 |
Kuning menjadi kuning bening |
- Flavonoid | |
|
n-butanol |
Mg-HCl |
Kuning menjadi jingga |
+ Flavonoid |
|
H2SO4 |
Kuning menjadi jingga kemerahan |
+ Flavonoid | |
|
Akuades |
Mg-HCl |
Jingga menjadi merah marun |
+ Flavonoid |
|
H2SO4 |
Jingga menjadi merah bata |
+ Flavonoid |
Hasil uji flavonoid disajikan pada Tabel 1 yang menunjukkan bahwa ekstrak n-butanol dan ekstrak air positif mengandung senyawa flavonoid, sedangkan pada ekstrak kloroform tidak mengandung senyawa flavonoid yang ditandai dengan tidak adanya perubahan warna yang spesifik ketika direaksikan dengan pereaksi flavonoid dan menunjukkan bahwa pada ekstrak kloroform tidak melarutkan flavonoid bebas (Markham,1988).
Ekstrak n-butanol dan air selanjutnya diuji aktivitas antioksidannya dengan metode DPPH. Hasil pengujian aktivitas antioksidan dengan metode DPPH menunjukkan bahwa pada ekstrak n-butanol dan air memiliki aktivitas sebagai antioksidan dengan nilai IC50 yang sama yaitu sebesar 24 ppm, sehingga dilakukkan pengujian antioksidan dengan menggunakan metode lipid peroksida ammonium tiosianat untuk mengetahui kemampuan ekstrak dalam menghambat terbentuknya lipid peroksida dan hasil pengujian menunjukkan bahwa ekstrak n-butanol memiliki nilai daya hambat yang lebih besar dibandingkan dengan ekstrak air dan kontrol positif (Vitamin E), sehingga ekstrak n-butanol dilanjutkan untuk dipisahkan dan dimurnikan dengan menggunakan KLT Preparatif. Hasil perhitungan persen (%) daya hambat ditunjukkan pada Tabel 2.
Tabel 2. Hasil Daya Hambat Pembentukan Lipid Peroksida
|
Ekstrak |
Absorbansi Da |
ya Hambat (%) |
|
Kontrol negatif |
0,771 |
- |
|
Kontrol positif |
0,377 |
51,10 |
|
n-butanol |
0,285 |
63,04 |
|
Air |
0,703 |
8,82 |
|
Tabel 3. Hasil |
Pemisahan Ekstrak n-butanol | |
|
dengan KLT Preparatif | ||
|
Fraksi Berat (F) (g) |
Warna Noda |
Harga Rf |
|
F1 0,12 |
Kuning kehijauan |
0,25 |
|
F2 0,14 |
Kuning |
0,68 |
|
F3 0,13 |
Biru |
0,81 |
|
F4 0,11 |
Kuning kehijauan |
0,75 |
Pemisahan komponen dalam ekstrak n-butanol dilakukan dengan menggunakan KLT preparatif dengan fase gerak kloroform dan fase diam silika gel GF254. Hasil pemisahan ekstrak n-butanol menghasilkan 4 fraksi dan hasil pemisahan ditunjukkan pada Tabel 3.
Keempat Fraksi yang diperoleh selanjutnya diuji flavonoid dengan pereaksi Wilstatter dan pereaksi Bate-Smith Matcalf. Hasil pengujian flavonoid ditunjukkan pada Tabel 4 yang menunjukkan bahwa fraksi F3 positif mengandung flavonoid dengan dugaan senyawa flavonoid golongan isoflavon. Menurut Geissman (1962) karakteristik dari senyawa isoflavon secara kualitatif ditunjukkan dengan terjadinya perubahan warna menjadi kuning dengan pereaksi Wilstatter maupun Bate-Smith Matcalf (Markham, 1988).
Fraksi F3 selanjutnya diuji kemurniannya secara KLT menggunakan beberapa fase gerak seperti klororform, etanol, kloroform : n-heksana (1:1) dan kloroform : n-heksana (1:3). Berdasarkan hasil uji kemurnian fraksi F3 menunjukkan noda tunggal yang menandakan fraksi F3 sudah relatif murni secara KLT, sehingga fraksi F3 dilanjutkan untuk diidentifikasi menggunakan FTIR dan UV-vis.
Spektrum inframerah isolat (Fraksi F3) ditunjukkan pada Gambar 1 yang menunjukkan adanya vibrasi ulur gugus –OH terikat dengan bentuk pita melebar pada bilangan gelombang 3356,14 cm-1 dan dugaan didukung dengan adanya serapan C-O alkohol pada bilangan gelombang 1242,16 cm-1. Serapan sangat lemah pada bilangan gelombang 3003,17 cm-1 diduga merupakan serapan dari C-H aromatik, dugaan didukung dengan munculnya serapan C-H aromatik keluar bidang yang muncul pada bilangan gelombang 877,61 cm-1. Serapan tajam pada bilangan gelombang 2924,09 cm-1 dan 2852,72 cm-1 menunjukkan serapan dari C-H alifatik, dugaan didukung dengan adanya serapan tajam pada bilangan gelombang 1377,17 cm-1 dan 1454,33 cm-1. Terdapatnya cincin aromatik pada isolat ditandai dengan adanya serapan C=C aromatik pada bilangan gelombang 1614,42 cm-1. Serapan yang mengidentifikasikan adanya gugus C=O pada isolat muncul pada bilangan gelombang 1737,86 cm-1 (Silverstein et al., 1991)
Tabel 4. Hasil Uji Flavonoid Pada Fraksi Hasil KLT Preparatif
|
Fraksi |
Pereaksi |
Perubahan Warna |
Keterangan |
Dugaan Golongan Senyawa Flavonoid |
|
F1 |
Mg-HCl H2SO4 |
Kuning kehijauan menjadi hijau Kuning kehijauan menjadi kuning |
- Flavonoid - Flavonoid |
- |
|
F2 |
Mg-HCl H2SO4 |
Tidak terjadi perubahan warna Tidak terjadi perubahan warna |
- Flavonoid - Flavonoid |
- |
|
F3 |
Mg-HCl H2SO4 |
Tidak berwarna menjadi kuning Tidak berwarna menjadi kuning |
+ Flavonoid + Flavonoid |
Isoflavon |
|
F4 |
Mg-HCl H2SO4 |
Kuning menjadi tidak berwarna Kuning menjadi kuning kehijauan |
- Flavonoid - Flavonoid |
- |
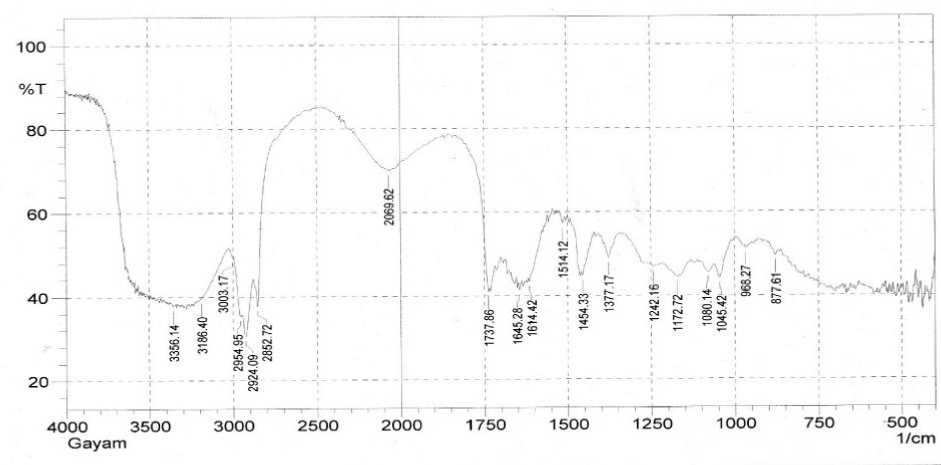
Gambar 1. Spektrum Inframerah dari Isolat F3
Spektra UV-vis isolat dipaparkan pada Gambar 2 yang menunjukkan bahwa isolat memiliki serapan pada panjang gelombang 261 nm yang merupakan pita II dan serapan dengan bentuk bahu pada panjang gelombang 310,60 nm yang merupakan pita I. Hasil identifikasi menggunakan FTIR dan UV-vis memperkuat dugaan bahwa isolat merupakan flavonoid golongan isoflavon karena flavonoid golongan isoflavon memberikan rentangan serapan pada panjang gelombang 245275 nm pada pita II dan 310-330 nm pada pita I, serta senyawa isoflavon pada kerangka dasarnya memiliki gugus fungsi C=C aromatik, C-H aromatik dan gugus C=O (Markham, 1988)
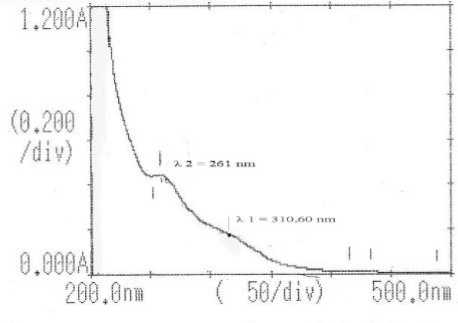
Gambar 2. Spektra UV-vis dari Isolat Flavonoid
Tabel 5. Data Panjang Gelombang dan Pergeseran Panjang Gelombang Isolat F3 Setelah Ditambahkan Pereaksi Geser
|
Pereaksi Geser |
Panjang gelombang λmaks (nm) |
Geseran Panjang gelombang λmaks (nm) | ||
|
Pita I |
Pita II |
Pita I |
Pita II | |
|
Etanol |
310,60 |
261 |
- |
- |
|
Etanol + NaOH |
330,60 |
269,40 |
+20 |
+ 8,4 |
|
Etanol + NaOH (5 menit) |
330,60 |
269,40 |
+ 20 |
+ 8,4 |
|
Etanol + NaOAc |
295,60 |
263 |
-15 |
+2 |
|
Etanol +NaOAc + H3BO3 |
301 |
260,20 |
-9,6 |
-0,8 |
|
Etanol + AlCl3 |
293,20 |
266,20 |
-17,4 |
+5,2 |
|
Etanol + AlCl3 + HCl |
301,80 |
267,00 |
-8,8 |
+6 |
Pola oksigenasi dari senyawa flavonoid yaitu dugaan letak gugus hidroksi (OH) bebas pada kerangka isoflavon dapat ditentukan dengan penambahan pereaksi geser seperti NaOH, NaOAc, NaOAc/H3BO3, AlCl3, AlCl3/HCl. Data pergeseran panjang gelombang setelah penambahan pereaksi geser ditunjukkan pada Tabel 5.
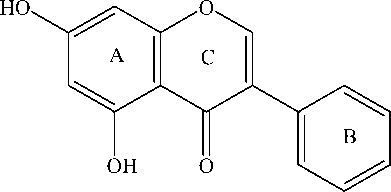
Tabel 5 menunjukkan bahwa pada pita I dan pita II mengalami pergeseran batokromik ketika di reaksikan dengan pereaksi geser NaOH.Terjadinya pergeseran batokromik pada pita I dan pita II setelah ditambahkan pereaksi geser NaOH menunjukkan kemungkinan adanya gugus OH pada cincin A dan cincin B. Pergeseran batokromik terjadi pada pita II setelah penambahan pereaksi geser NaOAc yang menandakan kemungkinan adanya gugus OH pada C-7, pergeseran hipsokromik pada pita II setelah penambahan pereaksi geser NaOAc/ H3BO3 menandakan tidak terdapatnya gugus orto dihidroksi baik pada cincin A maupun cincin B. Pergeseran batokromik pada pita II terjadi setelah penambahan pereaksi geser AlCl3 yang menandakan bahwa terdapat gugus OH pada C-5 yang membentuk kompleks dengan gugus keto dan AlCl3. Pergeseran batokromik setelah penambahan AlCl3/HCl menandakan tidak terdapatnya gugus orto dihidroksi pada cincin A. Pergeseran hipsokromik terjadi pada pita I setelah penambahan pereaksi geser AlCl3 dan AlCl3/HCl yang menandakan tidak terdapatnya gugus orto dihidroksi pada atom C-4’, C-5’ dan orto
dihidroksi pada cincin B, sehingga dugaan kerangka dasar senyawa flavonoid seperti ditunjukkan pada Gambar 3.
OH
Gambar 3. Dugaan Struktur Senyawa Flavonoid Isolat
Uji Aktivitas Antioksidan isolat dengan Metode DPPH
Uji aktivitas antioksidan pada isolat dilakukan untuk mengetahui kemampuan isolat dalam meredam radikal DPPH yang ditandai dengan terjadinya perubahan warna ungu menjadi kuning yang terukur pada panjang gelombang 517 nm. Data pengukuran dan perhitungan persen (%) peredaman radikal bebas DPPH ditunjukkan pada Tabel 6. Parameter yang digunakan untuk menunjukkan aktivitas antioksidan adalah Inhibitor Consentration (IC50) yang merupakan nilai yang menggambarkan kemampuan isolat dalam meredam radikal bebas sebesar 50%. Hasil pengujian aktivitas antioksidan isolat ditunjukkan pada Tabel 6 dan Gambar 4.
Tabel 6. Data Absorbansi Dan Perhitungan Persen (%) Peredaman Radikal Bebas
|
Konsentrasi (ppm) |
Absorbansi (A) |
% Peredaman radikal bebas |
Rata-rata % peredaman radikal bebas |
|
0,6971 | |||
|
Kontrol |
0,6971 |
- |
- |
|
0,6970 | |||
|
0,0739 |
89,39 | ||
|
2 |
0,0738 |
89,41 |
89,40 |
|
0,0738 |
89,41 | ||
|
0,0411 |
94,10 | ||
|
4 |
0,0410 |
94,10 |
94,10 |
|
0,0410 |
94,10 | ||
|
0,0396 |
94,31 | ||
|
6 |
0,0397 |
94,31 |
94,45 |
|
0,0413 |
94,75 | ||
|
0,0114 |
98,36 | ||
|
8 |
0,0112 |
98,30 |
98,32 |
|
0,0114 |
98,30 |
Gambar 4 menunjukkan bahwa isolat memiliki aktivitas sebagai antioksidan dan memiliki nilai IC50 sebesar 1 ppm. Nilai IC50 yang kecil menunjukkan bahwa isolat memiliki efektivitas sebagai penangkap radikal bebas yang baik, yang dipengaruhi oleh adanya gugus hidroksi dan gugus 4-oxo pada kerangka flavonoid (Cheng, 1973; Robak and Gryglewski,1998).
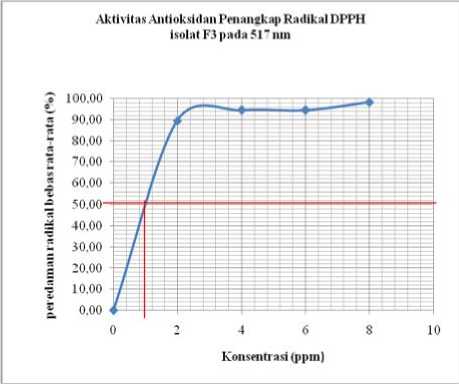
Gambar 4. Grafik Hubungan Antara Konsentrasi Isolat dengan Aktivitas Peredaman Radikal Bebas Rata-Rata
SIMPULAN DAN SARAN
Simpulan
Berdasarkan penelitian yang telah dilakukan dapat disimpulkan bahwa isolat flavonoid kulit batang gayam memiliki aktivitas sebagai antioksidan dan dugaan golongan senyawa flavonoid yang terkandung dalam isolat adalah isoflavon.
Saran
Berdasarkan hasil penelitian, maka dapat disarankan agar dilakukan pemisahan lebih lanjut pada ekstrak air kulit batang gayam karena ekstrak tersebut mengandung senyawa flavonoid dan memiliki aktivitas antioksidan dengan nilai IC50 sebesar 24 ppm.
UCAPAN TERIMA KASIH
Melalui kesempatan ini penulis meng-ucapan terima kasih kepada bapak Drs. Made Arsa, M.Si., ibu Dr. Dra. Ni Made Suaniti, M.Si. dan ibu Ni Luh Rustini, S.Si., M.Si. atas saran dan masukannya
DAFTAR PUSTAKA
Cheng, Y. and Prusoff, W. H., 1973, Relationship Between The Inhibition Constant (KI) And The Concentration Of Inhibitor Which Causes 50 Per Cent Inhibition (IC50) Of An Enzymatic Reaction, Biochem Pharmacol, 22 :
Geissman, T. A., 1962, The Chemistry Of Flavonoid Compounds,
<http://onlinelibrary.wiley.com/>, 26 Agustus 2014
Harbone, J. B., 1987, Metode Fitokimia : Penuntun cara Modern Menganalisa Tumbuhan,
edisi Kedua, a.b. Fadmawinata, K. dan Soediro, I., ITB, Bandung
Mabry, T. J., Markham, KR and Thomas, MB., 1970. The Systematic Identification of Flavonoids, New York, Springer, Verlag
Markham, K. R., 1988, Cara Mengidentifikasi Flavonoid, a.b. Kosasih Padmawinata, ITB, Bandung : 1-103
Robak, J. and Gryglewski, R. J., 1998, Flavonoids are Scavengers of Superoxide Anions, Biochem Pharmacol, 37 : 837-841
Silverstain, R. M., Basler, G. C., and Morill, T. C., 1981, Spektrometric Identification of Organic Compound, Jhon Willey & Sons, Inc., Singapore
22
Discussion and feedback