PERBANDINGAN AKTIVITAS SPESIFIK EKSTRAK KASAR ENZIM BROMELIN BUAH NANAS YANG DIISOLASI DENGAN BEBERAPA JENIS GARAM PENGENDAP
on
ISSN 1907-9850
PERBANDINGAN AKTIVITAS SPESIFIK EKSTRAK KASAR ENZIM BROMELIN BUAH NANAS YANG DIISOLASI DENGAN BEBERAPA JENIS GARAM PENGENDAP
I. A. Preharsini Kusuma, A. A. I. A. M. Laksmiwati, Made Arsa, dan Ketut Ratnayani
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran, Bali Email : preharsinik@gmail.com
ABSTRAK
Telah dilakukan penelitian yang bertujuan untuk mengetahui perbandingan aktivitas spesifik (kemurnian) enzim bromelin ekstrak kasar buah nanas (varietas Queen) dengan metode salting out yang menggunakan tiga jenis garam, diantaranya (NH4)2SO4, NaCl, dan garam tradisional Kusamba (Bali). Ekstrak kasar enzim bromelin diperoleh dengan metode pengendapan oleh garam dengan tingkat kejenuhan yang berbeda. Penentuan aktivitas spesifik ekstrak kasar tersebut meliputi penentuan konsentrasi protein total dengan metode Biuret dan pengujian aktivitas protease dengan metode Anson. Hasil penelitian menunjukkan bahwa aktivitas spesifik tertinggi hasil salting out (NH4)2SO4, NaCl dan garam tradisional Kusamba secara berturut-turut sebagai berikut : 0,2887 U/mg (pada kejenuhan 20%); 0,2705 U/mg (pada kejenuhan 40%); dan 0,1623 U/mg (pada kejenuhan 80%) dengan perbandingan 1 : 0,94 : 0,56. Hasil fraksinasi dengan kedua garam tersebut memiliki nilai aktivitas spesifik yang lebih rendah dibandingkan (NH4)2SO4, diduga disebabkan oleh kekuatan ion yang lebih rendah pada NaCl dan kehadiran ion-ion lain pada garam tradisional Kusamba serta kelarutan enzim bromelin yang berbeda-beda pada jenis garam tertentu. Namun, perbandingan NaCl yang mendekati (NH4)2SO4 dan ketersediaan garam tradisional Kusamba yang melimpah dapat menjadi alternatif pengganti (NH4)2SO4 dalam fraksinasi enzim bromelin dari ekstrak kasar buah nanas.
Kata kunci : buah nanas, enzim bromelin, salting out, aktivitas spesifik
ABSTRACT
The aim of this research was to find specific activity of bromelain enzyme extracted from crude extract of pineapple fruit (Queen variety) by salting out method using three different salts, which were (NH4)2SO4, NaCl, and Kusamba traditional salt. Crude extract of bromelain enzyme was obtained by precipitation method using salt with different levels of saturation. This study included determination of total protein concentration by using Biuret method and protease activity by using Anson method to get the specific activities of the crude extract. The results showed that the highest specific activities of bromelain enzymes precipitated with the three salts (NH4)2SO4, NaCl and Kusamba traditional salt with the ratio of 1: 0.94: 0.56 were 0.2887 U/mg (at 20% saturation) ; 0.2705 U/mg (at 40% saturation) and 0.1623 U/mg (at 80% saturation). Fractination of enzyme with the NaCl and Kusamba traditional salt gave smaller specific activity value than (NH4)2SO4. This results may caused of NaCl had smaller ionic strength, the presence of other ions in Kusamba traditional salt and the different solubility of bromelain enzyme in different salts. However, due to the ratio of NaCl approached (NH4)2SO4 and the availability of Kusamba traditional salt they could be used as alternative salts to replace (NH4)2SO4 in fractination bromelain enzyme from crude extract of pineapple fruit
Keywords : pineapple fruit, bromelain enzyme, salting out, specific activity
PENDAHULUAN
Tanaman nanas (Ananas comosus L.Merr) merupakan tanaman yang tumbuh pada iklim
tropis, seperti di Indonesia. Tanaman nanas mengandung enzim protease yang disebut enzim bromelin. Pemanfaatan enzim bromelin dapat diterapkan pada bidang medis yakni digunakan
sebagai agen anti-inflamasi pada inflamasi akut dan luka bakar. Pada bidang industri, pemanfaatan enzim bromelin meliputi industri pangan, industri tekstil, dan industri kosmetik (Bala et al., 2012). Penggunaan enzim bromelin pada berbagai industri menjadi alasan diperlukannya suatu metode untuk memperoleh enzim bromelin secara sederhana sehingga dapat diperoleh enzim bromelin yang bernilai ekonomis serta memilki aktivitas yang tinggi.
Tingkat kemurnian atau jumlah enzim bromelin dapat diketahui melalui penentuan aktivitas spesifik. Aktivitas spesifik dinyatakan dalam unit aktivitas enzim per miligram protein total (U/mg) (Halkerston, 2012). Metode isolasi enzim merupakan tahapan penting dalam memperoleh enzim dari sumbernya. Metode salting out lebih stabil terhadap isolat dibandingkan metode isolasi berdasarkan kelarutan lainnya, serta prosesnya lebih mudah dan sederhana.
Berdasarkan pada potensi garam sebagai pengendap protein, maka perlu dilakukan perbandingan aktivitas spesifik enzim bromelin buah nanas dengan teknik isolasi yang sederhana dan ekonomis menggunakan beberapa jenis garam. Garam yang digunakan antara lain (NH4)2SO4, NaCl dan garam tradisional Kusamba. Penentuan aktivitas spesifik ekstrak kasar tersebut meliputi penentuan konsentrasi protein total dengan metode Biuret dan pengujian aktivitas protease dengan metode Anson.
MATERI DAN METODE
Bahan
Bahan-bahan yang digunakan antara lain : buah nanas (varietas Queen), garam tradisional Kusamba yang diperoleh dari Desa Kusamba, Klungkung, Bali, (NH4)2SO4, NaCl, Buffer fosfat 0,05 M pH 7, Kasein 0,65% (b/v), Bovine Serum Albumin (BSA), reagen Biuret, Trichloroacetic Acid (TCA), L-tirosin, reagen Folin Ciocalteu dan Na2CO3 0,5 M.
Peralatan
Peralatan yang digunakan dalam penelitian ini adalah peralatan gelas, blender, pisau, lemari es, pipet mikro (Mettler Toledo), tip pipet mikro,
termometer, sentrifuse (Yenaco), neraca analitik (Shimadzu), inkubator (Memmert), vortex (Maxi Mix II Barnstead Thermolyne), pH meter (Schott), Spektrofotometer UV-Vis (double beam Shimadzu/UV-1800).
Cara Kerja
Penyiapan ekstrak buah nanas
Buah nanas dikupas dan dibersihkan, sebanyak 500 gram diblender sampai halus dan disaring sampai diperoleh sarinya. Kemudian sari nanas disentrifugasi pada kecepatan 3000 rpm selama 20 menit sampai diperoleh supernatan. Isolasi ekstrak kasar enzim bromelin buah nanas dengan metode salting out
Isolasi enzim bromelin dari supernatan buah nanas secara salting out dengan tiga jenis garam ((NH4)2SO4, NaCl dan garam tradisional Kusamba) dilakukan dengan menambahkan larutan garam dengan tingkat kejenuhan 10; 20; 40; 60 dan 80% dengan pengadukan secara perlahan. Larutan disimpan pada suhu 4oC selama 24 jam (semalam). Campuran endapan yang diperoleh kemudian disentrifugasi dengan kecepatan 5000 rpm selama 20 menit. Endapan protein tersebut kemudian dilarutkan dalam 0,05 M buffer fosfat pH 7 sampai volume 3 mL (selanjutnya disebut larutan ekstrak). Larutan ekstrak hasil isolasi dengan metode salting out pada berbagai tingkat kejenuhan disebut Larutan A1, A2, A3, A4, A5 (untuk (NH4)2SO4); B1, B2, B3, B4, B5 (untuk NaCl), dan C1, C2, C3, C4, C5 (untuk garam tradisional Kusamba). Selanjutnya, masing-masing larutan ekstrak ditentukan konsentrasi proteinnya dan aktivitas enzimnya untuk memperoleh aktivitas spesifik dari tiap ekstrak kasar enzim bromelin.
Penentuan konsentrasi protein dengan spektrofotometri metode Biuret (AOAC, 1995) Penentuan panjang gelombang maksimum
Panjang gelombang maksimum yang diperoleh adalah 545,2 nm.
Pembuatan kurva standar
Sebelum dilakukan penentuan konsentrasi protein pada larutan enzim, terlebih dahulu dibuat konsentrasi larutan standar BSA dengan variasi 1; 2; 4 dan 8 mg/mL. Sebanyak 1 mL standar dari masing-masing konsentrasi dipipet dan ditambahkan 4 mL reagen Biuret. Absorbansinya diukur pada panjang gelombang 545,2 nm. Selanjutnya dibuat kurva standar antara
konsentrasi standar BSA pada sumbu x dengan absorbansi masing-masing standar pada sumbu y. Penentuan konsentrasi protein ekstrak buah nanas
Penentuan konsentrasi protein total ekstrak buah nanas hasil isolasi dengan beberapa jenis garam dilakukan dengan cara memipet 1 mL masing-masing larutan A, B, C kemudian ditambahkan 4 mL reagen biuret. Larutan diaduk dan didiamkan selama 20 menit pada suhu kamar kemudian absorbansinya diukur pada panjang gelombang 545,2 nm. Konsentrasi protein total dapat dihitung menggunakan persamaan regresi linier yang diperoleh dari kurva standar BSA. Pengujian aktivitas protease ekstrak kasar enzim bromelin buah nanas (Anson, 1938 dalam Sigma 1999)
Penentuan panjang gelombang maksimum dan kurva standar
Panjang gelombang maksimum yang diperoleh adalah 729,6 nm. Selanjutnya dibuat kurva standar antara konsentrasi standar L-Tirosin pada sumbu x dengan absorbansi masing-masing standar pada sumbu y. Konsentrasi L-Tirosin pada sampel selanjutnya dapat dihitung berdasarkan persamaan regresi linier yang diperoleh. Pengujian aktivitas enzim
Pengujian aktivitas enzim dilakukan dengan cara sebagai berikut, sebanyak 2,5 mL kasein 0,65% (b/v) dipipet dan dimasukkan ke dalam tabung uji dan diinkubasi pada suhu 370C. Larutan kasein ditambah 0,5 mL larutan A (larutan ekstrak kasar enzim bromelin buah nanas hasil pengendapan garam (NH4)2SO4) kemudian diaduk dan diinkubasi pada suhu 370C selama 10 menit. Selanjutnya, campuran tersebut ditambah 5 mL Trichloroacetic Acid (TCA) 0,11 M untuk menghentikan reaksi enzimatis. Kemudian campuran diaduk dan diinkubasi pada suhu 370C selama 30 menit. Selanjutnya, campuran disentrifugasi dengan kecepatan 5000 rpm selama 10 menit. Pada pembuatan blanko sampel dilakukan prosedur yang sama, namun terdapat perbedaan pada tahap penambahan larutan A. Pada blanko, penambahan larutan A dilakukan setelah kasein ditambahkan TCA kemudian tahap selanjutnya sama dengan pengujian sampel. Prosedur yang sama juga dilakukan pada pengujian larutan B (NaCl) dan larutan C (garam tradisional Kusamba).
Selanjutnya dilakukan reaksi pewarnaan, supernatan dari larutan sampel hasil sentrifugasi dipipet sebanyak 1 mL dan dimasukkan ke dalam tabung reaksi, kemudian ditambah 2,5 mL Na2CO3 0,5 M serta 0,5 mL reagen Folin Ciocalteu. Setelah itu, absorbansinya diukur pada panjang gelombang 729,6 nm. Hal yang sama dilakukan pada supernatan dari larutan blanko. Aktivitas protease enzim dapat ditentukan dengan rumus berikut (Sigma, 1999) :
μmoltirosin x vol.total reaksi (mL)
Unit/mol =
VoLsainpel (mL) x waktu reaksK,m enit) x vol,u]i(mL
Penentuan aktivitas spesifik ekstrak kasar enzim bromelin buah nanas (Sigma, 1999)
Aktivitas spesifik didefinisikan sebagai unit aktivitas enzim (U/mL) dibagi dengan konsentrasi protein total (mg/mL) dan dapat diperoleh dengan menggunakan rumus (Sigma, 1999):
AKliviuiiJ Liizifii (U∕πιL) Aktivitas spesifik (U/mg) =
Konsentrasi proteintotal(mg∕mL'
HASIL DAN PEMBAHASAN
Pengendapan Protein Total Ekstrak Buah Nanas
Garam yang efektif dalam mengendapkan protein adalah garam yang memiliki jumlah muatan (anion) multivalen. Kemampuan anion dalam proses salting out berdasarkan deret Hofmeister adalah sebagai berikut : PO43-> SO42->COO->Cl- dan kemampuan kation monovalen adalah sebagai berikut : NH4+>K+>Na+ (Scopes, 1982). Kemampuan masing-masing garam ((NH4)2SO4, NaCl dan garam tradisonal Kusamba) dalam mengendapkan protein dilihat dari konsentrasi protein yang dihasilkan dari pengendapan oleh tiap garam. Setelah penambahan reagen Biuret, terbentuk warna biru transparan sampai warna ungu. Analisis dilanjutkan dengan pengukuran absorbansi dengan Spektrofotometer UV-Vis pada λmaks 545,2 nm. Persamaan regresi linier yang diperoleh adalah y = 0,041078 x + 0,008206. Data konsentrasi protein disajikan pada Tabel 1 dan grafik perbandingan konsentrasi protein ekstrak buah nanas hasil pengendapan
(NH4)2SO4, NaCl dan garam tradisional Kusamba disajikan pada Gambar 1.
Tabel 1. Konsentrasi protein ekstrak buah nanas hasil pengendapan garam (NH4)2SO4, NaCl dan garam tradisional Kusamba
|
No |
Jenis Garam |
Tingkat kejenuhan (%) |
Konsentrasi Protein (mg/mL) |
|
1. |
(NH4)2SO4 |
10 |
1,2000 ± 0,09565 |
|
20 |
1,3818 ± 0,11920 | ||
|
40 |
2,0853 ± 0,09043 | ||
|
60 |
3,0550 ± 0,16745 | ||
|
80 |
2,8505 ± 0,24160 | ||
|
2. |
NaCl |
10 |
1,1400 ± 0,06397 |
|
20 |
1,1919 ± 0,12286 | ||
|
40 |
1,3282 ± 0,14105 | ||
|
60 |
1,5213 ± 0,15815 | ||
|
80 |
2,4967 ± 0,26618 | ||
|
3. |
Garam |
10 |
1,1708 ± |
|
tradisional |
20 |
0,12155 1,1562 ± 0,09580 | |
|
40 |
1,1830 ± 0,08222 | ||
|
60 |
1,5822 ± 0,12711 | ||
|
80 |
1,9823 ± 0,03065 |
Grafik pada Gambar 1 menunjukkan bahwa konsentrasi protein ekstrak kasar buah nanas yang diendapkan dengan (NH4)2SO4 mengalami peningkatan seiring dengan meningkatnya kejenuhan larutan garam sampai pada tingkat kejenuhan 60% dengan nilai (3,0550 ± 0,16745) mg/mL. Hal tersebut disebabkan oleh semakin banyaknya jumlah ion garam yang mengikat air sehingga semakin banyak endapan
protein yang terbentuk. Namun terjadi penurunan konsentrasi protein pada tingkat kejenuhan 80% yang kemungkinan disebabkan oleh protein tersebut tidak mengendap lagi pada kejenuhan garam (NH4)2SO4 80% karena tiap jenis protein memiliki kelarutan yang berbeda-beda pada kondisi tertentu.
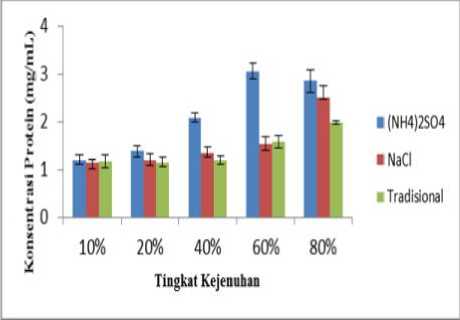
Gambar 1. Grafik perbandingan konsentrasi protein ekstrak buah nanas hasil pengendapan (NH4)2SO4, NaCl dan garam tradisional Kusamba
Pada grafik hasil pengendapan NaCl, konsentrasi protein total tertinggi adalah (2,4967 ± 0,26618) mg/mL pada kejenuhan 80% Selama proses salting out, NaCl memiliki kemampuan mengendapkan protein karena dapat mengikat air sehingga menurunkan kelarutan protein. Selain itu, NaCl juga termasuk garam anti-kaotropik (Farrah et.al, 1981) yakni jenis garam yang tidak merusak struktur protein.
Garam tradisional yang digunakan pada penelitian ini merupakan garam tradisional yang diperoleh dari Desa Kusamba, Klungkung. Alasan penggunaan garam tradisonal sebagai pengendap protein mengingat komponen penyusunnya yang sebagian besar terdiri dari ion Na+ dan ion Cl-(Kementerian Kelautan dan Perikanan, 2013) yang memiliki kemampuan untuk berikatan dengan air sehingga protein yang terkandung pada ekstrak buah nanas dapat mengendap. Garam tradisional Kusamba mengendapkan protein secara maksimal pada tingkat kejenuhan 80% dengan nilai konsentrasi protein sebesar (1,9823 ± 0,03065) mg/mL.
Berdasarkan hasil uji ANOVA Satu Jalan, pada tingkat kejenuhan 10 % dan 20%, nilai p>0,05 sehingga H0 diterima, artinya tidak terdapat perbedaan bermakna pada kejenuhan 10% dan 20%. Kemudian pada tingkat kejenuhan 40; 60 dan 80% nilai p<0,05 sehingga H0 ditolak, artinya terdapat perbedaan bermakna pada konsentrasi protein sebagai hasil dari pengendapan ketiga jenis garam. Pengujian dilanjutkan dengan uji Tukey/HSD. Hasil uji Tukey/HSD menunjukkan bahwa terdapat perbedaan konsentrasi protein dari ketiga jenis garam tersebut pada tingkat kejenuhan 40; 60 dan 80%.
Perbandingan konsentrasi protein tertinggi dari hasil pengendapan garam (NH4)2SO4 : NaCl : garam tradisional Kusamba adalah 1 : 0,82 : 0,65. Hal tersebut sesuai dengan deret Hofmeister, yakni ditinjau dari anion dan kationnya, (NH4)2SO4 merupakan garam yang paling efektif dalam proses salting out dibandingkan dua garam lainnya .
Pengujian aktivitas protease dari masing-masing ekstrak kasar enzim bromelin buah nanas
Absorbansi larutan filtrat setelah penambahan reagen Folin Ciocalteu diukur dengan spektrofotometer UV-Vis pada panjang gelombang maksimum yaitu pada 729,6 nm. Absorbansi yang diperoleh dimasukkan ke dalam persamaan y = 3,074 x + 0,01026. Data nilai aktivitas protease ekstrak kasar enzim bromelin buah nanas disajikan pada Tabel 2 dan grafik perbandingan aktivitas protease ekstrak kasar enzim bromelin buah nanas hasil pengendapan (NH4)2SO4, NaCl dan garam tradisional disajikan pada Gambar 2.
Berdasarkan grafik pada Gambar 2, nilai aktivitas protease enzim bromelin hasil pengendapan (NH4)2SO4 yang paling tinggi diperoleh pada kejenuhan 60% dengan nilai aktivitas enzim sebesar (0,4980 ± 0,00868) U/mL. Nilai aktivitas enzim mengalami peningkatan sampai tingkat kejenuhan 60% dan mengalami penurunan pada tingkat kejenuhan 80%. Hal ini kemungkinan disebabkan oleh protein enzim bromelin dapat diendapkan dengan optimal pada kejenuhan 60% sedangkan pada 80% masih terdapat sisa enzim yang masih dapat terendapkan.
Nilai aktivitas protease enzim hasil pengendapan NaCl yang paling tinggi diperoleh pada kejenuhan 40% dengan nilai
aktivitas enzim sebesar (0,3999 ± 0,03853) U/mL. Nilai aktivitas enzim mengalami peningkatan sampai pada tingkat kejenuhan 40% dan mengalami penurunan pada tingkat kejenuhan 60% sampai 80%. Hal ini kemungkinan disebabkan oleh enzim bromelin yang terendapkan oleh NaCl dapat terendapkan secara optimal pada kejenuhan 40%.
Tabel 2. Aktivitas protease enzim bromelin hasil pengendapan garam (NH4)2SO4, NaCl dan garam tradisional
|
No. |
Jenis Garam |
Tingkat kejenuhan (%) |
Aktivitas protease (U/mL) |
|
1. |
(NH4)2SO4 |
10 |
0,1191 ± 0,00123 |
|
20 |
0,3960 ± 0,01118 | ||
|
40 |
0,4537 ± 0,04735 | ||
|
60 |
0,4980 ± 0,00868 | ||
|
80 |
0,4300 ± 0,00796 | ||
|
2. |
NaCl |
10 |
0,0971 ± 0,00566 |
|
20 |
0,1256 ± 0,01868 | ||
|
40 |
0,3999 ± 0,03853 | ||
|
60 |
0,1980 ± 0,02475 | ||
|
80 |
0,1402 ± 0,02598 | ||
|
3. |
Garam |
10 |
0,0532 ± |
|
tradisional |
20 |
0,00758 0,0902 ± 0,00825 | |
|
40 |
0,1736 ± 0,03211 | ||
|
60 |
0,1703 ± 0,01098 | ||
|
80 |
0,3210 ± 0,08051 |
Nilai aktivitas protease enzim hasil pengendapan garam tradisional yang paling tinggi terdapat pada kejenuhan 80% dengan nilai aktivitas enzim sebesar (0,3210 ± 0,08051) U/mL.
Tingkat kejenuhan 80% menghasilkan ekstrak kasar enzim bromelin dengan aktivitas tertinggi. Hal tersebut kemungkinan disebabkan oleh enzim bromelin yang terendapkan oleh garam tradisional paling banyak terdapat pada kejenuhan 80%.
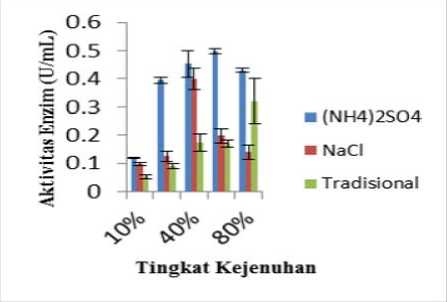
Gambar 2. Grafik perbandingan aktivitas protease ekstrak kasar enzim bromelin buah nanas hasil pengendapan (NH4)2SO4, NaCl dan garam tradisional
Aktivitas spesifik dari masing-masing ekstrak kasar enzim bromelin buah nanas
Teknik salting out tidak mengendapkan protein secara spesifik karena masih ada proteinprotein lain dalam ekstrak buah nanas selain protein enzim bromelin yang ikut mengendap selama proses tersebut. Konsentrasi protein yang tinggi tidak selalu sebanding dengan aktivitas protease enzim bromelin. Hal ini dikarenakan kehadiran protein lain selain enzim bromelin yang ikut terukur pada penentuan konsentrasi protein total. Oleh sebab itu, konsentrasi protein total yang tinggi tidak selalu menunjukkan aktivitas enzim yang tinggi sehingga perlu dilakukan penentuan aktivitas spesifik. Hal ini terbukti dari hasil penelitian yang diperoleh, yakni konsentrasi protein total hasil pengendapan NaCl dan garam tradisional Kusamba yang tidak selalu sebanding dengan aktivitas enzim. Sebagai contoh adalah hasil pengendapan NaCl. Pada kejenuhan 10% sampai 80%, konsentrasi protein total pada hasil pengendapan NaCl semakin meningkat seiring dengan meningkatnya kejenuhan. Namun, nilai aktivitas enzimnya mengalami penurunan mulai dari kejenuhan 60% dan 80%.
Semakin tinggi aktivitas spesifik menunjukkan semakin banyak jumlah enzim bromelin yang berhasil diendapkan dibandingkan protein lain pada tingkat kejenuhan tertentu (isolat yang diperoleh semakin murni). Variasi tingkat kejenuhan garam pada proses pengendapan enzim bromelin buah nanas dilakukan untuk mengetahui kemampuan garam dalam mengendapkan protein enzim agar diperoleh jumlah enzim yang optimal yang kemudian dilihat dari nilai aktivitas spesifik yang diperoleh. Data nilai aktivitas spesifik pada hasil pengendapan oleh tiap garam disajikan pada Tabel 3 dan grafik perbandingan aktivitas spesifik ekstrak kasar enzim bromelin buah nanas hasil pengendapan (NH4)2SO4, NaCl dan garam tradisional Kusamba disajikan pada Gambar 3.
Berdasarkan Tabel 3, nilai aktivitas spesifik tertinggi hasil pengendapan (NH4)2SO4 diperoleh pada tingkat kejenuhan 20% dengan nilai (0,2887 ± 0,03202) U/mg. Nilai aktivitas spesifik tertinggi hasil pengendapan NaCl diperoleh pada tingkat kejenuhan 40% dengan nilai (0,2705 ± 0,01845) U/mg. Nilai aktivitas spesifik tertinggi hasil pengendapan garam tradisional diperoleh pada tingkat kejenuhan 80% dengan nilai (0,1623 ± 0,04288) U/mg.
Nilai aktivitas spesifik tertinggi yang dihasilkan dari pengendapan (NH4)2SO4 terdapat pada kejenuhan 20%, hal ini menunjukkan bahwa pada tingkat kejenuhan tersebut, jumlah enzim bromelin yang diperoleh paling banyak walaupun konsentrasi protein total yang diperoleh lebih rendah dari tingkat kejenuhan 40-80%. Hal tersebut kemungkinan disebabkan oleh enzim bromelin yang diendapkan dengan (NH4)2SO4 lebih mudah diperoleh pada tingkat kejenuhan 20%.
Nilai aktivitas spesifik tertinggi yang dihasilkan dari pengendapan NaCl terdapat pada kejenuhan 40% walaupun konsentrasi protein total tertinggi dihasilkan pada kejenuhan 80%. Hal ini menunjukkan bahwa kosentrasi protein total tidak selalu sebanding dengan aktivitas enzim bromelin yang kemungkinn disebabkan oleh enzim bromelin yang diisolasi dengan NaCl lebih mudah diperoleh pada tingkat kejenuhan 40%.
Nilai aktivitas spesifik tertinggi yang dihasilkan dari pengendapan garam tradisional terdapat pada kejenuhan 80%. Berdasarkan grafik, nilai aktivitas spesifik mengalami peningkatan dari
kejenuhan 10% sampai 40%. Kemudian mengalami penurunan pada kejenuhan 60% dan pada 80% mengalami kenaikan dan merupakan tingkat kejenuhan dengan nilai aktivitas spesifik tertinggi. Nilai aktivitas spesifik yang naik-turun kemungkinan disebabkan oleh pengaruh ion-ion lain yang terdapat dalam garam tradisional. Kehadiran ion-ion lain selain Na+ dan Cl- misalnya K+, Mg2+ dan Ca2+ (Kementerian Kelautan dan Perikanan, 2013) kemungkinan dapat mempengaruhi kemampuan garam tradisional dalam mengendapkan enzim bromelin.
Tabel 3. Aktivitas spesifik enzim bromelin hasil pengendapan garam (NH4)2SO4, NaCl dan garam tradisional Kusamba
|
No. |
Jenis Garam |
Tingkat kejenuhan (%) |
Aktivitas spesifik (U/mg) |
|
1. |
(NH4)2SO4 |
10 |
0,0996 ± 0,00726 |
|
20 |
0,2887 ± 0,03202 | ||
|
40 |
0,2172 ± 0,01546 | ||
|
60 |
0,1632 ± 0,00622 | ||
|
80 |
0,1516 ± 0,01275 | ||
|
2. |
NaCl |
10 |
0,0854 ± 0,00761 |
|
20 |
0,1065 ± 0,02136 | ||
|
40 |
0,2705 ± 0,01845 | ||
|
60 |
0,1310 ± 0,02182 | ||
|
80 |
0,0562 ± 0,00800 | ||
|
3. |
Garam |
10 |
0,0455 ± 0,00525 |
|
tradisional |
20 |
0,0788 ± 0,01305 | |
|
40 |
0,1484 ± 0,03568 | ||
|
60 |
0,1082 ± 0,01233 | ||
|
80 |
0,1623 ± 0,04288 |
Nilai aktivitas spesifik dari hasil pengendapan (NH4)2SO4, NaCl dan garam tradisional Kusamba dapat terganggu dengan adanya sisa garam pada endapan selama proses salting out. Oleh sebab itu, untuk selanjutnya diperlukan adanya pemurnian ekstrak kasar enzim bromelin untuk meminimalkan gangguan dari sisa garam tersebut. Salah satu pemurnian hasil salting out adalah teknik dialisis, yakni difusi zat terlarut melalui membran semipermeabel. Selama proses dialisis sisa garam dapat dipisahkan dari protein (Budiman, 2011).
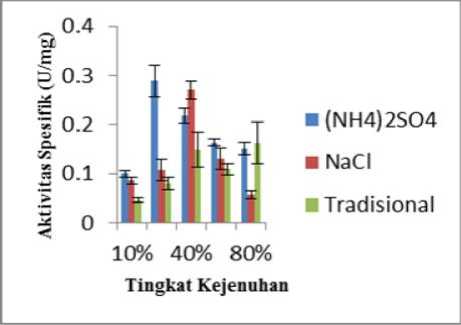
Gambar 3. Grafik perbandingan aktivitas spesifik ekstrak kasar enzim bromelin buah nanas hasil pengendapan (NH4)2SO4, NaCl dan garam tradisional Kusamba
Berdasarkan hasil uji ANOVA, nilai p<0,05 sehingga H0 ditolak, artinya terdapat perbedaan bermakna pada nilai aktivitas spesifik enzim bromelin sebagai hasil dari pengendapan ketiga jenis garam tersebut. Pengujian dilanjutkan dengan uji Tukey/HSD. Hasil uji Tukey/HSD menunjukkan bahwa terdapat perbedaan nilai aktivitas spesifik dari ketiga jenis garam tersebut pada tingkat kejenuhan 10% sampai 80%.
Perbandingan nilai aktivitas spesifik tertinggi hasil pengendapan (NH4)2SO4 : NaCl : garam tradisional adalah 1 : 0,94 : 0,56. Berdasarkan perbandingan tersebut, (NH4)2SO4 memiliki nilai aktivitas tertinggi dibandingkan dua garam lainnya. Hal ini diduga karena kekuatan ion pada NaCl yang lebih rendah dan kehadiran ionion lain pada garam tradisional Kusamba serta perbedaan kelarutan enzim bromelin pada jenis garam tertentu. Namun, rasio perbandingan NaCl yang mendekati (NH4)2SO4 menjadi salah satu faktor pendukung penggunaan NaCl sebagai alternatif pengganti (NH4)2SO4 dalam mengisolasi enzim bromelin dari ekstrak kasar buah nanas. Selain itu, penggunaan garam tradisional juga dapat menjadi alternatif pengganti (NH4)2SO4 karena ketersediaannya yang melimpah sehingga proses isolasi enzim bromelin ekstrak kasar buah nanas dapat dilakukan dengan sederhana dan ekonomis.
SIMPULAN DAN SARAN
Simpulan
-
1. Kemampuan masing-masing garam ((NH4)2SO4, NaCl, garam tradisional) dalam mengendapkan protein total secara berturut-turut adalah (NH4)2SO4 > NaCl > garam tradisional Kusamba dengan perbandingan 1 : 0,82 : 0,65.
-
2. Nilai aktivitas spesifik tertinggi dari ekstrak kasar enzim bromelin buah nanas hasil pengendapan (NH4)2SO4, NaCl dan garam tradisional Kusamba secara berturut-turut adalah sebagai berikut : 0,2887 U/mg (pada kejenuhan 20%); 0,2705 U/mg (pada kejenuhan 40%) dan 0,1623 U/mg (pada kejenuhan 80%) dengan perbandingan 1 : 0,94 : 0,56.
Saran
Diperlukan adanya proses pemurnian terlebih dahulu pada ekstrak hasil pengendapan garam agar gangguan pada penentuan aktivitas spesifik enzim bromelin dapat diminimalkan, misalnya dengan teknik dialisis.
UCAPAN TERIMA KASIH
Pada kesempatan ini, penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam penyelesaian penelitian ini.
DAFTAR PUSTAKA
AOAC, 1995, Official Methods of Analysis of The Association of Official Analytical Chemist, AOAC, Washington DC.
Bala, M., Nurul A. Ismail, Maizirwan M., Mohamed S. Jami, Hamzah M. Salleh, and Azura A., 2012, Bromelain Production: Current Trends and Perspective, Archives Des Sciences, 65 (11) :
Bintang, M., 2010, Biokimia Teknik Penelitian, Erlangga, Jakarta
Budiman, 2011, Isolasi Enzim α-Glukosidase dari Gabah (Oryza sativa var. Ciherang), Skripsi, Universitas Indonesia, Jakarta
Farrah, S.R., Dinesh O. Shah.,and Lonnie O. Ingram., 1981, Effect of chaotropic and antichaotropic agents on elution of poliovirus adsorbed on membrane filters, Proc.Natl. Acad. Sci., 78 (2) : 1229-1232
Gautam, S.S., S.K. Mishra, V. Dash, and Amit K., Goyal, and G. Rath, 2010, Comparative study of extraction, purification and estimation of bromelain from stem and fruit of pineapple plant, J. Pharm Sci., 34 : 67-76
Halkerston, Ian D.K., 2012, Sinopsis Biokimia Jilid Satu, a.b. Rudiharso, W., Binarupa Aksara Publisher, Tangerang Selatan
Handayani, W., A.A.I. Ratnadewi, dan Agung B. Santoso, 2007, Pengaruh Variasi Konsentrasi Sodium Klorida terhadap Hidrolisis Protein Ikan Lemuru (Sardinella lemuru Bleeker, 1853) oleh Protease Ekstrak Nanas (Ananas comosus [L.] Merr. var. Dulcis), Jurnal Teknologi Proses, 6 (1) : 1-9
Kementerian Kelautan dan Perikanan, 2013, Pembuatan Garam Bermutu, Direktorat Pemberdayaan Masyarakat Pesisir dan Pengembangan Usaha dan Direktorat Jenderal Kelautan dan Pulau-pulau Kecil Kementerian Kelautan dan Perikanan, Jakarta
Sigma, 1999, Enzymatic Assay of Protease : Casein as A Substrat, Sigma Quality Control Test Procedure
Scopes, R.K., 1982, Protein Purification Principle and Practice, Springer-Verlag, New York
Wuryanti, 2004, Isolasi dan Penentuan Aktivias Spesifik Enzim Bromelin Dari Buah Nanas (Ananas comosus L.), JKSA. VII (3) : 83-87
146
Discussion and feedback