SENYAWA STEROID PADA DAUN GAYAM (Inocarpus fagiferus Fosb) DAN AKTIVITASNYA SEBAGAI ANTIOKSIDAN TERHADAP DIFENILPIKRIL HIDRAZIL (DPPH)
on
ISSN 1907-9850
SENYAWA STEROID PADA DAUN GAYAM (Inocarpus fagiferus Fosb) DAN AKTIVITASNYA SEBAGAI ANTIOKSIDAN TERHADAP DIFENILPIKRIL HIDRAZIL (DPPH)
I Gusti Agung Putu Surya Adi Krisna, Sri Rahayu Santi, dan Ni Luh Rustini
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbara
Email : suryaadikrisna@gmail.com
ABSTRAK
Penelitian ini bertujuan untuk mengidentifikasi senyawa steroid daun gayam dan menguji aktivitasnya sebagai antioksidan. Serbuk kering daun gayam (1000 g) diekstraksi dengan 5000 mL etanol 96% menghasilkan 28,05 g ekstrak kental etanol. Fraksinasi ekstrak kental etanol dengan n-heksana dan kloroform berturut – turut menghasilkan 14,18 g fraksi n-heksana dan 2,21 g fraksi kloroform. Hasil uji steroid dengan pereaksi Liebermann-Burchard menunjukkan bahwa fraksi n-heksana dan kloroform positif mengandung steroid, namun secara kualitatif kandungan steroid pada fraksi n-heksana lebih besar dibandingkan dengan fraksi kloroform. Pemisahan fraksi n-heksana dilakukan dengan kromatografi kolom silika gel menggunakan campuran pelarut n-heksana : etanol (7:3) sebagai fase gerak menghasilkan 4 kelompok fraksi. Fraksi F1 poitif steroid dan relatif murni kemudian diidentifikasi dengan spektrofotometer inframerah serta ultraviolet-visible. Hasil identifikasi menunjukkan isolat steroid (F1) fraksi F1 mempunyai gugus fungsi O=H, C=O, C-H, and C=C tak terkonjugasi. Hasil uji antioksidan menunjukkan isolat steroid bersifat antioksidan terhadap difenilpikril hidrazil (DPPH) dengan nilai IC50 sebesar 4 ppm.
Kata kunci : steroid, Inocarpus fagiferus Fosb, antioksidan
ABSTRACT
This research aimed to identify steroid compound from leaf of gayam (Inocarpus fagiferus Fosb) and test its antioxidant activity. Dried leaf powder of gayam was extracted with 5000 mL of 96% ethanol to yield 28,05 g concentrated extract. This extract was then fractionated into n-hexane and choloform to yield 14,18 g n-hexane and 2,21 g choloform fractions respectively. The test using Lieberman Burchard reagent showed that both fractions contain steroid, but n-hexane fraction contained more steroid than chloroform fraction. Separation of n-hexane fraction was done using silica gel column chromatography with n-hexane : ethanol (7:3) as eluent and four groups of fraction were obtained. Fraction F1 contained steroid and was relatively pure therefore it was then identified. The infrared and ultraviolet-visible spectra suggest that the isolate (F1 fraction) has functional groups such as O-H, C=O, C-H, and unconjugated C=C and showed λmax at 279,407, and 669 nm. The antioxidant test showed that the isolate had antioxidant activity toward DPPH with IC50 of 4 ppm.
Keywords : steroids, Inocarpus fagiferus Fosb, antioxidants
PENDAHULUAN
Biodiversity hutan tropis seperti di Indonesia merupakan sumber chemodiversity akan senyawa-senyawa bioaktif. Senyawa-senyawa kimia tersebut sebagai lead compounds atau senyawa model yang sangat potensial untuk dikembangkan lebih lanjut sebagai obat atau bahan dasar obat yang sangat berguna pada bidang
kesehatan maupun bidang lainnya. Salah satu senyawa metabolit sekunder yang potensial dieksplorasi dari tumbuhan untuk dikaji aktivitasnya adalah golongan steroid (Achmad, 1986).
Menurut Raffauf (1970) ada dua famili dari kelompok monokotiledon dan 20 famili dari kelompok dikotiledon mempunyai kandungan steroid yang tinggi. Fabaceae merupakan salah
satu famili dari tumbuhan dikotiledon yang mengandung steroid. Steroid yang terdapat pada beberapa spesies Fabaceae banyak digunakan dalam pengobatan tradisional untuk menyembuhkan berbagai penyakit (Heyne, 1987) diantaranya sebagai analgesik, antihipertensi, antimikrobial, antibakteri dan antioksidan. Data keberadaan senyawa-senyawa steroid pada tumbuhan dari famili Fabaceae, menunjukkan masih banyak spesies lain dari genus ini yang belum diselidiki kandungan kimianya (Collins, 1990).
Gayam (Inocarpus fagiferus Fosb) atau di Bali di kenal dengan nama gatep adalah salah satu tumbuhan dari famili Fabaceae yang diketahui mengandung senyawa steroid hasil dari skrining fitokimia yang telah dilakukan sebelumnya. Pemanfaatan secara tradisional kulit batang tumbuhan ini sebagai obat disentri dan infeksi saluran kencing telah dilakukan masyarakat Bali sejak dahulu (Segatri, 1999). Santi (2000) melaporkan kulit batang gayam mengandung senyawa golongan triterpenoid dan flavonoid yang berpotensi sebagai antibakteri, serta senyawa golongan steroid dengan aktivitas antioksidan terhadap DPPH (Aditya, 2011).
Berdasarkan pendekatan kemotaksonomi bahwa suatu tumbuhan yang berada dalam satu genus atau famili yang sama akan mengandung senyawa kimia yang sama, (Venkataraman, 1976) dan senyawa metabolit sekunder yang terdapat dalam tumbuhan tidak terakumulasi pada satu bagian saja tetapi terdistribusi pada semua bagian tumbuhan (Koji Nakanishi, 1987), dengan demikian diduga pada daun gayam juga akan diperoleh senyawa golongan steroid dan memiliki aktivitas antioksidan. Dalam penelitian ini telah dilakukan isolasi dan identifikasi senyawa steroid yang terdapat pada daun gayam dan menguji aktivitas antioksidan dari isolat steroid tersebut terhadap difenilpikril hidrazil (DPPH).
MATERI DAN METODE
Bahan
Bahan yang digunakan dalam penelitian ini adalah daun Gayam (Inocarpus fagiferus Fosb), yang diperoleh dari daerah Padang Sambian Klod Denpasar Barat. Bahan kimia yang digunakan
meliputi etanol, kloroform dengan kemurnian teknis dan pro analisis, silika gel GF254 untuk kromatografi lapis tipis dan silika gel 60 untuk uji kromatografi kolom, DPPH (Difenilpikril hidrasil), akuades dan pereaksi uji fitokimia steroid Lieberman-Burchard (asam asetat anhidrida dan H2SO4 pekat).
Peralatan
Peralatan yang digunakan dalam penelitian ini adalah pisau, gunting, blender, ayakan, neraca analitik, seperangkat alat gelas, pipet mikro, kertas saring, aluminium foil, corong pisah, penguap putar vakum (rotary vacum evaporator), seperangkat alat kromatografi lapis tipis (KLT), kromatografi kolom, seperangkat alat spektrofotometer UV-vis dan spektrofotometer inframerah (IR).
Cara Kerja
Isolasi dan Identifikasi Senyawa Steroid Kulit Batang Gayam
Ekstraksi 1 kg serbuk kering daun gayam dengan cara maserasi menggunakan pelarut etanol 96% selama ± 24 jam. Filtratnya disaring, sedangkan ampasnya dimaserasi kembali dengan pelarut yang sama sampai senyawa yang terdapat di dalamnya terekstrak habis. Filtrat yang diperoleh dikumpulkan dan diuapkan pada tekanan rendah dan suhu 400C dengan penguap putar vacum (rotary vacum evaporator) sehingga diperoleh ekstrak pekat etanol dan ekstrak pekat etanol yang diperoleh kemudian ditimbang. Ekstrak pekat etanol dilarutkan dengan campuran etanol-air (7:3) kemudian etanolnya diuapkan menggunakan rotary vacum evaporator sampai habis dan hanya tersisa ekstrak air. Ekstrak air ini kemudian difraksinasi berturut – turut dengan n-heksana dan klorofom sehingga diperoleh tiga fraki yaitu fraki n-heksana, kloroform dan air. Fraksinasi menggunakan n-heksana dan klorofom dilakukan berulang kali sampai semua komponen senyawa yang bersifat non polar dan semi polar habis terekstraksi. Ketiga fraksi yang diperoleh diuapkan, ditimbang dan diuji steroid dengan pereaksi Lieberman-Burchard. Fraksi yang mengandung senyawa steroid paling tinggi kemudian dipisahkan dan dimurnikan dengan kromatogafi kolom.
Isolat steroid relatif murni yang diperoleh dari pemisahan dan pemurnian secara kromatografi, kemudian diidentifikasi sifat fisiko-kimianya menggunakan spektrofotometer UV-vis dan IR, serta diuji aktivitas antioksidannya terhadap DPPH.
Uji Aktivitas Antioksidan terhadap DPPH
Uji aktivitas antioksidan dilakukan dengan cara membuat terlebih dahulu larutan induk sampel 100 ppm dengan menimbang 1 mg sampel yang dimasukkan dalam labu ukur 10 mL, kemudian ditambahkan n-heksana sampai tanda batas. Larutan sampel dengan konsentrasi 5, 8, 10 ppm dibuat dengan mengambil larutan induk sebanyak 50 µL, 80 µL, 100 µL, , kemudian dimasukkan ke dalam 4 labu ukur 10 mL. Ke dalam masing – masing labu ukur ditambahkan 2 mL larutan DPPH 1 mM dan diencerkan dengan air sampai tanda batas, kemudian dikocok sampai homogen, dan didiamkan selama kurang lebih 30 menit dan diukur serapannya dengan spektrofotometer UV-vis pada panjang gelombang 515 nm.
HASIL DAN PEMBAHASAN
Isolasi dan Identifikasi Senyawa Steroid Kulit Batang Gayam
Hasil ekstraksi 1000 g serbuk daun gayam dengan 5000 mL etanol 96% (1500 mL x 3) menghasilkan ekstrak pekat etanol sebanyak 28,05 g. Ekstrak pekat etanol tersebut difraksinasi berturut – turut secara partisi dengan n-heksana dan kloroform, menghasikan fraksi pekat n-heksana sebanyak 14,18 g dan fraksi pekat kloroform sebanyak 2,21 g. Kedua ekstrak kemudian diuji kandungan steroidnya dengan
pereaksi Lieberman-Burchard dan hasilnya disajikan pada Tabel 1. Hasil uji steroid dengan pereaksi Lieberman-Burchard (Tabel 1) menunjukkan bahwa kedua fraksi yaitu fraksi n-heksana dan fraksi kloroform positif mengandung steroid ditunjukkan dengan terjadinya perubahan warna dari warna hijau menjadi kebiruan, dan fraksi n-heksana memberikan perubahan warna yang lebih jelas dibandingkan fraksi kloroform sehingga secara kualitatif dapat dikatakan kandungan steroid pada fraksi n-heksana lebih besar dibandingkan fraksi kloroform. Oleh karena itu fraksi n-heksana dilanjutkan pada proses pemisahan dan pemurnian.
Tabel 1. Hasil uji steroid fraksi n-heksana dan kloroform
Fraksi pekat Perubahan warna Keterangan
n-heksana hijau menjadi biru terang+ steroid
Kloroform hijau menjadi biru + steroid
Pemisahan komponen yang terkandung pada fraksi n-heksana dilakukan dengan menggunakan kromatografi kolom dengan fase diam silika gel sebanyak 80 g dan eluennya berupa campuran pelarut n-heksana – etanol (7:3). Eluen ini digunakan karena memberikan pola pemisahan terbaik dibandingkan dengan campuran eluen yang lain dengan menghasilkan 7 noda yang ditandai dengan kisaran harga Rf yang berjauhan satu sama lain. Hasil pemisahan 2 g fraksi n-heksana menghasilkan 116 eluat yang ditampung setiap 3 mL. Eluat yang mempunyai pola pemisahan yang sama digabungkan sehingga diperoleh empat kelompok fraksi (F1-F4) seperti yang tertera pada Tabel 2.
Tabel 2. Hasil pemisahan komponen fraksi n-heksana dengan kromatografi kolom
|
Fraksi (F) |
Berat (g) |
Warna |
Jumlah noda |
Harga Rf (cm) |
|
A (1-11) |
0,21 |
Coklat kehijauan |
1 |
0,95 |
|
B (12-23) |
0,14 |
Coklat kekuningan |
3 |
0,82 |
|
0,40 | ||||
|
0,34 | ||||
|
C (24-63) |
0,13 |
Kuning kehijauan |
2 |
0,27 |
|
0,23 | ||||
|
D (63-116) |
0,11 |
Kuning pucat |
1 |
0,21 |
Keempat kelompok fraksi selanjutnya diuji kandungan steroidnya dengan pereaksi Lieberman Burchard. Hasil uji steroid pada keempat kelompok fraksi seperti dipaparkan pada Tabel 3, yang menunjukkan bahwa fraksi F1 dan F2 positif mengandung steroid dengan menghasilkan perubahan warna dari hijau menjadi biru terang.
Tabel 3. Hasil uji steroid pada keempat
kelompok fraksi (F1-F4)
|
Fraksi |
Perubahan warna |
Keterangan |
|
F1 |
hijau menjadi biru terang |
+ steroid |
|
F2 |
hijau menjadi biru |
+ steroid |
|
F3 |
hijau menjadi hijau pudar |
- steroid |
|
F4 |
hijau menjadi hijau pudar |
- steroid |
Fraksi F1 terdiri dari satu komponen senyawa maka pada isolat fraksi F1 dilakukan uji kemurnian dengan menggunakan beberapa campuran eluen seperti n-heksana ; n-heksana : etanol (3:2) ; n-heksan : kloroform : etanol (3:1:2) ; n-heksan : etanol (3:1) ; n-heksana : etanol (1:1) yang menunjukkan bahwa fraksi F1 memberikan noda tunggal yang artinya fraksi F1 relatif murni secara KLT.
Hasil identifikasi isolat (fraksi F1) dengan spektrofotometer inframerah (Gambar 1) menunjukkan adanya serapan gugus fungsi karakteristik seperti OH pada 3444,87 cm-1, C-O alkohol pada 1166,93 cm-1, C-H alifatik pada 2926,09 cm-1 yang diperkuat dengan munculnya serapan pada 1454,33 cm-1, 1373,32 cm-1 dan serapan kuat pada 839,03 cm-1 karena vibrasi tekuk C-H alifatik keluar bidang dari cincin yang bukan aromatis. Selain itu terdapat gugus karakteristik C=O pada 1739,79 cm-1, C=C yang tidak terkonjugasi dalam kerangka dasar steroid pada 1614, 42 cm-1 yang didukung dengan munculnya serapan pada daerah 977,91 cm-1 karena vibrasi tekuk dari C-H ikatan rangkap pada cincin (Silverstain et al.,1991).
Identifikasi dengan spektrofotometer UV-vis (Gambar 2) menghasilkan tiga serapan utama pada panjang gelombang 407; 502 dan 610 nm. Serapan yang terjadi pada panjang gelombang 407 nm kemungkinan disebabkan oleh terjadinya transisi elektronik π → π* dari suatu kromofor C = C. Dugaan ini diperkuat dari data spektrum
inframerah dengan munculnya serapan dari C = C alifatik pada daerah bilangan gelombang 1614,42 cm-1. Serapan pada panjang gelombang 502 nm kemungkinan disebabkan terjadinya transisi elektronik n → σ* dari suatu auksokrom O-H yang mempunyai elektron non bonding. Dugaan ini diperkuat dari data spektrum inframerah dengan munculnya serapan dari gugus O=H alkohol pada daerah bilangan gelombang 3444,87 cm-1 (Silverstain et al., 1981; Sastrohamidjojo, 1991). Serapan pada panjang gelombang 610 kemungkinan disebabkan terjadinya transisi elektronik n → π* dari suatu kromofor yang mempunyai elektron non bonding seperti pada kromofor C=O. Dugaan ini juga diperkuat dari data spektrum inframerah dengan munculnya serapan dari gugus karbonil pada daerah bilangan gelombang 1739,79 cm-1.
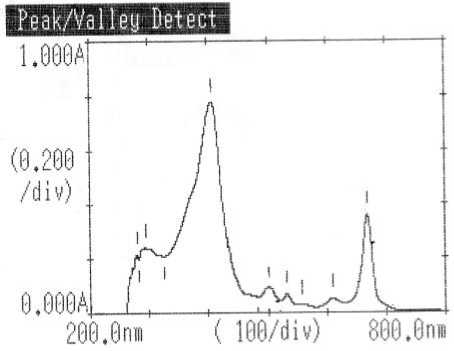
Gambar 2. Spektrum UV-vis dari isolat F1
Uji Aktivitas Antioksidan terhadap DPPH
Antioksidan adalah suatu senyawa inhibitor yang bekerja menghambat proses oksidasi dengan cara bereaksi dengan radikal bebas reaktif membentuk radikal bebas tidak reaktif yang relatif stabil (Sofia, 2008). Suatu senyawa dikatakan memiliki sifat antioksidan bila senyawa tersebut mampu mendonasikan satu atau lebih elektron kepada senyawa prooksidan, kemudian mengubah senyawa oksidan menjadi senyawa yang lebih stabil (Winarsi, 2005).
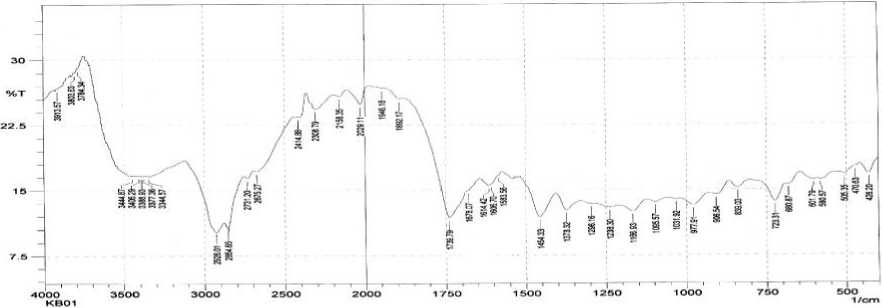
Gambar 1. Spektrum Inframerah dari isolat F1
Tabel 4. Data absorbansi dan perhitungan % peredaman radikal bebas DPPH
|
Konsentrasi |
Absorbansi (A) |
% Peredaman radikal bebas (%) |
Rata-rata % Peredaman radikal bebas (%) |
|
Kontrol |
0,5859 |
- |
- |
|
0,5163 |
- | ||
|
0,4981 |
- | ||
|
10 ppm |
0,1563 |
73,32 |
71,51 |
|
0,1501 |
70,93 | ||
|
0,1480 |
70,29 | ||
|
8 ppm |
0,1989 |
66,05 |
63,73 |
|
0,1921 |
62,79 | ||
|
0,1875 |
62,36 | ||
|
5 ppm |
0,2343 |
60,01 |
57,42 |
|
0,2297 |
55,51 | ||
|
0,2154 |
56,75 |
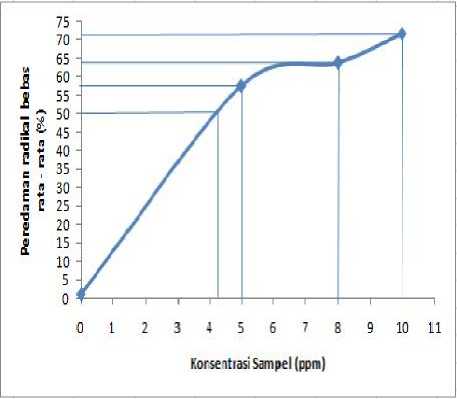
Gambar 3. Grafik hubungan antara konsentrasi sampel dengan aktivitas peredaman radikal bebas rata – rata
Uji aktivitas antioksidan dengan metode DPPH menggunakan metode hitung IC50. Uji ini dilakukan untuk mengetahui konsentrasi yang dibutuhkan untuk bisa meredam 50% radikal bebas DPPH yang ditunjukkan pada Tabel 4.
Nilai IC50 diperoleh dari plot grafik hubungan antara konsentrasi senyawa uji dengan persentase peredaman radikal bebas rata – rata, seperti ditunjukan pada Gambar 3.
Grafik pada Gambar 3 menunjukkan bahwa isolat memberikan IC50 pada konsentrasi sekitar 4 ppm. Nilai IC50 yang kecil menunjukkan bahwa senyawa uji tersebut mempunyai efektivitas penangkap radikal yang baik. Aktivitas antioksidan yang dihasilkan isolat kemungkinan diakibatkan karena adanya gugus O-H pada kerangka dasar steroid.
SIMPULAN DAN SARAN
Simpulan
Hasil identifikasi dengan spektrofotometer UV-vis dan spektrofotometer inframerah menunjukkan isolat steroid (fraksi F1) kemungkinan mengandung gugus fungsi O-H, C=O, C-H, dan C=C yang tidak terkonjugasi. Hasil uji antioksidan dengan metode DPPH menunjukkan bahwa isolat steroid yang terdapat pada daun gayam dapat digunakan sebagai antioksidan karena memberikan nilai IC50 pada konsentrasi 4 ppm.
Saran
Penelitian lebih lanjut perlu dilakukan untuk menganalisis senyawa steroid lain yang masih terdapat pada fraksi n-heksana daun gayam, dan menguji aktivitas antioksidannya untuk mengetahui apakah semua senyawa steroid yang terkandung pada fraksi n-heksana daun gayam dapat digunakan sebagai antioksidan.
UCAPAN TERIMA KASIH
Melalui kesempatan ini penulis ingin mengucapkan terima kasih kepada bapak Dr. Drs. Manuntun Manurung, ibu Dra. Iryanti Eka Suprihatin, M.Sc., Ph.D., dan bapak Drs. Made Arsa, M.Si. yang telah membantu dalam penyelesaian penelitian ini.
DAFTAR PUSTAKA
Achmad, S.A., 1986, Kimia Organik Bahan Alam, Universitas Terbuka, Jakarta
Aditya, 2011, Penelusuran Senyawa Antioksidan pada Kulit Batang Gayam, Skripsi, Jurusan Kimia, F MIPA, Universitas Udayana
Collins, R. H., 1990, Inventarisasi Tanaman Obat Indonesia, Edisi III, Depkes RI Badan Pengembangan dan Penelitian Kesehatan, Jakarta
Heyne, K., 1987, Tumbuhan Berguna Indonesia, Jilid 3, Departemen Kehutanan, Jakarta
Koji, N. and Griffin, W.J., 1987, Natural Products of Chemistry, A Comparison of Four Species of Scientific, Planta Meica, Tokyo
Raffauf, R.F., 1970, A Handbook of Alkaloids and Alkaloid Containing Plants, Willey-Interscience, New York
Santi, S. R., 2000, Isolasi dan Karakterasi Senyawa Flavonoid dari Kulit Batang Gayam (Inocarpus fagiferus Fosb), Tesis, Pasca Sarjana, Prodi Ilmu Kimia, Universitas Padjadjaran, Bandung
Sastrohamidjojo, H., 1991, Kromatografi, Edisi Kedua, Liberty, Yogyakarta
Segatri Putra, 1989, Taru Premana, Khasiat Tanam-tanaman Untuk Obat Tradisional, Upada Sastra, Denpasar
Silverstein, R. M., Basler, G.c., and Morril, T.C., 1991, Spectrometric Identification of Organic compound, John willey & Sons, Inc., Singapore
Sofia, D., 2008, Antioksidan dan Radikal Bebas, available from: http://www.chem-is-try.org/?sect=artikel&ext=81, 5 November 2012
Venkataraman, K., 1976, A Synopsis of The Genus Natural Phenolic Pigments, Missouri Botanical Garden, USA
Winarsi, H., 2005, Isoflavon, Gadjah Mada Universitas Press, Yogyakarta
256
Discussion and feedback