ISOLASI DAN AKTIVITAS ANTIKANKER PINOSTROBIN DARI TEMU KUNCI (Kaempferia pandurata Roxb) TERHADAP FIBROSARKOMA MENCIT HASIL INDUKSI BENZOPIREN
on
ISSN 1907-9850
ISOLASI DAN AKTIVITAS ANTIKANKER PINOSTROBIN DARI TEMU KUNCI (Kaempferia pandurata Roxb) TERHADAP FIBROSARKOMA MENCIT HASIL INDUKSI BENZOPIREN
Oka Adi Parwata1*, Sukardiman2, dan Alit Widhiartini3
-
1 Kelompok Studi Bahan Alam, Laboratorium Kimia Organik, Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana, Denpasar Bali.
-
2 Laboratorium Fitokimia dan Farmakognosi Fak. Farmasi Universitas Airlangga, Surabaya
-
3 Bagian Farmasi, Fakultas Kedokteran Universitas Udayana, Jln PB Sudirman, Denpasar Email : adi_parwata@unud.ac.id
ABSTRAK
Efek Induksi Apoptosis dan Antiangiogenesis Pinostrobin dari Temu Kunci (Kaempferia pandurata Roxb) terhadap Fibrosarkoma mencit hasil induksi benzopiren telah dilakukan. Pemeriksaan diawali pengambilan atau pembedahan jaringan fibrosarkoma pada mencit yang terinfeksi dan menimbang fibrosarkoma yang diperoleh. Jaringan fibrosarkoma yang diperoleh selanjutnya disimpan pada wadah yang telah berisi formalin 10%. Hasil penimbangan menunjukkan bahwa konsentrasi oral pinostrobin 80 mg/kg BB dapat menghambat pertumbuhan fibrosarkoma dengan berat 68,62% gram dan dengan obat kanker (kontrol +) terjadi hambatan 95,95 % dibandingkan dengan kontrol negative. Ini berarti pinostrobin berpotensi dikembangkan sebagai bahan kemoterapi kanker.
Hasil pemotretan patohistologi jaringan fibrosarkoma pada preparat HE dengan mikroskop cahaya dengan pembesaran 400x, menunjukkan banyak kromatin (polikromatin) yang membuktikan rusaknya sel akibat mengalami fibrosarkoma.
Kata kunci : Pinostrobin, fibrosarkoma, Apoptosis, dan Antiangiogenesis
ABSTRACT
Induction of apoptosis and antiangiogenesis effects of Pinostrobin from Kaempferia pandurata Roxb against Fibrosarkoma mice induced with benzopiren have been investigated. Examination begins with taking tissue of fibrosarcoma in mice infected and weighing the fibrosarcoma obtained. Fibrosarcoma tissues were then stored in 10 % formalin. Weighing results showed that pinostrobin oral concentration of 80 mg/kg can inhibit 68.62 % growth of fibrosarcoma. It was also shown that cancer drug (positive control) resulted in 95.95 % inhibition compared to the negative control. This means pinostrobin can potentially be developed as a cancer chemotherapy drug.
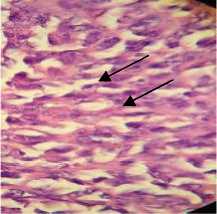
Patohystology analysis of the fibrosarcoma tissue with HE staining on light microscope with 400x magnification showed many chromatins (polychromatin) which proved the damage caused by the fibrosarcoma cells.
Keywords : pinostrobin, fibrosarkoma, Apoptosis, and Antiangiogenesis
PENDAHULUAN
Rimpang tanaman temu kunci (Kaempferia pandurata Roxb) sebagai obat tradisional di Indonesia pada umumnya banyak digunakan sebagai obat batuk kering, sariawan, gangguan pada usus besar, perut membengkak,
susah kencing pada anak-anak, radang selaput lendir pada mulut rahim, disentri, dan tumor/kanker. Berdasarkan penelitian yang dilaksanakan di Bangkok bahwa rimpang tanaman temu kunci (Kaempferia pandurata Roxb) diekstraksi dengan dieti eter menghasilkan kadar komponen senyawa flavonoid pinostrobinnya
relatif cukup besar yaitu 20 gram / 800 gram serbuk atau ± 2,5 % dan alpinetin sebanyak lebih kurang 1 % . Hasil penelitian ternyata pinostrobin memiliki aktivitas sebagai anti oksidan dan merelaksasi otot polos.(11) Salah satu metoda untuk menguji bahan - bahan yang bersifat sitotoksik adalah dengan uji toksisitas terhadap larva udang (Artemia salina L.). Metoda ini sering digunakan untuk screening awal terhadap senyawa aktif sebagai agent anti kanker di dalam ekstrak tanaman karena mudah, murah, cepat dan hasilnya dapat dipercaya. Hal ini dibuktikan dari 9 senyawa yang bersifat toksik terhadap larva udang setelah diuji langsung pada sel kanker (cell line) terbukti 7 dari senyawa tersebut dapat menghambat pertumbuhan sel kanker. Dengan kata lain uji ini mempunyai korelasi positif dengan potensi sebagai anti kanker.
Karena kadar pinostrobinnya cukup besar maka isolasi pinostrobin sebagai zat murni dapat dilakukan dengan cukup cepat. Dari struktur pinostrobin yang kepolarannya berkurang akibat adanya ikatan Hidrogen intra molekuler antara gugus karbonil pada C-4 dengan gugus hidroksi pada C-5 maka ekstraksi dapat dilakukan dengan pelarut yang kurang polar seperti kloroform dan n-heksana.
Hal ini dapat dilihat dalam struktur di
bawah ini :
CH3O O HO O HO O
OH O CH3O O OH O
Pinostrobin Alpinetin Pinocembrin
Berdasarkan strukturnya maka pinostrobin dapat diidentifikasi dengan spektroskopi UV-Vis untuk melihat λ maks sebagai ciri khas dari flavonoid yang terdiri dari 2 pita serapan yaitu pita I (325 nm) dan pita II (287 nm) serta pergeseran batokromik bila ditambah reaksi geser AlCl3 sebesar 20-26 nm untuk menandakan adanya substituen -OH pada posisi C-5. Identifikasi dengan spektroskopi IR untuk melihat gugus fungsinya, spektroskopi RMI Proton dan Karbon untuk melihat tipe dan jumlah dari pada atom H dan C dari Pinostrobin serta spektroskopi Massa
untuk melihat Massa Molekul Relatif (Mr) dan fragmentasi - fragmentasi dari 5-hidroksi-7-metoksi flavanon atau pinostrobin.
Senyawa flavonoid pinostrobin telah dapat diisolasi dari rimpang temu kunci (Kaempferia pandurata Roxb) dengan kadar ± 2,5%, dan telah diketahui bahwa senyawa pinostrobin memiliki aktivitas menghambat pertumbuhan sel kanker payudara manusia dan menghambat aktivitas enzim DNA Topoisomerase I (Sukardiman, 1999). Enzim DNA Topoisomerase mempunyai fungsi yang penting dalam proses intraseluler, yaitu berperan dalam proses replikasi dan proses proliferasi dari sel kanker. Dengan dihambatnya aktivitas enzim DNA Topoisomerase oleh senyawa inhibitor, maka proses terjadinya ikatan antara enzim dengan DNA sel kanker semakin lama. Sehingga akan terbentuk Protein Linked DNA Breaks (PLDB), akibatnya terjadi fragmentasi DNA sel kanker dan selanjutnya berpengaruh terhadap proses didalam sel khususnya proses replikasi sel yang diakhiri dengan kematian sel kanker. Adanya kerusakan DNA sel kanker dan selanjutnya berpengaruh terhadap proses didalam sel khususnya proses replikasi sel yang diakhiri dengan kematian sel kanker secara apoptosis (Sukardiman et al., 2006). Sehingga senyawa pinostrobin diduga memiliki aktivitas terapi maupun kemopreventif kanker secara in vivo pada kanker Fibrosarkoma Mencit Hasil Induksi Benzopirena. Adanya kerusakan DNA sel diduga dapat mengaktivasi tumor supressor gene p53 selain dapat menginduksi apoptosis, juga dapat mempengaruhi siklus sel dengan mempengaruhi inhibitor siklus sel p27 dan hambatan enzim cyclin-dependent kinase. Adanya aktivasi dan stabilisasi produk p53 oleh pinostrobin maka diduga dapat menghambat efek angiogenesis melalui mekanisme down regulasi atau penurunan ekspresi VEGF (Vascular Ephidermal Growth Factor) serta menurunkan ekspresi Cyclooxigense-2 (COX-2) dan Matrix Metaloproteinase – 9 (MMP-9) yang juga ikut terlibat dalam proses metastase sel kanker. Angiogenesis merupakan pembentukan kapiler darah dari sel kanker solid yang memiliki ukuran lebih besar dari 1-2 mm, akibatnya akan terjadi perkembangan dan pertumbuhan kanker dan akhirnya dapat menyebar keseluruh jaringan.
MATERI DAN METODE
Bahan
Bahan yang digunakan adalah serbuk rimpang temu kunci (Kaempferia pandurata Roxb) yang diperoleh dari Pasar Badung, Denpasar, Bali.
Bahan kimia yang digunakan adalah n-heksana teknis, n-heksana (p.a), metanol (p.a), etanol (p.a.), kloroform (p.a.), etil asetat (p.a) aquades, silika gel dan Plat KLT Aluminium dengan silika Gel GF-254 dari E Merck), dimetilsulfoksida dan larva udang (Artemia salina L.), formalin buffer 10%, PBS.
Peralatan
Alat yang digunakan adalah HPLC dan TLC -Densitometer Shimadzu CS-930, Spektrofotometer UV-Vis Hitachi 557 dan Shimadzu NIR 365, Spektrofotometer IR Jasco FTIR 5300, Spektrometer RMI Proton dan Karbon Hitachi FT-NMR 1500 serta Spektrometer Massa HP 8890, Mikroskop cahaya, preparat dan obyek glas.
Cara Kerja
Isolasi 5-hidroksi-7-metoksi flavanon pada Rimpang Temu Kunci (Kaempferia pandurata Roxb)
Ditimbang 1000 gram serbuk rimpang temu kunci, kemudian dilakukan perkolasi dengan pelarut n-heksana selama 24 jam (1 hari), perkolat yang ditampung diuapkan dengan rotari evavorator. Ekstrak n-heksan dibiarkan sampai timbul kristal amorf. Kristal amorf selanjutnya dikromatografi kolom vakum dengan pengembang n-heksana. Hasil kromatografi kolom kemudian ditampung, lalu diuapkan kembali dengan rotari evavorator sampai timbul kristal. Kristal disaring, kemudian direkristalisasi dengan metanol sebanyak 3 kali. Kristal yang diperoleh berwarna putih mengkilat. Kristal yang diperoleh ini selanjutnya ditentukan titik lelehnya dengan DTA dan Melting Points Apparatus Fiesher & John dan diuji kemurniannya dengan KLT dengan beberapa eluen yang polaritasnya berbeda, KLT-Densitometer dengan beberapa panjang gelombang serta KCKT. Dari hasil uji kemurnian ini bila pinostrobin dapat dikatakan murni selanjutnya diidentifikasi strukturnya dengan Spektroskopi UV-Vis untuk melihat λ maks dan pergeseran
batokromiknya, IR untuk menentukan gugus fungsinya, spektroskopi RMI Proton dan Karbon untuk menentukan tipe dan jumlah atom H dan C serta spektroskopi massa untuk menentukan Massa Molekul Relatif dari 5-hidroksi-7-metoksi flavanon / pinostrobin.
Induksi sel kanker Fibrosarkoma Mencit Hasil Induksi Benzopirena
Mencit jantan sebanyak 40 ekor mengalami proses adaptasi penelitian, selanjutnya semua mencit mendapatkan induksi benzopiren sebanyak 0,3 mg/0,2 mL dalam oleum olivarium secara injeksi subkutan pada daerah scapular sebanyak 5 kali, tiap dua hari sekali. Selanjutnya seluruh mencit dipelihara dalam suasana dan diet yang sama selama dua bulan / terbentuk kanker pada daerah tengkuk, Setelah volume kanker mencapai ± 100 mm3, mencit yang menderita kanker dikelompokkan secara acak menjadi 4 kelompok. Kelompok I adalah kontrol negatif, hanya diberikan CMC-Na. Kelompok II diberikan pinostrobin dosis 80 mg/kgBB ; kelompok III diberikan pinostrobin dosis 60 mg/kgBB ; kelompok IV diberikan siklofosfamid dengan dosis 13,33 mg/kgBB. Semua bahan uji diberikan secara intraperitonial (oral) dan diberikan setiap hari selama 14 hari. Setelah itu mencit dikorbankan dan dilakukan pengambilan jaringan kanker dan kemudian dilakukan penimbangan berat kanker.
HASIL DAN PEMBAHASAN
Isolat yang diperoleh positif flavonoid flavanon yaitu bila larutan sampel dalam metanol ditambah dengan FeCl3 , larutan menjadi berwarna merah, ditambah HCl pekat dan serbuk Mg, warna larutan menjadi merah muda dan ditambah NaOH 10%, larutan menjadi kuning muda. Uji kemurnian dengan KLT dengan mempergunakan fase gerak : n-butanol : Asam asetat : Air =4:1:5 ; Kloroform : Metanol = 3:1 ; Kloroform : Etanol = 15:1; n-heksana : etil asetat = 1:1 ; n-heksana : etil asetat = 3:1 ; n-heksana : etil asetat = 3:2 dan n-heksana : etil asetat = 7:3, setelah eluasi selesai plat disemprot atau ditaruh di atas uap amonia dan diamati dibawah lampu UV 254 nm diperoleh satu noda. Uji kemurnian dengan KLT-Densitometri pada panjang gelombang [220 nm (I) ; 254 nm (II);
287 nm (III); 300 nm (IV); 320 nm (V); dan 350 nm (VI)] diperoleh satu puncak serta diuji kemurniannya dengan KCKT diperoleh kemurnian 5-hidroksi-7-metoksi flavanon hasil isolasi = 94,83 %. Dari hasil uji kemurnian ini dapat dikatakan bahwa 5-hidroksi-7-metoksi flavanon hasil isolasi dikatakan murni secara kromatografi.
Analisis titik leleh dengan Melting Points Apparatus Feisher & John diperoleh range titik lelehnya = 99-100oC (I) ; 99,5-101,5oC (II) dan 99,5-100,5o C (III) serta dengan DTA diperoleh titik leleh = 97oC dan kestabilan zat sampai pada suhu 150oC. Identifikasi dengan spektrofotometer UV-Vis diperoleh λ maks =287 nm (pita II) dan bahu =325 nm (pita I), hal ini sesuai dengan literatur dimana flavonoid flavanon bila dianalisis dengan spektrofotometer UV-Vis akan menunjukkan dua pita serapan yaitu diantara 275 -295 nm (pita II) dan bahu pada 300-330 nm yang disebabkan gugus sinamoil dan benzoil dari flavanon, seperti ditunjukkan pada gambar di bawah ini, yang kemudian bila larutan pinostrobin dalam metanol ini ditambah dengan AlCl3 maka pita serapan II mengalami pergeseran batokromik sebesar 23 nm, hal ini menunjukkan bahwa pinostrobin merupakan flavonoid flavanon yang mengandung OH pada C-5, seperti yang ditunjukkan dalam struktur di bawah ini :
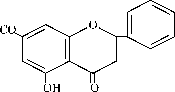
H3C
MeOH
AlCl3 ∕ HCl

Identifikasi dengan spektroskopi IR diperoleh bilangan gelombang 3437,46 cm-1 (menunjukkan -OH dengan ikatan Hidrogennya dengan -C=O pada C-4); 3061,31 cm-1 (menunjukkan -C-H strech dari aromatik) ; 1645, 43 cm-1 (menunjukkan -C=O keton yang mengalami ikatan hidrogen dengan -OH pada C-5) ; 1622,26 dan 1579,64 cm-1 (menunjukkan -C=C-aromatik) ; 3000-2800 dan 1450-1350 cm-1(menunjukkan -C-H metil dan metilen) ; 1250 dan 1290 cm-1 (menunjukkan -C-O).
Spektroskopi RMI proton menghasilkan pergeseran kimia (δ) pada 3,75 ppm (singlet) menunjukkan ArOCH3 (3H) ; 6,019 ppm (singlet) menunjukkan H-6 dan H-8 (2H) ; 11,948 ppm
(singlet) menunjukkan -OH (1H) ; 2,817-3,029 ppm (multiplet) menunjukkan H-3 cis atau trans (2H), multiplet dalam hal ini disebabkan karena tumpang tindih dan tetapan gandeng yang berbeda dari H yang berada dalam kedudukan cis atau trans ; 5,284 ppm (dd) menunjukkan H-2 (1H) sedangkan untuk RMI Karbon menghasilkan pergeseran kimia pada 55,583 ppm menunjukkan O-CH3 (1C) ; 79,121 ppm menunjukkan C-2 (1C) ; 43,326 ppm menunjukkan C-3 (1C) ; 195,440 ppm menunjukkan C-4 (1C) ; 163,944 ppm menunjukkan C-5 (1C) ; 95,037 ppm menunjukkan C-6 (1C) ; 167,755 ppm menunjukkan C-7(1C) ; 94,153 ppm menunjukkan C-8 (1C) ; 162, 572 ppm menunjukkan C-9 (1C) ; 103,025 ppm menunjukkan C-10 (1C) ; 138,241 ppm menunjukkan C1’ (1C) ; 125,954 ppm menunjukkan C2’dan C6’ (2C) ; 128,667 ppm menunjukkan C3’-C5’ (3C).(2,3,9) Dengan demikian dapat dikatakan dari hasil interpretasi spektrum RMI Proton dan Karbon diperoleh atom H = 14 dan C=16.
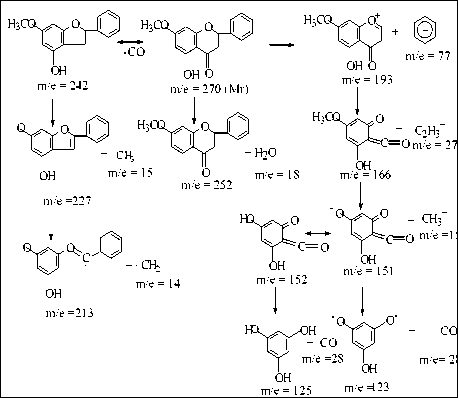
Spektroskopi Massa diperoleh ion molekul dengan m/e= 270 menunjukkan Massa Molekul Relatif dari Pinostrobin dan fragmentasi m/e = 252 (M+- H2O), m/e = 242 (M+-CO), m/e = 227 (M+-CO-CH3), m/e = 213 (M+-CO-C2H5), m/e = 193 (lepasnya cincin B/fenil yang diperkuat adanya fragmentasi m/e = 77), m/e = 166 (M+-C2H5-C6H5), m/e=152 (M+-C2H5-C6H5-CH3) dan m/e = 123 (M+-C2H5-C6H5-CH3-CO), seperti yang ditunjukka oleh skema berikut ini.
Berat Fibrosarkoma dan Gambar Histopatologi
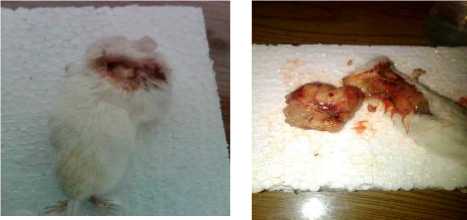
a. Mencit yang b. Fibrosarkoma hasil
dikorbankan pembedahan
Gambar 1. Pembedahan Fibrosarkoma sebelum diperlakukan
Sebelum dimasukkan ke dalam formalin buffer jaringan kanker ditimbang dan diperoleh beratnya = 3,4756 gram. Fibrosarkoma di masukkan dalam dalam Pot yang berisikan larutan buffer formalin 10%.

Gambar 3. Hasil Fibrosarkoma
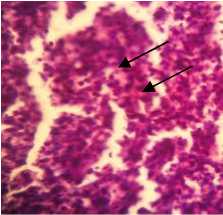
Hasil di Lab. Hewan, FF Unair (Oka AP., 2012)
Sumber : Pujitono, W. , 2010
Gambar 2. Hasil preparat Fibrosarkoma dengan pewarnaan HE (Pembesaran 40 x10)
Di sini terlihat banyak kromatin (polikromatin) yang membuktikan rusaknya sel akibat mengalami fibrosarkoma
Setelah dilakukan perlakuan selama 14 hari selanjutnya mencit dikorbankan diambil jaringan kankernya untuk pemeriksaan lanjutannya seperti berat kanker yang mendapat perlakuan.
Keseluruhan hasil fibrosarkoma hasil perlakuan dapat dilihat dalam gambar berikut ini :
Hasil Penimbangan seluruh fibrosarkoma dapat di lihat dalam Tabel 1.
Tabel 1. Hasil Penimbangan Fibrosakoma Jenis Berat Fibrosarkoma (gram )
Perlakuan I II III IV rata-rata
Tanpa 3,4756 3,4557 3,4656
Perlakuan
CMC-Na 4,2765 4,1665 4,1095 4,1383 4,1727 [Control(-)]
Pinostrobin 1,0665 1,0605 1,1198 1,1027 1,0874
80 mm/kg BB
Siklofosfamid0,1709 0,1021 0,2553 0,1021 0,1576 [Control (+)]
Analisis statistik menunjukkan bahwa terdapat perbedaan bermakna antara Pemberian pinostrobin pada mencit dengan konsentrasi 80 mg/kg BB dan pemberian obat antikanker siklofosfamid dengan p<0,05 atau ada hubingan signifikan antara pinostrobin 80 mg/kg BB dan siklofosfamid dengan pemberian CMC-Na sehingga dapat dikatakan pinostrobin berpotensi dipergunakan sebagai salah satu bahan obat kemoterapi kanker.
Penurunan berat fibrosarkoma dengan perlakuan pinostrobin dapat dilihat dalam histogram batang dan pie berikut ini :
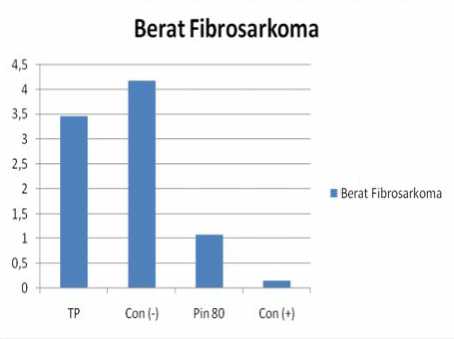
Gambar 4. Hasil Berat Fibrosarkoma
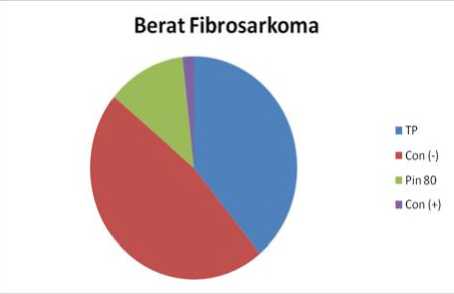
Gambar 5. Hasil Berat Fibrosarkoma
Melihat hasil di atas terlihat bahwa fibrosarkoma dengan tanpa perlakuan (kontrol negatif) mengalami kenaikan pertumbuhan sebesar 29,29%, sedangkan dengan konsentrasi oral Pinostrobin 80 mg/kg BB terjadi penurunan 68,62% dan dengan obat kanker (kontrol +) terjadi penurunan 95,95 %, hal ini berarti pinostrobin berpotensi dikembangkan sebagai bahan kemoterapi kanker.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian di atas dapat disimpulkan bahwa
-
1. Senyawa hasil isolasi yang didapatkan merupakan pinostrobin atau 5-hidroksi-7-metoksi flavanon.
-
2. Pinistrobin berpotensi dikembangkan sebagai kemoterapi penyakit kanker karena berat fibrosarkoma mengalami penurunan lebih dari 50 % dan dalam analisis statistik ternyata pinostrobin mempunyai pengaruh bermakna (p<0,05) dalam menghambat pertumbuhan kanker.
-
3. Hasil pemeriksaan Histopatologi sel fibrosarkoma dengan pewarnaan HE di dapatkan bahwa terdapat banyak kromatin (polikromatin) pada fibrosarkoma sebagai bukti rusaknya sel normal akibat terjadinya fibrosarkoma.
-
4. Konsentrasi oral pinostrobin 80 mg/kg BB dapat menurunkan 68,62% berat fibrosarkoma dan dengan obat kanker (kontrol +) terjadi penurunan 95,95 %, hal ini berarti pinostrobin berpotensi dikembangkan sebagai bahan kemoterapi kanker.
Saran
Perlu dilakukan penelitian lebih lanjut tentang efek apoptosis dan antiangiogenesis dari hasil perlakuan di atas secara imunohistokimia untuk melihat ekspresi p53, VEGF dan MMPs-9.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih yang sedalam-dalamnya kepada semua pihak khususnya Bapak Prof. Dr. Sukardiman, Drs, Apt. MS. dan Dr.rer.nat. Mulja Hadi Santosa, Apt. atas segala bimbingan dan ijin penggunaan lab Fitokimia dan Farmakognosi Fak. Farmasi Unair serta Bapak Eko Adiputra atas bantuannya dalam pemeliharaan dan pembedahan mencit di Lab. Hewan Fak. Farmasi Unair selama penelitian dikerjakan. Kami tak lupa mengucapkan terima kasih yang sedalam-dalamnya kepada Kepala LPPM Unud dan Staf atas dana yang diberikan dalam membiayai penelitian ini.
DAFTAR PUSTAKA
Anonim, 2005, Fibrosarkoma, http://medika-online.blogspot.com/2005/11/, fibrosar-koma.html , 28 September 2011
Bail,L., Aubourg L., and Habrioux G., 2000, Effect of pinostrobin on estro, Aug, 1 (156910) : 37-44
Banerjee S., Carlos, B.R., and Bharat B.A., 2002, Suppression of 7,12-Dimethylbenz(a)
anthracene-induced Mammary Carcinogenesis in Rats by Resveratrol,
Carcinogenesis, 62 : 4945-4954
Chrestella J., 2009, Gambaran Immunoekspresi Matrix Metallo-proteinase 9 (MMP-9) pada Lesi-Lesi Prakanker dan Karsinoma Serviks Invasif, Thesis, Universitas Sumatra Utara, Medan
Cumming, J. and Smyth, J.F., 1993, DNA Topoisomerase I and II as target of Rational Design of New Anticancer Drugs, Ann Oncology, Aug, 3 (7) : 533-534
Hembing W., 1994, Tanaman Berkhasiat Obat di Indonesia, Jilid III, Penerbit Pustaka
Kartini, Jakarta
Jianguo, M., Karin, Reed,A., and James, M., Gallo, 2002, Cells Designed to Deliver Anticancer Drug by Apoptosis, Cancer Research, 62 : 1382-1387
Manahan, D. and Wienberg, R.A., 2002, The Hallmarks of Cancer, Cell, 100 (57-70) : 1-59
Markam K.R., 1988, Cara Identifikasi Flavonoid, a.b. Penerbit ITB, Bandung, h. 1-59
Nagata, S., 1997, Apoptosis by Death Factor, Cell, 88 : 355 – 365
Oka Adi Parwata, 1998, Isolasi, Identifikasi Senyawa Pinostrobin pada Rimpang Temu Kunci (Kaempferia pandurata Roxb) dan Standarisasi Ekstrak Etanol Berdasarkan Kadar Pinostrobinnya dengan KLT
Densitometri, Thesis, PPS Unair,
Surabaya
Oka Adi Parwata, 2000, Uji Toksisitas Senyawa Pinostrobin pada Rimpang Temu Kunci (Kaempferia pandurata Roxb), DIK/DIKS, Lemlit Unud, Bali
Pai, S., Kaustubh, D., and Debabrata, M., 2001, Central Role of p53 Regulation of Vascular Permeability Factor/Vascular
Endothelial Growth Factor (VPF/VEGF) Expression in Mammary Carinoma, Cancer Research, 61 : 6952-6957
Pratiwi D,, dkk., 2009, Ekstrak Etanol Jeruk Nipis (Citrus auranttiifolia (C) Swingle) Meningkatkan Ekspresi p53 Pada Sel Payudara Tikus Galur Spague Dawley Terinduksi 7,12-dimetilbenzene-[A] Antrasena, Cancer Chemoprevention
Research Center, Fakultas Farmasi, UGM, Yogyakarta
Puspita N., dkk., 2009, Ekstrak etanol kulit jeruk mandarin (Citrus reticulata) Meningkatkan Ekspresi Faktor VEGF Pada Sel Kanker Kolon WiDr, Cancer Chemoprevention Research Center, Fakultas Farmasi, UGM, Yogyakarta
Ravi, R., Bijoyesh, M., Zaver, M.B., Carrie. H.S., and Dmitri, A., 2000, Regulation of tumor angiogenesis by p53-induced degradation of hypoxia-inducible factor 1α, Gene and Development, 14
Samiasih S., 2010, Perbedaan Ekspresi VEGF Sel Adenokarsinoma Kolorektal Tikus Sprague Dawley Dengan dan Tanpa Pemberian Ekstrak Phyllantus niruri, Thesis, UNDIP, Semarang
Silverstein, Bassler, and Morrill, 1981, Spectrometric Identification of Organic Compounds, John Willey and Sons, New York
Sukardiman, Mulyadi. T., dan Agus. D. 19981999, Mekanisme, Senyawa Flavonoid dari Kaempferia pandurata pada Kultur Sel Kanker Payudara Manusia, Penelitian Risbin IPTEKDOK
Sukardimana, Hadi Poerwono, Sofia Mubarika, dan Sismindari, 2000, Penapisan Senyawa Antikanker dari Tanaman Obat Indonesia dengan Molekul Target Enzim DNA Topoisomerase, Laporan Penelitian Domestic Collaborative Research Grant (DCRG)
Sukardimanb, Darwanto A, Tanjung M., and Parwarta Oka Adi, 2000, Cytotoxic Mechanism of Flavonoid from Temu Kunci (Kaempferia pandurata) in Cells Culture of Human Mammary Carcinoma, Clinical Hemorheology and Microcirculation, 23 : 185-190
Sukardiman, Noor Cholies Z., dan Sismindari, 2006, Induksi Apoptosis dan Peningkatan Ekspresi p53, Bax serta Aktivasi Enzim Caspase Sel Kanker Payudara Manusia oleh Pinostrobin dari Kaempferia pandurata Roxb, Laporan Penelitian Hibah Bersaing Tahun I, Lembaga Penelitian Universitas Airlangga
Wittmann S, Bali P, Donapaty S, Nimmanapalli R, Guo F, Yamaguchi H, Huang M, Jove R,
Wang HG, and Bhalla K., 2003, Flavopiridol down-regulates antiapoptotic proteins and sensitizes human breast cancer cells to epothilone B-induced apoptosis. Cancer Res, 63: 93-99
Whibley C., 2009, p53 polymorphisms: cancer implications, Nature RevIew Cancer, Vol. 9, Februari 2009, p. 95-107, http://www. google.co.id /p53+cancer+ search, l 6 Desember 2011
250
Discussion and feedback