STUDI INTERAKSI GLYCOGEN SYNTHASE KINASE-3? DENGAN SENYAWA AKTIF HIBISCUS SABDARIFFA LINN. SECARA IN SILICO
on
JURNAL KIMIA (JOURNAL OF CHEMISTRY) 17 (2), JULI 2023 DOI: https://doi.org/10.24843/JCHEM.2023.v17.i02.p8
p-ISSN 1907-9850
e-ISSN 2599-2740
STUDI INTERAKSI GLYCOGEN SYNTHASE KINASE-3β DENGAN SENYAWA AKTIF HIBISCUS SABDARIFFA LINN. SECARA IN SILICO
R. K. Anggraeni1*, L. Erliana2, T. Andraini3
1Fakultas Ilmu Kesehatan, Universitas Pembangunan Nasional Veteran Jakarta 2Departemen Kimia Kedokteran, Fakultas Kedokteran, Universitas Indonesia 3Departemen Fisiologi dan Fisika Kedokteran, Fakultas Kedokteran, Universitas Indonesia *Email: risakusuma@upnvj.ac.id
ABSTRAK
Hibiscus sabdariffa Linn. (HSL) merupakan salah satu tanaman yang ada di Indonesia. Tanaman tersebut diketehui mengandung banyak senyawa aktif yang berkhasiat, seperti quercetin. Senyawa tersebut termasuk dalam golongan flavonoid yang diketahui berpotensi untuk menghambat aktifitas Glycogen Synthase Kinase-3β (GSK-3β). GSK-3β terlibat dalam berbagai aspek fungsi otak mulai dari perkembangan otak awal, hingga berbagai aspek fungsinya pada orang dewasa seperti perkembangan sinaptik yang tepat dan transmisi saraf. Disregulasi aktivitas GSK-3β baik pada perkembangan awal atau pada masa dewasa dapat menjadi predisposisi gangguan neuropsikiatri dan neurologis. Penelitian ini bertujuan untuk mengidentifikasi, mengevaluasi serta mengeksplorasi afinitas dan interaksi molekuler antara senyawa aktif HBS terhadap GSK-3β dengan menggunakan simulasi penambatan molekuler secara in silico. Penelitian ini diawali dengan preparasi GSK-3β dan penetapan sisi aktifnya menggunakan ligan alaminya. Selanjutnya dilakukan studi interaksi molekuler antara senyawa aktif HSL terhadap sisi aktif GSK-3β dengan metode molekuler docking. Hasil uji menunjukkan bahwa Methyl_ epigallocatechin dan 3-Methylquercetin memiliki kemampuan untuk berikatan dengan GSK-3β. Dari hasil molekuler docking dan farmokokinetik dapat disimpulkan bahwa senyawa Methyl_ epigallocatechin dan 3-Methylquercetin berpotensi menjadi inhibitor kompetitif GSK-3β berdasarkan studi in silico.
Kata kunci: GSK-3β, Diabetes Melitus, Hibiscus sabdariffa Linn.
ABSTRACT
Hibiscus sabdariffa Linn. (HSL) is one of the plants in Indonesia. These plants are known to contain many efficacious active compounds, such as quercetin. These compounds belong to the class of flavonoids which are known to have the potential to inhibit the activity of Glycogen Synthase Kinase-3β (GSK-3β). GSK-3β is involved in various aspects of brain function from early brain development, to various aspects of its function in adults such as proper synaptics and nerve transmission. Dysregulation of GSK-3β activity either in early development or in adulthood can predispose to neuropsychiatric and neurological disorders. This study aims to identify, evaluate and investigate the affinity and molecular interactions between HBS active compounds for GSK-3β using in silico molecular docking simulations. This study began with the preparation of GSK-3β and determination of its active site using natural ligands. Furthermore, a molecular interaction study was carried out between the HSL active compound and the active site of GSK-3β using the molecular docking method. The test results showed that Methyl_ epigallocatechin and 3-methylquercetin had the ability to bind to GSK-3β. From the results of molecular docking and pharmacokinetics, it can be concluded that the compounds Methylepigallocatechin and 3-Methylquercetin have the potential to become competitive inhibitors of GSK-3β based on in silico studies.
Keywords: GSK-3β, Diabetes Mellitus, Hibiscus sabdariffa Linn.
PENDAHULUAN
Glycogen Synthase Kinase-3 (GSK-3) merupakan serin/threonin protein kinase yang pertama kali diidentifikasikan berperan pada sintesis glikogen. Sejalan dengan kemajuan penelitian, GSK-3 ditemukan terlibat pada banyak preoses seluler setidaknya lebih dari 40 protein
berbeda yang telah diidentifikasikan sebagai target fosforilasi GSK-3. GSK-3 terdiri dari dua isoenzim, yaitu GSK-3 alpha (GSK-3α) dan GSK-3 beta (GSK-3β), keduanya dikode oleh gen yang berbeda. Sekitar 85% urutan asam amino GSK-3α dan GSK-3β memiliki kesamaan termasuk 98% domain katalitiknya. Meskipun memiliki kesamaan struktur, GSK-3α dan GSK-3β tidak
sama secara fungsional karena isoenzim beta sangat diperlukan untuk perkembangan. Kedua isoenzim GSK-3 pada mamalia diekpresikan pada semua jaringan, ekspresi paling banyak pada otak dewasa, hal itulah yang menyebabkan ia penting untuk berbagai fungsi (Jaworski et al., 2019).
Studi sebelumnya menunjukkan bahwa GSK-3β terlibat dalam berbagai aspek fungsi otak mulai dari perkembangan otak awal, hingga berbagai aspek fungsinya pada orang dewasa seperti perkembangan sinaptik yang tepat dan transmisi saraf. Perlu keseimbangan yang tepat dalam pengaturan aktivitas GSK-3β untuk menjalankan fungsinya di neuron. Disregulasi aktivitas GSK-3β baik pada perkembangan awal atau pada masa dewasa dapat menjadi predisposisi gangguan neuropsikiatri dan neurologis (Jaworski et al., 2019). Baik studi in vitro dan in vivo menunjukkan bahwa peningkatan regulasi GSK-3β menginduksi Alzheimer Disease (AD) seperti hiperfosforilasi protein Tau terkait mikrotubulus yang menyebabkan defisit memori, protein Tau berfungsi untuk membantu menstabilkan mikrotubulus pada sel saraf di otak, sementara inhibisi GSK-3 menurunkan hiperfosforilasi Tau yang kemudian dapat meningkatan fungsi sinaptik kognitif (Wang dan Mandelkow., 2016). GSK-3β memiliki beragam fungsi fisiologis yang terkait dengan neurogenesis, pensinyalan intraseluler, sinaptik plastisitas dan viabilitas neuron. Spinelli dalam reviewnya menyebutkan bahwa GSK-3β mengatur proliferasi sel progenitor saraf dan neuroplastisitas. Aktivasinya menginduksi hiperfosforilasi protein tau yang dianggap sebagai penentu utama patogenesis AD. Insulin dapat menginduksi fosforilasi GSK3β pada residu serin 9 yang mengakibatkan penurunan aktivitas enzimatiknya (Spinelli et al., 2019). Dengan demikian penghambatan GSK-3β telah dianggap sebagai target terapi potensial neurodegeneratif .
Salah satu tanaman tropis yang berperan pada neurodegeneratif adalah Hibiscus sabdariffa Linn (HSL). HSL termasuk dalam famili Malvaceae yang banyak ditanam di berbagai negara. Tanaman ini sering digunakan dalam pengobatan tradisional karena kaya akan fitokimia seperti polifenol terutama antosianin, polisakarida dan asam organik sehingga memiliki prospek yang sangat besar dalam penggunaan terapi modern. Menurut Riaz dan Chopra dalam reviewnya sebagian besar penelitian mendukung dan memberikan dasar ilmiah untuk pernyataan bahwa HSL dan konstituen aktifnya berperan penting dalam pencegahan penyakit kronis dan degeneratif yang berhubungan dengan stres
oksidatif (Riaz dan Chopra., 2018). Saat ini penelitian interaksi senyawa aktif dalam HSL terhadap GSK-3β secara in silico belum sepenuhnya diketahui, oleh karena itu pada penelitian kali ini, peneliti akan menganalisis molekuler docking GSK-3β terhadap senyawa aktif pada HSL.
MATERIAL DAN METODE
Molekuler Docking
Penelitian in silico dilakukan dengan menggunakan perangkat lunak MarvinSketch, AutoDockTools-1.5.6, AutoDock Tools, LigPlot+, dan PyMOL. Perangkat keras yang digunakan adalah seri LENOVO Thinkpad 13 2nd Gen Signature Edition dengan prosesor Intel® Core™ i5-7200U CPU @ 2.50GHz 2.71 GHz dan sistem operasi Windows 10 Pro 64-bit. Informasi struktur tiga dimensi protein reseptor diperoleh dari situs web Protein Data Banks (PDB).
Persiapan Ligan
Ligan merupakan konstituen fitokimia HSL dari penelitian yang dilakukan oleh Herranz-López et al. (Herranz-López et al., 2017) yang terdiri dari 39 senyawa dalam HSL ditambah dengan satu native ligand yaitu N2V (kode native ligand pada PDB) yang kemudian akan di docking dengan GSK-3β. Dua dan struktur tiga dimensi ligan diperoleh dari database Pubchem® di .sdf format. Selain itu, struktur yang tidak ditemukan di database Pubchem® digambar secara manual menggunakan MarvinSketch. Semua struktur kemudian dioptimalkan dalam tiga dimensi dan mengubah format ke .pdb menggunakan MarvinSketch. Semua ligan ini kemudian diberi muatan, set torsi dengan format .pdbqt menggunakan AutoDockTools-1.5.6.
Persiapan Protein
Pada persiapan protein GSK-3β sebagai protein target dihasilkan dari pemodelan struktur tiga dimensi dalam format .pdb dengan PDB ID 3F7Z. Setelah itu, bagian yang tidak terpakai termasuk molekul air dihilangkan, ditambahkan hidrogen non-polar, diberikan muatan gasteiger, ukuran dan grid koordinat diatur. Pemilihan protein target dalam database PDB didasarkan pada hasil X-Ray kristalografi. Protein yang dipisahkan dari ligannya, proses ini bertujuan untuk mendapatkan protein tanpa ligan dan dengan ligan, sedangkan pelepasan atom HOH dari permukaan molekul protein dilakukan pada kondisi tanpa pelarut. Langkah-langkah ini
dilakukan dengan menggunakan AutoDockTools-1.5.6. ukuran grid box 40x40x40 Å dan grid center x: -0,025 y: 13.328 z: 17.837 dihasilkan di sekitar pusat residu situs aktif reseptor.
Validasi Protokol Molecular Docking
AutoDockTools 1.5.6 digunakan untuk mengetahui interaksi antara berbagai senyawa dan GSK-3β dengan cara memberikan inhibitor. AutoDock memerlukan koordinat reseptor dan ligan dalam format Mol2 atau PDB. Atom hidrogen polar ditambahkan dari file reseptor dan muatan parsialnya ditambahkan ke atom karbon
yang sesuai. File PDB reseptor diubah menjadi file format PDBQT yang berisi koordinat atom reseptor, muatan parsial, dan parameter solvasi. File ligan diubah menjadi file PDBQT. Kemudian penyiapan grid dan peta dihitung menggunakan program AutoGrid4 dengan dimensi 40 × 40 × 40 poin. Jarak grid adalah 0,375 dan pengaturan parameter AutoDock4 default digunakan untuk docking. Semua proses docking dilakukan menggunakan Lamarckian Genetic Algorithm (LGA) dan nilai docking yang diperoleh dalam kkal/mol. Dalam penelitian ini, LGA dipilih untuk mencari konformasi terbaik.
Gambar 1. Molekul 3D GSK-3β

Gambar 2. Ligan GSK-3β
Prediksi Molecular Docking antara Senyawa Aktif Hibiscus sabdariffa Linn. dengan GSK3β
Molekuler docking dilakukan untuk memprediksi interaksi antar molekul seperti protein (enzim, DNA) dengan senyawa aktif atau protein dengan protein. Pada penelitian ini, molekuler docking dilakukan antara senyawa aktif HSL dengan reseptor GSK-3β dengan PDB ID 3F7Z struktur tiga dimensi ini memiliki resolusi 3,00 Å tanpa mutasi. Senyawa aktif HSL yang dilakukan docking terdiri dari 39 senyawa aktif, ini sesuai dengan review yang dilakukan oleh Lopez, et,al seperti terlihat pada Tabel 1.
Metode molekuler docking dilakukan menggunakan aplikasi software AutoDock 4.2.6. Hasil molekuler docking menunjukkan terdapat interaksi antara senyawa aktif HSL dengan GSK-3β yang memiliki fungsi untuk menginhibisi. Senyawa aktif HSL yang berinteraksi dengan GSK-3β dijabarkan di dalam Tabel 2.
Berdasarkan hasil docking dengan GSK-3β, tiga senyawa aktif yang memiliki hasil docking terbaik adalah Kaempferol-3-O-sambubioside, Methyl_ epigallocatechin dan 3-Methylquercetin. Kaempferol-3-O-sambubioside terikat pada GSK-3β dengan ΔG yaitu -9.48 kkal/mol dan K1 112.34 nM. Kaempferol-3-O-sambubioside terikat pada GSK-3β dengan tujuh ikatan hidrogen melibatkan situs pengikatan Glu97, Asn186, Ile62, Vall35, Phe201. Kemudian Methyl_ epigallocatec dengan ΔG -9,66 kkal/mol dan memiliki tiga ikatan hidrogen di situs Lys85, Vall35, Phe201. Senyawa signifikan terakhir adalah 3-methylquercetin dengan ΔG -8,68 kkal/mol yang memiliki tujuh ikatan hidrogen di situs Lys85, Asp133, Glu97, Vall35, Phe201. Ketiga senyawa ini memiliki ikatan energi bebas yang paling dekat dengan nilai ligan asli, dan memiliki afinitas pengikatan tertinggi diantara ligan lainnya. Perbandingan residu asam amino dan jumlah ikatan hidrogen senyawa terbaik dijabarkan dalam Tabel 3.
Tabel 1. Senyawa Aktif HSL
No. Senyawa Aktif
-
1 Cyanidine 3-sambubioside
-
2 Delphinidin 3-O-beta-D-
sambubioside
-
3 Delphinidin 3-sambubioside
-
4 Hibiscus acid dimethylester
-
5 Hibiscus acid
-
6 Hydroxycitric acid
-
7 Kaempferol-3-O-sambubioside
-
8 Kaempferol-3-O-rutinoside
-
9 Prodelphinidin B3
-
10 Quercetin-3-rutinoside
-
11 Myricetin-3-arabinogalactoside
-
12 2-O-trans_Feruloylhydroxitricacid
-
13 2-O-caffeoylhydroxycitricacid
-
14 Caffeoylquinic acid
-
15 2-O-Caffeoylhydroxycitric acid
-
16 3-p-Coumaroylquinic acid
-
17 5-O-Caffeoylshikimic acid
-
18 Caffeoylglucose
-
19 Chlorogenic acid
-
20 Chlorogenoquinone
-
21 Cryptochlorogenic acid
-
22 Ethylchlorogenate
-
23 Methyl digallate-para
-
24 Methyl digillate-meta
-
25 Moupinamide
-
26 Neochlorogenic acid 3D
27 Methyl-epigallocatechin
28 Tetra-O-methyljeediflavanone
29 3-methylquercetin
30 Kaempferol
31 Kaempferol-3-glucuronide
32 Leucoside
33 Myricetin
34 Myricetin-3-glucoside
35 Quercetin 3-7-diglucuronide
36 Quercetin 3-O-glucuronide
37 Quercetin 3-sambubioside
38 Quercetin
39 Quercetin-3-glucoside
Tabel 2. Perbandingan nilai ΔG dan Ki dari hasil docking senyawa aktif HSL dengan GSK-3β
|
No |
Senyawa Aktif |
Binding Energy / ∆G (kcal/mol) |
Inhibition Constant (Ki) (uM) |
|
1 |
Cyanidine 3-sambubioside |
-7.25 |
4.87 |
|
2 |
Delphinidin 3-O-beta-D-sambubioside |
-6.38 |
21.22 |
|
3 |
Delphinidin 3-sambubioside |
-6.03 |
37.70 |
|
4 |
Hibiscus acid dimethylester |
-4.47 |
529.35 |
|
5 |
Hibiscus acid |
-2.01 |
33.41 |
|
6 |
Hydroxycitric acid |
-1.44 |
87.72 |
|
7 |
Kaempferol-3-O-sambubioside |
-9.48 |
112.34 |
|
8 |
Kaempferol-3-O-rutinoside |
+1761.45 | |
|
9 |
Prodelphinidin B3 |
-7.12 |
6.05 |
|
10 |
Quercetin-3-rutinoside |
-8.20 |
981.56 |
|
11 |
Myricetin-3-arabinogalactoside |
+1535.12 | |
|
12 |
2-O-trans_Feruloylhydroxitricacid |
+254.63 | |
|
13 |
2-O-caffeoylhydroxycitricacid |
+256.72 | |
|
14 |
Caffeoylquinic acid |
+186.31 | |
|
15 |
2-O-Caffeoylhydroxycitric acid |
+223.66 | |
|
16 |
3-p-Coumaroylquinic acid |
+129.64 | |
|
17 |
5-O-Caffeoylshikimic acid |
+208.39 | |
|
18 |
Caffeoylglucose |
+180.76 | |
|
19 |
Chlorogenic acid |
+245.68 | |
|
20 |
Chlorogenoquinone |
+194.08 | |
|
21 |
Cryptochlorogenic acid |
+271.80 | |
|
22 |
Ethylchlorogenate |
+290.26 | |
|
23 |
Methyl digallate-para |
+149.09 | |
|
24 |
Methyl digillate-meta |
+169.67 | |
|
25 |
Moupinamide |
-8.05 |
1.26 |
|
26 |
Neochlorogenic acid 3D |
-6.12 |
32.79 |
|
27 |
Methyl-epigallocatechin |
-9.66 |
83.26 |
|
28 |
Tetra-O-methyljeediflavanone |
-8.05 |
1.25 |
|
29 |
3-methylquercetin |
-8.68 |
434.27 |
|
30 |
Kaempferol |
-7.95 |
1.50 |
|
31 |
Kaempferol-3-glucuronide |
-7.90 |
1.61 |
|
32 |
Leucoside |
-7.04 |
6.87 |
|
33 |
Myricetin |
-7.56 |
2.89 |
|
34 |
Myricetin-3-glucoside |
-7.12 |
6.05 |
|
35 |
Quercetin 3-7-diglucuronide |
-4.33 |
675.07 |
|
36 |
Quercetin 3-O-glucuronide |
-7.69 |
2.30 |
|
37 |
Quercetin 3-sambubioside |
-6.85 |
9.51 |
|
38 |
Quercetin |
-8.27 |
862.64 |
|
39 |
Quercetin-3-glucoside |
-7.49 |
3.26 |
Tabel 3. Perbandingan residu asam amino dan jumlah ikatan hidrogen
|
Asam amino |
Native ligand |
Kaempferol-3-O-sambubioside |
Methyl_ epigallocatechin |
3-Methylquercetin |
|
Leu132 |
S |
^ |
S | |
|
Lys85 |
S |
S |
^ |
S |
|
(H: 3.18Å) |
(H:2.66 Å) |
(H: 2.65 Å) | ||
|
Met101 |
S |
^ | ||
|
Cys199 |
S |
S |
^ |
S |
|
Asp200 |
S |
S |
^ |
S |
|
(H: 2.88 Å) | ||||
|
Phe67 |
S |
S | ||
|
Gln185 |
S |
S | ||
|
(H: 2.94 Å) | ||||
|
Gly63 |
S | |||
|
Thr138 |
S |
^ | ||
|
Leu188 |
S |
^ |
^ |
S |
|
Ala83 |
S |
^ |
S |
S |
|
Tyr134 |
S |
^ |
S |
S |
|
Val110 |
S |
^ |
S |
S |
|
Val70 |
S |
^ |
S | |
|
Asp133 |
S |
S |
S | |
|
(H: 3.00 Å) | ||||
|
Ile62 |
S |
S |
S | |
|
Glu97 |
S |
^ |
S |
S |
|
(H: 2.98 Å) |
(H: 2.76 Å) | |||
|
Leu130 |
S |
S | ||
|
Asn186 |
S |
^ | ||
|
(H: 2.57 Å) | ||||
|
Ile62 |
S |
^ | ||
|
(H: 2.90 Å) | ||||
|
(H: 2.67 Å) | ||||
|
Vall35 |
S |
^ |
S |
S |
|
(H: 2.84 Å) |
(H: 2.77 Å) |
(H: 2.80 Å) |
(H: 2.47 Å) (H: 3.04 | |
|
(H: 2.91 Å) |
Å) (H: 3.25 Å) | |||
|
Phe201 |
^ |
S |
S | |
|
(H: 3.20 Å) |
(H: 3.10 Å) |
(H: 3.10 Å) |
Ket : S : Residu asam amino
H : Ikatan hidrogen
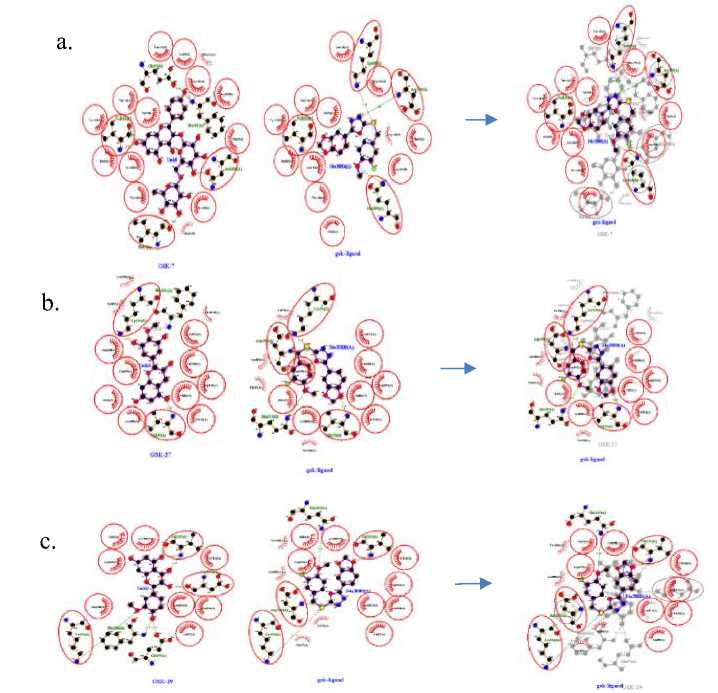
Gambar 3. Perbandingan dua dimensi hasil docking.
a. Interaksi Kaempferol-3-O-sambubioside dan Ligan, b. Interaksi 3Methyl-epigallocatechin dan Ligan, c. Interaksi 3-methylquercetin dan Ligan
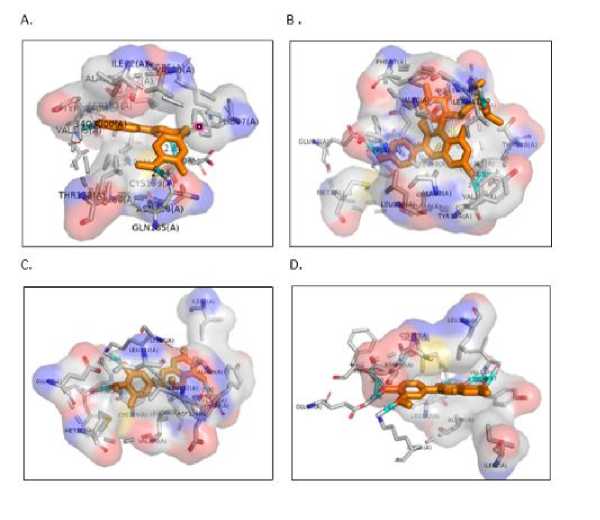
Gambar 4. Perbandingan tiga dimensi hasil docking.
A Kontrol Positif, B. Kaempferol-3-O-sambubioside, C. 3 Methyl-epigallocatechin, D. 3-methylquercetin
Toksisitas
Tujuan dari tahap ini adalah untuk memprediksi dan menilai kemungkinan toksisitas dan risiko yang timbul dari senyawa uji yang dapat mempengaruhi manusia. Prediksi toksisitas sangat penting dilakukan, karena senyawa uji sebagai kandidat obat tidak hanya membutuhkan aktivitas biologis yang baik, tetapi juga senyawa yang memiliki nilai toksisitas rendah. Pada penelitian ini, uji prediksi toksisitas dilakukan dengan menggunakan Ademetsar
(http://lmmd.ecust.edu.cn/admetsar1/predict). Jenis toksisitas yang diuji meliputi toksisitas endokrin, karsinogenisitas dan AOT (non-toxic with acute oral toxicity). Hasil uji ditunjukan pada Tabel 4.
Respon antagonis inhibitor dengan enzim atau protein reseptor tidak dapat menjamin kesesuaian inhibitor sebagai obat potensial. Oleh karena itu, ADME (absorpsi, distribusi, metabolisme, dan ekskresi) merupakan analisis kemiripan obat yang penting dalam penemuan obat selain itu dapat membantu membuat keputusan apakah inhibitor bisa diberikan ke sistem biologis atau tidak. Inhibitor dengan sifat ADME yang buruk dan efek toksisitas yang tinggi pada sistem biologis sering menjadi penyebab utama sebagian besar obat yang gagal dalam fase percobaan klinis (Abdullahi and Adeneiji., 2020).
Sifat fisikokimia ligan dapat diketahui dengan menetukan sifat hidrofilik atau hidrofobik suatu senyawa yang berdifusi pasif pada membran sel. Ini tertuang pada Aturan Lipinski. Koefisien kelarutan dalam lemak/air dinyatakan dalam nilai log P dengan rentang -0,4 –5. Semakin besar nilai logP menunjukan bahwa senyawa tersebut bersifat hidrofobik yang berarti senyawa tersebut cenderung memiliki toksisitas yang tinggi karena senyawa tersebut akan tinggal lebih lama pada lipid bilayer, jika hal tersebut terjadi maka akan menurunkan selektifitas ikatan terhadap enzim target karena senyawa terdistribusi lebih luas didalam tubuh. Sedangkan semakin negatif nilai logP juga tidak baik karena tidak dapat menumbus lipid bilayer. Kemudian senyawa yang memiliki berat lebih dari 500 Da tidak dapat berdifusi menembus membran sel. Jumlah donor dan akseptor ikatan hidrogen mendeskripsikan semakin besar kapasitas ikatan hidrogen, maka semakin besar pula energi yang dibutuhkan agar proses absorpsi dapat terjadi, rentang nilai yang baik untuk donor dan akseptor ikatan hidrogen adalah kurang dari 10 (Lipinski et al., 2012). Dalam penelitian ini, farmakokinetik dilakukan menggunakan Swiss ADME (http://www.swissadme.ch/), sedangkan Hasil ADME ditunjukkan pada Tabel 5.
Tabel 4. Prediksi Toksisitas
|
Ligand |
Toksisitas | |
|
AMES Karsinogenesis |
AOT | |
|
Kaempferol-3-O-sambubioside |
- - |
III |
|
Methyl-epigallocatechin |
- - |
III |
|
3-Methylquercetin |
- - |
III |
|
Tabel 5. Farmakokinetik | |
|
Ligand |
Drug likeness Molecular Weight H-bond H-bond LogP (g/mol) Acceptors donors |
|
Kaempferol-3-O-sambubioside |
594.52 15 9 -1.13 |
|
Methyl-epigallocatechin |
320.29 7 5 0.88 |
|
3-Methylquercetin |
316.26 7 4 1.65 |
|
Ligand |
Farmakokinetik GI Abs Inhibitor CYP CYP1A2 CYP2CI9 CYP2C9 CYP2D6 CYP3A4 |
|
Kaempferol-3-O-sambubioside |
Low No No No No No |
|
Methyl-epigallocatechin |
High No No No No No |
|
3-Methylquercetin |
High Yes No No Yes Yes |
HASIL DAN PEMBAHASAN
Senyawa aktif HSL yang akan di docking dengan GSK-3β terdiri dari 39 senyawa aktif yang didapatkan dari literature review oleh Lopez, et al. (López et al., 2017). Molekuler docking merupakan suatu metode yang dilakukan untuk memprediksi interaksi antar molekul yang stabil dan spontan dengan senyawa aktif atau protein dengan protein (Meng et al., 2011). Pendekatan ini menggunakan metode komputasi, sehingga memungkinkan untuk mengkarakterisasi sifat ligan di situs pengikatan protein target. Hasil uji komputerisasi molekuler docking menunjukkan bahwa terdapat interaksi senyawa aktif dan GSK-3β dengan 3 senyawa terbaik adalah Kaempferol-3-O-sambubioside, 3 Methyl-epigallocatechin, dan 3-methylquercetin.
Pada penelitian ini binding energy (ΔG) yang digunakan menunjukkan kekuatan dan afinitas interaksi antara ligan dan reseptor dimana ΔG yang lebih besar berkorelasi dengan interaksi yang lebih lemah sedangkan semakin kecil nilai ΔG maka semakin baik dan kuat interaksi antara ligan dan reseptor. Nilai ΔG negatif memiliki energi bebas kompleks yang kecil sehingga interaksi reseptor dan senyawa menjadi lebih stabil. Jadi, ligan dengan jumlah ΔG yang paling sedikit memiliki afinitas terbaik (Meng et al, 2011). Adapun nilai Inhibition Constant (Ki) merujuk pada semakin rendah nilai maka semakin tinggi afinitas ligan pada active site reseptor. Semua nilai ΔG dan Ki ligan uji nantinya dibandingkan dengan hasil ligan kontrol positif atau ligan asli untuk mengetahui potensi ligan uji. Residu protein digunakan untuk menentukan lokasi interaksi ikatan hidrogen tertentu dan menilai kesamaan interaksi antara ligan uji dan native ligand. Situs aktif reseptor dan situs pengikatan reseptor dari target protein yang digunakan dalam penelitian ini didapatkan dari PDB. Berdasarkan hasil docking dengan GSK-3β, senyawa dengan ΔG terendah adalah Methyl-epigallocatechin (ΔG = -9,66 kcal/mol), Kaempferol-3-O-sambubioside (ΔG= -9,48 kkal/mol) dan 3-Methylquercetin (ΔG= -8,68 kkal/mol). Ketiga senyawa ini memiliki nilai binding energy pada GSK-3β paling rendah dibandingkan senyawa uji lainnya. Hal ini menunjukkan bahwa senyawa tersebut memiliki stabilitas konformasi kompleks ligan-protein paling tinggi. Berdasarkan hasil visualisasi dua dan tiga dimensi menunjukkan bahwa konformasi pengikatan ini membentuk interaksi ikatan hidrogen di dalam situs aktif GSK-3β yaitu lima interaksi ikatan hidrogen Kaempferol-3-O-
sambubioside (Glu97, Asn186, Ile62, Vall35, Phe201), tiga interaksi ikatan hidrogen Methylepigallocatechin (Vall35, Phe201, Lys85), dan lima interaksi ikatan hidrogen 3-Methylquercetin (Vall35, Phe201, Lys85. Asp133, Glu97) dengan GSK-3(3F7Z) pada binding site. Peran asam amino dapat meningkatkan interaksi ligan-protein dan afinitas dari pengikatan inhibitor.
Pada tabel 4 menunjukan bahwa ketiga senyawa diatas tidak diprediksi beracun atau karsinogen. Namun, termasuk dalam kategori AOT III yang artinya sedikit beracun jika tertelan secara oral. Aturan Lipinski menyatakan bahwa obat yang aktif secara oral tidak lebih dari satu penyimpangan kriteria. Adapun aturan lipinski yaitu apabila berat kurang dari 500 Da, nilai logP kurang dari 5, jumlah donor ikatan hidrogen kurang dari 5, dan jumlah akseptor ikatan hidrogen kurang dari 10. Methyl-epigallocatechin dan 3-Methylquercetin memiliki berat kurang dari 500 g/mol, nilai donor maupun akseptor ikatan hidrogen dan nilai log P yang memenuhi kriteria Aturan Lipinski, sedangkan Kaempferol-3-O-sambubioside memiliki berat lebih dari 500 g/mol. Kemudian Analisa ADMET menggunakan admetSAR mengungkapkan Methylepigallocatechin dan 3-Methylquercetin memiliki skor Human Intestinal Absorption (HIA) yang lebih baik daripada Kaempferol-3-O-sambubioside. Sedangkan 3- Methylquercetin dapat menghambat tiga inhibitor CYP seperti yang ditunjukkan pada tabel 5. Induktor yang menginduksi CYP akan meningkatkan sintesis enzim, interaksi induktor CYP dengan substratnya menyebabkan laju kecepatan metabolisme obat meningkat sehingga kadar obat menurun dan efikasinya menurun, begitupun sebaliknya. Tidak adanya inhibisi pada CYP menyebakan meningkatnya pembentukan metabolit yang bersifat reaktif sehingga menimbulkan resiko toksik. Pada studi ini analisa toksik berdasarkan inhibitor CYP terbaik terdapat pada 3-Methylquercetin.
SIMPULAN
Molekuler docking diterapkan untuk mengeksplorasi mekanisme pengikatan dan untuk mengkorelasikan skor docking dan energi dengan aktivitas turunan (HSL) yang memiliki aktivitas penghambatan yang baik terhadap GSK-3β. Kami menemukan ada tiga senyawa terbaik untuk menghambat aktivasi GSK-3β yaitu Kaempferol-3-O-sambubioside, Methyl- epigallocatechin dan 3-Methylquercetin. Namun pada analisa
farmakokinetik berdasarkan absorpsi GI kami menemukan bahwa Kaempferol_3-O-
sambubioside memiliki tingkat absorpsi GI yang rendah, sehingga pada uji ini kami menemukan dua senyawa aktif dari HBS, yaitu Methylepigallocatechin dan 3-Methylquercetin yang memiliki hasil baik dalam absorpsi GI, sedangkan berdasarkan inhibitor CYP ditemukan hanya 3-Methylquercetinyang dapat menginhibisi tiga CYP. Dari hasil tersebut kami dapat melanjutkan lebih jauh dengan pengujian in vitro dan in vivo lebih lanjut untuk pengembangan dan otentikasi kemungkinan inhibitor kuat GSK-3β.
DAFTAR PUSTAKA
Abdullahi, M. and Adeniji, S. E., 2020. In-silico molecular docking and
ADME/pharmacokinetic prediction studies of some novel carboxamide derivatives as anti-tubercular agents. Chemistry Africa. 3(4):989-1000.
Herranz-López, M., Olivares-Vicente, M., Encinar, J. A., Barrajón-Catalán, E., Segura-Carretero, A., Joven, J. and Micol, V., 2017. Multi-targeted molecular effects of Hibiscus sabdariffa polyphenols: an opportunity for a global approach to obesity. Nutrients. 9(8): 4
Jaworski, T., Banach-Kasper, E. and Gralec, K., 2019. GSK-3β at the intersection of neuronal plasticity and neurodegeneration. Neural plasticity. 2-9.
Lipinski, C. A., Lombardo, F., Dominy, B.W. and Feeney, P.J., 2012. Experimental and
computational approaches to estimate solubility and permeability in drug discovery and development settings.
Advanced drug delivery reviews. 64: 4-17.
Meng X-Y, Zhang H-X, Mezei M, Cui
M.2011.Molecular Docking: A Powerful Approach for Structure-Based Drug
Discovery. Curr Comput Aided-Drug Des [Internet]. 2011 Jun 1. 7(2):146–57.
Available from:
http://www.eurekaselect.com/openurl/cont ent.phpgenre=article&issn=15734099&vol ume=7&issue=2&spage=146.
Spinelli, M., Fusco, S. and Grassi, C. 2019. Brain insulin resistance and hippocampal plasticity: mechanisms and biomarkers of cognitive decline. Frontiers in neuroscience. 13: 788.
Wang, Y. & Mandelkow, E. 2016. Tau in physiology and pathology. Nature reviews. Neuroscience. 17: 5–21.
174
Discussion and feedback