Gambaran Radiologis Pre-Operasi Sebagai Penentu Prognosis Pasien Glioma: Studi Pada Rumah Sakit Rujukan Pusat di Jawa Barat
on

DIRECTORY OF
OPEN ACCESS
JOURNALS
E-ISSN: 2548-981X
P-ISSN: 2548-5962

Gambaran Radiologis Pre-Operasi Sebagai Penentu Prognosis Pasien Glioma: Studi Pada Rumah Sakit Rujukan Pusat di Jawa Barat
Hendrikus Masang Ban Bolly1,3*, Achmad Adam2, Nina Puspitaningrum4, Ahmad Faried2, Muhammad Zafrullah Arifin2
-
1. Program Pascasarjana Doktor Ilmu Kedokteran, Fakultas Kedokteran Universitas Padjadjaran Bandung, Jawa Barat.
-
2. Departemen Bedah Saraf, Fakultas Kedokteran Universitas Padjadjaran/RS. Hasan Sadikin Bandung, Jawa Barat.
-
3. Departemen Bedah Fakultas Kedokteran Universitas Cenderawasih Jayapura, Papua.
-
4. Departemen Radiologi, RSUD Dok II Jayapura, Papua.
*penulis korespondensi: hendrikusbolly@gmail.com.
ABSTRAK
Tujuan: Untuk menilai nekrosis tumor, penyengatan zat kontras, dan edema peritumoral pada MRI pre-operasi sebagai prediktor rerata waktu kesintasan pasien glioma derajat rendah dan tinggi. Metode: Penelitian ini menggunakan desain potong lintang retrospektif yang melibatkan 26 pasien glioma derajat rendah (n=11) dan derajat tinggi (n=15) berdasarkan hasil histopatologi pasca operasi. Gambaran radiologi MRI pre-operatif dinilai menggunakan parameter nekrosis, penyengatan zat kontras dan edema peritumoral. Selain itu juga dihitung waktu kesintasan pasien pasca operasi untuk kemudian dianalisis secara statistik angka rerata kesintasan menggunakan analisis Kaplan-Meier. Hasil: Gambaran nekrosis tumor pada MRI pre-operatif memiliki pengaruh yang secara statistik bermakna terhadap rerata waktu kesintasan pasien glioma (p=0,021). Selain itu Karnofsky performance score (KPS) pasca operasi (p=0,050) dan lokasi tumor (p=0,036) juga berpengaruh pada rerata waktu kesintasan pasien glioma. Pasien glioma dalam penelitian ini memiliki rerata waktu kesintasan yang lebih pendek jika memiliki gambaran nekrosis derajat II pada MRI pre operatif (14 bulan); rerata waktu kesintasan lebih panjang jika lokasi tumor di lobus oksipital (38 bulan) dan KPS pasca operasi ≥70 (28,67 bulan). Kesimpulan: Pemeriksaan radiologis pre-operatif dapat
berkontribusi dalam penentuan prognosis pasien glioma. Meski demikian derajat histopatologis dan pemeriksaan molekuler tetap berperan penting dalam penentuan pilihan terapi lanjutan dan prognostik pasien glioma.
Kata kunci: glioma, MRI, nekrosis, prognosis, kesintasan.
DOI: https://doi.org/10.24843/JBN.2023.v07.i02.p03
ABSTRACT
Aim: To evaluate tumour necrosis, contrast enhancement, and peri-tumour oedema in the MRI preoperative as a prognostic factor for mean survival time in glioma patients. Method: This research analysed 26 patients retrospectively which already underwent tumour resection operatively and histological examination proved as astrocytic lower-grade glioma (n=11) and high-grade glioma (n=15). We reviewed some variables on pre-operative MRI as necrosis grading, enhancement and peri-tumour oedema. The survival time of patients was counted from the first day after the operation procedure. We use SPSS to count mean survival time of Kaplan-Meier analysis for each variable. Results: Our results showed that grade II necrosis on preoperative MRI was statistically significant to contribute to the shorter survival time (14 months) of the glioma patients. We also found that tumour location also has different survival time significantly (p= 0.036) and postoperative KPS has different survival time significantly (p= 0.050) respectively. Regarding gliomas, tumor location at occipital lobe has longer mean survival time (38 months) and postoperative KPS ≥ 70 has longer mean survival time (28.67 months). Conclusion: We conclude that the clinical routine of MRI examinations for gliomas patients may contribute to survival time predictions. Despite the histological degree of tumor
findings, molecular entities are still important factors for the future treatment consideration of gliomas patients and affect the final survival time.
Keywords: glioma, MRI, necrosis, prognostic, survival.
PENDAHULUAN
Glioma adalah salah satu tumor otak primer yang bersifat ganas dan letal.1,2 Glioma berasal dari sel-sel glial atau jaringan pendukung di sel otak dan korda spinalis. Sel glial sendiri dikelompokkan menjadi sel astrosit, oligodendroglial dan ependymal. Tumor glial terdiri dari glioblastoma, astrositoma, oligodendroglioma, ependymoma dan sub-ependymoma. Tumor glioma derajat I dan II dikategorikan sebagai glioma derajat rendah, sedangkan derajat IIIIV sebagai glioma derajat tinggi.3-5 Astrositoma difus (WHO grade II) memiliki insidensi 0,55 - 0,75 per 100.000 populasi; astrositoma anaplastik (WHO grade III) memiliki insidensi 0,37 per 100.000 populasi, sedangkan glioblastoma (WHO grade IV) memiliki insidensi 2,36 per 100.000.6,7
Prognosis kasus glioma berdasarkan derajat histopatologi secara umum adalah buruk. Astrositoma difus memiliki angka rentang kesintasan 6-8 tahun (median 10,9 tahun); astrositoma anaplastik 3-5 tahun; dan glioblastoma hanya 27.1 bulan.5,8,9 Penentuan prognosis sejak awal sangat penting untuk membantu rekomendasi pilihan terapi, modalitas terapi tambahan selain pembedahan dan akhirnya menentukan kualitas hidup pasien. Penentuan prognosis saat ini selalu dilakukan pasca pembedahan dan merujuk pada hasil pemeriksaan derajat tumor berdasarkan gambaran histopatologis. Metode yang lebih terbaru dalam penentuan prognosis pasien glioma saat ini adalah ditentukan berdasarkan pemeriksaan molekuler status mutasi enzim isositrat dehydrogenase-1 (IDH1).5 Pemeriksaan status mutasi tersebut dapat dilakukan
melalui beberapa metode seperti pemeriksaan polymerase chain reaction (PCR), sekuensing Sanger dan imunohistokimia.10-11 Sayangnya, modalitas pemeriksaan tersebut tidak tersedia merata di seluruh fasilitas kesehatan di Indonesia.
Pemeriksaan Computed Tomography scan (CT scan) atau Magnetic Resonance Imaging (MRI) kepala lebih rutin dilakukan dalam kerangka diagnostik dan persiapan peri-operatif untuk pasien-pasien dengan kecurigaan massa intra-kranial. Beberapa penelitian sebelumnya menggunakan penilaian beberapa parameter penting pada hasil pemeriksaan MRI pre-operatif untuk menentukan prognosis pasien glioma.12,13,14 Metode ini merupakan cara lebih sederhana dan murah dibanding pemeriksaan histopatologi dan molekuler lainnya. Penelitian ini dilakukan untuk memprediksi angka kesintasan rata-rata pasien glioma dalam konteks penentuan prognosis berdasarkan karakteristik radiologis terkait nekrosis, penyengatan zat kontras Gadolinium dan edema peritumoral pada kasus glioma (grade II, III, dan IV) yang telah dioperasi dan memiliki hasil pemeriksaan histopatologis.
METODE
Penelitian ini menggunakan desain potong lintang (cross sectional) yang secara retrospektif menggunakan hasil pemeriksaan derajat histopatologis tumor dan gambaran neuroimaging pre-operatif (MRI). Sebanyak 26 sampel pasien Glioma yang telah menjalani operasi bedah otak dan kemudian diperiksa derajat histopatologi menggunakan pewarnaan hematoxylin-eosin kemudian
didiagnosis sebagai glioma derajat rendah yaitu astrositoma difus (WHO grade II) sebanyak 11 pasien dan glioma derajat tinggi (astrositoma anaplastik, WHO grade III dan glioblastoma WHO grade IV) sebanyak 15 pasien. Seluruh pasien tersebut kemudian ditelusuri kelengkapan pemeriksaan
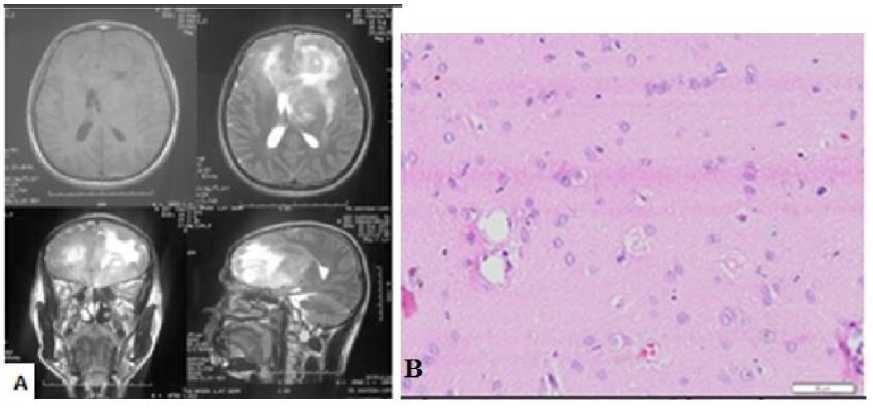
Gambar 1. MRI pre operatif (A), temuan intra-operatif (B) dan hasil penilaian derajat histopatologis menggunakan pewarnaan HE.
Penilaian parameter MRI pre-operatif merujuk pada kriteria penilaian yang digunakan dalam penelitian Hammound et al (1996).12 Penilaian meliputi nekrosis, penyengatan zat kontras pada batas tepi tumor dan edema peri-tumoral. Waktu kesintasan pasien dihitung sejak hari pasca operasi sampai dengan 30 April 2019 (dalam bulan). Analisis rerata waktu kesintasan (mean survival time/MST) dilakukan melibatkan semua sampel sehingga dapat diketahui prediksi waktu kesintasan pasien glioma derajat rendah dan derajat tinggi di RSUP Dr. Hasan Sadikin berdasarkan prediktor karakteristik MRI pre-operatifnya.
Analisis data menggunakan perangkat lunak SPSS 23 untuk menghitung MST pada analisis Kaplan-Meier untuk setiap variabel nekrosis, penyengatan zat kontras dan edema
radiologis MRI pre-operatif pada periode 2014 hingga 2019 untuk kemudian dianalisis beberapa parameter radiologisnya (Gambar 1). Penelitian ini dilakukan sesuai persetujuan etik dari Komite Etik Penelitian Kesehatan RSUP Dr. Hasan Sadikin Nomor LB.02.01/X.6.5/109/2019.
peritumoral. Selain itu Karnofsky performance score (KPS) pre dan pasca operatif, lokasi tumor pada lobus otak, dan jenis kelamin juga dinilai dalam penelitian ini. Log rank test (nilai p) bermakna jika ≤0,05. Penilaian variabel pada MRI pre-operatif menggunakan panduan seperti dalam Tabel 1.
HASIL
Sebanyak 26 sampel terdiri atas 11 hasil histopatologis yang menunjukan glioma derajat rendah (grade II) dan 15 glioma derajat tinggi (grade III dan IV) dinilai karakteristik demografis dan parameter MRI pre-operatif berdasarkan kriteria pada Tabel 1. Data demografi pasien dapat dilihat dalam Tabel 2. Hasil pemeriksaan dan pembacaan MRI pre-operatif dinilai oleh ahli radiologi bersertifikat.
|
Tabel 1. Definisi Variabel Penilaian | |
|
Kriteria |
Definisi |
|
Nekrosis |
Pada gambaran MRI terlihat sebagai penurunan intensitas sinyal T1 dan seringkali dikelilingi oleh penebalan kontras di sekitar nodul tumor. Grade 0 = tidak ada nekrosis pada gambaran MRI Grade I = area nekrosis <25% dari volume total tumor Grade II = area nekrosis antara 25-50% dari volume total tumor Grade III = area nekrosis >50% dari volume total tumor |
|
Penyengatan zat kontras oleh tepi batas tumor |
Merupakan gambaran yang muncul pada MRI sebagai area dengan peningkatan intensitas sinyal T1 yang mengelilingi area nekrosis. Dinilai pada gambaran pasca pemberian zat kontras Gadolinium di T1. Grade 0 = tidak ada penebalan Grade I = intensitas sinyal di sekitar nodul tumor kurang dari intensitas di lemak Grade II = intensitas sinyal di sekitar nodul tumor sama dengan intensitas di lemak |
|
Edema |
Pada gambaran MRI tampak sebagai area dengan peningkatan intensitas sinyal T2 di luar area yang menyengat zat kontras Gadolinium. Edema dinilai pada potongan T2 MRI. Grade I = jumlah edema kurang dari volume tumor Grade II = jumlah edema kira-kira sama dengan volume tumor Grade III = jumlah edema lebih besar dibanding volume tumor |
Tabel 2. Demografi Subjek Penelitian
|
Karakteristik |
Glioma derajat rendah |
Glioma derajat tinggi |
|
Jenis Kelamin | ||
|
Laki-laki |
6 |
11 |
|
Perempuan |
5 |
4 |
|
Usia (tahun) |
34.63 ± 16,33 |
49,53 ± 10,28 |
|
Karnofsky Performance Score (KPS) | ||
|
Pre operasi (mean) |
50 |
55 |
|
Pasca operasi (mean) |
54 |
53 |
|
Mortalitas | ||
|
Hidup |
10 |
13 |
|
Meninggal |
1 |
2 |
Hasil analisis waktu kesintasan menggunakan Kaplan-Meier pada semua sampel untuk parameter nekrosis di pemeriksaan MRI pre-operatif secara statistik berbeda bermakna untuk setiap derajat nekrosisnya (p = 0,021). Namun demikian, MST untuk variabel penyengatan tepi batas tumor terhadap zat kontras Gadolinium tidak berbeda bermakna (p=0,937); demikian juga untuk parameter edema peritumoral (p = 0,362). Sedangkan
untuk variabel KPS pasca operasi menunjukan perbedaan signifikan antara KPS <70 dan ≥70 (p = 0,050).
Variabel lain yang juga dianalisis adalah terkait lokasi tumor yang ternyata secara statistik berbeda bermakna (p = 0,036). Sementara jenis kelamin dan KPS pre operasi secara statistik tidak memiliki perbedaan yang bermakna. Hasil analisis MST data dilihat dalam Tabel 3.
Tabel 3. Hasil MST Kaplan-Meier Glioma Derajat Rendah dan Tinggi Berdasarkan Analisis MRI Pre operatif
|
Kriteria |
Derajat |
Hasil Perhitungan Kaplan-Meier (bulan) |
Nilai-p | |
|
MST |
IK 95% | |||
|
Nekrosis |
0 |
24 |
8,23-39,68 | |
|
I |
23,63 |
19,94-28,31 | ||
|
II |
14 |
5,8-22,19 |
0,021 | |
|
III |
29,25 |
20,81-37,69 | ||
|
Penyengatan |
I |
23,36 |
17,56 – 29,16 |
0,937 |
|
Zat Kontras |
II |
23,79 |
16,64 – 30,92 | |
|
Edema |
I |
23,46 |
17,15-29,76 | |
|
II |
21,10 |
14,52-27,68 |
0,362 | |
|
III |
36 |
28,16-43,84 | ||
|
Lokasi Tumor |
Frontal |
29,75 |
26,94 – 32,57 | |
|
Oksipital |
38 |
0 – 38 |
0,036 | |
|
Parietal |
29 |
6,99 – 15,31 | ||
|
Multilobar |
18,39 |
14,25 – 22,52 | ||
|
KPS Pasca |
<70 |
20,21 |
15,64 – 24,79 |
0,050 |
|
operasi |
≥70 |
28,67 |
20,77 – 36,57 | |
|
KPS Pre |
<70 |
21,50 |
16,27 – 26,72 |
0,233 |
|
Operasi |
≥70 |
26,67 |
18,96 – 34,37 | |
|
Jenis kelamin |
Laki-laki |
20,71 |
15,09 – 25,05 |
0,063 |
|
Perempun |
28,89 |
21,76 – 36,02 | ||
Hasil penelitian ini menunjukkan bahwa yang berlokasi di lobus frontal ternyata gambaran nekrosis grade II (25-50% dari memiliki MST terpanjang (29,75 bulan), volume total tumor) memiliki MST terpendek sebaliknya massa tumor yang multilobar (14 bulan) dibanding nekrosis grade III memiliki MST terpendek (18,39 bulan). KPS (>50% dari volume total tumor) yang pasca operasi yang nilainya ≥70 juga memiliki MST terpanjang (29,25 bulan). memiliki MST lebih panjang dibanding KPS Demikian juga dengan lokasi tumor glioma <70 (p=0,005) (Tabel 3).
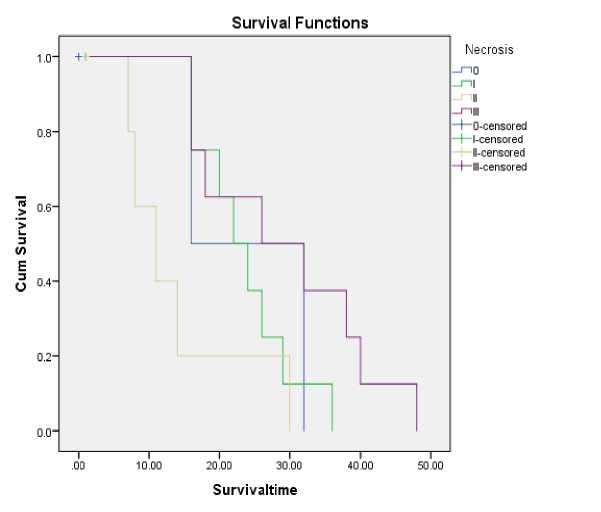
Gambar 2. Diagram MST Kaplan Meier untuk variabel Nekrosis
DISKUSI
Secara radiologis, gambaran neuroimaging berdasarkan pemeriksaan computed tomography scan (CT Scan) dan Magnetic Resonance Imaging (MRI) ketiga jenis glioma (grade II, III dan IV) memiliki perbedaan. Astrositoma difus (grade II) pada CT scan terlihat memiliki batas tidak tegas, massa homogen dengan densitas massa rendah; tanpa penyengatan kontras; sedangkan pada pemeriksaan MRI akan terdapat gambaran pada T1 sebagai hipointensitas dan T2 hiperintensitas.8 Astrositoma anaplastik pada CT scan terlihat densitas massa yang sangat rendah dan berbatas tidak tegas. Berbeda dengan WHO grade II, kontras secara parsial dapat mengalami penyengatan namun tidak ditemukan penyengatan cincin dan nekrosis sentral. Pertumbuhan tumor yang lebih cepat disertai dengan perkembangan edema peritumoral menyebabkan efek massa, pergeseran midline dan peningkatan tekanan intrakranial.8-9 Berbeda dengan kedua glioma sebelumnya, pada glioblastoma (grade IV) memiliki area nekrosis yang lebih luas, tidak menyengat kontras, berukuran besar saat diagnosa, edema lebih minimal dan peningkatan temuan kistik dan komponen difus.5,8
Memprediksi angka kesintasan dan prognosis sangat penting bagi pasien tumor glioma. Hal ini terkait dengan karakteristik sel tumor yang ganas dan terkait aspek klinis pasien itu sendiri. Penentuan prognosis pasien sangat dipengaruhi oleh banyak faktor seperti KPS pre-operatif, luasnya reseksi tumor, lokasi tumor, gejala klinis awal, waktu pertama kali diagnosis, prosedur re-operasi yang dijalani pasien dan berbagai terapi tambahan seperti kemoterapi maupun radioterapi.12,14,15,17
Pada penelitian ini diketahui bahwa perbedaan derajat nekrosis, lokasi tumor, dan
KPS pasca operasi berpengaruh signifikan sebagai penentu prognosis pasien glioma derajat rendah (grade II) dan derajat tinggi (grade III dan IV). Penelitian ini menunjukkan bahwa nekrosis grade II pada gambaran MRI pre operatif memiliki angka rerata kesintasan yang lebih pendek (Gambar 2). Beberapa penelitian lain melaporkan fakta yang unik dan menarik terkait hasil ini. Pada glioblastoma (grade IV), angka kesintasan lebih panjang dicapai jika ditemukan gambaran nekrosis grade I dan penyengatan zat kontras oleh batas tumor grade I pada MRI pre operatif.12 Hasil Hammound dkk.12 ini didukung juga oleh penelitian Wu dkk.13 yang menemukan bahwa predikor angka kesintasan pasien lebih pendek pada glioma grade III dan IV adalah edema peritumoral dan perluasan nekrosis tumor. Angka kesintasan yang menjadi lebih pendek juga dipengaruhi oleh KPS, derajat patologis, usia pasien dan kemo-radioterapi yang diterima pasien.13 Artinya pada berbagai penelitian menunjukkan bahwa seharusnya derajat nekrosis yang lebih luas akan memberikan prediksi angka kesintasan yang lebih pendek. Dalam penelitian ini terjadi sebaliknya diduga karena variasi rentang waktu kesintasan yang memiliki jarak sangat jauh antar kelompok grade II, grade III dan grade IV.
Penelitian ini menemukan bahwa edema bukan sebagai prediktor angka kesintasan pasien. Hasil tersebut berbeda dengan hasil yang dicapai oleh Schoenegger dkk.14 yang menemukan bahwa semakin besar edema peritumoral maka akan semakin pendek angka kesintasan pasien. Selain itu, pemendekan waktu kesintasan pasien juga dipengaruhi oleh KPS pasca operasi, usia pasien, dan jenis reseksi massa tumor glioma itu sendiri.14,18 Secara khusus untuk glioma derajat rendah, terdapat faktor derajat histopatologi tumor, lokasi massa tumor dan
penyengatan zat kontras yang akan mempengaruhi prognosis pasien.15 Sedangkan pada glioma derajat tinggi, terdapat faktor usia, KPS, status mental, luas reseksi tumor, derajat histopatologis yang diketahui akan sangat mempengaruhi prognosis pasien.16
Glioma merupakan jenis tumor otak yang memiliki karakteristik alami bersifat difus dan infiltratif.18 Ekstensi prosedur operasi untuk reseksi tumor sangat ditentukan juga oleh pemeriksaan pre-operatif MRI; sehingga seringkali tujuan operatif juga tergantung pada luas massa tumor yang tergambar pada pemeriksaan radiologis.18 Dengan demikian, sekali lagi gambaran radiologis pre-operatif memiliki peranan pada kerangka berpikir perhitungan dan prediksi angka kesintasan pasien glioma. Pada penelitian lain, diketahui juga bahwa MST grade III dan IV di Thailand adalah masing-masing 20 bulan dan 9 bulan.17 Sayangnya, penelitian ini tidak membedakan secara spesifik analisis MST pada grade III dan IV, namun lebih berfokus pada prediksi MST secara keseluruhan pasien glioma (grade II, III dan IV) menggunakan panduan penilaian MRI pre-operatif. Hal ini merupakan salah satu keterbatasan dalam penelitian ini. Keterbatasan lainnya adalah penelitian ini tidak menganalisis beberapa faktor preditor lainnya seperti luas reseksi tumor, modalitas kemoterapi, radioterapi dan penanda molekuler seperti status mutasi IDH1 yang saat ini diketahui juga berkontribusi pada MST pasien glioma
SIMPULAN
Penelitian retrospektif yang dilakukan pada salah satu RS pusat di Jawa Barat ini menunjukkan spesifikasi faktor penentu MST pasien glioma. Pada pasien glioma derajat rendah (grade II) dan tinggi (grade III dan IV) memiliki angka kesintasan yang lebih panjang tergantung pada derajat nekrosis di
gambaran MRI pre-operatif, lokasi tumor dan KPS pasca operasi. Meski demikian derajat histologis dan entitas pemeriksaan molekuler seperti status mutasi IDH1 akan lebih kuat sebagai prediktor prognosis pasien glioma.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada Kepala Departemen Bedah Saraf FK Unpad/RSUP Dr. Hasan Sadikin yang telah mendukung pelaksanaan penelitian ini.
PERNYATAAN
Semua penulis menyatakan tidak ada konflik kepentingan dengan pihak manapun terkait tulisan ini.
DAFTAR PUSTAKA
-
1. Abdi Z, Eskandary H, Nematollahi-Mahani SN. Effects of Two Types of Human Cells on Outgrowth of Human Glioma in Rats. Turk Neurosurg.
2018;28:19-28.
-
2. Gokturk D, Kelebek H, Ceylan S, dkk. The Effect of Ascorbic Acid Over the Etoposide- and Temozolemide-Mediated Cytotoxicity in Glioblastoma Cell
Culture: A Molecular Study. Turk
Neurosurg. 2018;28:13-8.
-
3. Erdi F, Bulent K, Hasan E, dkk. New Clues in the Malignant Progression of Glioblastoma: Can the Thioredoxin
System Play a Role? Turk Neurosurg. 2018;28:7-12
-
4. Kyritsis AP, Bondy ML, Rao JS, dkk. Inherited predisposition to glioma. Neuro-oncology. 2010;12:104-13
-
5. Ohgaki H, Kleihues P, von Deimling A, dkk. Glioblastoma IDH-mutant. Dalam: Louis DN, Ohgaki H, Wiestler OD, dkk editors. WHO Classification of Tumours of the Central Nervous System Revised. 4th Ed. Lyon: International Agency for Research on Cancer; 2016. hal.52-6.
-
6. Ostrom QT, Bauchet L, Davis FG, dkk. The epidemiology of glioma in adults: a
“state of the science” review. Neuro Oncol. 2014;16:896-913.
-
7. Fu J, Shu J, Yu X, dkk. Predicting tumor recurrence of astrocytoma by Ki-67 and proton magnetic resonance spectra. Int J Clin Exp Med. 2017;10:11187-96.
-
8. von Deimling A, Huse JT, Yan H, dkk. Diffuse astrocytoma, IDH-mutant. Dalam: Louis DN, Ohgaki H, Wiestler OD, dkk editors. WHO Classification of Tumours of the Central Nervous System Revised. 4th Ed. Lyon: International Agency for Research on Cancer; 2016. hal.18-23.
-
9. Mellai M, Piazzi A, Caldera V, dkk. IDH1 and IDH2 mutations,
immunohistochemistry and associations in a series of brain tumors. J Neurooncol. 2011;105:345-57.
-
10. Preusser M, Wohrer A, Stary S, dkk. Value and Limitations of
Immunohistochemistry and gene Sequencing for Detection of the IDH1R132H mutation in diffuse Glioma Biopsy Specimens. J Neuropathol Exp Neurol. 2011;70:715-23.
-
11. Catteau A, Giraldi H, Monville F, dkk. A new sensitive PCR assay for one-step detection of 12 IDH1/2 mutations in glioma. Acta Neuropathol Commun. 2014;2:58.
-
12. Hammoud MA, Sawaya R, Shi W, dkk. Prognostic significance of preoperative MRI scans in Glioblastoma multiforme. J Neurooncol. 1996;27:65-73.
-
13. Wu CX, Lin GS, Lin ZX, dkk.
Peritumoral edema on magnetic resonance imaging predicts a poor
clinical outcome in malignant glioma. Oncol Lett. 2015;10:2769-76.
-
14. Schoenegger K, Oberndorfer S, Wuschitz B, dkk. Peritumoral edema on MRI at initial diagnosis: an independent prognostic factor for glioblastoma? Eur J Neurol. 2009;16:874-8.
-
15. Stupp R, Janzer RC, Hegi ME, dkk. Prognostic Factors for Low Grade Gliomas. Semin Oncol. 2003;30(6 Suppl 19):23-8.
-
16. Buckner JC. Factors influencing survival in high-grade gliomas. Semin Oncol. 2003;30(6 Suppl 19):10-4.
-
17. Noiphithak R, Veerasarn K. Clinical predictors for survival and treatment outcome of high-grade glioma in Prasat Neurological Institute. Asian J Neurosurg. 2017;12:28-33.
-
18. Moiyadi AV. Glioma surgery: The art and science. International Journal of Neurooncology. 2018;1:6-10.
60
Discussion and feedback