TEKNIK STERILISASI DAN EFEKTIVITAS 2,4-D TERHADAP PEMBENTUKAN KALUS EKSPLAN DAUN NILAM (Pogostemon cablin Benth) IN VITRO
on
J. Agric. Sci. and Biotechnol.
ISSN: 2302-0113
Vol. 8, No. 1, Juli 2019
TEKNIK STERILISASI DAN EFEKTIVITAS 2,4-D TERHADAP PEMBENTUKAN KALUS EKSPLAN DAUN NILAM (Pogostemon cablin Benth) IN VITRO
Yuyun Fitriani1, Gede Wijana2*), Ida Ayu Putri Darmawati2
-
1Program Studi Agronomi, Jurusan Budidaya Pertanian, Fakultas Pertanian, Universitas Udayana
-
2Program Studi Agroekoteknologi, Fakultas Pertanian, Universitas Udayana *)Corresponding author: wijana07@yahoo.com
Abstract
Patchouli plant (Pogostemon cablin Benth) is a plant that produce essential oil which is called patchouli oil. Indonesia is the largest supplier of patchouli oil in the world market, which contribute about 90%. Advantage of patchouli oil in the perfume industry is a fixative property, it has the ability to bind with other oils therefore the scent can last for long time and has yet to be made synthetically. However, it takes very long time to produce essential oils in the conventional production system, becouse the growth of patchouli plant is relative slow. One alternative to produce the raw material or patchouli plant faster is through the tissue culture. The sterilization technique and the growth regulator are main factor in tissue culture. Therefore the purpose of this study was to find a sterilization technique, as wel as the concentration of growth regulators 2,4-D (2,4-
diclorophenoxy acetic acid) in MS + coconut water medium. Sterilization with HgCl2 (mercury chloride) at concentration 0.1% for 10 min was the best method of sterilization to minimize contamination. Plant growth regulators 2,4-D at concentration 0.5 ppm was found very affectivein accelerating the formationof patchouli leaf callus in vitro. The callus formation occured retatively fast (9.67 days) with cream-colour, crumb texture, and with diameter 1.21 cm. The fresh and dry weight of callus were 1.35 g and 0.76 g respectively.
Keywords : Pogostemon cablin, sterilization technique, 2,4-D, callus formation.
Tanaman nilam (Pogostemon cablin Benth) merupakan salah satu tanaman penghasil minyak atsiri yang terkenal dengan nama minyak nilam (patchouli oil). Indonesia merupakan pemasok minyak nilam terbesar di pasaran dunia dengan kontribusi 90% dari kebutuhan dunia. Industri parfum menggunakan minyak nilam sebagai bahan baku utama yang fungsinya tidak dapat digantikan oleh minyak lain, karena minyak nilam bersifat fiksatif. Proses produksi minyak atsiri
secara konvensional sangat panjang di mulai dari budidaya tanaman, pemetikan, penyimpanan kemudian penyulingan. Salah satu alternatif dalam memproduksi minyak nilam yaitu teknik kultur jaringan sangat perlu untuk dikaji.
Pada umumnya untuk mempelajari sintesis metabolit sekunder secara in vitro yang sering digunakan adalah kultur organ, kultur suspensi sel dan kultur kalus (Manthell dan Smith, 1983 dalam Fitriani, 2002). Kultur yang lebih berpotensi untuk digunakan dalam menghasilkan metabolit sekunder adalah kultur suspensi sel dan kultur kalus (Indrianto, 2002). Kalus merupakan kumpulan sel yang tidak beraturan yang terjadi dari sel-sel jaringan yang membelah diri secara terus menerus. Melalui kultur kalus akan diperoleh kalus dari eksplan yang diisolasi dan ditumbuhkan dalam lingkungan terkendali yang dikenal dengan teknik kultur jaringan (Gunawan, 1988).
Kegagalan pada teknik kultur jaringan sering disebabkan oleh adanya kontaminan pada eksplan dan media kultur. Sterilisasi merupakan salah satu upaya untuk menghilangkan mikoorganisme penyebab kontaminan pada eksplan. Kontaminasi merupakan faktor dominan yang mempengaruhi keberhasilan dalam teknik kultur jaringan terutama pada eksplan. Beberapa bahan kimia yang dapat digunakan untuk mensterilkan permukaan eksplan adalah sunligth cair, clorox, (NaOCl), HgCl2, AgNo3 dan alkohol. Sugiharto et al., (2007) menggunakan larutan clorox dengan konsentrasi 5% selama 3 menit kemudian dilakukan pembilasan berulang menggunakan aquades steril. Eksplan dari jenis tanaman yang berbeda, kadangkala berbeda pula teknik dan bahan sterilannya, sehingga perlu pengkajian.
Faktor lain penentu keberhasilan kultur jaringan adalah penggunaan zat pengatur tumbuh (ZPT) pada media.jenis dan konsentrasi ZPT sangat tergantung pada jenis tanaman dan tujuan kulturnya. ZPT merupakan komponen yang sangat penting untuk pertumbuhan dan perkembangab eksplan (Indrianto, 2002). Wattimena (1988) ZPT yang umum digunakan untuk menginduksi kalus adalah golongan auksin 2,4-D. Selain auksin ZPT sitokinin juga berpengaruh terhadap deferensiasi sel dalam proses embryogenesis somatik seperti BAP dan BA.
Penambahan senyawa organik seperti air kelapa pada media kultur sebagai sumber gula, asam amino, vitamin dan ZPT, dapat mengoptimalkan terbentuknya kalus. Tulecke et al., 1961 dalam Utari (2006) menyatakan air kelapa mengandung zat/bahan-bahan seperti unsur hara, vitamin, asam amino, asam nukleat dan zat pengatur tumbuh seperti auksin dan asam giberelat yang berfungsi sebagai penstimulasi proliferasi jaringan, memperlancar metabolisme dan respirasi.
Penggunaan air kelapa jika dipadukan dengan auksin akan mempunyai pengaruh positif dalam pertumbuhan dan perkembangan tanaman secara in vitro, sehingga diharapkan ada hubungan yang sinergis antara penggunaan air kelapa dan auksin jenis 2,4-D pada media dasar MS untuk meningkatkan terbentuknya kalus (Gunawan, 1992).
Tujuan dari penelitian ini adalah untuk menentukan teknik sterilisasi terbaik dalam menekan terjadinya kontaminasi. Menentukan pengaruh 2,4-D terhadap terbentuknya kalus eksplan daun nilam serta mendapatkan konsentrasi 2,4-D terbaik terhadap pembentukan kalus.
Penelitian dilaksanakan pada bulan April hingga Agustus 2010 di UPT kultur Jaringan, Program Studi Agroekoteknologi, Fakultas Pertanian, Universitas Udayana. Alat yang digunakan adalah autoklaf, gelas ukur, petridish, scapel, pinset, lampu burnsen, LAFC, oven, timbangan, pH meter, batang pengaduk, gelas erlenmeyer, botol ukur, aluminium foil, kertas steril,label, penggarir, kamera. Bahan yang digunakan adalah daun tanaman nilam Aceh daun ketiga dari atas, media dasar MS (Murashige and Skoog), agar-agar sebagai pemadat, ZPT (zat pengatur tumbuh) 2,4-D, sukrosa, air kelapa gading, bahan sterilan detergen, clorox, HgCl2 dan AgNO3.
Percobaan ini dibagi atas dua tahap yaitu (I) Metode sterilisasi eksplan daun nilam dan (II) Efektivitas 2,4-D terhadap pembentukan kalus daun nilam in vitro.
Percobaan I: Metode sterilisasi eksplan daun nilam dibagi tiga perlakuan yaitu: Metode A. Daun nilam direndam dalam clorox 20% + 1 tetes tween selama 10 menit. Dibilas dengan aquades steril, kemudian direndam lagi ke clorox 10% selama 7 menit dan dibilas dengan aquades steril tiga kali. Ambil eksplan dan ditaruh di petridish kemudian eksplan dipotong-potong dengan ukuran 1 cm x 1 cm dan ditanam.
Metode B. Daun nilam dalam larutan Hgcl20,1% selama 10 menit dan dibilas aquades steril 3 kali. Kemudian eksplan dipotong-potong di petridish yang berisi asam ascorbat dan ditiriskan ditissu steril dan ditanam.
Metode C. Daun nilam direndam di AgNO3 0,1% selama 10 menit, dibilas dengan aquades steril 3 kali, kemudian eksplan dipotong-potong di petridish yang berisi asam ascorbat 2 g/l, eksplan ditiriskan ditissu dan siap ditanam.
Masing-masing metode sebanyak 18 botol dan setiap botol berisi 3 eksplan, sehingga terdapat 54 botol kultur dan 162 eksplan. Pengamatan dilakukan selama 2 minggu dan yang diamatai presentase kontaminasi dan presentase browning. Kemudian hasil terbaik digunakan pada percobaan ke II (Efektivitas 2,4-D terhadap pembentukan kalus daun nilam).
Percobaan ke II menggunakan Rancangan Acak Lengkap (RAL) faktor tunggal dengan tiga ulangan. Perlakuan yang dicobakan yaitu konsentrasi 2,4-D (0,0; 0,5; 1,0; 1,5; 2,0 dan 2,5) ppm pada media MS yang mengandung 150 ml/l air kelapa gading. Pengamatan dilakukan setiap hari selama 4 minggu. Parameter yang diamati adalah: waktu pelengkungan, waktu muncul kalus, warna kalus, struktur kalus, diameter kalus, berat basah kalus dan berat kering oven kalus. Data hasil pengamatan yang nilainya kurang dari 10, ditransformasikan menggunakan
rumus akar kuadrat √x +0,5 (Gaspersz, 1995, dalam Amien, 2007). Data selanjutnya dianalisis sidik ragam jika perlakuannya berpengaruh nyata menggunakan uji Duncan 5%. Data yang tidak bisa dianalisis ditabulasi dan dibahas secara deskriptif.
Salah satu permasalahan yang menghambat keberhasilan kultur jaringan adalah adanya kontaminasi dan browning. Jumlah kultur tanaman nilam yang terkontaminasi terbanyak didapatkan pada metode A (Clorox) yaitu 100% dan terkontaminasi terkecil diperoleh pada metode B yaitu 44,5% (Tabel 1). Metode B: sterilan HgCl2 dan pemotongan eksplan dilakukan di dalam asam askorbat merupakan metode yang paling baik untuk menekan kontaminasi. Kontaminasi ini dapat terjadi sejak 1 hari setelah tanam sampai akhir pengamatan.
Tabel 1. Pengaruh metode sterilasasi eksplan pada 14 hari setelah tanam.
Metode Sterilisasi Kontaminasi Ekplan Hidup Browning
(%) (%) (%)
|
Metode A |
100 |
0 |
100 |
|
Metode B |
44,5 |
55,5 |
16,7 |
|
Metode C |
77,8 |
22,2 |
38,9 |
Beberapa penelitian menunjukkan bahwa HgCl2 efektif untuk menekan terjadinya kontaminasi. Penelitian yang dilakukan Geeta et al., (2000) pada eksplan panili yang akan diinisiasi disterilksn terlebih dahulu permukaannya menggunakan HgCl2 (mercuri chloride) dengan kosentrasi 0,1% selama 10 menit dan dibilas berulang dengan aquades steril. Giridhar et al., (2001) pada multiplikasi tunas panili juga menggunakan HgCl2 (mercuri chloride) dengan kosentrasi 0,1% sebagai bahan sterilan.
Fenomena terjadinya kontaminasi sangat beragam. Keragaman tersebut dapat di lihat dari jenis kontamian yang lebih banyak di dominasi oleh jamur dibandingkan dengan bakteri (Gambar 1). Tingkat serangan yang tinggi diakibatkan oleh sumber eksplan yang masih membawa kontaminasi dalam jumlah yang banyak sehingga masih sulit untuk di tanggulangi dengan ketiga metode sterilisasi tersebut.

Gambar 1. Eksplan yang mengalami kontaminasi jamur dan bakteri
Keragaman hasil efektifitas sterilisasi dipengaruhi oleh jenis bahan yang digunakan dan jenis kontaminan. Yusnita (2003) berpendapat bahwa kontaminasi yang disebabkan oleh mikroorganisme endofitik (mikroorgsnisme yang hidup di dalam sel atau ruang antar sel tanaman) yang sering merupakan biota dari tanaman sumber eksplan, sulit diatasi dengan sterilisasi permukaan.
Bakteri tidak saja ada pada bahan tanaman dibagian permukaan tetapi kadang-kadang ada pada bagian dalam bahan tanaman. Biasanya bila ada di permukaan respon kontaminasinya sangat cepat, dalam tempo dua kali 24 jam sudah bisa terlihat. Tetapi bila bersifat internal responnya muncul setelah beberapa hari bahkan kadang –kadang bisa sampai satu bulan sehingga hasilnya akan mengecewakan (Santosa dan Nursandi,2003).
Selain kontaminasi, eksplan juga mengalami mati fisiologis. Ciri kultur matifisiologis diawali dengan pencoklatan (browning). Browning (Gambar 2) merupakan suatu karakter munculnya warna coklat atau hitam sering kali membuat pertumbuhan dan perkembangan eksplan terhambat dan mengakibatkan kematian pada jaringan.
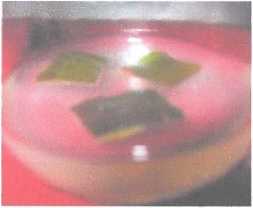
Gambar 3. Eksplan yang mrngalami browning,
Pada percobaan ini persentasi kultur browning terbesar diperoleh pada Metode A 100% dan terendah di peroleh pada Metode B yaitu 16,7%. Browning merupakan proses atau peristiwa teroksidasinya senyawa fenol menjadi quinon yang berasal dari eksplan.
Menurut Santosa dan Nursandi (2003) browning dapat disebabkan oleh penggunaan bahan tanam yang tidak marismatik atau jaringan dewasa, tindakan sterilisasi yang berlebihan, media yang tidak cocok atau lingkungan yang tidak mendukung. Faktor teknis pada saat penanaman juga sangat mempengaruhi terjadinya browning, seeperti penggunaan scapel dan pinset yang masih panas dan lamanya proses pengeringan eksplan yang sudah disterilisasi dari larutan sterilan pada saat penanaman di ruangan kultur.
Percobaan II: Efektifitas 2,4 D terhadap pembentukan kalus daun nilam secara in vitro
Hasil analisis statistik menunjukkan bahwa pemberian kosentrasi zat pengatur tumbuh 2,4-D berpengaruh sangat nyata (P<0,01) terhadap semua variabel yang diamati (Tabel 2).
Tabel 2. Signifikansi pengaruh kosentrasi 2,4-D pada pembentukan kalus daun nilam in vitro.
|
No |
Variabel |
Signifikansi |
|
1 |
Diameter kalus |
** |
|
2 |
Berat basah total kalus |
** |
|
3 |
Berat kering oven total |
** |
Keterangan: **= berpengaruh sangat nyata (P<0,01)
Waktu pelengkungan tercepat diperoleh pada kosentrasi 0,0 ppm dan 2,0 ppm 2,4D sama yaitu 3,67 hari (Tabel 3). Pelengkungan terjadi menandakan bahwa sudah mulai terjadinya aktivitas dalam sel (Gamabar 4). Zat pengatur tumbuh 2,4-D sebagai salah satu hormon auksin sintetis yang mempengaruhi permabialitas dinding sel, sehingga air masuk secara osmosis ke dalam sel dan menyebabkan kekakuan pada bagian daun yang mengalami pelukaan.
Perkembangan selanjutnya kalus terbentuk yang ditandai dengan adanya pertambahan sel pada pinggir daun bekas potongan dan pada bagian tulang daun (Gambar 5). Kalus adalah suatua kumpulan sel amorphous yang terjadi dari sel-sel jaringan yang membelah diri secara terus menerus. Pembentukan kalus pada jaringan luka dipacu oleh zat pengatur tumbuh auksin dan sintokinin endogen serta kalus dapat terbuntuk sebagai akibat stress (Dodds dan Roberts, 1983 dalam Luri, 2010). Bagain eksplan yang terinisiasi membentuk kalus, disebabkan sel-sel yang kontal dengan media terdorong menjadi maristematik dan selanjutnya aktif mengadakan pembelahan seperti jaringan penutup luka. Kalus yang berumur empat belas hari mulai memenuhi bekas potongan (Gambar 6).

Gambar 4. Ekspaln mengalami pelengkungan (tiga hari setelah tanam)
Tabel 3. Pengaruh kosentrasi 2,4-D terhadap waktu pelengkunagan, waktu muncul
kalus, warna kalus dan tekstur kalus pada setiap media perlakuan.
|
Konsentrasi 2,4-D (ppm) |
Waktu Pelengkungan (hari) |
Waktu Muncul Kalus (hari) |
Warna kalus |
Tekstur kalus |
|
0,0 |
3,67 |
30,00* |
- |
- |
|
0,5 |
3,33 |
9,67 |
Putih Kekuningan |
Remah |
|
1,0 |
3,33 |
8,00 |
Putih Kekuningan |
Remah |
|
1,5 |
3,00 |
11,33 |
Putih Kekuningan |
Kompak |
|
2,0 |
3,67 |
12,33 |
Kuning Kecoklatan |
Kompak |
|
2,5 |
3,33 |
13,33 |
Kuning kecoklatan |
kompak |
Keterangan : *= Sampai hari ke 30 (pengamatan terakhir) tidak terbentuk kalus
Tabel 3 menujukkan bahwa pemunculan kalus berbeda nyata antara yang menggunakan dan yang tanpa 2,4-D. Media tanpa 2,4-D kalus tidak terbentuk, sedangkan yang menggunakan 2,4-D terbentuk kalus. Walau demikian diantara perlakuan ada kecenderungan semakin tinggi kosentrasi 2,4-D kemunculan kalus semakin lambat. Media dengan kosentrasi 0,5-1,0 ppm 2,4-D kalus muncul pada 8-10 hari setelah eksplan ditanam, sedangkan pada kontrol sampai hari yang ke 30 (pada pengamatan terakhir) tidak terbentuk kalus.
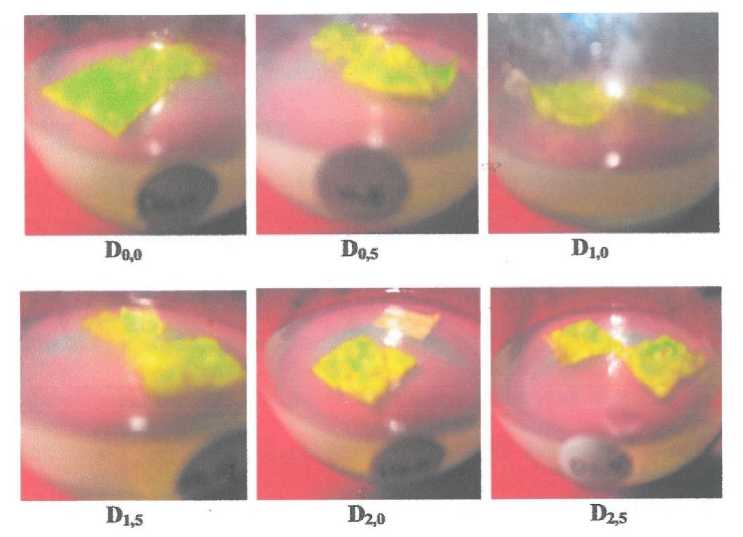
Gambar 5. Waktu munculnya kalus pada perlakuan 2,4-D.
Makin tinggi kosentrasi zat pengatur tumbuh yang di berikan, induksi kalus makin terhambat. 2,4-D merupkan zat pengatur tumbuh dari golongan auksin yang dapat menyebabkan pembesaran sel dalam jaringan dan merangsang pembentukan kalus. Penggunaan 2,4-D kosentrasi rendah akan lebih baik dalam menginduksi kalus dibanding kosentrasi tinggi (Hadipoentyanti et al., 2008). Hal ini disebabkan karena 2,4-D mempunyai sifat fotoksitas yang sangat tinggi, bila kosentrasinya berlebihan dalam tanaman.
Tabel 3 menunjukan bahwa variabel warna kalus yang diperoleh yaitu putih kekuning kuningan dan kuning kecoklatan.warna putih kekuningan diperoleh dengan penambahan kosentrasi berturut-turut 0,5 ppm, 1,0 ppm, dan 1,5 ppm 2,4-D, sedangkan perlakuan kosentrasi 2,0 ppm dan 2,5 ppm 2,4-D warna yang dihasilkan yaitu kuning kecoklatan.
Semua peerlakuan dari awal pertumbuhan kalus berwarna putih kekuningan, setelah beberapa hari terjadi perubahan warna kalus menjadi kuning kecoklatan pada kosentrasi 2,0 ppm dan 2,5 ppm 2,4-D (Gambar 7). Hal ini menandakan bahhwa peningkatan kosentrasi 2,4-D dapat memicu terjadinya oksidadi senyawa fenolik menjadi quinon yang menyebabkan pencoklatan pada kalus. Vickery dan vickery 1980 dalam Fitriani (2002) menyatakan bahwa sintesis senyawa fenolik dipacu oleh cekaman atau gangguan pada sel tanaman.
Sejumlah peneliti menemukan fenomena yang serupa. Penelitian efek zat pengatur tumbuh pada tanaman gandum secara in vitro, penggunaan 2,4-D menghasilkan kalus yang remah dan putih. Monirul (2005) Ragapadmi (2006) melaporkan bahwa pengggunaan 2,4-D pada kultur jaringan benih padi menghasilkan kalus yang brsifat remah dan bening. Proliferasi kalus dari ekplan
daun tanaman kina dengan penggunaan plicloram menghasilkan kalus yang remah berwarna putih kecoklatan.
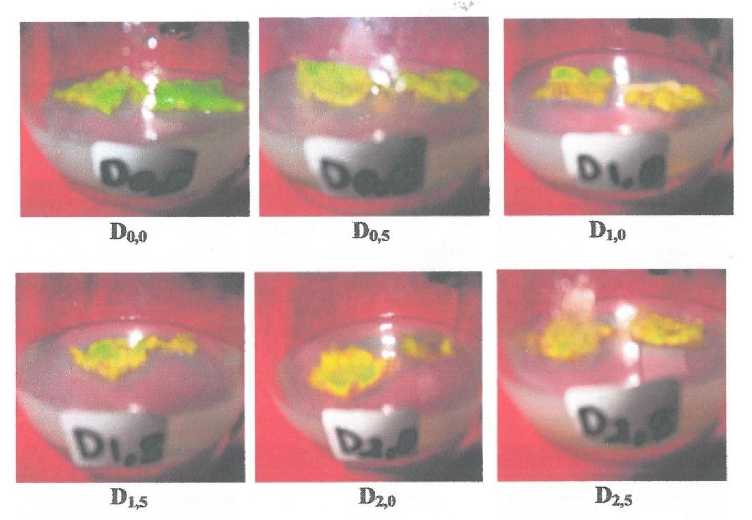
Gambar 6. Kalus yang brumur 14 hari pada setiap media perlakuan
Tektur kalus yang di peroleh dari keenam perlakuan kosentrasi 2,4-D yang di tambahkan pada media mempunyai mas kalus dua macam yaitu remah (friabel) dan kompak. Masa kalus remah (friabel) diperoleh pada media dengan penambahan 0,5 ppm dan 1,0 ppm 2,4-D, sedangkan media yang ditambah dengan 1,5 ppm, 2,0 ppm dan 2,5 ppm 2,4-D masa kalusnya aayang diperoleh sama yaitu kompak (Tabel 3). Penyebab kekompakan kalus adalah karena terjadi nya peristiwa lignifikasi (proses pembentukan lignin pada dinding sel).
Bila masa kalus remah maka pemindahan kalus cukup dilakukan dengan mengabil kalus dengan spatula atau skapel lansung disubkultur di media baru. Namun bila kalus kompak mesti dipindah ke petridish steril untuk di potong-potong dengan skapel baru disubkultur kemedia baru.
Ukuran kalus menunjukan bahwa banyaknya sel yang terbrntuk dari sel-sel jaringan awal yang membelah diri secara terus menerus. Semakin besar ukuran kalus menunjukan bahwa semakin tinggi aktivitas dan jumlah sel-sel jaringan awal yang membelah diri.
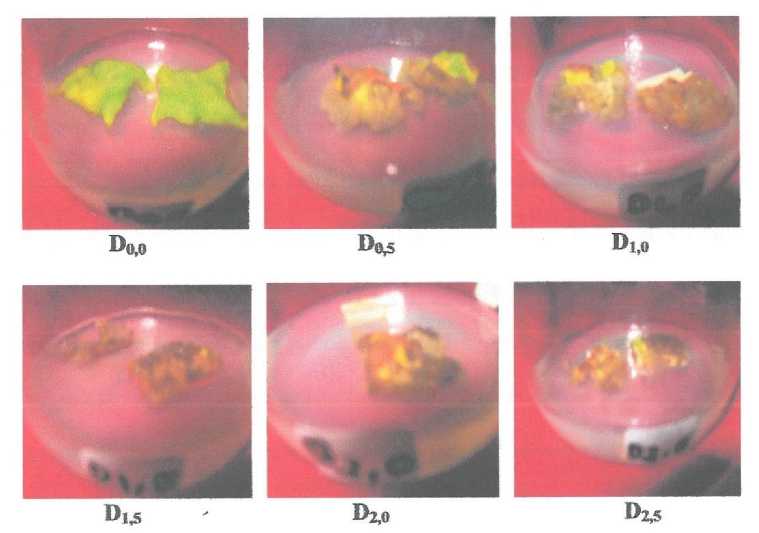
Gambsr 7. Kalus eksplan daun nilam umur 30 hari pada setiap perlakuan media
Tabel 4 menunjukan bahwa pengararuh yang di hasilkan dari perlakuan kosentrasi2,4-D sangat nyata terhadap diameter kalus, kosentrasi 2,4-D yang di taaambahkan pada media dapat meningkatkan diameter kalus yang sangat nyata di bandingkan dengan perlakuan tanpa penambahan 2,4-D (D0,0) hingga 70,42% dan kelima perlakuan kosentrasi 2,4- D menunjukan perbedaan hasil yang sangat nyata.
Kosentrasi 2,4-D yang paling baik yaitu 0,5 ppm (D0,5) dan 1,0 ppm (D1,0) dapat meningkatkan berata basah kalus hingga 90,14% dan 87,32% jika dibandingkan dengan kontrol (D0,0) dan perlakuan yang lain (D1,5, D2,0 dan D2,5). Berat kering oven kalus menunjukkan bahwa perbedaan yang sangat nyata dari seluruh perlakuan, dan kosentrasi 2,4-D 0,5-1,0 ppm (D0,5 ; D1,0) dapat meningkatkan berat kering oven kalus paling baik hingga 7,04% jika dibandingkan dengan seluruh perlakuan. Aplikasi 2,4-D sangat efektif meningkatkan diameter kalus, berat basah kalus dan berat kering oven kalus. Seluruh variabel tersebut saling berkaitan satu sama yang lain. Besarnya diameter kalus yang dihasilkan dipengaruhi oleh waktu pelengkungan dan waktu munculnya kalus. Berat basah kalus dan berat kering oven kalus bernilai tinggi karena dukungan dari besarnya diameter kalus yang dihasilkan. Kosentrasi 2,4-D yang paling efektif untuk pembrntukan kalus yaitu, kosentrasi 0,5 ppm dan 1,0 ppm, sedangkan kosentrasi diatasanya (1,5; 2,0; dan 2,5 ppm ) dapat menghambat terbentuknya kalus eksplan daun nilam.
|
Tabel 4. Pengaruh konsentrasi 2,4-D terhadap diameter kalus, berat basah kalus dan berat kering oven kalus pada setiap media perlakuan | |||
|
Konsentrasi 2,4-D Diameter kalus |
Berat basah kalus (g) |
Berat kering oven Kalus (g) | |
|
(cm) | |||
|
0,0 |
0,71 d |
0,71 c |
0,71 c |
|
0,5 |
1,21 a |
1,35 a |
0,76 a |
|
1,0 |
1,19 a |
1,33 a |
0,76 a |
|
1,5 |
1,09 bc |
1,06 b |
0,74 b |
|
2,0 |
1,04 c |
0,98 b |
0,74 b |
|
2,5 |
1,15 ab |
1,13 b |
0,75 ab |
|
Keterangan : Angka-angka yang diikuti oleh huruf yang sama sama menunjukkan perbedaan tidak nyata pada uji Duncan 5%. |
pada kolom yang | ||
Sterilisasi dengan HgCl2 0,1% (10 menit) dan pemotongan di dalam asam ascorbat 2 g/l menekan paling banyak kontaminan daun nilam in vitro. Zat pengatur tumbuh 2,4-D sangat efektif dalam memacu pembentukan kalus daun nilam in vitro. Penggunaan 0,5 ppm 2,4-D paling efektif dalam pembentukan kalus. Kalus yang terbentuk relatif cepat (9,67 hari), berwarna putih kekuningan, bertekstur remah, diameter kalus lebar (1,21 cm), bobot basah dan kering oven kalus berat (1,35 g dan 0,76 g).
Daftar Pustaka
Amien, S., M. Arianti, M. Arief, dan D. Kurniawan. 2007. Induksi Kalus dari Daun Nilam Kultivar Lhoksemauwe, Sidikalang dan Tapak Tuan dengan 2,4-D. Zuriat. 18 (2):179-192.
Fitriani, A. 2002. Kandungan Ajmalisin pada Kultur Kalus Catharanthus roseus L. G. Don setelah dielisitasi Homogenat Jamur Pythium aphanidermatum Edson Fitzp. 15 Desember 2009. http://www.rudyct.com/PPS702-ipb/06223/any_fitriani.htm.
Geetha, S dan S. A. 2000. In Vitro Propagation of Vanilla planifolia, a Tropical Orchid. Current. Science. 79(6):886-889. 15 Oktober 2010
http://www.currentscience.com.
Gunawan, L. W. 1992. Teknik Kultur Jaringan. Pusat Antar Universitas
Bioteknologi. Institut Pertanian Bogor. Bogor. 80 hal.
Gunawam, L. W. 1988. Zat Pengatur Tumbuh Tanaman. Pusat Antar Universitas
Bioteknologi. Institut Pertanian Bogor. Bogor. 82 hal.
Hadipoentyanti, E., Amelia, Nursalam, S. Y. Hartati dan S. Suhesti. 2008.
Perakitan Varietas untuk Ketahanan Nilam Terhadap Penyakit Layu Bakteri. Balai Penelitian Tanaman Obat dan Aromatik. Bogor. 17 Desember 2009. http://minyakatsiriindonesia.wordpress.com/budidaya-nilam/endang-hadipoentyanti-dkk/-
Indrianto, A. 2002. Kultur Jaringan Tumbuhan. Fakultas Biologi. Universitas Gadjah Mada. Yogyakarta. 134 hal.
Luri, S. 2010. Kultur Kalus. Kultur-jaringan.blogspot.com. 30 Juli 2010.
http://kultur-jaringan.blogspot.com/2009/08/kultur-kalus.15.html
Monirul, I., Md. M. Ahmed. dan D Mahaldar. 2005.In Vitro Callus Induction and Plant Regeneration in Seed Explants of Rice (Oriza sativa L.) Research J. Of Agricultur dan Biologi. Science. 1(1):72-75.
Ragapadmi, P. 2006. Induksi Kalus dan Optimasi Regenerasi Empat Varietas Padi melalui Kultur In Vitro. Jurnal AgroBiogen. 2(2):74-80.
Santosa, U dan F. Nursandi. 2003. Kultur Jaringan Tanaman. Universitas Muhammadiyah Malang Press. Malang.191 hal.
Sugiharto, B., T. Rahayu dan M. Faatih. 2007. Propagasi Tanaman Nilam (Pogostemon cablin Benth) secara In Vitro dengan Kombinasi Sitokinin dan Auksin 2,4-D. Jurnal Biologi. Semarang. 17(1):39-47.
Untari, R. Dan D. M. Puspitaningtyas. 2006. Pengaruh Bahan Organik dan NAA terhadap Pertumbuhan Anggrek Hitam (Coelogyne pandurata Lindl.) dalam Kultur In Vitro. Biodiversitas. 7(3):344-348.
Wattimena, G. A. 1988. Zat Pengatur Tumbuh Tanaman. Pusat Antar Universitas Bioteknologi Institut Pertanian Bogor. Bogor. 82 hal.
Yusnita. 2003. Kultur Jaringan, Cara Memperbanyak Tanaman secara Efisien. Agromedia Pustaka. Jakarta.105 hal.
https://ojs.unud.ac.id/index.php/JASB
52
Discussion and feedback