UJI ANTAGONIS BAKTERI ENDOFIT TERHADAP Colletotrichum scovillei PENYEBAB PENYAKIT ANTRAKSONA PADA CABAI BESAR (Capsicum annuum L.)
on
J. Agric. Sci. and Biotechnol.
ISSN: 2302-0113
Vol. 8, No. 1, Juli 2019
UJI ANTAGONIS BAKTERI ENDOFIT TERHADAP Colletotrichum scovillei PENYEBAB PENYAKIT ANTRAKSONA PADA CABAI BESAR (Capsicum annuum L.)
I Gede Karta Satria Wibawa1, Dewa Ngurah Suprapta2*), Khamdan Khalimi2
-
1Program Magister Bioteknologi Pertanian, Program Pascasarjana Universitas Udayana
-
2Laboratorium Biopestisida Fakultas Pertanian Universitas Udayana *)Corresponding author: ngurahsuprapta@unud.ac.id
Abstract
Colletotrichum scovillei is a newly discovered species causing anthracnose disease on chilli pepper (Capsicum annuum L.) in Bali. With the increasing reports of Colletotricum spp. resistance against chemical fungicide, biological control is taken as the alternatives to control this disease. In this study a total of 69 endophytic bacteria isolates was recovered from different solanaceae plants samples collected from nine regions of Bali and screened for the antagonism againstC. scovillei. From the potential 15 candidates of isolates with inhibition activity above 90%, hypersensitivity test were taken on tobacco leaf, and isolate CBCKB1 was chosen for further test. The CBCKB1 isolate was identified as Bacillus amyloliquefaciens based on molecular identification. Detached fruit bioassay proved that isolate CBCKB1 formula was effective in reducing the disease percentage and disease severity of anthracnose disease on chilli pepper.
Keywords: Chilli pepper, Colletotrichum scovillei, endophytic bacteria
Penyakit antraknosa yang disebabkan oleh jamur Colletotrichum spp. merupakan kendala utama dalam produksi cabai besar di Indonesia (Menteri Pertanian Indonesia, 2018). Penyakit ini dapat menyerang hampir seluruh bagian tanaman cabai besar dan dilaporkan mampu menyebakan kehilangan produksi mencapai 80% (Oo dan Oh, 2016; Widodo dan Hidayat, 2018). Survey lapangan yang dilakukan pada tahun 2018 menemukan C. scovillei sebagai spesies baru yang menyerang pertanaman cabai besar di Bali (Khalimi et al., 2019). Untuk mencegah terjadinya ledakan penyakit antraknosa yang disebabkan oleh C. scovillei, maka metode pengendalian yang efektif diperlukan segera.
Pemanfaatan agen antagonis merupakan salah satu metode yang dapat dipilih dalam mengendalikan penyakit antraknosa. Bakteri endofit merupakan agen antagonis yang berpotensi dikembangkan sebagai agen antagonis terhadap C.
scovillei. Suryadi et al. (2013) menyatakan bakteri endofit sangat berpotensi dikarenakan banyak tersedia di alam, memiliki daya tumbuh yang cepat serta mudah dikembangkan. Bakteri endofit juga dilaporkan mampu mengendalikan patogen tanaman melalui mekanisme seperti (1) antibiosis, (2) kompetisi, (3) induksi ketahanan dan (4) hiperparasitisme (Card et al., 2016). Berdasarkan pernyataan tersebut, maka dilakukan penelitian untuk mencari isolat bakteri endofit yang efektif mengendalikan penyakit antraknosa pada buah cabai yang disebabkan oleh C. scovillei.
Penelitian ini dilaksanakan dari bulan Januari sampai Juli 2019. Pengujian laboratorium dilaksanakan di Laboratorium Biopestisida, Fakultas Pertanian, Universitas Udayana, sedangkan identifikasi molekuler dari isolat bakteri endofit terpilih dilakukan di PT. Genetika Science Indonesia.
Isolat jamur C. scovillei yang digunakan dalam penelitian ini didapatkan dari koleksi Laboratorium Biopestisida, Fakultas Pertanian, Universitas Udayana. Isolat bakteri endofit dikumpulkan dari tanaman solanacea yang didapatkan dari sembilan kabupaten di Bali. Tanaman tembakau yang digunakan dalam penelitian ini dipelihara dalam rumah kaca yang tersedia pada KebunPercobaan Fakultas Pertanian Universitas Udayana. Buah cabai besar yang digunakan adalah varietas Gada MK F1 yang dibeli dari petani di sekitar kabupaten Badung. Bahan lain yang dipergunakan adalah media Potato Dextrose Agar (PDA), air steril, ethanol70%, ethanol95%,larutan NaOCl0.5%, larutan NaHCO310% dan Tween 80.
Alat yang digunakan dalam penelitian ini adalah kamera, kantong plastic, gunting, pinset, pisau, autoclave, tabung reaksi, labu Erlenmeyer, cawan petri, gelas beaker, timbangan digital,laminar air flow cabinet, jarum ose, cork borer, shaker, kertas saring WhatmanNo.2, aluminium foil, tissue, kertas millimeter block alat tulis dan penggaris.
Bakteri endofit diisolasi dari bagian filosfer tanaman solanaceae yang dipilih secara acak dari sembilan kabupaten di Bali. Isolasi bakteri mengikuti metode Paul et al. (2013). Inkubasi dilakukan selama 2, 5 dan 7 hari, setiap isolat yang muncul kemudian dimurnikan sampai didapatkan isolat murni. Isolat C. scovilleiyang didapatkan dari koleksi Laboratorium Biopestisida, Fakultas Pertanian, Universitas Udayana diremajakan kembali menggunakan media PDA hingga didapatkan koloni murni yang siap digunakan untuk pengujian.
Aktifitas daya hambat dari total 69 isolat endofit terhadap C. scovillei
dilakukan mengikuti metodeuji dual kultur oleh Dewi (2018). Pengamatan pada
tahap seleksi awal dilakukan ketika luas koloni jamur C. scovillei pada perlakuan kontrol telah tumbuh sebesar ≥4 cm. Persentase daya hambat (PDH) dihitung menggunakan rumus sebagai berikut:
Koloni pada kontrol-koloni pada perlakuan
PDH (%) = x 100%
Luas koloni pada kontrol
Isolat dengan persentase daya hambat ≥90% kemudian diseleksi dan diuji kembali menggunakan metode dual kultur yang sama untuk menentukan aktivitas antagonismenya, dengan diberikan tiga ulangan untuk tiap perlakuan isolat dan menggunakan model rancangan acak lengkap (RAK). Pengamatan untuk penentuan antagonism isolat pilihan kemudian dilakukan ketika koloni jamur C. scovillei memenuhi cawan petri dengan menggunakan rumus persentase daya hambat.
Uji hipersensitif 15 isolat bakteri endofit terpilih menggunakan daun tanaman tembakau(Nicotiana tabacum L.) mengikuti metode Mulaw et al. (2018). Tingkat patogenesitas diukur sesuai dengan skala reaksi hipersensitif (HR) yang muncul pada daun tembakau sebagai berikut:
-
A) Skala 0(tidak virulen): ketika tidak ada gejala hipersensitif yang muncul.
-
B) Skala 1 (kurang virulen): ketika reaksi HR terjadi dengan diameter ≤ 0.5 cm. C) Skala 2 (cukup virulen): ketika reaksi HR terjadi dengan diameter 0.5-1 cm.
-
D) Skala 3 (highly virulent): ketika reaksi HR terjadi dengan diameter diatas 1 cm.
Isolat CBCKB1 dengan daya hambat tertinggi dan bersifat non-patogen kemudian dipilih sebagai kandidat tunggal dan diidentifikasi secara molekuler, menggunakan primer 16S 63F forward primer (5ʹ-CAG GCC TAA CAC ATG CAA GTC-3ʹ) dan reverse primer 1387R (5ʹ-GGG CGG WGT GTA CAA GGC-3ʹ).
Formulasi isolat bakteri endofit CBCKB1 mengikuti prosedur dari Maharta (2013), menggunakan rumus sebagai berikut:
C1 x V1 = C2 x V2
Keterangan:
C1 = konsentrasi awal (gram/ml)
V1 = volume awal (ml)
C2 = konsentrasi yang diperlukan (gram/ml)
V2 = volume yang diinginkan (ml)
Suspensi jamur C. scovillei dibuat mengikuti prosedur dari Afifah (2017) dan tingkat kerapatan spora diatur sampai 1.25 x 106 spora/ml.Pengujian pada buah cabai besar mengikuti prosedur Basha (2011) dan Afifah (2017). Perlakuan
formula yang diujikan pada buah cabai terdiri dari kontrol positif (K+), kontrol
negatif (K–), formula konsentrasi 1% (P1), formula konsentrasi 2% (P2) dan
formula konsentrasi 5%. Rancangan percobaan menggunakan RAL, tiap
perlakuan diulang sebanyak lima kali dan tiap unit perlakuan menggunakan empat
buah cabai besar.Variabel yang diamati adalah intensitas penyakit dan persentase
penghambatan penyakit. Intensitas penyakit dihitung menggunakan rumus oleh
Afifah (2017) sebagai berikut:
DS
Σ(nxV) ZkN
x 100 %
Keterangan:
DS = Intensitas penyakit (%)
n = jumlah buah cabai besar pada tiap skor yang diamati
V = score untuk tiap gejala penyakit yang diamati
Z = skor tertinggi
N = jumlah keseluruhan dari buah cabai besar yang diamati
Skor untuk intensitas penyakit mengikuti skor dari Mayee dan
Datar (1986) sebagai berikut:
-
i. Skor 0: tidak muncul gejala
-
ii. Skor 1: gejala yang muncul antara 1% - 10%.
-
iii. Skor 3: gejala yang muncul antara11% - 25%.
-
iv. Skor 5: gejala yang muncul antara26% - 50%.
-
v. Skor 7: gejala yang muncul antara51% - 75%.
-
vi. Skor 9: gejala yang muncul antara76% - 100%.
Persentase daya hambat penyakit dihitung menggunakan rumus dari Basha (2011) sebagai berikut:
Daya hambat penyakit (%) _persentase peπvakιt p adz kontrol - persentase pada perlakuan y py
100%
Data yang didapatkan dari pengamatan dianalisis menggunakan analysis of variance (ANOVA). Apabila terdapat pengaruh yang berbeda nyata antara perlakuan, maka akan dilanjutkan dengan analisis Duncan’s multiple range test (DMRT) pada taraf 5%.
Hasil seleksi awal terhadap 69 isolat bakteri endofit menunjukkan bahwa 66 isolat mampu menghambat pertumbuhan koloni jamur C. scovillei sebesar 7,45% sampai 98,08%, sebaliknya tiga isolat lainnya memacu pertumbuhan sebesar 3,03% sampai 14,23%. Berdasarkan hasil seleksi tersebut, 15 isolat bakteri yang terdiri dari CRB4, CBCKB1, TBP1, TCKB2, CBCKB3, TCKB1, CRB1, TTP1, CRPayD1, CBCKB2, TPayB1, CRBP4, RBP3, CRCKD2 dan CRWG10 menunjukkan daya hambat diatas 90%.
Uji antagonisme lanjutan terhadap 15 isolat tersebut menunjukkan bahwa isolat CBCKB1 memiliki daya hambat tertinggi, yaitu sebesar 99,20% terhadap jamur C. scovillei, seperti yang disajikan pada Tabel 1.
Tabel 1. Antagonisme 15 isolat terpilih terhadap pertumbuhan koloni jamurC. scovilleipada media PDA setelah 21 hari inkubasi
|
No. |
Isolat |
Luas koloni C. scovillei (cm2) |
Daya hambat (%) dibandingkan kontrol |
|
1 |
CBCKB1 |
0,432 a |
99,20 |
|
2 |
TCKB2 |
0,558 a |
98,97 |
|
3 |
TBP1 |
0,595 a |
98,90 |
|
4 |
CRB4 |
0,605 a |
98,88 |
|
5 |
CBCKB3 |
0,648 a |
98,80 |
|
6 |
TCKB1 |
0,738 b |
98,63 |
|
7 |
TTP1 |
0,778 b |
98,56 |
|
8 |
CRB1 |
0,948 c |
98,24 |
|
9 |
CRBP4 |
0,958 c |
98,23 |
|
10 |
TPayB1 |
0,988 c |
98,17 |
|
11 |
CRPayD1 |
1,012 d |
98,13 |
|
12 |
RBP3 |
1,142 e |
97,89 |
|
13 |
CBCKD2 |
1,152 e |
97,87 |
|
14 |
CRCKD2 |
1,228 f |
97,73 |
|
15 |
CRWG10 |
1,435 g |
97,34 |
|
16 |
Control |
54,025 h |
- |
Keterangan: Nilai rata-rata yang diikuti huruf yang sama menunjukkan berbeda
tidak nyata berdasarkan uji DMRT dengan taraf 5%.
Tanaman cabai merupakansalah satu jenis tanaman solanacea yang diketahui berasosiasi dengan beragam jenis bakteri endofit yang berpotensi sebagai agen antagonis(Amaresan et al., 2014). Basha et al. (2010) berhasil mengisolasi 45 bakteri endofit dari daun dan buah tanaman cabai dan mendapatkan 16 isolat yang bersifat antagonis terhadap C. gloeosporioides danC. capsici, dengan masing-masing daya hambatberkisar antara 4,2 % sampai 33,3% dan 23% sampai 46%. Allu et al. (2014) melaporkan bahwa dari total 19 isolat bakteri endofit dari buah tanaman cabai, sepuluh isolat mampu menghambat pertumbuhan jamurC. gloeosporioides, dengan daya hambat berkisar antara 48,18% sampai 65,44%.
Uji hipersensitif terhadap 15 isolat pilihan mengungkap bahwa isolat CBCKB1, CRB4, TTP1, CRB1, CRBP4, RBP3, CBCKD2, CRCKD2 dan CRWG10 bersifat non-patogenik layaknya perlakuan kontrol negatif. Isolat terpilih lainnya bersifat sedikit patogenik dengan menyebabkan reaksi
hipersensitif pada daun tembakau dengan diameter kurang dari 0,5cm, sedangkan perlakuan kontrol positif bersifat sangat patogenik dengan reaksi hipersensitif lebih dari 1cm. Berdasarkan hasil uji hipersensitif, isolat CBCKB1 dipilih sebagai isolat tunggal untuk diidentifikasi secara molekuler.
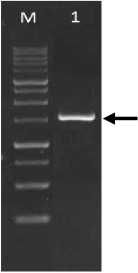
Hasil PCR dari sekuen isolat CBCKB1 yang diamplifikasi menggunakan primer 16S menunjukkan fragmen dengan ukuran ±1.500 bp seperti pada Gambar 1.
1500 bp
1000 bp
250 bp
±1500
Gambar 1. Hasil PCR dari isolat CBCKB1
(M) = Marka DNA 1 kb (Geneaid), (1) = isolat CBCKB1)
Berdasarkan hasil pencarian BLAST pada GenBank, isolat CBCKB1 diketahui memiliki kekerabatan dengan beberapa strain bakteri Bacillus amyloliquefaciensseperti yang tersaji pada Tabel 2.
Tabel 2. Kekerabatan isolat CBCKB1 dengan strain B. amyloliquefaciens dari GenBank
|
Nama strain |
Nomor aksesi |
Kekerabatan (%) |
|
B. amyloliquefaciens strain ML265 |
KC692168 |
95,98 |
|
B. amyloliquefaciens strainOTG001 |
MN216302 |
95,91 |
|
B. amyloliquefaciens strain HX2016004 |
MN176577 |
95,91 |
|
B. amyloliquefaciens strain DSLB-4 |
MK795392 |
95,89 |
|
B. amyloliquefaciens strain Z17-2 |
MK271286 |
95,91 |
|
B. amyloliquefaciens strain XZ34-1 |
MK086133 |
95,91 |
|
B. amyloliquefaciens strain HN-3 |
MK310270 |
95,81 |
|
B. amyloliquefaciens strain ZF75 |
MK215647 |
95,81 |
|
B. amyloliquefaciens strain TEH18 |
MN099360 |
95.83 |
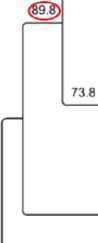
Hasil analisis pohon filogenetik dari isolat CBCKB1 menggunakan metode Maximum Parsimony (MP) dengan 1000 kali pengulangan Bootstrapmenunjukkan bahwa isolat CBCKB1 merupakan bagian dari spesies B. amyloliquefaciens, dengan Bootstrap Supports (BS) sebesar 89,8% seperti yang disajikan pada Gambar 2.
62.8
CBCKB1 Isolates—
50.6
100
80,2
-----KC692168 1
pMN216302 1
59 5 — MK795392 1
MK086133 1
MN099360 1
MK271286 1
MN176577 1
MK310270 1
MK215647 1
MH482863 1
Bacillus amyloliquefaciens strain ML265 Bacillus amyloliquefaciens strain 0TGOO1 Bacillus amyloliquefaciens strain DLSB 4 Bacillus amyloliquefaciens strain XZ34 1 Bacillus amyloliquefaciens strain TEH18 Bacillus amyloliquefaciens strain Z17 2 Bacillus amyloliquefaciens strain HX2016004 Bacillus amyloliquefaciens strain HN 3 Bacillus amyloliquefaciens strain ZF75 Bacillus thuringiensis strain B t LDC532
GQ140344 1 Bacillus thuringiensis strain BRC HZM2
□QO87228 1 Escherichia coli strain BL21 DE3
.........I.......∣∣∣
0.0 100,0
Gambar 2. Pohon filogeni dari isolat CBCKB1 dengan strain B. amyloliquefaciens yang didapatkan dari Genbank.Bootstrap Supports sebesar 89,8%
B. amyloliquefaciensdilaporkan mampu menghasilkan beragam metabolit sekunder dan dikenal sebagai salah satu spesies penting dari genus bacillus yang memiliki daya antagonisme yang kuat terhadap patogen tanaman (Shahzad et al., 2017). Ji et al. (2013) melaporkan kemampuan antagonis dari bakteri B. amyloliquefaciens strain CNU114001 terhadap patogen seperti Alternaria panax, Botrytis cinera, C. acutatum, C. orbiculare, Corynespora cassicola, Fusarium oxysporum, Penicillium digitatum, Rhizoctonia solani, Stemphylium lycopersici, Pyricularia grisea danSclerotinia sclerotiorum. Kim et al. (2015) melaporkan bakteri endofitB. amyloliquefaciens strain GYL4 yang diisolasi dari daun tanaman cabai memiliki daya antagonisme yang tinggi terhadap C. coccodesdan mampu menghambat pembentukan lesio antraknosa pada daun cabai mencapai 93,3%. Srikhong et al. (2018) melaporkan kemampuan B. amyloliquefaciens strain M10 dalam menghambat penyakit antraknosa yang disebabkan oleh C. capsici pada buah cabai dan tomat sebesar 72,24% dan 79,38%.
Hasil pengujian formulasi bakteri B. amyloliquefaciens terhadap penyakit antraknosa pada buah cabai besar menunjukkan bahwa aplikasi formulasi mampu menurunkan intensitas serta persentase penyakit dari antraknosa (Tabel 3.).
Tabel 3. EfektivitasB. amyloliquefaciens isolat CBCKB1 terhadap penyakit antraknosa yang disebabkan C. scovillei pada buah cabai besar setelah 10 hari inkubasi
|
No. |
Perlakuan |
Intensitas penyakit |
Persentase penyakit |
Persentase penghambatan penyakit |
|
1 |
Kontrol positif (K+) |
95.55% |
90.22% a |
0 |
|
2 |
Formulasi CBCKB1 1% |
53.33% |
33.98%b |
63.24% |
|
3 |
Formulasi CBCKB1 2% |
31.11% |
16.70% c |
81.48% |
|
4 |
Formulasi CBCKB1 5% |
10% |
5.03%d |
94.42% |
|
5 |
Kontrol negatif (K–) |
0 |
0e |
0 |
Keterangan: Nilai rata-rata yang diikuti huruf yang sama menunjukkan berbeda tidak nyata berdasarkan uji DMRT dengan taraf 5%.
Buah tanaman cabai besar pada perlakuan kontrol positif (K+) terserang penyakit antraknosa dengan intensitas yang parah mencapai 95,55% dengan persentase penyakit sebesar 90,22%. Perlakuan formula B. amyloliquefaciens isolat CBCKB1 dengan konsentrasi 1% mampu menurunkan intensitas antraknosa mejadi 53,33% dengan persentase sebesar 33,98%, formula 2% konsentrasi mampu menurunkan intensitas menjadi 31,11% dan persentase penyakit menjadi 16,70%, sedangkan perlakuan 5% mampu menurunkan intensitas penyakit menjadi 10% dengan persentase 5.03% (Gambar 3.).
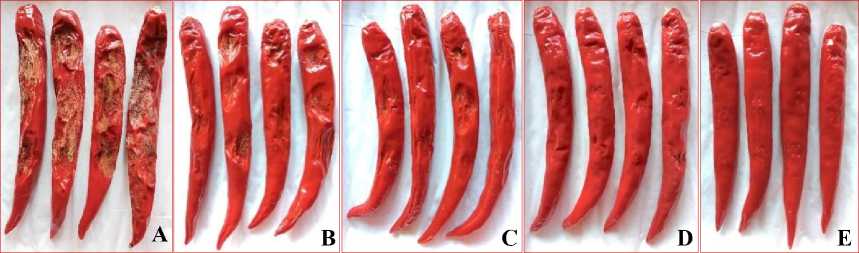
Gambar 3. Tingkat serangan penyakit antraknosa yang disebabkan oleh C. scovillei pada buah cabai besar.(A) Kontrol (+), (B) formula isolat CBCKB1 konsentrasi
1%(C) formula konsentrasi 2%, (D) formula konsentrasi 5%, (E) Kontrol (–).
Ramanujam et al. (2012) mengujikan isolat bakteriB. tequilensis PHB-185, B. subtilis PMB-123, B. subtilis ENB-24, B. megaterium PMB-53, B. megaterium ENB-86, B. pumilus PMB-183 danP. putida PBA-5 terhadap C. capsicidan menemukan bahwa isolat bakteri mampu menurunkan persentase
penyakit antraknosa pada buah cabai sebesar 67,84%, 61,69%, 55,41%, 54,33%, 59,66%, 50,29% dan 50,68% secara berturut-turut. Srikhong et al. (2018)
melaporkan kemampuan antagonis dari B. amyloliquefaciens strain M10 dalam menekan penyakit antraknosa pada buah cabai besar yang disebabkan oleh C. capsicisebesar 72,24%. Birari et al. (2018) melaporkan kemampuan P.
fluorescensdanT. viridedalam menurunkan tingkat intensitas penyakit antraknosa yang disebabkan oleh C. capsicipada buah cabai sebesar 39,80% dan 37,02%, serta menurunkan persentase penyakit dari 79,62% pada kontrol menjadi 50.01% dan 53.50% secara berturut-turut.
Berdasarkan hasil pengujian pada buah cabai besar, aplikasi formula bakteri endofitB. amyloquefaciensisolat CBCKB1 terbukti efektif dalam menghambat perkembangan penyakit antraknosa yang disebabkan C. scovillei pada buah cabai besar. Menurut Alvindia dan Natsuaki (2009), kemampuan untuk mengkolonisasi habitat dari suatu agen antagonis merupakan salah satu faktor penting yang menentukan keberhasilan pengendalian menggunakan agen antagonis. B. amyloliquefaciens isolat CBCKB1 merupakan bakteri endofit yang didapatkan dari buah tanaman cabai di kabupaten Tabanan, Bali. Sebagai bakteri yang berasal dari tanaman cabai, diyakini bahwa keberhasilan aplikasi isolat CBCKB1 dalam menghambat penyakit antraknosa pada buah cabai dikarenakan isolat CBCKB1 mampu mengkolonisasi sel jaringan buah cabai besar dan dapat bekerja dengan baik dalam menghambat perkembangan penyakit antraknosa yang disebabkan oleh jamur C. scovillei.
Bakteri endofit isolat CBCKB1 merupakan isolat bakteri yang paling efektif dalam menghambat pertumbuhan jamur C. scovillei, dengan daya antagonisme mencapai 99,20%. Berdasarkan hasil identifikasi molekuler, bakteri endofit isolat CBCKB1 teridentifikasi sebagai spesies dari bakteri B. amyloquefaciens. Hasil pengujian secara langsung pada buah cabai besar juga menunjukkan efektifitas dari isolat CBCKB1 dalam menghambat perkembangan penyakit antraknosa yang disebabkan oleh jamur C. scovillei pada buah cabai besar.
Daftar Pustaka
Afifah, Z. 2017. “Uji Antagonis Mikroba Endofit Trichoderma sp. dan Bacillus cereus terhadap Patogen Colletotrichum capsici Penyebab Penyakit Antraknosa pada Cabai Rawit (Capsicum frustescens)”(minithesis). Malang: Universitas Islam Negeri Maulana Malik Ibrahim.
Allu, S., Kumar, P., and Audipudi, V. 2014. Isolation, Biochemical and PGP Characterization of Endophytic Pseudomonas aeruginosa Isolated from Chilli Red Fruit Antagonistic against Chilli Anthracnose Disease. International Journal of Current Microbiology and Applied Sciences, 3(2): 318-329.
Alvindia, D.G. and Natsuaki, K.T. 2009. Biocontrol Activities of Bacillusamyloliquefaciens DGA14 Isolated from Banana Fruit Surface Against Banana CrownRot-Causing Fungi.Crop Protection,(28): 236-242.
Amaresan, N., Jayakumar, V. and Thajuddin, N. 2014. Isolation and Characterization of Endophytic Bacteria Associated with Chilli (Capsicum annuum) Grown in Coastal Agricultural Ecosystem. Indian Journal of Biotechnology,(13): 247-255.
Basha, H.T. 2011. “Biological Control of Chilli Anthracnose Pathogen, Colletotrichum capsici (Syd.) using Antagonistic Microorganism” (thesis). India: University of Mysore.
Basha, H., Hemannavar, V., Ramanujam, B., Rangeshwaran, R. and Sriram, S. 2010. Screening of Chilli Microflora and Other Biocontrol Agents forTheir Antagonistic Effects on Colletotrichumspp. InfectingChillies. The Journal of Plant Protection Sciences, 2(1): 38-44.
Card, S., Johnson,L.,TeasdaleS. and Caradus, J. 2016. Deciphering Endophyte Behaviour: The Link betweenEndophyte Biology and Efficacious Biological ControlAgents. FEMS Microbiology Ecology, 92(2016): 1-19.
DOI: 10.1093/femsec/fiw114.
Dewi, N.K.D.A. 2018. “Effectiveness of Rhizobacteria to Control Stem Rot Disease on Groundnut (Arachis hypogea L.) caused by Sclerotium roflsii”(thesis). Denpasar: Udayana University.
Direktorat Jenderal Hortikultura. 2018. Laporan Kerja Direktoran Jenderal Hortikultura TA. 2017. Diakses dari laman:
http://sakip.pertanian.go.id/admin/data2/LAKIN%20HORTI%202017.pdf.
Ji, S.H., Paul, N.C., Deng, J.X., Kim, Y.S., Yun, B.S. and Yu, S.H. 2013. Biocontrol Activity of Bacillus amyloliquefaciensCNU114001 against Fungal Plant Diseases. Mycobiology, 41(4): 234-242. Available online at:
http://dx.doi.org/10.5941/MYCO.2013.41.4.234.
Khalimi, K., Darmadi, A.A.K. and Suprapta, D.N. 2019. First Report on the Prevalence of Colletotrichum scovillei Associated withAnthracnose on Chili Pepper in Bali, Indonesia. International Journal of Agriculture & Biology, DOI: 10.17957/IJAB/15.1072.
Kim, J.D., Jeon, B.J., Han, J.W., Park, M.Y., Kang, S.A. and Kim, B.S. 2015. Evaluation of the Endophytic Nature of Bacillusamyloliquefaciens Strain GYL4 and Its Efficacyin the Control of Anthracnose. Pest Management Science, 72(8): 1529-1536. DOI: 10.1002/ps.4181.
Mahartha, K. 2013. “Uji Efektivitas Rizobakteri sebagai Agen Antagonis terhadap Fusarium oxysporum f.sp. capsiciPenyebab Penyakit Layu Fusarium Pada Tanaman Cabai Rawit (Capsicum frutescens L.)” (minithesis). Denpasar: Udayana University.
Mayee, C.D. and Datar, V.V. 1986.Phytopathometry, Technical. Bulletin-1 (Special Bulletin-3). India: Marathawada Agricultural University.
Mulaw, T., Wamishe, Y. and Jia, Y. 2018. Characterization and in Plant Detection of Bacteria that Cause Bacterial Panicle Blight of Rice. Research Journal of Plant Pathology, 1(1): 1-7. Available online at:
http://www.imedpub.com/research-journal-of-plant-pathology/.
Oo, M.M. and Oh, S.K. 2016. Chilli Anthracnose (Colletotrichum spp.) Disease and its Management Approach. Korean Journal of Agricultural Science, 43(2):153-162. DOI: http://dx.doi.org/10.7744/kjoas.20160018.
Paul, N., Ji, S.H., Deng, J.X. and Yu, S.H. 2013. Assemblages of Endophytic Bacteria in Chilli Pepper (Capsicum annuum L.) and Their Antifungal Activity against Phytopathogens In Vitro. Plant Omics Journal, 6(6): 441448.
Ramanujam, B., Hemannavar, V., Basha, H. and Rangeshwaran, R. 2012. PostHarvest Fruit Bioassay of Phylloplane, Pomoplane and Endophytic MicrobesagainstChilli Anthracnose Pathogen, Colletotrichum capsici (Syd.) E. J. Butler &Bisby. Journal of Biological Control, 26(1): 62-69.
Shahzad, R., Khan, A.L., Bilal, S., Asaf, S. and Lee, I.J. 2017. Plant GrowthPromoting EndophyticBacteria versus Pathogenic Infections: anExample of Bacillus amyloliquefaciensRWL-1 and Fusarium oxysporum f. sp.lycopersici in Tomato. PeerJ,(5):1-21. DOI: 10.7717/peerj.3107.
Srikhong, P., Lertmongkonthum, K., Sowanpreecha, R. and Rerngsamran, P. 2018. Bacillus sp. Strain M10 as a Potential Biocontrol AgentProtecting Chili Pepper and Tomato Fruits from AnthracnoseDisease caused by Colletotrichum capsici. BioControl, 63(6): 833-842. Available online
at:https://doi.org/10.1007/s10526-018-9902-8.
Suryadi, Y., Priyatno, T.P., Samudra, I.A., Susilowati,D.N., Patricia and Irawati, W. 2013. Karakterisasi dan Identifikasi Isolat Bakteri Endofitik Penghambat Jamur Patogen Padi. Bulletin Plasma Nutfah, 19(1): 25-32.
Widodo and Hidayat, H. 2018. Identification of Colletotrichum Species Associated with Chili Anthracnose in Indonesia by Morphological Characteristics and Species-Specific Primers. Asian Journal of Plant Pathology, 12(1): 7-15. DOI: 10.3923/ajppaj.2018.7.15.
https://ojs.unud.ac.id/index.php/JASB
41
Discussion and feedback