BIOEKOLOGI Grapevine leafroll-Associated Virus type 3 (GLRAV-3) PENYEBAB PENYAKIT DAUN MENGGULUNG PADA TANAMAN ANGGUR (Vitis vinifera L.)
on
J. Agric. Sci. and Biotechnol.
ISSN: 2302-0113
Vol. 7, No. 1, Juli 2018
BIOEKOLOGI Grapevine leafroll-Associated Virus type 3 (GLRAV-3) PENYEBAB PENYAKIT DAUN MENGGULUNG PADA TANAMAN
ANGGUR (Vitis vinifera L.)
Yuyun Fitriani1, I Gede Rai Maya Temaja2, dan G. N. Alit Susanta Wirya3. 1Program Magister Bioteknologi Pertanian, Program Pascasarjana Universitas
Udayana
-
2,3Laboratorium Biopestisida Fakultas Pertanian, Universitas Udayana Jl. PB. Sudirman Denpasar Bali Indonesia
Abstract
The survey of vineyard fields in Buleleng, Bali, Indonesia was conducted, some grapevine cultivars were found had grapevine leaf roll disease symptomps. The symptoms including interveinal reddening or yelowing and fall leaves, down rolling of leaves, phloem disruption, and the fruit maturation is delayed. The analysis of enzyme linked immunosorbent assay (ELISA) of symptom leaf with Grapevine leaf roll-associated virus type 3 (GLRaV-3) antiserum shown the disease was corresponding to the GLRaV-3. The study was conducted to identify the mealybug that colonized of grapevine, to determine capability of mealybug to transmitted GLRaV-3 and host range GLRaV-3.
Base on the survey ofmealybuginvineyard fields in Buleleng, Bali, the two types of mealybug were identified, namely Ferrisia virgata (Ckll.) (Hemiptera: Pseudococcidae) and Maconellicoccus hirsutus (Green) (Hemiptera: Pseudococcidae). Results of the transmission test showed that only M. Hirsutus are capable of transmitting GLRaV-3. The plant range host test of GLRaV-3 inoculation with M. hirsutuswas conducted and the symptom was detected on3plants species, grapevines (Vitis vinifera), native gooseberry (Physalis floridana) andshoe flower (Hibiscus rosa-sinensis) from18 species of plants that used.
Keywords: Grapevine Leaf Roll-associated Virus type 3 (GLRaV-3), grapevine (Vitis vinifera L.), Maconellicoccushirsutus, host range
Anggur (Vitis vinifera L.) adalah salah satu jenis tanaman hortikultura yang sesuai dengan daerah beriklim kering. Permintaan buah anggur makin meningkat dari tahun ke tahun. Untuk memenuhi kebutuhan buah anggur ini pemerintah harus mengimpor dari luar. Impor buah anggur Indonesia tahun 2012 mencapai US $ 119.334.667 (Badan Pusat Statistik, 2012).
Minat masyarakat untuk menanam anggur tampak semakin meningkat. Namun dalam budidaya tanaman anggur, banyak kendala yang dihadapi oleh para petani. Salah satu kendala tersebut adalah serangan patogen yang menyebabkan kerugian utama dalam produksi buah anggur. Penyakit-penyakit utama tanaman anggur adalah Grapevine flek virus (GFkV), grapevine virus A (GVA), grapevine
virus B (GVB) (Rosciggliano & Castellano, 1985; Engelbrecht & Kasdorf, 1990; Garau et al., 1995), penyakit daun menggulung (Leafroll disease) dan Grapevine leafroll-associated virus type 3 (GLRaV-3) (Petersen & Charles, 1997).
Perbanyakan anggur umumnya dilakukan secara vegetatif untuk memproduksi buah secara cepat. Cara ini memberikan peluang yang sangat besar untuk menyebar dan bertahannya virus pada komoditas tersebut. Menurut Turturo et al., (2005), Grapevine leaf roll-associated virus - 3 (GLRaV-3) adalah penyebab utama penyakit daun menggulung anggur. Secara ekonomi, penyakit ini cukup penting karena menyebabkan kerugian yaitu kehilangan hasil produksi berkisar antara 10-70% (Good & Monish, 2000; Akbas et al., 2009). Di samping kerugian hasil, virus ini juga dapat menimbulkan beberapa akibat yang tidak diinginkan, yaitu terhambatnya proses pematangan buah, penurunan hasil, perubahan pigmentasi, dan penurunan akumulasi gula (Akbas et al., 2009).
GLRaV-3 merupakan virus dominan yang ditemukan di negara-negara penghasil anggur (Sforza et al., 2003; Anfoka et al., 2004; Martin et al., 2005; Akbas et al., 2009; Wang et al., 2011). GLRaV-3 dapat ditularkan oleh mealybug Planococcus ficus, Pseudococcus longispinus, Planococcus citri, dan Pseudococcus affinis (Cabaleiro & Segura, 1997). Sedangkan penyebaran jarak jauh GLRaV-3 terjadi terutama melalui bahan perbanyakan vegetatif tanaman. Pengetahuan mengenai GLRaV-3 yaitu virus penyebab penyakit daun menggulung anggur sama sekali belum tersedia di Indonesia.
Berdasarkan dari uraian di atas tujuan yang ingin dicapai adalah untuk identifikasi mealybug yang mengkoloni tanaman anggur di Bali, untuk mengetahui jenis mealybug yang dapat sebagai vektor dan untuk mengetahui tanaman apa yang dapat di infeksi oleh GLRaV-3.
Survei mealybug yang mengkoloni pertanaman anggur dilakukan di Kecamatan Kubutambahan, Banjar, Seririt dan Gerokgak Kabupaten Buleleng, Bali. Setiap jenis mealybug diambil 25 sampai 50 ekor dan dimasukkan ke dalam botol yang berisi alkohol 70% untuk kemudian dipreparasi dan diidentifikasi di Laboratorium Biosistematika Serangga, Fakultas Pertanian IPB, Bogor.
Sedangkan survei terhadap tanaman anggur yang menunjukkan gejala GLRaV-3 dilakukan di tempat yang sama yaitu dengan mengamati bagian daun tanaman anggur yang berwarna merah, klorosis daun disertai menggulung dan tanaman kurang vigor. Tanaman anggur yang diduga terinfeksi GLRaV-3 dari hasil pengamatan dikoleksi, dan kemudian dipelihara di rumah kaca untuk digunakan sebagai bahan penelitian (sumber inokulum).
Pemeliharaan Mealybug
Mealybug diperbanyak dan dipelihara pada buah Labu (Cucurbita moschata (Duch) Poir.
Identifikasi Mealybug yang Mengkoloni Tanaman Anggur
Preparasi spesimen dilakukan dengan mengikuti metode William & Watson (1988), dan menggunakan kunci identifikasi Williams (2004).
Perbanyakan Sumber Inokulum dan Tanaman Uji
Sumber inokulum GLRaV-3 di peroleh dari stek tanaman terinfeksi yang di ambil dari pertanaman anggur di Kecamatan Kubutambahan.
Efisiensi Penularan GLRaV-3 oleh Mealybug
Sebanyak 500 nimfa mealybug dipindahkan ke kotak plastik untuk dipuasakan selama 2 jam dan selanjutnya mealybug tersebut diletakkan pada tanaman anggur yang telah terinfeksi GLRaV-3 dengan periode makan akuisisi selama 4 jam. Mealybug tersebut kemudian dipindahkan ke tanaman anggur sehat sebanyak 1, 5, 10, 15 individu setiap tanaman, dengan periode inokulasi 7 hari. Pemindahan mealybug dengan hati-hati menggunakan kuas agar stiletnya tidak patah. Tiap perlakuan di ulang 15 kali. Sebagai kontrol, tanaman anggur diperlakukan sama, kecuali mealybug diberi periode makan akuisisi pada tanaman anggur sehat. Tanaman uji dipelihara di dalam kurungan kedap serangga dan mealybug dimatikan. Pengamatan dilakukan setiap hari sampai 2 bulan setelah penularan terhadap masa inkubasi, gejala dan persentase tanaman yang sakit. Hasil penularan dikonfirmasi dengan uji serologi (ELISA).
Uji Kisaran Inang terhadap GLRaV-3
Tanaman uji yang digunakan adalah dari famili (1) Vitaceae: yaitu tanaman anggur (Vitis vinifera var Black Caroline, Vitis vinifera var Red Prince dan Vitis vinifera var Green Belgy), (2) Solanaceae: Cabe rawit (Capsicum frutecens), Tomat (Lycopersicon esculentum), Terong (Solanum molengena), Kecubung (Datura stramonium), Nicotiana tabacum var White Burley, Nicotiana benthamiana dan Ceplukan (Physalis floridana), (3) Leguminoceae: Kacang panjang (Vigna unguiculata), Kacang Hijau (Vigna radiatus) dan Kacang tanah (Arachis hypogea), (4) Cucurbitaceae: Mentimun (Cucumis sativus) dan Labu (Cucurbita moschata), (5) Crucuferaceae: Kubis (Brasica oleracea) dan Sawi Hijau (B. juncea), (6) Amaranthaceae: Bunga Ratna (Gomphrena globosa), (7) Annonaceae: Srikaya (Annona squamosa), (8) Malvaceae: bunga sepatu (Hibiscus rosa-sinensis). Tanaman uji ditumbuhkan di rumah kaca kebun percobaan Fakultas Pertanian Unud Jl. Pulau Moyo No. 16 Pegok, Denpasar Selatan.
Deteksi Virus GLRaV-3 dengan Metode Enzyme Linked Immunosorbent Assay (ELISA)
Deteksi sampel secara serologi dengan metode DAS-ELISA mengikuti metode ADGEN. Antiserum dilarutkankan ke dalam coating buffer (1:1000) dan dimasukkan ke dalam plat mikrotiter sebanyak 100 µl tiap sumuran plat mikrotiter kemudian diinkubasikan pada suhu 37 oC selama 2 sampai 4 jam. Plat mikrotiter dicuci sebanyak 5-7 kali dengan PBST. Sampel daun tanaman digerus dalam sample extraction buffer dengan perbandingan 1:5 (b/v). Cairan perasan tanaman
yang dihasilkan diambil sebanyak 100 µl kemudian dimasukkan ke dalam sumuran plat mikrotiter dan diinkubasikan selama semalam pada suhu 4 oC. Plat mikrotiter dicuci lagi sebanyak 5-7 kali dengan PBST. Kemudian ke dalam sumuran plat mikrotiter diisi 100 µl enzim konjugat yang sudah diencerkan dengan bufer konjugat dan diinkubasi pada 37 oC selama 4 jam. Selanjutnya dilakukan pencucian dengan PBST sebanyak 5-7 kali, sumuran plat mikrotiter kemudian disi dengan 100 µl substrat p-nitrophenyl phosphate (PNP) yang dilarutkan dalam bufer PNP dan diinkubasi pada suhu ruang selama 30 menit sambil diamati terjadinya perubahan warna pada sumuran plat mikrotiter. Pengamatan secara kuantitatif dilakukan dengan pembacaan nilai absorban pada panjang gelombang 405 nm dengan ELISA reader. Reaksi dihentikan dengan menambahkan larutan NaOH 3 M sebanyak 50 µl ke dalam masing-masing sumuran. Kontrol negatif yang digunakan adalah tanaman sehat dan bufer.
Hasil identifikasi menggunakan kunci determinasi William (2004), menunjukkan bahwa spesimen mealybug terindetifikasi menjadi 2 spesies yaitu Ferrisia virgata (Ckll.) (Hemiptera : Pseudococcidae) (K1, G2, S2) dan Maconellicoccus hirsutus (Green) (Hemiptera : Pseudococcidae) (K2, G1, S1, B) (Gambar 1).


Gambar 1. Dua spesies mealybug yang mengkoloni pertanaman anggur di Kabupaten Buleleng (A) Ferrisia virgata (Ckll). dan (B) Maconellicoccus hirsutus
Nama umum F. virgata adalah kutu putih atau striped mealybug, termasuk ke dalam Ordo Hemiptera, Sub ordo Sternorrhyncha, Super famili Coccoidea, family Pseudococcidae (William, 2004). Tubuh F. virgata berwarna abu-abu gelap, panjang tubuh 4 mm; badan memanjang oval, 2 submedial memanjang terbuka disekitar punggung, tidak ada ovisac di punggung, beberapa helai filamen venter yang membentuk pad, dengan 1 pasang filamen lilin lateral yang mencolok disekitar setengah tubuhnya. Saluran setae tergabung dalam pelek, ada multilocular ventral pada 3 segmen posterior perut, memiliki lebih dari 8 pori-pori
multilocular segmen VI, disekitar pelek terdapat saluran besar berbentuk tabung, dan memiliki 1 pasang cerari Gambar 2.

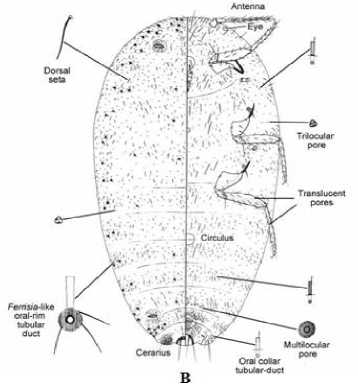
Gambar 2. Hasil identifikasi Ferrisia virgata secara mikroskopis (A) Preparat mikroskop dan (B) Diagram tubuh Sumber: William (2004).
M. hirsutus yang memiliki nama umum pink hibiscus mealybug, termasuk ordo Hemiptera, sub ordo Sternorrhyncha, dan famili Pseudococcidae (William, 2004). Badannya memanjang berbentuk oval, dan panjang tubuhnya 2,5-4 mm, warna tubuhnya merah kecoklatan dan oranye ke merah mudaan, memiliki 9 segmen antena, mempunyai 4-7 pasang cerari, 20 lebih pori trilocular di setiap sisi punggung di setiap segmen perut, pori-pori discodial tersebar di kedua permukaan, 15 lebih oral rim saluran tubular di setiap sisi segmen dorsum anterior abdomen dan segmen toraks, 10 setae disetiap segmen ventral abdomen, tibia lebih panjang dari tarsus, pori-pori multilocular terdapat banyak di venter perut, tembus di belakang tibia dan tarsus Gambar 3.
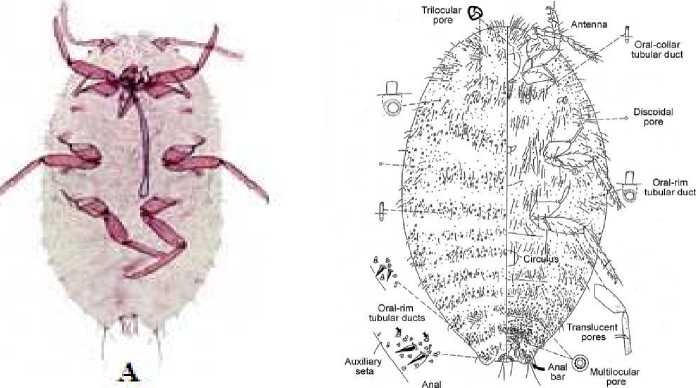
cerarius
Gambar 3. Hasil identifikasi secara mikroskopis (A) Preparat mikroskop dan (B) Diagram tubuh M. Hirsutus, Sumber: Miller (1999); William (2004).
Efisiensi Penularan GLRaV-3 oleh Mealybug
Hasil pengujian penularan GLRaV-3 oleh mealybug Ferrisia virgata dan Maconellicoccus hirsutus menunjukkan bahwa hanya M. Hirsutus yang mampu menularkan GLRaV-3 dengan frekuensi infeksi 73,3% yang menggunakan 5 individu mealybug dari tanaman terinfeksi ke tanaman sehat (Tabel 1). Frekuensi infeksi meningkat menjadi 100% pada penularan menggunakan 10 dan 15 individu mealybug setiap tanaman. Sedangkan mealybug F. virgata tidak mampu menularkan GLRaV-3 dari tanaman terinfeksi ke tanaman sehat. Uji penularan GLRaV-3 melalui mealybug terhadap tanaman uji yang dilakukan Tsai et al., (2010) yaitu mampu menginfeksi tanaman uji sebesar 60% pada penularan menggunakan 5 individu mealybug di setiap tanaman dari tanaman sakit ke tanaman uji sehat.
Pada pengujian penularan GLRaV-3 melalui mealybug M. hirsutus dengan 10,15 maelybug individu pada setiap tanaman sudah mampu menularkan GLRaV-3. Hasil ini sama seperti penelitian Kruger et al., (2006) dengan menggunakan 15 mealybug pertanaman menyebabkan tanaman anggur terinfeksi GLRaV-3 sebesar 60%. Selain itu, Petersen & Charles (1997) menggunakan 10 mealybug pertanaman, tanaman positif terinfeksi GLRaV-3 sebesar 57%.
Tabel 1. Hasil penularan GLRaV-3 melalui F. virgata dan M. hirsutus
|
Jumlah mealybug/ tanaman |
Frekuensi infeksi* | |
|
F.virgata |
M. hirsutus | |
|
1 |
0% (0/15**) |
0% (0/15) |
|
5 |
0% (0/15) |
73,3% (11/15) |
|
10 |
0% (0/15) |
100% (15/15) |
|
15 |
0% (0/15) |
100% (15/15) |
*Verifikasi infeksi berdasarkan ELISA
**a/b : a sampel menunjukkan posotif terinfeksi dari b sampel yang di uji.
jumlah sampel yang positif uji ELISA
Frekuensi Infeksi = x 100 %
Jumlah Sampel
Kisaran Inang GLRaV-3
Tanaman yang di uji pada kisaran inang ini adalah dari famili (1) Vitaceae yaitu tanaman anggur: Vitis vinifera var Red Prince, Vitis vinifera var Green Belgy dan Vitis vinifera Black Caroline, (2) Solanaceae: Cabe rawit (Capsicum frutescens), Tomat (Lycopersicon esculentum), Terong (Solanum Melongena), Kecubung (Datura stramonium), Nicotiana benthamiana, N. tabacum var. White Burley, Ceplukan (Physalis floridana), (3) Leguminoceae: Kacang panjang (Vigna unguiculata), Kacang hijau (V. radiatus), Kacang tanah (Arachis hypogaea), (4) Cucurbitaceae: Mentimun (Cucumis sativus), Labu (Cucurbita
moschata), (5) Crucuferaceae: Kubis (Brassica oleracea), Sawi hijau (B. Juncea), (6) Amaranthaceae: Bunga Ratna (Gomphrena globosa), (7) Annonaceae: Srikaya (Annona squamosa), (8) Malvaceae: Bunga sepatu (Hibiscus rosa-sinensis) (Gambar 4).
Inokulasi GLRaV-3 melalui mealybug dapat menimbulkan gejala pada 3 spesies tanaman uji. GLRaV-3 isolat Kubutambahan menginfeksi tanaman anggur (Vitis vinifera), Ceplukan (Physalis floridana) dan bunga sepatu (Hibiscus rosa-sinensis) dari 18 spesies tanaman yang digunakan dalam uji kisaran inang. GLRaV-3 hanya menginfeksi tanaman dari famili Vitaceae, Ceplukan dan Bunga Sepatu, tetapi tidak menginfeksi spesies-spesies dari famili, Leguminoceae, Cucurbitaceae, Crucuferaceae, Amaranthaceae, dan Annonaceae (Gambar 5, Tabel 2).

Gambar 4. Delapan belas spesies tanaman indikator untuk uji kisaran inang GLRaV-3

Gambar 5. Variasi gejala pada tanaman anggur akibat infeksi GLRaV-3, A.
Tanaman anggur sehat, B. Hanya klorotik pada daun, C. Daun menjadi berwarna merah, D. Daun berwarna merah, klorotik dan menggulung.
Gejala daun menjadi klorotik, berwarna merah dan menggulung ditemukan pada tanaman anggur varietas Red Prince dan Black Caroline (Gambar 5). Sedangkan gejala klorotik saja tanpa menunjukkan warna merah dan menggulung ditemukan pada tanaman anggur varietas Green Belgy, Ceplukan, dan Bunga Sepatu. Penelitian Fuchs et al., 2009 yang menggunakan satu kultivar anggur hibrida dari 12 kultivar anggur, hanya menemukan enam kultivar yang memberikan reaksi negatif terhadap GLRaV-3, yaitu kultivar Lemberger, Cabarnet Franc, Chardonnay, Gewurtztraminer, Pinot Noir, dan Riesling.
Tabel 2. Respon berbagai tanaman indikator terhadap infeksi GLRaV-3 isolat Kubutambahan.
|
Famili dan spesies tanaman |
Frekuensi infeksi* Variasi gejala** |
|
Vitaceae Anggur (Vitis vinifera) var Red Prince Anggur (V. vinifera) var Green Belgy Anggur (V. vinifera) var Black Caroline Solanaceae Cabe rawit (Capsicum frutescens) Tomat (Lycopersicon esculentum) Terong (Solanum Melongena) Kecubung (Datura stramonium) Nicotiana benthamiana N. tabacum var. White Burley Ceplukan (Physalis floridana) Leguminoceae Kacang panjang (Vigna unguiculata) Kacang hijau (V. radiatus) Kacang tanah (Arachis hypogaea) Cucurbitaceae Mentimun (Cucumis sativus) Labu (Cucurbita moschata) Crucuferaceae Kubis (Brassica oleracea) Sawi hijau (B. juncea) Amaranthaceae Bunga Ratna (Gomphrena globosa) Annonaceae Srikaya (Annona squamosa) Malvaceae Bunga sepatu (Hibiscus rosa-sinensis) |
10/10 me, kl, gl 8/10 kl 10/10 me, kl, gl 0/10 - 0/10 - 0/10 - 0/10 - 0/10 - 0/10 - 8/10 kl 0/10 - 0/10 - 0/10 - 0/10 - 0/10 - 0/10 - 0/10 - 0/10 - 0/10 - 6/10 kl |
*Frekuensi infeksi berdasarkan ELISA
**me: daun berwarna merah, gl: daun menggulung, kl: daun klorotik
Spesies mealybug yang mengkoloni tanaman anggur di Bali adalah Ferrisia virgata (Ckll) (Hemiptera Pseudococcidae) dan Maconellicoccus hirsutus (Green) (Hemiptera: Pseudococcidae). GLRaV-3 isolat Kubutambahan cukup efisien ditularkan oleh mealybug Maconellicoccus hirsutus (Green) (Hemiptera: Pseudococcidae) dan dapat mengakibatkan muncul gejala pada tanaman anggur yaitu daun menjadi klorotik, berwarna merah dan menggulung. GLRaV-3 mampu
menginfeksi tanaman anggur varietas Red Prince, Green Belgy, Black Caroline, Ceplukan (Physalis floridana) dan Bunga Sepatu (Hibiscus rosa-sinensis).
Daftar Pustaka
Akbas, B., B. Kunter, & D. Ilham. 2009. Influence of Leafroll on Local Grapevine Cultivars in Agroecological Conditions of Central Anatolia Region. Hort. Sci. (Prague), 36(3):97-104.
Anfoka, G. H., W. Shahrour, & M. K. Nakhla. 2004. Detection and Molecular Characterization of Grapevine Fanleaf Virus and Grapevine leafroll-associated Virus 3 in Jordan. Journal of Plant Pathology, 86 (3):203-207.
Badan Pusat Statistik. 2012. Nilai Impor dan Ekspor Buah tahun 2012. Kementerian Pertanian Jakarta.
Cabaleiro, C., & A. Segura. 1997. Some characteristics of the transmission of grapevine leafroll associated virus 3 by Planococcus citri Rosso. Eur. J. of Plant Pathol. 103:373-378.
Chong, T., A. Roda & C. M. Mannion. 2008. Life history of mealybug, Maconellicoccus hirsutus (Green) (Hemiptera : Pseudococcidae), at constant temperature. Environ. Entomol. 37 : 323-332.
Engelbrecht, D., & G. Kasdorf. 1990. Transmission grapevine leafroll disease and associated closteroviruses by the vine mealybug, Planococcus ficus. Phytophylactica 22: 341-346.
Fuchs, M., T. E. Martinson., G. M. Loeb & H. C. Hoch. 2009. Survey of the three major leafroll disease-associated viruses in Finger Likes vineyards in New York. Plant Dis. 93:395-401.
Garau, R., V. A. Prota., D. Boscia, M. Fiori, & U. Prota. 1995. Pseudococcus affinis Mask., new vector of grapevine trichoviruses A and B. Vitis 34: 6768.
Good, X & J. Monis. 2000. Partial Genome Organization, Identification of the Coat Protein Gene, and Detection of Grapevine Leafroll-assosiated Virus-5. Agritope Inc., Portland.
Kruger, K., D. Saccagi., & N. Douglas. 2006. Grapevine leafroll-associated virus 3-vector interaction : transmission by the mealybug Planococcus ficus and Pseudococcus longispinus (Hemiptera : Pseudococcidae). Extended Abstracts, 15th virus-like disease of the grapevine, 2006. Stellenbosch, South Africa, pp 130-131.
Martin, R. R., K. C. Easwell., S. Lamprecht, & I. E. Tzanetakis. 2005. Survey for Viruses of Grapevine in Oregon and Washington. Plant Disease, 89:763766.
Miller, D. R. 1999. Identification of the Pink Hibiscus Mealybug,
Maconellicoccus hirsutus (Green) (Hemiptera : Sternorrhycha :
Pseudococcidae). Insecta Mundi. 13 : 189-203.
Petersen, C., & J. Charles. 1997. Transmission of grapevine leafroll-
associatedclosteroviruses by Pseudococcus longispinus and P. calceolariae. Plant Pathology 46: 509-515
Rosciglione, B., & M. Castellano. 1985. Further evidence that mealybugs can transmit grapevine virus A (GVA) to herbaceoushosts. Phytopathologia Medetteranea 24: 186-188
Sforza, R., E. Boudon-Padieu, & C. Greif. 2003. New Mealybug Vectoring Leafroll-associated Viruses-1 and -3 (GLRaV-1 and -3). European Journal of Plant Pathology 109:975-981.
Tsai, C. W., A. Rohawni., D. A. Gollino., K. M. Danee., & R. P. P. Almeida. 2010. Mealybug transmission of grapevine leafroll viruses:an analysis ofvirus-vector specificity. Phytopathology 100: 830-834.
Turturo, C., P. Saldarelli., D. Yafeng., M. Digiaro., A. Minafra., V. Savino, & G. P. Martelli. 2005. Genetic variability and population structure of Grapevine leafroll-associated virus 3 isolate. J. of Gen. Virol. 86:217-224.
Wang, J., A. M. Sharma., S. Duffy, & R. P. P. Almeida. 2011. Genetic Diversity in 3’ Terminal 4.7-kb Region of Grapevine Leafroll-associated Virus-3. The American Phytophatological Society 101:445-450.
William, D. J., & G. W. Watson. 1988. The Scale Insects of the Tropical South Pasific. Part 2. The Mealybug (Pseudococcidae). CAB International, Wallinaford.
William, D. J. 2004. The Mealybug of Southern Asia Southdane. Kuala Lumpur
Discussion and feedback