Aktivitas Antibakteri Lactobacillus plantarum 1 RN9 Terhadap Escherichia coli ATCC 25922
on
Itepa: Jurnal Ilmu dan Teknologi Pangan,
Lucia Denok Wihartati dkk / Itepa 11 (4) 2022 669-687
ISSN : 2527-8010 (Online)
Aktivitas Antibakteri Lactobacillus plantarum 1 RN9 Terhadap Escherichia coli ATCC 25922
Antibacterial Activity of Lactobacillus plantarum 1 RN9 Against Escherichia coli ATCC 25922
Lucia Denok Wihartati 1, I Dewa Gde Mayun Permana 1*, Ni Made Indri Hapsari A. 1, Ni Nyoman Puspawati 1
1Program Studi Teknologi Pangan, Fakultas Teknologi Pertanian, Universitas Udayana Kampus Bukit Jimbaran, Badung-Bali
-
*Penulis korespondensi: IDG Mayun Permana, Email: mayunpermana@unud.ac.id
Abstract
The objectives of this research were to determine the antibacterial activity of Lactobacillus plantarum 1 RN9 on several metabolites with different incubation times against E. coli ATCC 25922 and to determine its optimum incubation times in producing the highest antibacterial activity against Escherichia coli ATCC 25922. This research used L. plantarum 1 RN9 which was isolated from dadih (Dadih is a typical Minang fermented milk made from buffalo milk, keep 2 nights in a bamboo tube covered with banana leaves), incubation times (12, 24, 36, and 48 hours), with three types of supernatant namely cell-free supernatant (CFS), neutral cell-free supernatant, and heated neutral cell-free supernatant. The supernatants were tested for its antimicrobial activity against E. coli ATCC 25922. There were two methods used in this research, namely agar-based disk diffusion and contact method. The highest antimicrobial activity of L. plantarum 1 RN9 against E. coli ATCC 25922 with cell-free culture supernatant was shown by isolate RN9 at incubation time of 24 hours with a decrease of 1.76 log cycle and 6.50 mm inhibition diameter.
Keywords : Lactobacillus plantarum 1 RN9, Escherichia coli ATCC 25922, antibacterial activity
PENDAHULUAN
Keracunan makanan merupakan salah satu kasus yang sering terjadi di seluruh dunia. Keracunan makanan dapat disebabkan karena adanya kontaminasi akibat tercemar oleh virus, logam berat, dan bakteri patogen. Bakteri patogen yang sering menyebabkan keracunan pada makanan, hingga menyebabkan Kejadian Luar Biasa (KLB) adalah Escherichia coli. Berdasarkan data yang diperoleh dari tahun 2000-2015 di Indonesia bakteri E.coli menyebabkan kasus keracunan sebesar 20%. Adanya cemaran bakteri E. coli menunjukkan rendahnya tingkat sanitasi dan praktek higiene. Beberapa strain E. coli dapat menyebabkan penyakit karena menghasilkan
toksin enterotoksin pada saluran pencernaan (Arisanti et al., 2018).
Salah satu kasus diare yang diakibatkan infeksi bakteri E. coli 0157:H7 terjadi di Jepang pada tahun 1996 dengan KLB terbesar, dengan korban sebanyak 6.309 anak sekolah, 92 anggota staf sekolah, dan menyebabkan dua kasus kematian (Hartono dan Widiastuti, 2005). Salah satu terapi yang dapat digunakan untuk menyembuhkan diare adalah dengan mengonsumsi probiotik. Beberapa strain probiotik yang dapat digunakan sebagai terapi untuk diare adalah Lactobacillus reuteri, Lactobacillus rhamnosus GG, Bifidobacterium lactis, dan Lactobacillus casei. Mekanismenya secara singkat yaitu dengan meningkatkan kolonisasi bakteri probiotik di dalam lumen saluran cerna,
sehingga seluruh epitel mukosa usus telah diduduki oleh bakteri probiotik melalui reseptor dalam sel epitel usus, sehingga tidak terdapat tempat lagi untuk bakteri patogen untuk melekatkan diri pada sel epitel usus dan akhirnya kolonisasi (Sanz et al., 2007).
Aktivitas antibakteri merupakan salah satu syarat yang harus dipenuhi oleh mikroba yang akan dikategorikan menjadi probiotik. Antibakteri merupakan komponen yang dapat menghambat pertumbuhan dari bakteri atau kapang (bakteristatik atau fungistatik) hingga membunuh bakteri atau kapang (bakterisidal atau fungisidal) dan bersifat germisidal (menghambat germinasi dari spora bakteri). Supernatan dari kultur bakteri asam laktat mengandung senyawa antibakteri yang merupakan hasil metabolit sekunder. Komponen antibakteri yang terdapat pada BAL yaitu asam organik, karbondioksida, hidrogen peroksida, diasetil, reuterin, dan bakteriosin mampu menghambat pertumbuhan mikroba patogen dalam makanan atau tubuh (FAO, 2002; Zheng et al., 2013; Fardiaz, 1993; Amezquita dan Brashears, 2002; Suskovic et al., 2010).
Puspawati et al. (2018b) mengisolasi bakteri asam laktat strain Lactobacillus plantarum 1 RN9 dengan bentuk koloni bintang yang diisolasi dari dadih yang difermentasi menggunakan bambu petung yang kemudian diencerkan, dan diisolasi pada media MRSA. L. plantarum 1 RN9 memiliki karakteristik Gram positif dengan bentuk batang pendek berantai, katalase negatif, mampu tumbuh pada suhu 10°C sampai suhu 45°C, tahan dan mampu tumbuh pada pH 2 sampai pH 6, serta
mampu tumbuh pada kondisi lingkungan yang mengandung garam empedu dengan konsentrasi 0,3%. L. plantarum 1 RN9 belum diteliti kemampuannya dalam menghambat pertumbuhan mikroba patogen khususnya Escherichia coli ATCC 25922.
Penelitian Sundari (2014) menyatakan bahwa isolat BAL dari ASI memiliki aktivitas penghambatan terhadap bakteri Escherichia coli ATCC 25922 dan penelitian Putra (2015) menyatakan isolasi bakteriosin isolat BAL dari ASI memiliki aktivitas penghambatan terhadap Escherichia coli ATCC 25922 dengan waktu inkubasi yang berbeda. Bakteriosin yang dihasilkan dari 7 isolat yang diteliti memiliki waktu optimum yang berbeda, 4 isolat dengan waktu inkubasi 12 jam, 1 isolat dengan waktu inkubasi 36 jam, dan 2 isolat dengan waktu inkubasi 60 jam. Menurut Rattanachaikunsopon dan Phumkhachorn (2006) produksi senyawa antibakteri seperti bakteriosin dari Lactobacillus plantarum N014 dipengaruhi oleh waktu inkubasi dan diproduksi secara optimum pada fase logaritma dan saat bakteri akan memasuki fase stasioner dari bakteri. BAL memiliki kurva pertumbuhan yang berbeda sehingga mengakibatkan waktu optimum produksi antibakteri juga akan berbeda. Berdasarkan penelitian-penelitian tersebut perlu dilakukan penelitian untuk mengetahui aktivitas antibakteri L. plantarum 1 RN9 dengan waktu inkubasi yang berbeda terhadap E. coli ATCC 25922.
METODE
Penelitian ini menggunakan Lactobacillus plantarum 1 RN9 yang diperoleh dari
Laboratorium Mikrobiologi Fakultas Teknologi Pertanian Universitas Udayana; isolat Escherichia coli ATCC 25922 yang diperoleh dari Bali Seafood Inpection Laboratory Sanur, Bali; Nutrient Agar (NA) (Merck), LB (Lactose Broth) (NEOGEN), DeMan Rogosa and Sharpe Broth (MRSB), Eosin Methylene Blue Agar (EMBA) (Oxoid), Lactose Broth (LB) (NEOGEN), bacto agar (Merck) sebagai bahan tambahan dalam pembuatan MRSA, paper disk blank (Oxoid CT0998B), NaOH 1 N, gliserol 20%, NaCl (Merck), alkohol 70% dan 95%, H2O2 (3%), tisu, kapas, aquades (Bratachem), dan kit pengecatan gram (kristal violet, lugol, etanol 95%, dan safranin).
Alat yang digunakan dalam penelitian ini diantaranya adalah cawan petri (Anumbra), tabung reaksi (IWAKI), gelas ukur (Pyrex), jarum ose, gelas beaker (Pyrex), bunsen, jangka sorong, batang bengkok, erlenmeyer (Pyrex), kaca objek, eppendorf, tips, mikropipet (DragonLab), inkubator (Memmert), Laminar Air Flow (Kojair), autoklaf (HiClave HVE50), hot plate, sentifuse, sterilisator, indikator kertas pH Universal (Merck), tissue, aquades, aluminium foil, kertas label, plastik, dan kertas buram timbangan analitik (Shimadzu ATY224), vortex (Maxi-MIX II), dan mikroskop (Nikon E-100).
Rancangan Penelitian
Penelitian ini merupakan penelitian eksperimental untuk mengetahui aktivitas antibakteri berbagai perlakuan metabolit dari L. plantarum 1 RN9 terhadap E. coli ATCC 25922 dengan perlakuan waktu inkubasi yaitu: 12; 24; 36;
dan 48 jam, dan jenis metabolit, yaitu supernatan bebas sel (SBS), supernatan bebas sel netral (SBSN), dan supernatan bebas sel netral yang dipanaskan (SBSNP). Masing-masing perlakuan dilakukan diulang sebanyak 2 kali. Data dianalisis secara deskriptif kuantitatif dan disajikan dalam bentuk tabel dan gambar (Bower, 2013).
Pelaksanaan Penelitian
Tahapan penelitian yang akan dilakukan meliputi penyegaran L. plantarum 1 RN9; uji konfirmasi dengan pengecatan Gram, pengamatan morfologi sel, dan uji katalase; pembuatan kultur stok/kerja. Tahapan selanjutnya adalah pengujian aktivitas antibakteri metode difusi agar (Effendi et al., 2014) dan metode kontak (Rahayu, 2000). Penyegaran L. plantarum 1 RN9 dan E. coli ATCC 25922
L. plantarum 1 RN9 sebelumnya disimpan dengan menggunakan metode penjeratan (imobilisasi) (Dewanti-Hariyadi et al., 2003 dalam Winarti, 2011) menggunakan manik-manik di dalam tabung microtube yang berisi campuran kultur dan gliserol 20% dan disimpan pada suhu -80°C di dalam freezer. Penyegaran L. plantarum 1 RN9 dilakukan dengan menginokulasi manik-manik yang mengandung mikroba (±3 biji) dengan ose dari kultur induk ke dalam 5 ml media MRSB steril, kemudian diinkubasi pada suhu 37 0C selama 24-48 jam. Hasil ditandai dengan adanya kekeruhan pada media. Penyegaran E. coli ATCC 25922 pada media Lactose Broth (LB) steril dan diinkubasi pada suhu 37°C selama 24-36 jam (Juniarthati, 2011).
Pewarnaan Gram
Pewarnaan Gram dilakukan menurut Harrigan dan McCance (1998). Sebanyak satu ose air steril diteteskan pada kaca objek ditambah dengan satu ose isolat kultur kerja yang disebarkan hingga rata, selanjutnya difiksasi di atas nyala api bunsen. Preparat ditambah satu tetes kristal ungu dan didiamkan selama 1 menit, selanjutnya dicuci menggunakan air mengalir dengan posisi miring kemudian dikeringkan dengan kertas tisu. Preparat ditambah satu tetes lugol dan didiamkan selama 2 menit, kemudian dicuci menggunakan air mengalir dengan posisi miring dan dikeringkan dengan kertas tisu. Preparat ditambah etanol 95% dan didiamkan selama 10-20 detik kemudian dicuci dengan air serta dikeringkan. Preparat ditambah satu tetes safranin dan didiamkan selama 10-20 menit kemudian dibilas dengan air. Preparat ditetesi minyak imersi dan diamati dibawah mikroskop hingga perbesaran 1000 kali. Isolat bersifat Gram positif jika sel berwarna ungu dan Gram negatif jika sel berwarna merah. Isolat yang mempunyai sifat Gram positif digunakan untuk pengujian selanjutnya.
Pengamatan Morfologi Bakteri
Pengamatan bentuk bakteri dilakukan menurut Harrigan dan McCance (1998). Preparat Gram yang diperoleh dari pewarnaan Gram diamati di bawah mikroskop dengan pembesaran 1000 x. Mikroba yang mempunyai bentuk kokus, streptokokus, basil pendek, basil panjang, basil berantai dan berbentuk basil mirip huruf Y kemudian dilanjutkan ke pengujian berikutnya.
Uji Katalase
Uji katalase dilakukan menurut Harrigan dan McCance (1998). Diambil broth kultur kerja sebanyak 100ul, kemudian diteteskan pada kaca preparat. Kaca preparat yang berisi kultur ditetesi dengan larutan H2O2 3%. Hasil pengujian positif ditandai dengan terbentuknya gelembung gas pada preparat, sedangkan hasil pengujian negatif ditandai dengan tidak terbentuknya gelembung gas pada preparat.
Pembuatan Kultur Kerja dan Stok L. plantarum 1 RN9 dan E coli ATCC 25922
Pembuatan kultur stok dan kultur kerja L. plantarum 1 RN9 dibuat dengan cara membiakkan L. plantarum 1 RN9 yang telah disegarkan sebelumnya pada media MRSA dengan metode streak for single cell colony agar memperoleh koloni tunggal. Satu koloni tunggal diambil dan diinokulasi pada 5 ml media MRSB kemudian diinkubasi pada suhu 370C selama 24 jam. Suspensi tersebut dibuat kultur stok dalam gliserol dengan cara menambahkan 500 µL kultur L. plantarum 1 RN9 pada 500 µL gliserol 20% pada microtube yang telah berisi manik-manik kemudian disimpan dalam freezer dengan suhu -80°C. Kultur kerja dibuat dengan cara menusukkan kultur L. plantarum 1 RN9 dari media MRSB dengan menggunakan jarum ose pada media MRSA tegak kemudian diinkubasi pada suhu 37°C selama 48 jam kultur kerja kemudian disimpan pada suhu 4°C.
Pembuatan kultur stok dan kultur kerja bakteri E. coli ATCC 25922 dibuat dengan cara membiakkan E. coli ATCC 25922 yang telah
disegarkan pada media Lactose Broth (LB). Suspensi tersebut dibuat kultur stok dalam gliserol dengan cara menambahkan 500 µl kultur E. coli ATCC 25922 pada 500µl gliserol 20% pada microtube yang telah berisi manik-manik kemudian disimpan dalam freezer dengan suhu -80°C. Kultur kerja E. coli ATCC 25922 dibuat dengan menginokulasi dari media LB pada media NA miring dan diinkubasi selama 24-36 jam pada suhu 37°C kemudian disimpan pada suhu 4°C (Juniarthati, 2011).
Pembiakkan Kultur L. plantarum 1 RN9
Pembiakkan kultur dilakukan dengan cara mengambil 1 ose dari kultur kerja dan diinokulasikan ke dalam MRSB kemudian diinkubasi dengan waktu berbeda yaitu 12, 24, 36, dan 48 jam. L. plantarum 1 RN9 yang sudah dibiakkan kemudian digunakan untuk pengujian parameter yang akan diteliti.
Total Bakteri Asam Laktat
Total bakteri asam laktat dihitung dengan metode Total Plate Count (TPC) yaitu dengan menginokulasi L. plantarum 1 RN9 pada media MRSA pada pengenceran 10-5-10-7. Koloni yang tumbuh dihitung hingga didapatkan jumlah koloni yang selanjutnya digunakan untuk menghitung total bakteri asam laktat yang memiliki jumlah koloni antara 25-250. Satuan yang digunakan dalam perhitungan jumlah bakteri adalah cfu/ml (cfu = colony forming units) (Fardiaz, 1993).
Persiapan Pengujian Aktivitas Antibakteri terhadap E. coli ATCC 25922
Persiapan supernatan yang akan digunakan untuk pengujian aktivitas antibakteri terhadap E.
coli ATCC 25922 merujuk pada Juniarthati (2011) yang dimodifikasi.
Persiapan Supernatan Bebas Sel (SBS)
Kultur BAL yang digunakan dalam penelitian ini adalah kultur yang sebelumnya sudah diinkubasi dengan waktu inkubasi berbeda yaitu 12, 24, 36, dan 48 jam pada suhu 37°C. Suspensi L. plantarum 1 RN9 dalam tabung reaksi disentrifugasi pada suhu 4°C dengan kecepatan 6000 rpm selama 15 menit. Supernatan dan pelet yang terbentuk kemudian dipisahkan, bagian yang digunakan adalah supernatan yang disebut supernatan bebas sel (SBS).
Supernatan Bebas Sel Netral (SBSN)
Sebanyak 3 ml SBS dinetralkan dengan menggunakan NaOH 1 N hingga pH mencapai 6,8 selanjutnya disebut supernatan bebas sel netral (SBSN). Tujuan dari penetralan adalah untuk menghilangkan pengaruh asam organik yang dihasilkan BAL.
Supernatan Bebas Sel Netral Panas (SBSNP)
SBSN diambil sebanyak 1,5 ml untuk diberi perlakuan pemanasan menggunakan hotplate pada suhu 100°C selama 15 menit, yang selanjutnya disebut supernatan bebas sel netral dipanaskan (SBSNP). Tujuan dari pemanasan ini adalah untuk menghilangkan hidrogen peroksida, diasetil dan karbondioksida, sehingga yang tersisa hanya bakteriosin.
Pengujian Aktivitas Antibakteri L. plantarum 1 RN9 Terhadap E. coli ATCC 25922
Pengujian aktivitas antibakteri L. plantarum 1 RN9 terhadap E. coli ATCC 25922
dilakukan dengan metode difusi agar (Effendi et al., 2014) dan metode kontak (Rahayu, 2000).
Metode Difusi
Pengujian metode difusi agar diawali dengan kultur bakteri E. coli ATCC 25922 diinokulasikan dalam LB dan diinkubasi pada suhu 37 0C selama 24 jam, kemudian sebanyak 100µl diinokulasikan pada media NA kemudian disebar dengan menggunakan batang bengkok secara merata. Kertas cakram direndam selama ± 1 menit ke dalam masing-masing perlakuan supernatant (SBS, SBSN, dan SBSNP) dan MRSB steril sebagai kontrol, kemudian kertas cakram diletakkan di atas media NA yang telah diinokulasi dengan bakteri E. coli ATCC 25922 dan diinkubasi pada suhu 37 0C selama 24 jam.
Diameter penghambatan adalah ditandai dengan adanya besar zona area bening yang terbentuk di sekitar kertas cakram yang diukur dengan satuan mm. Diameter zona penghambatan (mm) diukur dengan jangka sorong sebanyak empat kali pada posisi yang berbeda dan dirata-ratakan. Hasil aktivitas antibakteri dikategorikan pada ukuran diameter zona hambat, apabila diameter zona hambat sama dengan diameter difusi berarti tidak ada penghambatan; diameter 1–3 mm menunjukkan penghambatan lemah; diameter 3–6 mm menunjukkan penghambatan sedang; dan diameter > 6 mm menunjukkan aktivitas penghambatan kuat (Pan et al., 2009).
Metode Kontak
Pengujian metode kontak dilakukan dengan cara sebanyak 1 µl E. coli ATCC 25922
yang telah disegarkan selama 24 jam dan diencerkan hingga 103 kemudian dimasukkan kedalam 1 ml SBS sesuai perlakuan. Dilakukan pemupukan cawan pada jam ke-0 dan jam ke- 8 lalu cawan diinkubasi pada suhu 37°C selama 48 jam. Dilakukan perhitungan pertumbuhan relatif dinyatakan sebagai Nt/N0 dimana Nt adalah log dari jumlah koloni setelah kontak 8 jam dan N0 adalah log dari jumlah koloni pada waktu kontak 0 jam. Perhitungan koloni didasarkan pada Standard Plate Count (SPC) (Harrigan, 1998) dan dihitung penurunan jumlah koloni untuk setiap perlakuan dan ulangan. Cawan yang dipilih dan dihitung adalah cawan yang mengandung jumlah koloni antara 25-250.
HASIL DAN PEMBAHASAN
Uji Konfirmasi Lactobacillus plantarum 1 RN9 dan Bakteri Escherichia coli ATCC 25922
Konfirmasi L. plantarum 1 RN9 dan bakteri E. coli ATCC 25922 dilakukan berdasarkan karakteristik fisik yang meliputi pewarnaan Gram, pengamatan morfologi bakteri, dan uji katalase. Hasil pengujian dapat dilihat pada Tabel 1. Berdasarkan Tabel 1 dapat diketahui bahwa L. plantarum 1 RN9 tergolong ke dalam bakteri asam laktat karena memiliki karakteristik fisik yaitu berbentuk basil, Gram positif, dan katalase negatif. Hal ini sesuai dengan penelitian Puspawati et al., (2018b) yang melaporkan hasil uji konfirmasi L. plantarum 1 RN9 memiliki hasil uji konfirmasi yang serupa, yaitu bersifat katalase negatif, berbentuk batang, dan Gram positif.
Tabel 1. Hasil uji konfirmasi L. plantarum 1 RN9 dan bakteri E. coli ATCC 25922
|
No. Bakteri |
Karakteristik Fisik Cat Gram Katalase Morfologi |
|
1 Lactobacillus plantarum 1 RN9 2 Escherichia coli ATCC 25922 |
Gram + Negatif Basil Gram - Positif Basil pendek |
Menurut Hutkins (2006) bakteri asam laktat merupakan Gram positif, tidak menghasilkan enzim katalase, berbentuk batang maupun kokus, fermentatif, tidak berspora, tahan terhadap asam, dan bersifat anaerob atau anaerob fakultatif.
Hasil pengecatan gram pada keseluruhan L. plantarum 1 RN9 menunjukkan bakteri merupakan bakteri Gram positif yang ditandai dengan warna ungu. Perbedaan struktur dinding sel bakteri Gram positif dan negatif menyebabkan terjadinya perbedaan warna yang diserap oleh sel bakteri. Dinding sel dari bakteri Gram positif mengandung peptidoglikan yang tebal sebanyak 90% dengan kandungan asam amino yang bersifat polar dan asam teikoat, serta lipid yang rendah, sedangkan dinding sel dari bakteri Gram negatif tersusun dari peptidoglikan sebanyak 5-20%, lipopolisakarida, lipoprotein, fosfolipid, dan protein (Lay, 1994; Pelczar dan Chan, 2005; Neu dan Gootz, 1996).
Uji katalase yang dilakukan pada seluruh L. plantarum 1 RN9 menunjukkan hasil katalase
negatif. Katalase negatif ditandai dengan tidak adanya gelembung gas O2 yang dihasilkan dari degradasi H2O2 oleh enzim katalase. Enzim katalase dapat memecah senyawa H2O2 menjadi H2O dan O2. Uji katalase yang dilakukan pada bakteri untuk mengetahui kemampuan bakteri dalam menghasilkan enzim katalase (Surono, 2004; Salminen et al., 2004). Hasil uji konfirmasi E. coli ATCC 25922 dilakukan berdasarkan karakteristik fisik yang meliputi uji pewarnaan Gram, pengamatan morfologi bakteri, dan uji katalase. Hasil uji konfirmasi E. coli ATCC 25922 dilihat pada Tabel 1. Hasil uji konfirmasi karakteristik E. coli ATCC 25922, yaitu berbentuk batang pendek, katalase positif, dan Gram negatif. Hal ini sesuai dengan pernyataan (Bhunia, 2008), bahwa E. coli ATCC 25922 memiliki bentuk batang pendek, katalase positif, dan Gram negatif.
Total Bakteri Asam Laktat
Total BAL L. plantarum 1 RN9 dengan berbagai waktu inkubasi dilihat pada Gambar 1
|
9,35 |
Total BAL | ||
|
. 3 10,00 S ≡ f 8,00 Λ M- 6,00 a ~ 4,00 |
9,17 8,42 |
6,38 | |
|
12 |
24 36 Waktu Inkubasi (Jam) |
48 | |
Gambar 1. Grafik total BAL L. plantarum 1 RN9 yang diinkubasi dengan waktu yang berbeda
Berdasarkan Gambar 1 diketahui bahwa total BAL L. plantarum 1 RN9 pada waktu inkubasi 12 dan 24 jam tidak mengalami peningkatan ataupun penurunan. Hal tersebut dapat dilihat pada waktu inkubasi 12 dan 24 jam yang masih berada pada siklus log yang sama. Hal tersebut diduga pada waktu inkubasi 12 dan 24 jam L. plantarum 1 RN9 telah memasuki fase stasioner atau fase pertumbuhan tetap. Fase stasioner adalah keadaan dimana jumlah sel yang membelah sama dengan jumlah sel yang mati sehingga jumlah sel tetap akibat penumpukan produk beracun dan atau kehabisan nutrisi. Pada fase ini jumlah populasi sel bakteri yang tumbuh sama dengan jumlah sel yang mati (Pelczar dan Chan, 1986; Judoamidjojo et al., 1990).
Pada waktu inkubasi 36 dan 48 jam total BAL pada L. plantarum 1 RN9 cenderung mengalami
penurunan, hal tersebut ditujukkan bahwa total BAL L. plantarum 1 RN9 mengalami penurunan sebesar 2 siklus log dari 8,42 log cfu/ml menjadi 6,38 log cfu/ml. Hal tersebut diduga pada waktu inkubasi 36 jam dan 48 jam L. plantarum 1 RN9 sudah memasuki fase kematian. Fase kematian adalah fase dimana jumlah sel bakteri mulai menurun karena nutrisi dalam media dan cadangan energi dalam sel mulai habis (Pelczar dan Chan, 1986).
Aktivitas Antibakteri L. plantarum 1 RN9 terhadap E. coli ATCC 25922 Metode Difusi Agar
Hasil aktivitas antibakteri pada berbagai perlakuan metabolit dari L. plantarum 1 RN9 terhadap E. coli ATCC 25922 dapat dilihat pada Tabel 2.
Tabel 2. Aktivitas antibakteri pada berbagai perlakuan metabolit dari L. plantarum 1 RN9 dengan berbagai waktu inkubasi terhadap E. coli ATCC 25922
|
Jenis Metabolit |
Waktu Inkubasi (Jam) | |||
|
12 |
24 |
36 |
48 | |
|
SBS |
5,58 |
6,50 |
5,88 |
2,68 |
|
(Sedang) |
(Kuat) |
(Sedang) |
(Lemah) | |
|
SBSN |
4,50 |
4,88 |
2,98 |
1,00 |
|
(Sedang) |
(Sedang) |
(Lemah) |
(Lemah) | |
|
SBSNP |
3,08 |
3,63 |
1,88 |
0,75 |
|
(Sedang) |
(Sedang) |
(Lemah) |
(Lemah) | |
Keterangan: Kriteria berdasarkan (Pan et al., 2009)
Pan et al., (2009) menyatakan bahwa kekuatan aktivitas antimikroba dikategorikan pada ukuran diameter zona hambat: diameter zona hambat sama dengan diameter sumur berarti tidak ada penghambatan, diameter diantara 1–3 mm berarti penghambatan lemah, diameter diantara 3–
6 mm berarti penghambatan sedang dan diameter >
-
6 mm berarti aktivitas penghambatan kuat.
Aktivitas Antibakteri Supernatan Bebas Sel (SBS)
Senyawa organik utama yang dihasilkan
BAL adalah asam laktat. Selain asam laktat, BAL
diketahui juga menghasilkan senyawa bersifat antibakteri dan memilki spektrum penghambatan yang cukup luas yang dihasilkan dalam jumlah
lebih sedikit yaitu asam asetat, asam propionat, hidrogen peroksida, diasetil, dan bakteriosin (Lindgren dan Dobrogosz, 1990).
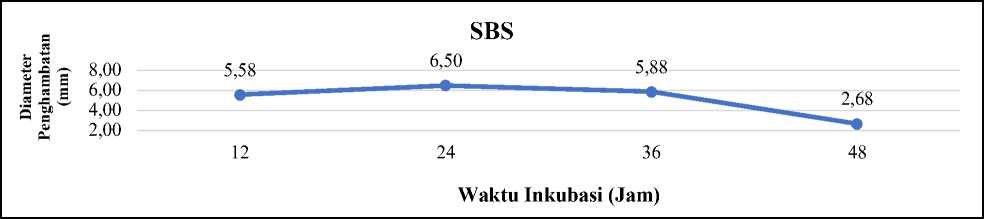
Gambar 2. Grafik aktivitas antibakteri perlakuan SBS L. plantarum 1 RN9 terhadap E. coli ATCC 25922
Aktivitas antibakteri L. plantarum 1 RN9 pada perlakuan SBS terhadap E. coli ATCC 25922, menunjukkan bahwa L. plantarum 1 RN9 dapat menghambat pertumbuhan E. coli ATCC 25922 dengan metode difusi pada semua waktu inkubasi. Hasil menunjukkan bahwa aktivitas antibakteri tertinggi dengan perlakuan SBS menghasilkan diameter penghambatan sebesar 6,50 mm dengan kriteria kuat pada waktu inkubasi 24 jam. Aktivitas antibakteri perlakuan SBS terendah menghasilkan diameter penghambatan sebesar 2,68 mm dengan waktu inkubasi 48 jam (Gambar 2).
Pada waktu inkubasi 24 jam merupakan fase stasioner dari L. plantarum 1 RN9 hal tersebut ditunjukkan pada hasil total BAL. Perbedaan aktivitas antibakteri SBS pada L. plantarum 1 RN9 dengan berbagai waktu inkubasi disebabkan oleh kurva pertumbuhan setiap bakteri yang berbeda. Menurut Campos et al. (2005) pembentukan senyawa antibakteri selama inkubasi terjadi pada saat memasuki pertengahan fase eksponensial, pembentukan optimum pada fase stasioner, dan
berdasarkan dari strain bakteri penghasil antibakteri dan E. coli ATCC 25922.
Asam organik yang terbentuk selama inkubasi akan menyebabkan pH berada pada kisaran pH pertumbuhan bakteri, dimana asam yang terbentuk tersebut dalam bentuk yang tidak terdisosiasi sehingga dapat berdifusi ke dalam sel mikroba. Asam yang terbentuk dapat melemahkan permeabilitas dari bakteri Gram negatif dengan merusak membran luar. Asam laktat bersifat larut dalam air, sehingga mampu menembus periplasma bakteri Gram negatif melalui protein porin pada membran luar. Pelindung permeabilitas membran sel sebagian besar tersusun dari lipopolisakarida kemudian membran akan rusak oleh asam sehingga substansi antibakteri seperti diasetil, bakteriosin, hidrogen peroksida dan laktoperoksidase sistem dapat berpenetrasi ke dalam membran sitoplasma (Davidson et al., 2010; Alakomi et al., 2000).
Hidrogen peroksida memiliki sifat bakterisidal karena kemampuannya sebagai oxidizing agent terhadap sel E. coli ATCC 25922.
Bagian dari dinding sel seperti gugus sulfidril dan lipid membran sel dapat dengan mudah teroksidasi. Akibatnya proses metabolisme seperti glikolisis terhambat dan kerja enzim seperti hexokinase dan aldehid-3-fosfat juga terganggu. Hidrogen peroksida umumnya bersifat bakteriostatik terhadap bakteri Gram positif dan bersifat bakterisidal untuk bakteri Gram negatif. (Salminen et al., 2004). Diasetil juga diketahui lebih efektif untuk membunuh bakteri Gram negatif, khamir, dan kapang dibandingkan bakteri Gram positif (Menurut Davidson et al., 1993).
Bakteriosin merupakan senyawa aktif membran yaitu dapat berinteraksi dengan reseptor spesifik pada membran sel target yang menyebabkan ketidakstabilan atau depolarisasi membran hingga terbentuknya lubang pada membran yang pada akhirnya akan mengakibatkan kebocoran pada sel bakteri, akibatnya bakteri akan mati (Engelke et al.,
1992). Bakteriosin tidak hanya bersifat bakterisidal tetapi juga bersifat bakteriostatik seperti yang dinyatakan oleh Magdalena (2009) bahwa bakteriosin yang dihasilkan oleh Lactobacillus fermentum 2B2 yang diisolasi dari daging, bersifat bakteriostatik yang hanya menghambat pertumbuhan mikroorganisme. Berdasarkan sifat bakteriostatik tersebut dapat diduga bahwa bakteriosin tidak membunuh E. coli ATCC 25922 namun dapat menghambat pertumbuhannya.
Aktivitas Antibakteri Supernatan Bebas Sel Netral (SBSN)
Penetralan bertujuan untuk menghilangkan pengaruh dari asam organik sebagai komponen utama senyawa antibakteri dari BAL, sehingga memaksimalkan komponen aktivitas antibakteri lainnya. Metabolit yang masih terdapat pada SBSN adalah hidrogen peroksida, diasetil, bakteriosin dan karbondioksida (CO2).
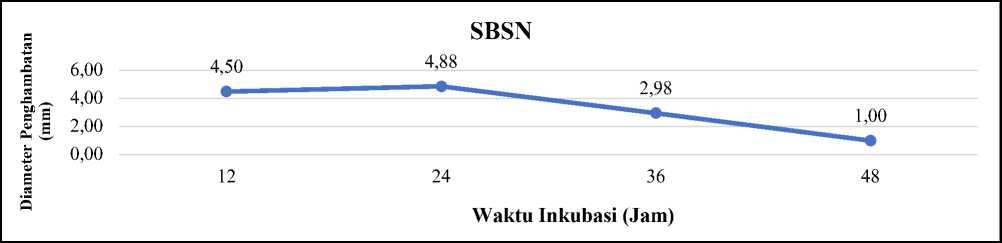
Gambar 3. Grafik aktivitas antibakteri perlakuan SBSN L. plantarum 1 RN9 terhadap E. coli ATCC 25922
Aktivitas antibakteri L. plantarum 1 RN9 pada perlakuan SBSN terhadap E. coli ATCC 25922, menunjukkan bahwa L. plantarum 1 RN9 dapat menghambat pertumbuhan E. coli ATCC 25922 dengan metode difusi pada semua waktu inkubasi. Hasil menunjukkan bahwa aktivitas antibakteri
tertinggi dengan perlakuan SBSN menghasilkan diameter penghambatan sebesar 4,88 mm dengan kriteria sedang pada waktu inkubasi 24 jam. Aktivitas antibakteri dengan perlakuan SBSN terendah menghasilkan diameter penghambatan
sebesar 1,00 mm dengan waktu inkubasi 48 jam (Gambar 3).
Hasil menunjukkan bahwa L. plantarum 1 RN9 dengan waktu inkubasi 48 jam menunjukkan diameter penghambatan terendah. Waktu inkubasi berkaitan dengan diameter penghambatan aktivitas antibakteri yang dihasilkan. Semakin kecil ukuran diameter penghambatan terhadap E. coli ATCC 25922 diduga karena L. plantarum 1 RN9 telah memasuki fase kematian, hal tersebut ditunjukkan pada hasil total BAL. Pada waktu inkubasi 24 jam L. plantarum 1 RN9 menunjukkan diameter penghambatan tertinggi, hal tersebut diduga karena pada waktu inkubasi tersebut L. plantarum 1 RN9 dapat menghasilkan metabolit sekunder seperti hidrogen peroksida, diasetil, bakteriosin dan karbondioksida (CO2) dengan optimum (Campos et al., 2005; Rachmawati et al. 2006).
Hidrogen peroksida bersifat bakterisidal karena kemampuannya sebagai oxidizing agent terhadap sel E. coli ATCC 25922. Bagian dari dinding sel seperti gugus sulfidril dan lipid membran sel dapat dengan mudah teroksidasi. Akibatnya proses metabolisme seperti glikolisis terhambat dan kerja enzim seperti hexokinase dan aldehid-3-fosfat juga terganggu. Hidrogen peroksida umumnya bersifat bakteriostatik terhadap bakteri Gram positif dan bersifat bakterisidal untuk bakteri Gram negatif. (Setianingsih, 2010; Salminen et al., 2004).
Diasetil lebih efektif jika berada pada pH kurang dari 7 dan sifat antibakterinya berlawanan dengan keberadaan glukosa, asetat, dan Tween 80. Diasetil juga diketahui lebih efektif untuk membunuh bakteri Gram negatif, khamir, dan
kapang dibandingkan bakteri Gram positif (Menurut Davidson et al., 1993). Bakteriosin merupakan senyawa aktif membran yaitu dapat berinteraksi dengan reseptor spesifik pada membran sel target yang menyebabkan ketidakstabilan atau depolarisasi membran hingga terbentuknya lubang pada membran yang pada akhirnya akan mengakibatkan kebocoran pada sel bakteri, akibatnya bakteri akan mati (Engelke et al., 1992). Bakteriosin tidak hanya bersifat bakterisidal tetapi juga bersifat bakteriostatik seperti yang dinyatakan oleh Magdalena (2009) bahwa bakteriosin yang dihasilkan oleh Lactobacillus fermentum 2B2 yang diisolasi dari daging, bersifat bakteriostatik yang hanya menghambat pertumbuhan mikroba. Berdasarkan sifat bakteriostatik tersebut dapat diduga bahwa bakteriosin tidak membunuh E. coli ATCC 25922 namun dapat menghambat pertumbuhannya.
Aktivitas Antibakteri Supernatan Bebas Sel Netral Panas (SBSNP)
Metabolit yang masih terdapat pada SBSNP adalah bakteriosin, sedangkan metabolit-metabolit yang lain seperti hidrogen peroksida, diasetil, enzim yang bersifat bakteriolitik, dan karbondioksida hilang akibat pemanasan. Bakteriosin merupakan peptida pendek yang stabil terhadap panas. Selain itu, karena adanya asam-asam amino tertentu pada bakteriosin tersebut yang mampu mempertahankan struktur bakteriosin dari pengaruh panas (Kusmarwati, 2014).
Aktivitas antibakteri L. plantarum 1 RN9 pada perlakuan SBSNP terhadap E. coli ATCC 25922, menunjukkan bahwa L. plantarum 1 RN9 dapat
menghambat pertumbuhan E. coli ATCC 25922 dengan metode difusi pada semua waktu inkubasi. Hasil menunjukkan bahwa aktivitas antibakteri tertinggi dengan perlakuan SBSN menghasilkan diameter penghambatan sebesar 3,63 mm dengan
kriteria Sedang pada waktu inkubasi 24 jam. Aktivitas antibakteri dengan perlakuan SBSNP terendah menghasilkan diameter penghambatan sebesar 0,75 mm dengan waktu inkubasi 48 jam (Gambar 4).
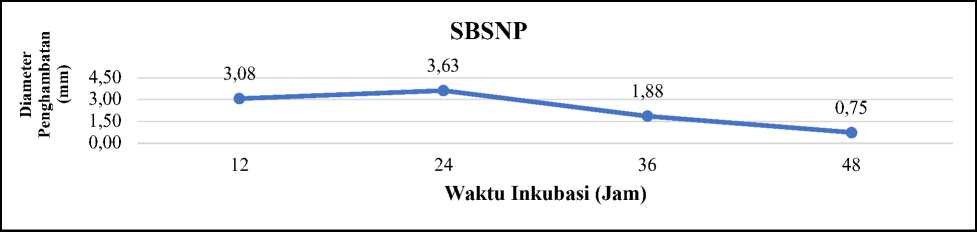
Gambar 4. Grafik aktivitas antibakteri perlakuan SBSNP L. plantarum 1 RN9 terhadap E. coli ATCC 25922
Waktu inkubasi berkaitan dengan diameter penghambatan aktivitas antibakteri yang dihasilkan. Waktu inkubasi 24 jam menunjukkan aktivitas antibakteri tertinggi, hal tersebut diduga pada waktu inkubasi tersebut bakteriosin yang dihasilkan oleh L. plantarum 1 RN9 lebih optimum karena berada pada fase stasioner. Waktu inkubasi 48 jam menunjukkan diameter penghambatan aktivitas antibakteri terendah, hal tersebut diduga pada waktu inkubasi 48 jam L. plantarum 1 RN9 telah memasuki fase kematian hal tersebut ditunjukkan pada hasil total BAL. Pembentukan senyawa antibakteri terutama bakteriosin selama inkubasi terjadi pada saat memasuki pertengahan fase eksponensial dan pembentukan optimum pada fase stasioner (Campos et al., 2005). Menurut Rattanachaikunsopon dan Phumkhachorn (2006) bakterisiosin yang dihasilkan L. plantarum N014 dihasilkan selama fase logaritma dan mencapai
kadar tertinggi saat bakteri penghasil memasuki fase stasioner. Pertumbuhan yang melewati fase stasioner akan menurunkan aktivitas bakteriosinnya yang dapat disebabkan terbebasnya protease dari sel saat sel memasuki fase kematian.
Bakteriosin merupakan senyawa aktif membran yaitu dapat berinteraksi dengan reseptor spesifik pada membran sel target yang menyebabkan ketidakstabilan atau depolarisasi membran hingga terbentuknya lubang pada membran yang pada akhirnya akan mengakibatkan kebocoran pada sel bakteri, akibatnya bakteri akan mati (Engelke et al., 1992). Bakteriosin tidak hanya bersifat bakterisidal tetapi juga bersifat bakteriostatik seperti yang dinyatakan oleh Magdalena (2009) bahwa bakteriosin yang dihasilkan oleh Lactobacillus fermentum 2B2 yang diisolasi dari daging, bersifat bakteriostatik yang hanya menghambat pertumbuhan mikroorganisme.
Berdasarkan sifat bakteriostatik tersebut dapat diduga bahwa bakteriosin tidak membunuh E. coli ATCC 25922 namun dapat menghambat pertumbuhannya.
Aktivitas Antibakteri L. plantarum 1 RN9 terhadap E coli ATCC 25922 Metode Kontak
Hasil aktivitas antibakteri dari L. plantarum 1 RN9 terhadap E. coli ATCC 25922 pada berbagai perlakuan metabolit pada Tabel 3.
Aktivitas Antibakteri Supernatan Bebas Sel (SBS)
Metabolit yang terkandung dalam SBS berupa asam organik lemah (asam laktat, asam asetat, dan asam propionat), karbon dioksida, hidrogen peroksida, diasetil, dan bakteriosin. Bakteri E. coli ATCC 25922 merupakan bakteri Gram negatif yang mana dinding sel utamanya tersusun dari lapisan lipid yang lebih tinggi dan
berlapis rangkap berupa lipopolisakarida yang terdiri atas membran dan lapisan peptidoglikan yang tipis dan terletak pada periplasma (di antara lapisan luar dan membran sitoplasma) (Lindgren dan Dobrogosz, 1990; Campos et al., 2005; Pelczar dan Chan, 1986).
Aktivitas antibakteri L. plantarum 1 RN9 pada perlakuan SBS terhadap E. coli ATCC 25922, menunjukkan bahwa L. plantarum 1 RN9 dapat menghambat pertumbuhan E. coli ATCC 25922 dengan metode kontak pada semua waktu inkubasi. Aktivitas antibakteri tertinggi dengan perlakuan SBS dapat menurunkan jumlah koloni E. coli ATCC 25922 sebesar 1,76 siklus log dengan waktu inkubasi 24 jam. Aktivitas antibakteri dengan perlakuan SBS terendah dapat menurunkan jumlah koloni E. coli ATCC 25922 sebesar 0,87 siklus log dengan waktu inkubasi 48 jam (Gambar 5).
Tabel 3. Aktivitas antibakteri pada berbagai perlakuan metabolit dari L. plantarum 1 RN9 dengan
berbagai waktu inkubasi terhadap E. coli ATCC 25922
|
Jenis Metabolit |
12 |
Waktu In 24 |
kubasi (Jam) 36 |
48 |
|
SBS |
-1,43 |
-1,76 |
-1,49 |
-0,87 |
|
SBSN |
-1,35 |
-1,49 |
-0,94 |
+0,32 |
|
SBSNP |
-1,31 |
-1,45 |
-0,24 |
+0,35 |
Keterangan: (-) = terjadi penurunan jumlah koloni
(+) = terjadi peningkatan jumlah koloni
|
SBS | |
|
o -0,90 'W ^ -1,20 Z ≡ -1,50 ©3 -1,80 'W |
-0,87 -1,43 -1,76 -1,49 12 24 36 48 Waktu Inkubasi (Jam) |
Pada Gambar 5 dapat dilihat bahwa aktivitas antibakteri tertinggi pada L. plantarum 1 RN9 dengan waktu inkubasi 24 jam disebabkan karena L. plantarum 1 RN9 telah memasuki fase stasioner dan hal tersebut sesuai dengan hasil total BAL. Menurut Campos et al. (2005) pembentukan senyawa antibakteri selama inkubasi terjadi pada saat memasuki pertengahan fase eksponensial, pembentukan optimum pada fase stasioner, dan berdasarkan dari strain bakteri penghasil antibakteri dan E. coli ATCC 25922.
Asam organik yang terbentuk selama inkubasi akan menyebabkan pH berada pada kisaran pH pertumbuhan bakteri, dimana asam tersebut dalam bentuk yang tidak terdisosiasi sehingga dapat berdifusi ke dalam sel mikroorganisme. Asam laktat bersifat larut dalam air, sehingga mampu menembus periplasma bakteri Gram negatif melalui protein porin pada membran luar. Pelindung permeabilitas membran sel sebagian besar tersusun dari lipopolisakarida kemudian membran akan rusak oleh asam sehingga substansi antibakteri seperti diasetil, bakteriosin, hidrogen peroksida dan laktoperoksidase sistem dapat berpenetrasi ke dalam membran sitoplasma (Davidson et al, 2010; Alakomi et al., 2000).
Hidrogen peroksida memiliki sifat bakterisidal dikarenakan kemampuannya sebagai oxidizing agent terhadap sel E. coli ATCC 25922. Bagian dari dinding sel seperti gugus sulfidril dan lipid membran sel dapat dengan mudah teroksidasi. Akibatnya proses metabolisme seperti glikolisis terhambat dan kerja enzim seperti hexokinase dan aldehid-3-fosfat juga terganggu. Hidrogen
peroksida umumnya bersifat bakteriostatik terhadap bakteri Gram positif dan bersifat bakterisidal untuk bakteri Gram negatif. Diasetil lebih efektif jika berada pada pH kurang dari 7 dan sifat antibakterinya berlawanan dengan keberadaan glukosa, asetat, dan Tween 80. Diasetil juga diketahui lebih efektif untuk membunuh bakteri Gram negatif, khamir, dan kapang dibandingkan bakteri Gram positif (Salminen et al., 2004; Davidson et al., 1993).
Bakteriosin merupakan senyawa aktif membran yaitu dapat berinteraksi dengan reseptor spesifik pada membran sel target yang menyebabkan ketidakstabilan atau depolarisasi membran hingga terbentuknya lubang pada membran yang pada akhirnya akan mengakibatkan kebocoran pada sel bakteri, akibatnya bakteri akan mati (Engelke et al., 1992). Bakteriosin tidak hanya bersifat bakterisidal tetapi juga bersifat bakteriostatik seperti yang dinyatakan oleh Magdalena (2009) bahwa bakteriosin yang dihasilkan oleh Lactobacillus fermentum 2B2 yang diisolasi dari daging, bersifat bakteriostatik yang hanya menghambat pertumbuhan mikroorganisme. Berdasarkan sifat bakteriostatik tersebut dapat diduga bahwa bakteriosin tidak membunuh E. coli ATCC 25922 namun dapat menghambat pertumbuhannya.
Aktivitas Antibakteri Supernatan Bebas Sel Netral (SBSN)
Penetralan bertujuan untuk menghilangkan pengaruh dari asam organik sebagai komponen utama senyawa antibakteri dari BAL, sehingga memaksimalkan komponen aktivitas antibakteri
lainnya. Metabolit yang masih terdapat pada SBSN adalah hidrogen peroksida, diasetil, bakteriosin dan karbondioksida (CO2).
Aktivitas antibakteri L. plantarum 1 RN9 pada perlakuan SBSN terhadap E. coli ATCC 25922, menunjukkan bahwa L. plantarum 1 RN9 dapat menghambat pertumbuhan E. coli ATCC 25922 dengan metode kontak pada semua waktu
inkubasi. Hasil menunjukkan bahwa aktivitas antibakteri tertinggi dengan perlakuan SBS dapat menurunkan jumlah koloni E. coli ATCC 25922 sebesar 1,49 siklus log dengan waktu inkubasi 24 jam. Aktivitas antibakteri dengan perlakuan SBSN terendah ditunjukkan dengan terjadi kenaikan jumlah koloni sebesar 0,87 siklus log dengan waktu inkubasi 48 jam (Gambar 6).
|
SBSN 0,32 | |
|
O ’S 0,40 -0,10 'W ^ -0,60 Z S -1,10 ^S -1,60 w |
-1,35 1 -0,94 -1,35 -1,49 12 24 36 48 Waktu Inkubasi (Jam) |
Gambar 6. Grafik aktivitas antibakteri perlakuan SBSN L. plantarum 1 RN9 terhadap E. coli ATCC 25922
Pada Gambar 6 dapat dilihat bahwa aktivitas antibakteri tertinggi pada L. plantarum 1 RN9 dengan waktu inkubasi 24 jam disebabkan karena L. plantarum 1 RN9 telah memasuki fase stasioner dan hal tersebut sesuai dengan hasil total BAL. Hal tersebut diduga pada waktu inkubasi 24 jam L. plantarum 1 RN9 dapat menghasilkan metabolit sekunder seperti hidrogen peroksida, diasetil, bakteriosin dan karbondioksida (CO2) dengan optimum (Campos et al., 2005). L. plantarum 1 RN9 pada waktu inkubasi 48 jam mengalami kenaikan koloni E. coli ATCC 25922, hal ini diduga karena L. plantarum 1 RN9 telah memasuki fase kematian yang ditunjukkan pada hasil total BAL. Semakin lama pertumbuhan, bakteri asam laktat akan mengalami peningkatan
dengan lamanya waktu inkubasi. Peningkatan ini berlangsung secara logaritma. Meningkatnya jumlah biomassa akan menyebabkan jumlah bakteriosin yang dihasilkan juga akan meningkat dan kemudian menurun setelah mencapai fase stasioner.
Hidrogen peroksida bersifat bakterisidal karena kemampuannya sebagai oxidizing agent terhadap sel. Bagian dari dinding sel seperti gugus sulfidril dan lipid membran sel dapat dengan mudah teroksidasi. Akibatnya proses metabolisme seperti glikolisis terhambat dan kerja enzim seperti hexokinase dan aldehid-3-fosfat juga terganggu. Hidrogen peroksida umumnya bersifat bakteriostatik terhadap bakteri Gram positif dan bersifat bakterisidal untuk bakteri Gram negatif.
Diasetil lebih efektif jika berada pada pH kurang dari 7 dan sifat antibakterinya berlawanan dengan keberadaan glukosa, asetat, dan Tween 80. Diasetil juga diketahui lebih efektif untuk membunuh bakteri Gram negatif, khamir, dan kapang dibandingkan bakteri Gram positif (Salminen et al., 2004; Davidson et al., 1993).
Bakteriosin merupakan senyawa aktif membran yaitu dapat berinteraksi dengan reseptor spesifik pada membran sel target yang menyebabkan ketidakstabilan atau depolarisasi membran hingga terbentuknya lubang pada membran yang pada akhirnya akan mengakibatkan kebocoran pada sel bakteri, akibatnya bakteri akan mati (Engelke et al., 1992). Bakteriosin tidak hanya bersifat bakterisidal tetapi juga bersifat bakteriostatik seperti yang dinyatakan oleh Magdalena (2009) bahwa bakteriosin yang dihasilkan oleh Lactobacillus fermentum 2B2 yang diisolasi dari daging, bersifat bakteriostatik yang hanya menghambat pertumbuhan mikroorganisme. Berdasarkan sifat bakteriostatik tersebut dapat diduga bahwa bakteriosin tidak membunuh E. coli ATCC 25922 namun dapat menghambat pertumbuhannya.
Aktivitas Antibakteri Supernatan Bebas Sel Netral (SBSNP)
Metabolit yang masih terdapat pada SBSNP adalah bakteriosin, sedangkan metabolit-metabolit yang lain seperti hidrogen peroksida, diasetil, enzim yang bersifat bakteriolitik, dan karbondioksida hilang akibat pemanasan. Bakteriosin merupakan peptida pendek yang stabil terhadap panas. Selain itu, karena adanya asam-asam amino tertentu pada bakteriosin tersebut yang mampu mempertahankan struktur bakteriosin dari pengaruh panas (Kusmarwati, 2014).
Aktivitas antibakteri L. plantarum 1 RN9 pada perlakuan SBSNP terhadap E. coli ATCC 25922, menunjukkan bahwa L. plantarum 1 RN9 dapat menghambat pertumbuhan E. coli ATCC 25922 dengan metode kontak pada semua waktu inkubasi. Hasil menunjukkan bahwa aktivitas antibakteri tertinggi dengan perlakuan SBS dapat menurunkan koloni E. coli ATCC 25922 sebesar 1,45 siklus log dengan waktu inkubasi 24 jam. Aktivitas antibakteri perlakuan SBSN terendah ditunjukkan dengan terjadi kenaikan jumlah koloni E. coli ATCC 25922 sebesar 0,35 siklus log dengan waktu inkubasi 48 jam (Gambar 7).

Gambar 7. Grafik aktivitas antibakteri perlakuan SBSNP L. plantarum 1 RN9 terhadap E. coli ATCC 25922
Pada Gambar 7 dapat dilihat bahwa aktivitas antibakteri tertinggi pada L. plantarum 1 RN9 dengan waktu inkubasi 24 jam diduga disebabkan karena L. plantarum 1 RN9 telah memasuki fase stasioner yang ditunjukkan dengan hasil total BAL dan perbedaan aktivitas antibakteri tersebut disebabkan karena sifat dari bakteri penghasil antibakteri yang berbeda, sehingga bakteriosin diproduksi secara optimum. Menurut Boe (1996) semakin lama pertumbuhan, bakteri asam laktat akan mengalami peningkatan dengan lamanya waktu inkubasi. Peningkatan ini berlangsung secara logaritma, meningkatnya jumlah biomassa akan menyebabkan jumlah bakteriosin yang dihasilkan juga akan meningkat dan kemudian menurun setelah mencapai fase stasioner akhir. Pada waktu inkubasi 36 jam aktivitas antibakteri mulai mengalami penurunan, hal tersebut diduga karena bakteri L. plantarum 1 RN9 telah memasuki fase kematian, hal tersebut ditunjukkan pada hasil total BAL. Pembentukan senyawa antibakteri selama inkubasi terjadi pada saat memasuki pertengahan fase eksponensial, pembentukan optimum pada fase stasioner, dan berdasarkan dari strain bakteri penghasil antibakteri dan E. coli ATCC 25922 (Campos et al., 2005). Menurut Rattanachaikunsopon dan Phumkhachorn (2006) bakterisiosin yang dihasilkan L. plantarum N014 dihasilkan selama fase logaritma dan mencapai kadar tertinggi saat bakteri penghasil memasuki fase stasioner. Pertumbuhan yang melewati fase stasioner akan menurunkan aktivitas bakteriosinnya yang dapat
disebabkan terbebasnya protease dari sel saat sel memasuki fase kematian.
Bakteriosin merupakan senyawa aktif membran yaitu dapat berinteraksi dengan reseptor spesifik pada membran sel target yang menyebabkan ketidakstabilan atau depolarisasi membran hingga terbentuknya lubang pada membran yang pada akhirnya akan mengakibatkan kebocoran pada sel bakteri, akibatnya bakteri akan mati (Engelke et al., 1992). Bakteriosin tidak hanya bersifat bakterisidal tetapi juga bersifat bakteriostatik seperti yang dinyatakan oleh Magdalena (2009) bahwa bakteriosin yang dihasilkan oleh Lactobacillus fermentum 2B2 yang diisolasi dari daging, bersifat bakteriostatik yang hanya menghambat pertumbuhan mikroorganisme. Berdasarkan sifat bakteriostatik tersebut dapat diduga bahwa bakteriosin tidak membunuh E. coli ATCC 25922 namun dapat menghambat pertumbuhannya.
KESIMPULAN
Aktivitas antibakteri tertinggi dari L. plantarum 1 RN9 terhadap E. coli ATCC 25922 terdapat pada perlakuan SBS yang ditunjukkan pada waktu inkubasi 24 jam dengan diameter penghambatan 6,5 mm dengan penurunan 1,76 siklus log; SBSN ditunjukkan pada waktu inkubasi 24 jam dengan diameter penghambatan 4,88 mm dengan penurunan 1,49 siklus log; dan serta SBSNP ditunjukkan pada waktu inkubasi 24 jam dengan diameter penghambatan 3,63 mm dengan penurunan 1,59 siklus log.
Waktu inkubasi optimum untuk mendapatkan aktivitas antibakteri tertinggi dari L.
plantarum 1 RN9 terhadap E. coli ATCC 25922, yaitu pada waktu inkubasi 24 jam.
DAFTAR PUSTAKA
Alakomi, H.L., E. Skytta, M. Saarela, T. M. Sandholm, K. L. Kala, dan I. M. Helander. 2000. Lactic acid permeabilizes gramnegative bacteria by disrupting the outer membrane. Applied And Environmental Microbiology. American Society for Microbiology. Finland
Amezquita, A. and M.M. Brashears. 2002. Competitive inhibition of listeria monocytogenes in ready to eat meat products by lactic acid bacteria. Food Protection Journal 65 (2): 316-325.
Arisanti, R. R., C. Indriani, dan S. A. Wilopo. 2018. Kontribusi agen dan faktor penyebab kejadian luar biasa keracunan pangan di Indonesia: kajian sistematis. Berita Kedokteran Masyarakat (BKM Journal of Community Medicine and Public Health) Vol. 34 No. 3. Hal 99-106. UGM. Yogyakarta.
Bhunia, A. K. 2008. Foodborne Microbial Pathogens: Mechanisms And Pathogenesis. Springer, New York.
Boe, Joe Young. 1996. Evaluation of optimum production for bacteriocin from Lactobacillus sp jb 42 isolation from kimchi. J Microbiol Biotech 6: 63-67.
Bower, J. 2013. Statistical Methods For Food Science: Introductory Procedures For The Food Practitioner, 2nd edition. 3:44-90. Wiley-Blackwell. DOI:
10.1002/9781118541593
Campos, C. A., O. Rodriguez, P. C. Mata, M. Prado, J.B. Velazquez. 2005. Preliminary characterization of bacteriocins from Lactococcus lactis, Enterococcus faecium and Enterococcus mundtii strains isolated from turbot (Psetta maxima). Food Research International 39 (2006) 356–364. Elsevier.
Davidson, P. M., J.N. Sofos, dan A. L. Branen. 1993. Antimicrobial in Food . 2nd Edition . Resised and Expanded. Marcell Dekker Inc., New York.
De Vuyst, L. dan E.J. Vandamme. 1994. Bacteriocins of Lactic Acid Bacteria.
Blackie Academic and Professional, London.
Effendi, F., A. P. Roswiem, dan E. Stefani. 2014. Uji aktivitas antibakteri teh kombucha probiotik terhadap bakteri Escherichia coli dan Staphylococcus aureus. Fitofarmaka. Jurnal Ilmiah Farmasi 4(2): 1-9.
Engelke, G., Z.G. Eckel, Z., M. Hammelman, dan K.D. Entian. 1992. Biosynthesis of Antibiotic Nissin, Genomic Organization and Membrane Localization of the Nis B. Protein. Applied Environmental Microbiology 55:476-511.
FAO dan WHO. 2002. Guidelines for the Evaluation of Probiotics in. Ontario: Joint FAO/WHO Working Group.
Fardiaz, S. 1993. Mikrobiologi Pangan I. PT. Gramedia Pustaka Utama, Jakarta.
Harrigan, W.F. dan M. Chance M.E. 1998. Laboratory Methods in Food Microbiology 3rd edition.Academic Press, Inc., New York.
Hartono, A. dan P. Widyastuti. 2005. Penyakit Bawaan Makanan. Jakarta: EGC.
Hutkins, R.W. 2006. Microbiology and Technology of Fermented Foods. Blackwell Publishing Asia. Australia.
Judoamidjojo, M., A.A. Darwis, dan E.G. Sa’id. 1990. Tekonologi Fermentasi. Rajawali Press. Jakarta.
Juniarthati, P.E. 2011. Skrining Bakteri Asam Laktat Isolat Susu Sapi Bali Penghasil Bakteriosin penghambat Bakteri Patogen E.coli Penyebab Diare Akut. Skripsi. Jurusan Farmasi Universitas Udayana.
Kusmarwati, Arifah, F.R. Arief dan S. Haryati. 2014. Eksplorasi bakteriosin dari bakteri asam laktat asal rusip Bangka dan Kalimantan. JPB Perikanan. 9(1): 29–40.
Lay, W. B. 1994. Analisis Mikroba di Laboratorium. PT Raja Grafindo Persada, Jakarta
Lindgren, S.E dan W.J. Dobrogosz. 1990. Antagonistic Activities of Lactic Acid Bacteria in Food and Feed Fermentation. FEMS Microbiol. Rev., 87, 149-64.
Magdalena, L. 2009. Produksi dan Karakterisasi Bakteriosin Asal Lactobacillus fermentum 2B2 serta Aktivitas Antibakterinya terhadap Bakteri Patogen. Skripsi. Fakultas Peternakan. Institut Pertanian Bogor.
Neu, H.C. and T.D. Gootz. Antimicrobial Chemotherapy. Dalam Baron, S. editor. Medical Microbiology. Edisi 4. Galvestone: The University of Texas Medical Branch; 1996. Bab 11.
Pan, X., F. Chen, T. Wu, H. Tang, dan Z. Zhao. 2009. The acid, bile tolerance and antimicrobial preoperty of Lactobacillus acidophilus nit. Journal of Food Control 20 pages 598-602.
Pelczar, M. J. dan E. C. S. Chan, , 1986. Dasar-Dasar Mikrobiologi. Universitas Indonesia Press, Jakarta.
Pelczar, M.J. dan E.C.S. Chan. 2005, Dasar-Dasar Mikrobiologi, Jilid I Penerjemah Hadiotomo, R.S., T. Imas, S.S. Tjitrosomo, dan S.L. Angka. UI-Press, Jakarta.
Puspawati, N.N., I.M. Sugitha, A.S. Duniaji. 2018b. Aplikasi Awal Dan Identifikasi Bakteri Asam Laktat Sebagai Starter Dadih/Susu Fermentasi Dari Berbagai Jenis Bambu (Bambusa sp) Yang Tumbuh Di Bali (Potensi Bal Yang Diisolasi Dari Bambu Sebagai Probiotik Secara In Vitro). Laporan Hasil Penelitian Hibah Penelitian Strategis Nasional Institusi (PSNI). Belum Dipublikasi. Universitas Udayana, Bali.
Putra, A.A.N.D.P. 2015.Optimasi Waktu Produksi dan Penghambatan Bakteriosin dari Bakteri Asam Laktat yang Diisolasi dari Air Susu Ibu (ASI) terhadap Mikroba Patogen Escherichia coli ATCC 25922.Skripsi. Fakultas Teknologi Pertanian. Universitas Udayana, Jimbaran.
Rachmawati, I., Suranto, R. Setyaningsih. 2006. Uji antibakteri bakteri asam laktat asal asinan sawi terhadap bakteri patogen. Bioteknologi, no. 2, vol. 2, hal. 43-48.
Rahayu, W.P. 2000.Aktivitas Antibakteri Bumbu Masakan Tradisional Hasil Olahan Industri Terhadap Bakteri Patogen dan Perusak. Bul Tekno & Industri Pangan XI (2): 42-48, ISSN 0216-2318.
Rattanachaikunsopon, P dan P. Phumkhachorn. 2006. Isolation and preliminary characterization of a bacteriocin produced by Lactobacillus plantarum N014 isolated from nham, a traditional thai fermented pork. Journal of Food Protection, Vol. 69, hal. 1937–1943.
Salminen, S., A.V. Wright, dan A. Ouwehand. 2004. Lactic Acid Bacteria: Microbiology and Functional Aspects. 3rd edition. Revise and Expanded. Marcel Dekker, Inc., New York.
Sanz Y, Nadal I, Sánchez E. 2007. Probiotics as drugs against human gastrointestinal infections. Recent Pat Antiinfect Drug Discov. 2(2): 148-56.
Setianingsih, S. 2010. Kajian Senyawa Antibakteri Bakteri Asam Laktat Homofermentatif Isolat ASI. Skripsi. Departemen Ilmu Dan Teknologi Pangan. Fakultas Teknologi Pertanian. Institut Pertanian Bogor, Bogor.
Sugitha, I.M., 1995. Dadih : Olahan Susu Kerbau Tradisional Minang, Manfaat, Kendala, Dan Prospeknya dalam Era Industrialisasi Sumatera Barat. Seminar Sehari Penerapan Teknologi Hasil Ternak Untuk Peningkatan Gizi Masyarakat. Fakultas Peternakan-Western University Training Centre. Padang
Sundari, L. S. 2014. Aktivitas Antibakteri Bakteri Asam Laktat dari Air Susu Ibu (ASI) terhadap Mikroba Patogen Escherichia coli ATCC 25922.Skripsi. Fakultas Teknologi Pertanian. Universitas Udayana, Jimbaran.
Surono, I.S. 2004. Probiotik Susu Fermentasi dan Kesehatan. Yayasan Pengusaha Makanan dan Minuman Seluruh Indonesia (YAPMMI). TRICK. Jakarta. p 31-32
Suskovic J.,B. Kos, J. Beganovic, A. L. Pavunc, K. Habjanic, dan S. Matosic. 2010. Antimicrobial activity of lactic acid bacteria. Food Technol. Biotechnol. 48 (3) Hal. 296– 307.
Winarti, S. 2011. Seleksi Bakteri Asam Laktat Isolat ASI yang Berpotensi Menurunkan Kolesterol secara In Vitro. Skripsi S1. Tidak dipublikasikan. Institut Pertanian Bogor, Bogor.
Zheng, L., Y.M. Bae, K.S. Jung, S. Heu, S. Y. Lee. 2013. Antimicrobial activity of natural antimicrobial substances against spoilage bacteria isolated from fresh produce. Food Control. 32(2):665-672.
687
Discussion and feedback