IDENTIFIKASI SENYAWA FITOKIMIA DAN AKTIVITAS ANTIOKSIDAN EKSTRAK KASAR DAUN PEPE
on
Jurnal Ilmu dan Teknologi Pangan Vol. 8, No. 2, 111-121, Juni 2019
ISSN : 2527-8010 (ejournal)
IDENTIFIKASI SENYAWA FITOKIMIA DAN AKTIVITAS ANTIOKSIDAN EKSTRAK KASAR DAUN PEPE
(Gymnema reticulatum Br.) PADA BERBAGAI JENIS PELARUT Identification of Phytochemical Compounds and Antioxidant Activity of Pepe Leaves (Gymnema reticulatum Br.) Crude Extract in Various Solvent Types
Dewa Gede Eka Prayoga1), Komang Ayu Nocianitri2), Ni Nyoman Puspawati2) 1)Mahasiswa Program Studi Imu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Unud 2)Dosen Program Studi Imu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Unud Kampus Bukit Jimbaran, Badung-Bali
ABSTRACT
This research was conducted to identify the phytochemical compounds and antioxidant activity of pepe leaves (Gymnema reticulatum Br.) crude extract in various solvent types. The experimental design used in this research was a completely randomized design with solvent type treatments consisting of 5 types : aquadest, ethyl acetate 96%, acetone 70%, ethanol 70%, and methanol 95%. The treatment was repeated three times, so that 15 experimental units were obtained. Qualitative data obtained in this research were displayed with tables, while quantitative data were analyzed by variance and if the treatment had a significant effect, then followed by Duncan's test. The results showed that the treatment of solvent types affected phytochemical compounds that was extracted from pepe leaves and had a significant effect (P<0.01) on yield, total phenol, total flavonoids, and antioxidant activity. The best results showed that 70% acetone solvents were able to extract phytochemical compounds from alkaloids, saponins, phenols, flavonoids, and steroids in the form of sterols and had the highest antioxidant activity based on 62.06% free radical inhibition percentage with IC50 values of 200.775 mg/L, yield 32.35%, total phenol 36.14 mgGAE/g extract, and total flavonoids 50.37 mgQE/g extract.
Keywords : pepe leaves, extraction, solvent, phytochemical compounds, antioxidant.
PENDAHULUAN
Tanaman pepe (Gymnema reticulatum Br.) merupakan sejenis tumbuhan merambat yang berasal dari India. Bagian tanaman pepe yang sering digunakan adalah daun dan akar. Di Bali, daun pepe sering digunakan sebagai salah satu bagian dalam isian sarana upakara, sayuran, dan jamu tradisional (loloh). Sayur pepe dibuat dengan menggunakan bagian daun (kecuali yang telah menguning) yang direbus terlebih dahulu sebelum dipotong, kemudian dicampurkan dengan bumbu, cacahan daging dan sedikit santan. Sayur daun pepe atau yang lebih dikenal dengan urab don pepe memiliki rasa yang gurih karena adanya santan dan sedikit rasa pahit
dari daun pepe. Daun pepe bersama-sama dengan bahan lain juga digunakan sebagai ramuan obat muntaber dalam pembuatan jamu tradisional (loloh) (Putra, 1991). Penggunaan daun pepe sebagai obat muntaber telah menunjukkan hasil positif diantaranya mampu menghambat pertumbuhan Staphylococcus aereus dan Eschericia coli. Di dalam daun pepe terdapat kandungan senyawa 3,7,11,15-tetrametil-2-hexadesena-1-ol, ester metil hexadekanoat, dan dioktil-1,2-benzenedikarboksilat sebagai antibakteri yang telah diidentifikasi dari fraksi aktif ekstrak daun pepe pada pelarut metanol 70% (Swantara et al., 2010). Menurut Thakur et al., (2012) tanaman gymnema pada umumnya
*Korespondensi Penulis:
Email: prayogadekaega@gmail.com1)
memiliki kandungan senyawa fitokimia diantaranya alkaloid, flavonoid, saponin, serta fenol. Beberapa senyawa fitokimia dalam tanaman gymnema tersebut dapat berperan sebagai antioksidan.
Senyawa fitokimia pada suatu tanaman dapat diperoleh dengan cara ekstraksi. Beberapa faktor yang dapat mempengaruhi proses ekstraksi diantaranya bagian tanaman, ukuran bahan, suhu, metode, waktu, konsentrasi pelarut, serta jenis pelarut (Kumoro, 2015). Polaritas dari jenis pelarut yang digunakan dalam ekstraksi harus sama atau sangat dekat dengan polaritas bahan aktif yang diekstrak agar ekstraksi berjalan secara efisien sebab menurut prinsip like dissolves like tidak semua senyawa akan terlarut dalam suatu cairan pelarut (Mottaleb dan Sarker, 2012).
Berdasarkan penelitian Suryani et al. (2015), jenis pelarut terbaik untuk menghasilkan kandungan total flavonoid dan aktivitas antioksidan tertinggi pada daun matoa secara berturut-turut adalah pelarut metanol 95% dan aseton 90% dengan metode maserasi. Shabri dan Rohdiana (2016) menyatakan bahwa ekstraksi teh hijau dengan labu ekstraktor menggunakan pelarut aseton 70% menghasilkan rendemen dan kadar polifenol tertinggi. Sementara pada penelitian uji aktivitas antioksidan daun manggis hutan (Garcinia daedalanthera Pierre.) hasil ekstraksi dengan metode maserasi, jenis pelarut yang menunjukan hasil terbaik adalah etil asetat 96% (Erawati, 2012). Penelitian Widarta dan Arnata (2017) menunjukan bahwa pelarut yang tepat digunakan untuk memperoleh aktivitas antoksidan yang tertinggi pada ekstraksi daun alpukat dengan bantuan ultrasonik adalah etanol 70%. Maka, dalam penelitian ini dipilih lima jenis pelarut yaitu aquades, metanol 95%, etanol 70%, aseton 70%, dan etil asetat 96%. Sementara itu, metode ekstraksi yang digunakan adalah metode maserasi karena memiliki kelebihan yaitu : biaya proses yang rendah, tidak
memerlukan keahlian khusus dalam penerapannya, serta tidak menggunakan panas dibandingkan dengan beberapa metode ekstraksi yang lain. Berdasarkan uraian tersebut di atas maka penting dilakukan identifikasi senyawa fitokimia serta uji aktivitas antioksidan terhadap ekstrak kasar daun pepe pada berbagai jenis pelarut.
METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Pengolahan Pangan, Laboratorium Mikrobiologi Pangan, Laboratorium Analisis Pangan, Laboratorium Biokimia dan Nutrisi Program Studi Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, dan Laboratorium Fitokimia Program Studi Farmasi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana. Waktu pelaksanaan penelitian mulai Mei sampai Agustus 2018.
Bahan dan Alat
Bahan yang digunakan dalam penelitian adalah daun pepe (Gymnema reticulatum Br.) yang diperoleh dari Desa Tegal Tugu, Kecamatan Gianyar, serta bahan kimia yang terdiri dari aquades, metanol, etanol, etil asetat, aseton, pereaksi Dragendorff, pereaksi Wagner, pereaksi Meyer, FeCl3 (Merck), serbuk magnesium, HCl (Merck), kloroform (Merck), asam asetat anhidrat, H2SO4 (Merck), reagen Folin-Ciocalteau (Merck), Na2CO3 (Merck), NaNO2 (Merck), AlCl3 (Merck), NaOH (Merck), air es, asam galat (Sigma), kuersetin (Sigma), dan 1,1-diphenyl-2-picrylhydrazil (DPPH) (Sigma).
Peralatan yang dipergunakan dalam penelitian ini terdiri dari botol sampel, aluminium foil, kertas saring Whatman No. 1, rotary vaccum evaporator (IKA RV10 basic), pipet volume (pyrex), timbangan analitik (sartorius), spektrofotometer UV-VIS (Biochrom Libra), pipet tetes, pipet volume
(pyrex), beaker glass (pyrex), vortex, gelas ukur (pyrex), erlenmeyer (pyrex), labu ukur, spatula, corong, pisau, tampah, shaker (HEALTH), cawan porselen, blender (Philips), oven (Blue-M), loyang, water bath, tabung reaksi, kuvet, ayakan 60 mesh (Retsch), dan kertas label.
Pelaksanaan Penelitian
Persiapan Sampel
Daun yang dipilih dari tanaman pepe adalah 8 daun pertama dari pucuk tanaman. Daun pepe segar dicuci bersih kemudian dipotong-potong dengan lebar ± 1 cm dan dikeringkan dengan oven pada suhu 400C selama 24 jam (kadar air ≤ sebesar 7,71%). Daun pepe yang telah dikeringkan, dihaluskan menggunakan blender kemudian diayak dengan ayakan 60 mesh. (Widarta dan Arnata, 2017).
Ekstraksi Daun Pepe
Serbuk daun pepe ditimbang masing masing 50 gram dan ditambahkan pelarut dengan perbandingan bahan dan pelarut 1:10, selanjutnya dimaserasi selama 30 jam pada suhu ruang. Selama proses maserasi dilakukan proses pengadukan dengan bantuan shaker pada jam ke 12 dan jam ke 24, masing-masing selama 30 menit. Setelah 30 jam larutan disaring dengan kertas whatman no.1 kemudian filtrat yang diperoleh diuapkan dengan vacuum rotary evaporator pada suhu 400C dengan kecepatan 100 rpm (Suryani et al., 2015., yang dimodifikasi). Ekstrak kental yang diperoleh ditimbang untuk dihitung rendemen ekstraknya kemudian ditempatkan di dalam botol, untuk selanjutnya dilakukan uji secara kualitatif dan kuantitatif. Uji kualitatif dilakukan untuk identifikasi senyawa fitokimia meliputi: alkaloid, fenol, flavonoid, saponin, triterpenoid dan sterol. Sementara itu uji kuantitatif meliputi penentuan total fenol, total flavonoid, dan aktivitas antioksidan.
Rancangan Penelitian dan Analisis Data
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan perlakuan 5 jenis pelarut yaitu : aquades (Q), etil asetat 96% (S), aseton 70% (A), etanol 70% (E), dan metanol 95% (M). Penelitian ini diulangan sebanyak 3 kali sehingga diperoleh 15 unit percobaan. Data kualitatif yang diperoleh pada penelitian ini ditampilkan dalam bentuk table kemudian dideskripsikan, sementara data kuantitatif selanjutnya dianalisis dengan sidik ragam dan jika perlakuan berpengaruh nyata akan dilanjutkan dengan uji Duncan (Gomez dan Gomez, 1995).
HASIL DAN PEMBAHASAN
Rendemen
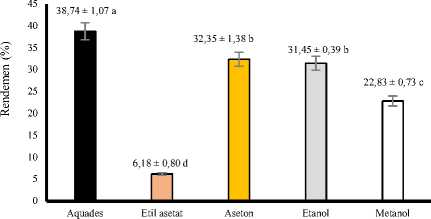
Hasil sidik ragam menunjukkan bahwa jenis pelarut yang dipergunakan dalam ekstraksi berpengaruh sangat nyata (P<0,01) terhadap rendemen ekstrak daun pepe. Grafik hubungan antara jenis pelarut dengan rendemen ekstrak kasar daun pepe dapat dilihat pada Gambar 1.
Jenis Pelarut
Keterangan : Notasi yang sama menunjukkan perlakuan berbeda tidak nyata (P>0,05).
Gambar 1. Grafik hubungan antara jenis pelarut dengan rendemen ekstrak kasar daun pepe.
Berdasarkan pada Gambar 1 dapat dilihat bahwa rata-rata rendemen rendemen ekstrak daun pepe tertinggi didapat pada perlakuan ekstraksi dengan pelarut aquades yaitu 38,74%, sementara rendemen terendah terdapat pada perlakuan ekstraksi dengan
pelarut etil asetat 96% yaitu 6,18%. Jenis pelarut yang digunakan pada proses ekstraksi mempengaruhi hasil rendemen ekstrak daun pepe. Menurut Voight (1994) proses ekstraksi terjadi dengan mengalirnya pelarut ke dalam sel yang menyebabkan protoplasma membengkak dan bahan yang terkandung dalam sel akan terlarut sesuai dengan kelarutannya. Kemampuan melarutkan yang tinggi ini berhubungan dengan kepolaran pelarut dan kepolaran senyawa yang diekstraksi (Vogel, 1978). Semakin mirip kepolaran pelarut dengan kepolaran zat yang terkandung dalam bahan yang diekstraksi maka akan semakin banyak komponen zat yang dapat diekstraksi sehingga dapat terjadi peningkatan rendemen yang diperoleh. Peningkatan tersebut disebakan oleh semakin mudahnya pengikatan zat dalam bahan oleh pelarut. Setiap jenis pelarut memiliki polaritas yang berbeda, dan pada jenis pelarut yang sama dengan konsentrasi yang berbeda juga memiliki polaritas yang berbeda (Tan et al., 2013). Polaritas dari pelarut secara berurutan
adalah aquades (9), metanol (6,6), aseton (5,4), etanol (5,2), dan etil asetat (4,3) (Barwick, 1997). Polaritas pelarut-pelarut ini akan semakin meningkat seiring dengan penurunan konsentrasinya jika dilarutkan dalam air (Kumoro et al., 2009). Senyawa-senyawa yang terkandung pada daun pepe kemungkinan memiliki sifat polar dan mendekati kepolaran pelarut aquades sehingga menghasilkan persentase rendemen yang lebih tinggi dibanding dengan pelarut yang lainnya. Penelitian Syafitri et al., (2014) menunjukan bahwa pelarut air menghasilkan persentase rendemen yang tinggi pada ekstraksi buah harendong mentah dibandingkan pelarut etanol 96% dan etanol 70%.
Identifikasi Senyawa Fitokimia Secara Kualitatif
Data hasil identifikasi senyawa fitokimia ekstrak daun pepe pada perlakuan berbagai jenis pelarut dapat dilihat pada Tabel 1.
Tabel 1. Hasil identifikasi senyawa fitokimia
|
Ekstrak |
Senyawa fitokimia | |||||
|
Alkaloid |
Saponin |
Fenol |
Flavonoid |
Triterpeniod |
Sterol | |
|
Aquades |
+ |
+ |
+ |
+ |
- |
- |
|
Etil asetat |
- |
- |
+ |
+ |
- |
+ |
|
Aseton |
+ |
+ |
+ |
+ |
- |
+ |
|
Etanol |
+ |
+ |
+ |
+ |
- |
- |
|
Metanol |
+ |
+ |
+ |
+ |
- |
+ |
Keterangan : Tanda (+) menunjukan adanya senyawa yang diuji, sementara tanda (-) menunjukan senyawa yang diuji tidak ada pada ekstrak.
Identifikasi senyawa fitokimia dilakukan setelah proses ekstraksi untuk mengetahui golongan senyawa yang terdapat dalam ekstrak kasar daun pepe berdasarkan jenis pelarut yang digunakan. Pengujian senyawa alkaloid dilakukan dengan mereaksikan ekstrak yang telah diencerkan dengan reagen Mayer, reagen Dragendorff, dan reagen Wagner. Reaksi positif pengujian alkaloid dengan reagen Mayer ditunjukkan pada semua perlakuan jenis pelarut dengan
terjadinya pembentukan endapan putih. Sementara itu, pada reagen Dragendorff reaksi positif dengan terbentuknya endapan coklat muda hingga kuning ditunjukkan pada perlakuan pelarut aquades, aseton, etanol, dan metanol. Begitu pual pada reagen Wagner terjadi endapan coklat muda hingga kuning yang menunjukkan reaksi positif ditunjukkan pada perlakuan pelarut aquades, aseton, etanol, dan metanol. Pembentukan endapan terjadi karena terbentuknya senyawa
kompleks dari reaksi senyawa alkaloid dengan ion logam K+ pada masing-masing pereaksi yang digunakan (Marliana et al., 2005). Hasil positif untuk pengujian alkaloid minimal ditunjukkan oleh reaksi pembentukan endapan pada dua reagen dari tiga reagen yang dipergunakan dalam pengujian sehingga pada pengujian alkaloid, sehingga hasil positif ditunjukkan oleh perlakuan dengan pelarut aquades, aseton, etanol, dan metanol. Ekstrak dengan perlakuan pelarut etil asetat menunjukkan reaksi positif hanya terjadi pada reagen Mayer dengan terbentuknya endapan putih sehingga pengujian dapat dianggap negatif. Menurut Endarini (2016) garam alkaloid berbeda sifatnya dengan alkaloid bebas dalam bentuk basa. Alkaloid dalam bentuk basa biasanya tidak larut dalam air tetapi mudah larut dalam pelarut organik (seperti benzena, eter, kloroform) sementara dalam bentuk garamnya, alkaloid mudah larut dalam pelarut polar. Hal ini menunjukkan bahwa kandungan senyawa alkaloid didalam ekstrak daun pepe merupakan senyawa alkaloid dalam bentuk garamnya karena reaksi positif ditunjukkan pada pelarut yanng bersifat polar.
Uji saponin dilakukan dengan metode Forth, yaitu hidrolisis saponin dalam air. Timbulnya busa pada uji Forth menunjukkan adanya glikosida yang mempunyai kemampuan membentuk buih dalam air yang terhidrolisis menjadi glukosa dan senyawa aglikonnya. Hasil positif pengujian saponin dengan terjadinya pembentukan busa ditunjukkan pada perlakuan dengan pelarut aquades, aseton, etanol, dan metanol. Reaksi positif ditandai dengan busa yang terbentuk tidak kurang dari 10 menit setelah pengocokan serta stabil dengan penambahan HCl 2M (Setyowati et al., 2014). Sementara pada perlakuan dengan pelarut etil asetat, pembentukan busa tidak terjadi sehingga pengujian dapat dianggap negatif dikarenakan kelarutan sampel etil asetat sangat rendah didalam air sehingga terjadi pengendapan
pada sampel. Menurut Robinson (1991) senyawa saponin memiliki gugus polar dan non-polar bersifat aktif permukaan sehingga saat saponin dikocok dengan air akan mengalami hidrolisis dan dapat membentuk misel. Struktur misel yang terbentuk menyebabkan gugus polar menghadap keluar dan gugus non-polar menghadap kedalam sehingga akan tampak seperti busa.
Hasil positif pengujian fenol dengan terjadinya warna hijau hingga hijau kehitaman pada sampel setelah penambahan FeCl3 5 % ditunjukkan pada semua perlakuan jenis pelarut. Senyawa fenol memiliki gugus hidroksil yang dapat bereaksi dengan ion Fe3+ pada larutan FeCl3 5 % sehingga terjadinya pembentukan senyawa kompleks berwarna hijau kehitaman (Harborne, 1987).
Hasil positif pengujian flavonoid dengan terjadinya warna merah, kuning atau jingga pada sampel setelah penambahan serbuk Mg dan HCl ditunjukkan pada semua perlakuan jenis pelarut. Serbuk logam Mg dan HCl berfungsi mereduksi inti benzopiron yang terdapat pada struktur flavonoid dan membentuk garam flavilium yang berwarna merah atau jingga (Achmad, 1986 dalam Khotimah, 2016).
Pengujian triterpenoid dan steroid menunjukkan hasil negatif pada golongan senyawa triterpenoid disemua perlakuan jenis pelarut. Sementara hasil positif ditunjukkan pada golongan steroid dengan terbentuknya warna hijau setelah penambahan asam asetat anhidrida dan asam sulfat pekat pada perlakuan pelarut etil asetat, aseton dan metanol. Hal ini dikarenakan ketiga pelarut tersebut memiliki kepolaran dan sifat yang sesuai dengan golongan senyawa steroid dikarenakan steroid adalah senyawa turunan lipid yang tidak terhidrolisis (Iling et al., 2017). Penambahan asam asetat anhidrida dalam uji Liebermann-Burchard berfungsi untuk menyerap air dan membantu pengoksidasian asam oleh asam sulfat, karena reaksi pengoksidasian asam tersebut tidak
akan berlangsung jika masih terkandung air didalam senyawa yang direaksikan.
Identifikasi Senyawa Fitokimia Secara Kuantitatif
-
1. Total Fenol
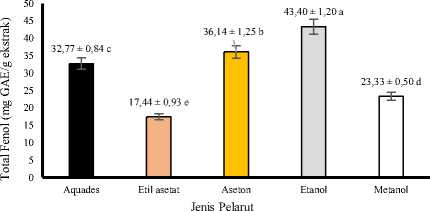
Hasil sidik ragam menunjukkan bahwa jenis pelarut yang dipergunakan dalam ekstraksi berpengaruh sangat nyata (P<0,01) terhadap total fenol ekstrak daun pepe. Grafik hubungan antara jenis pelarut dengan total fenol ekstrak kasar daun pepe dapat dilihat pada Gambar 2.
Keterangan : Notasi yang sama menunjukkan perlakuan berbeda tidak nyata (P>0,05).
Gambar 2. Grafik hubungan antara jenis pelarut dengan total fenol ekstrak kasar daun pepe.
Gambar 2 menunjukkan nilai rata-rata total fenol terendah diperoleh menggunakan pelarut etil asetat 96% yaitu 17,44 mg GAE/g ekstrak dan rata-rata tertinggi total fenol diperoleh pada pelarut etanol 70% yaitu 43,40 mg GAE/g ekstrak. Hal tersebut menunjukan bahwa senyawa fenol dalam daun pepe terekstraksi secara efektif dengan pelarut etanol 70%. Etanol merupakan pelarut polar yang dapat menarik senyawa polar. Menurut Hanani (2017) senyawa fenol yang terdapat dalam tumbuhan umumnya adalah senyawa fenol yang berikatan dengan gula membentuk glikosida yang lebih mudah larut pada pelarut polar.
Pengujian total fenol didasarkan pada prinsip pembentukan senyawa kompleks berwarna biru ketika bereaksi dengan reagen
Folin-Ciocalteau dan absorbansinya dapat diukur pada panjang gelombang 760 nm. Senyawa fenolat (garam alkali) atau gugus fenolik-hidroksi akan mereduksi asam heteropoli yang terdapat pada reagen Folin-Ciocalteau menjadi suatu kompleks molibdenum-tungsten yang berwarna biru. Penambahan Na2CO3 berfungsi untuk menciptakan kondisi basa agar terjadi disosiasi proton pada senyawa fenolik menjadi ion fenolat sehingga dapat bereaksi dengan reagen Folin-Ciocalteau (Apsari dan Susanti, 2011 dalam Wachidah, 2013).
Penelitian Fidrianny et al. (2013) menyatakan bahwa pelarut etanol menghasilkan persentase total fenol yang lebih tinggi dibandingkan pelarut etil asetat dan n-Heksan pada ekstrak daun binahong. Widarta dan Arnata (2017) juga mendapatkan hasil kandungan total fenol yang tinggi menggunakan pelarut etanol 70% dibandingkan pelarut aseton 70% pada ekstrak daun alpukat. Sementara pada ekstrak daun gayam, kandungan total fenol yang paling besar didapat dari ekstrak etanol dibandingkan ekstrak metanolnya (Lestari et al., 2018).
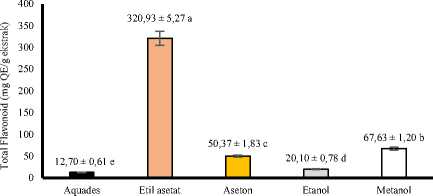
Hasil sidik ragam menunjukkan bahwa jenis pelarut yang dipergunakan dalam ekstraksi berpengaruh sangat nyata (P<0.01) terhadap total flavonoid ekstrak daun pepe. Grafik hubungan antara jenis pelarut dengan total flavonoid ekstrak kasar daun pepe dapat dilihat pada Gambar 3.
Jenis pelarut
Keterangan : Notasi yang sama menunjukkan perlakuan berbeda tidak nyata (P>0,05).
Gambar 3. Grafik hubungan antara jenis pelarut dengan total flavonoid ekstrak kasar daun pepe.
Gambar 3 menunjukkan nilai rata-rata total flavonoid terendah diperoleh menggunakan pelarut aquades yaitu 12,70 mg QE/g ekstrak dan rata-rata tertinggi total flavonoid diperoleh pada pelarut etil asetat 96% yaitu 320,93 mg QE/g ekstrak. Hal tersebut menunjukan bahwa senyawa flavonoid dalam daun pepe terekstraksi secara efektif dengan pelarut etil asetat. Golongan senyawa flavonoid terbagi dalam beberapa jenis dan memiliki kepolaran yang berbeda-beda tiap jenisnya tergantung pada jumlah dan posisi gugus hidroksilnya (Harbone, 1987). Umumnya flavonoid ditemukan berikatan dengan gula membentuk glikosida yang menyebabkan senyawanya lebih mudah larut dalam pelarut polar. Sementara dalam bentuk aglikonnya, senyawa flavonoid memiliki sifat kurang polar sehingga cenderung lebih mudah larut dalam pelarut non-polar (Hanani, 2017). Etil asetat merupakan pelarut semi polar dan dapat melarutkan senyawa polar maupun nonpolar sehingga senyawa flavonoid pada daun pepe baik yang bersifat polar maupun nonpolar dapat terekstraksi lebih efektif.
Penelitian Fidrianny et al. (2013) menyatakan bahwa pelarut etil asetat menghasilkan persentase total flavonoid yang lebih tinggi dibandingkan pelarut etanol dan n-Heksan pada ekstrak daun binahong. Total flavonoid yang tertinggi pada ekstrak daun kersen juga didapatkan dari hasil fraksi etil asetat dibandingkan ekstrak etanol, fraksi n-heksan, dan fraksi airnya (Puspitasari et al., 2017). Sementara itu, hasi penelitian Pratiwi et al. (2010) didapatkan bahwa pada pelarut etil asetat menghasilkan kandungan total flavonoid lebih tinggi dibandingkan metanol dan air pada ekstraksi daun kumis kucing.
Aktivitas Antioksidan
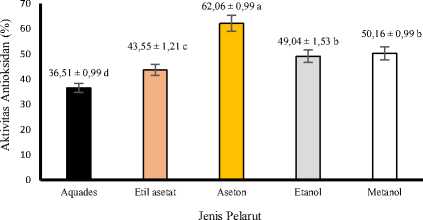
Hasil sidik ragam menunjukkan bahwa jenis pelarut yang dipergunakan dalam ekstraksi berpengaruh sangat nyata (P<0,01) terhadap aktivitas antioksidan ekstrak daun pepe. Grafik hubungan antara jenis pelarut dengan aktivitas antioksidan ekstrak kasar daun pepe dapat dilihat pada Gambar 4.
Keterangan : Notasi yang sama menunjukan perlakuan berbeda tidak nyata (P>0,05).
Gambar 4. Grafik hubungan antara jenis pelarut dengan aktivitas antioksidan ekstrak kasar daun pepe.
Gambar 4 menunjukkan nilai rata-rata aktivitas antioksidan terendah diperoleh menggunakan pelarut aquades yaitu 36,51%, sementara rata-rata tertinggi aktivitas antioksidan diperoleh pada pelarut aseton 70% yaitu 62,06%. Penelitian Suryani et al. (2015) menyatakan bahwa pada ekstrak daun matoa, pelarut aseton menunjukan aktivitas antioksidan yang lebih tinggi dibandingkan pelarut aquades, metanol, etanol, dan isopropanol. Demikian juga pada ekstrak kacang tunggak, didapatkan aktivitas antioksidan yang lebih tinggi menggunakan pelarut aseton dibandingkan metanol dan etanol (Yulistian et al., 2015). Pada penelitian ini, aktivitas antioksidan berdasarkan penangkapan radikal DPPH memiliki hubungan dengan kandungan fenolik dan flavonoid tanaman. Senyawa-senyawa fenol telah dilaporkan mempunyai aktivitas antioksidan karena sifat-sifat redoksnya. Senyawa fenolik beraksi sebagai agen pereduksi, pemberi hidrogen, peredam oksigen singlet, dan juga sebagai pengkelat logam yang potensial
(Kahkonen et al., 1999 dalam Rohman 2007). Grafik hubungan antara total fenol dengan aktivitas antioksidan dan total flavonoid dengan aktivitas antioksidan pada ekstrak daun pepe dapat dilihat pada Gambar 5A dan 5B.
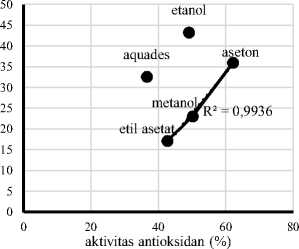
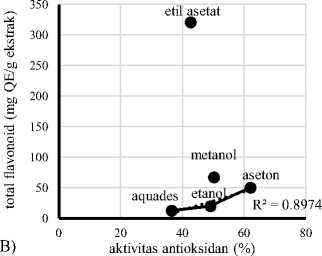
Gambar 5. Hubungan antara total fenol dengan aktivitas antioksidan (A) dan total flavonoid dengan aktivitas antioksidan (B) pada ekstrak daun pepe.
Gambar 5 menunjukkan korelasi antara total fenol dengan aktivitas antioksidan dan total flavonoid dengan aktivitas antioksidan pada ekstrak daun pepe dengan perlakuan jenis pelarut. Koefisien korelasi (R²) antara total fenol dengan aktivitas antioksidan ekstrak daun pepe pada pelarut etil asetat, metanol, dan aseton sebesar 0,9936, sementara koefisien korelasi (R²) antara total flavonoid dengan aktivitas antioksidan ekstrak daun pepe pada pelarut aquades, etanol, dan aseton sebesar 0,8974. Sarwono (2006) menyatakan bahwa koefisien korelasi (R²) yang mempunyai nilai 0,75 keatas dapat dikategorikan memiliki korelasi sangat kuat. Aktivitas antioksidan ekstrak daun pepe pada pelarut etil asetat, metanol, dan aseton
memiliki korelasi positif dengan meningkatnya total fenol yang dihasilkan. Sementara berdasarkan peningkatan total flavonoid terhadap aktivitas antioksidan ekstrak daun pepe, korelasi positif ditunjukkan pada pelarut aquades, etanol dan aseton. Hal ini sesuai dengan penelitian Rohman et al. (2007) yang menyatakan bahwa terdapat korelasi antara total fenol dengan aktivitas antioksidan dan total flavonoid dengan aktivitas antioksidan pada ekstrak daun mengkudu.
Berdasarkan hasil analisis yang telah dilakukan, pelarut aseton 70% memberikan perlakuan terbaik dibandingkan dengan pelarut aquades, etil asetat, etanol dan metanol pada ekstraksi daun pepe ditunjukkan dengan persentase penghambatan radikal bebasnya yang lebih tinggi, sehingga perlakuan ini dipilih untuk diuji penentuan IC50. Grafik hubungan antara konsentrasi ekstrak daun pepe dengan aktivitas antioksidannya dapat dilihat pada Gambar 6.
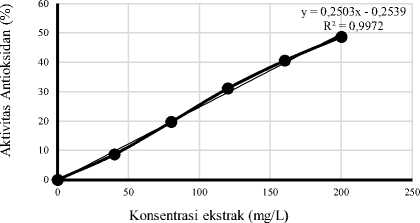
Gambar 6. Grafik hubungan antara konsentrasi ekstrak daun pepe dengan aktivitas antioksidan.
Gambar 6 menunjukkan bahwa peningkatan konsentrasi ekstrak berbanding lurus dengan persentase aktivitas antioksidan. Berdasarkan analisis regresi linier diperoleh persamaan yaitu y = 0,2503x – 0,2539 dengan nilai koefisien korelasi (R2) sebesar 0,9972. Berdasarkan persamaan tersebut didapatkan nilai IC50 sebesar 200,775 mg/L. Menurut Blois (1958) nilai IC50 yang didapat dalam penelitian ini termasuk dalam kategori lemah. Semakin rendah nilai IC50 maka semakin
besar kemampuan antioksidannya dikarenakan IC50 menunjukkan besarnya konsentrasi suatu senyawa dalam menghambat radikal DPPH sebanyak 50%. Nilai IC50 dari ekstrak aseton daun pepe lebih rendah dibandingkan nilai IC50 dari ekstrak aseton daun kelor yaitu 427,49 mg/L (Meigaria et al., 2016). Akan tetapi nilai IC50 dari ekstrak aseton daun pepe lebih tinggi dibandingkan nilai IC50 dari ekstrak aseton daun matoa yaitu 43,53 mg/L (Suryani et al., 2015).
KESIMPULAN DAN SARAN
Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan, maka dapat disimpulkan beberapa hal sebagai berikut :
-
1. Jenis pelarut berpengaruh terhadap jenis zat fitokimia yang terekstrak dan berpengaruh sangat nyata terhadap rendemen, total fenol, total flavonoid, dan aktivitas antioksidan ekstrak daun pepe.
-
2. Hasil penelitian menunjukkan bahwa pelarut aseton 70% mampu mengekstraksi senyawa fitokimia alkaloid, saponin, fenol, flavonoid, dan steroid dalam bentuk sterol serta memiliki aktivitas antioksidan tertinggi berdasarkan persentase penghambatan radikal bebas yaitu 62,06% dengan nilai IC50 sebesar 200,775 mg/L, rendemen sebesar 32,35%, total fenol sebesar 36,14 mgGAE/g ekstrak, dan total flavonoid sebesar 50,37 mgQE/g ekstrak.
Saran
Perlu dilakukan penelitian lebih lanjut terkait pengaruh konsentrasi dari pelarut terhadap ekstraksi daun pepe sehingga mendapatkan ekstrak dengan aktivitas antioksidan yang lebih tinggi serta aplikasinya pada produk pangan.
DAFTAR PUSTAKA
Barwick, V. J. 1997. Strategies for Solven Selection – A Literature Review. Trends In Analytical Chemistry, 16 (6), 293-309.
Blois, M.S. 1958. Antioxidant Determinations by the Use of a Stable Free Radical. J. Nature, 181 : 1199-1200.
Endarini, L. H. 2016. Farmakognisi dan Fitokimia. Badan Pengembangan dan Pemberdayaan Sumber Daya Manusia Kesehatan, Jakarta.
Erawati. 2012. Uji Aktivitas Antioksidan Ekstrak Daun Garcinia daedalanthera Pierre. dengan Metode DPPH dan Identifikasi Golongan Senyawa Kimia Dari Fraksi Paling Aktif. Skripsi S1. Fakultas Matematika dan Ilmu Pengetahuan Alam UI, Depok.
Fidrianny, I., K. R. Wirasutisna, dan P. Amanda. 2013. Senyawa Antioksidan dari Ekstrak Etil Asetat Daun Binahong (Anredera cordifolia (Ten.) Steenis) dari Babakan Ciparay, Bandung Selatan, Indonesia. Acta Pharmaceutica Indonesia, Vol. XXXVIII, No. 1
Gomez, K. A., dan A. A. Gomez. 1995. Prosedur Statistik Untuk Penelitian Pertanian. UI Press, Jakarta.
Hanani, E. 2017. Analisis Fitokimia. Penerbit Buku Kedokteran EGC, Jakarta.
Harborne, J. B. 1987. Metode Fitokimia : Penuntun Cara Modern Menganalisis Tumbuhan (diterjemahkan oleh Kosasih Padmawinata dan Iwang Soediro). Institut Teknologi Bandung, Bandung.
Illing, I., W. Safitri, dan Erfiana. 2017. Uji Fitokimia Ekstrak Buah Dengen. Jurnal Dinamika Vol. 08. No.1 : 66-84.
Khotimah, K. 2016. Skrining Fitokimia dan Identifikasi Metabolit Sekunder Senyawa Karpain pada Ekstrak Metanol
Daun Carica pubescens Lanne & K. Koch dengan LC/MS. Skripsi S1. UIN Maulana Malik Ibrahim, Malang.
Kumoro, A.C., M. Hasana dan H. Singha. 2009. Effects of Solvent Properties on the Soxhlet Extraction Of Diterpenoid Lactones from Andrographis paniculata leaves. J. Science Asia 35 : 306-309.
Kumoro, A.C. 2015. Teknologi Ekstraksi Senyawa Bahan Aktif dari Tanaman Obat. Plantaxia, Yogyakarta.
Lestari, D. M., N. Mahmudati, Sukarsono, Nurwidodo, dan Husamah. 2018. Aktivitas Antioksidan Ekstrak Fenol Daun Gayam (Inocarpus fagiferus Fosb.). J. Biosfera vol. 35 no. 1 pp. 37 – 43
Marliana, S. D., V. Suryanti, dan Suyono. 2005. Skrining Fitokimia dan Analisis Kromatografi Lapis Tipis Komponen Kimia Buah Labu Siam (Sechium edule Jacq. Swartz.) dalam Ekstrak Etanol. J. Biofarmasi 3 (1): 26-31
Meigaria, K. M., I. W. Mudianta, dan N. W. Martiningsih. 2016. Skrining Fitokimia dan Uji Aktivitas Antioksidan Ekstrak Aseton Daun Kelor (Moringa oleifera). J. Wahana Matematika dan Sains, vol. 10, no. 2.
Mottaleb, M. A., dan S. D. Sarker. 2012. Accelerated Solvent Extraction for Natural Product Isolation. In : S. D. Sarker and Lutfun Nahar (eds.), Natural Product Isolation, Method in Molecular Biology vol. 864 pp. 75-88.
Pratiwi, P., M. Suzery, dan B. Cahyono. 2010. Total Fenolat dan Flavonoid dari Ekstrak dan Fraksi Daun Kumis Kucing (Orthosiphon stamineus B.) Jawa Tengah serta Aktivitas Antioksidannya. J. Sains & Matematika vol. 18 no.4.
Puspitasari, A. D., dan R. L. Wulandari. 2017. Aktivitas Antioksidan, Penetapan Kadar Fenolik Total dan Flavonoid Total Ekstrak Daun Kersen (Muntingia calabura L.). J. Pharmaciana vol.7, no.2, pp. 147-158.
Putra, S. 1991. Taru Premana, Cetakan V. PT Upada Sastra, Denpasar.
Robinson, T. 1991. The Organic Constituen of HigherPlants. 6th Edition.
Department of
Biochemistry. University of Massachus etts
Rohman, A. S. Riyanto, dan N. K. Hidayati. 2007. Aktivitas Antioksidan, Kandungan Fenolik Total, dan Flavonid Total Daun Mengkudu. Jurnal AGRITECT, Vol. 27, No. 4
Sarwono, J. 2006. Metode Penelitian Kuantitatif dan Kualitatif. Graha Ilmu, Yogyakarta
Setyowati, W. A. E., S. R. D. Ariani., Ashadi., B. Mulyani dan C. P. Rahmawati. 2014. Skrining Fitokimia dan Identifikasi Komponen Utama Ekstrak Metanol Kulit Durian (Durio zibethinus Murr.) Varietas Petruk. Seminar Nasional Kimia dan Pendidikan Kimia UNS, Surakarta.
Shabri, dan D. Rohdiana. 2016. Optimasi dan Karakterisasi Ekstrak Polifenol Teh Hijau dari Berbagai Pelarut. Jurnal Penelitian Teh dan Kina, 19 (1), pp. 5766
Suryani, N. C., D. G. M. Permana, dan A.A.G.N. A. Jambe. 2015. Pengaruh Jenis Pelarut Terhadap Kandungan Total Flavonoid dan Aktivitas Antioksidan Ekstrak Daun Matoa (Pometia pinnata). Skripsi S1. Tidak dipublikasikan. Fakultas Teknologi Pertanian Universitas Udayana, Bali.
Swantara, I M. D., I. B. Darmayasa, dan S. Lestari. 2010. Karakterisasi Fraksi Aktif Antibakteri Ekstrak Dari Daun Pepe (Gymnema reticulatum Br.). Jurnal Kimia 4 (2), pp. 101-112.
Syafitri, N. E., M. Bintang, dan S.Falah. 2014. Kandungan Fitokimia, Total Fenol, dan Total Flavonoid Ekstrak Buah Harendong (Melastoma affine D. Don). J. Current Biochemistry vol. 1 (3): 105 - 115
Tan, M.C., C.P. Tan dan C.W. Ho. 2013. Effects of Extraction Solvent System, Time and Temperature on Total Phenolic Content of Henna (Lawsonia inermis) Stems. International Food Research Journal 20: 3117-312.
Thakur G. S., R. Sharma dan B.S. Sanodiya. 2012. Gymnema sylvestre: An Alternative Therapeutic Agent for Management of Diabetes. Journal of Applied Pharmaceutical Science vol. 2 (12), pp. 001-006.
Vogel, A. I. 1978. Textbook of Quantitative Chemical Analysis. Woolwich Polytechnic, London
Voight, R. 1994. Buku Pengantar Teknologi Farmasi (diterjemahkan oleh Soedani, N.). Edisi V. Universitas Gadjah Mada Press, Yogyakarta
Wachidah, L. N. 2013. Uji Aktivitas Antioksidan serta Penentuan Kandungan Fenolat dan Flavonid Total dari Buah Parijto. Skripsi S1. Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Islam Negeri Syarif
Hidayatullah, Jakarta.
Widarta, I. W. R., dan I. W. Arnata. 2017 . Ekstraksi Komponen Bioaktif Daun Alpukat dengan Bantuan Ultrasonik pada Berbagai Jenis dan Konsentrasi
Pelarut. AGRITECH, vol. 37, no. 2, Hal. 148-157.
Yulistian, D. P., E. P. Utomo, S. M. Ulfa, dan E. Yusnawan. 2015. Studi Pengaruh Jenis Pelarut terhadap Hasil Isolasi dan Kadar Senyawa Fenolik dalam Biji Kacang Tunggak (Vigna unguiculata (L.) Walp) sebagai Antioksidan. Kimia Student Journal, vol.1, no. 1, pp. 819 – 825.
121
Discussion and feedback