SAWAR DARAH OTAK
on
SAWAR DARAH OTAK
Aluh Sri Yuliana Ulfa1, Tjok Gde Bagus Mahadewa2 1,2Fakultas Kedokteran, Universitas Udayana Jalan panglima Sudirman Denpasar Bali aluhsriyulianaulfa@yahoo.com
Abstrak
Sawar Darah Otak (SDO) adalah membran pemisahan sirkulasi darah dari cairan ekstraselular otak (BECF) dalam sistem saraf pusat (SSP). Sawar Darah Otak merupakan penghalang fisik antara pembuluh darah lokal dan sebagian besar dari sistem saraf pusat itu sendiri, dan tempat berhentinya zat yang melewati bagian atas otak. Sawar Darah Otak memiliki sifat permeabel terhadap alkohol, dan beberapa logam berat yang dapat melintasi membran Sawar Darah Otak. Konsep Sawar Darah Otak pertama kali diperkenalkan oleh Paul Ehrlich. Paul Ehrlich menemukan bahwa injeksi intravena pewarna ke dalam aliran darah meninggalkan noda pada seluruh jaringan di sebagian besar organ kecuali otak. Menggunakan mikroskop elektron dan elektron-padat pelacak seperti horseradish peroksidase (HRP) menunjukkan bahwa sawar darah otak terletak di sel-sel endotel kapiler dari otak.Sawar Darah Otak juga melindungi otak secara internal seperti tengkorak yang melindungi otak dari luar.
Kata kunci: Sawar Darah Otak, Sistem Syaraf Pusat
Abstract
The Blood–Brain Barrier (BBB) is a separation of circulating blood from the brain extracellular fluid (BECF) in the central nervous system (CNS). It is a physical barrier between the local blood vessels and most parts of the central nervous system itself, and stops many substances from travelling across it. The BBB is permeable to alcohol, and some heavy metals can cross the blood-brain barrier as well. The concept of the blood brain barrier was first introduced by Paul Ehrlich. He found that intravenous injection of dyes into the bloodstream stained all the tissues in most organs except the brain. Using electron microscopy and electron-dense tracers such as horseradish peroxidase (HRP) a group of scientists demonstrated that the blood- brain barrier is located in endothelial cells of capillaries of the brain.The BBB is to protecting the brain internally as the skull is to protecting it externally.
Keywords: Blood–Brain Barrier, Central Nervous System
Sawar Darah Otak (SDO) adalah struktur membran yang secara primer berfungsi untuk melindungi otak dari bahan-bahan kimia dalam darah, dimana fungsi metabolik masih dapat dilakukan. Sawar darah otak ini terdiri dari sel-sel endotelial, yang tersusun sangat rapat di kapiler otak. Kepadatan yang tinggi lebih banyak membatasi lewatnya substansi-substansi dari aliran darah dibandingkan sel-sel endotelial kapiler tubuh lainnya. Proyeksi sel-sel astrosit (juga disebut “glia limitans”) mengelilingi sel endotelial SDO, menyediakan dukungan biokimia untuk sel tersebut. SDO berbeda dengan blood-cerebrospinal fluid barrier yang menyerupainya, suatu sel-sel koroid pada pleksus koroideus, dan dari blood-retinal barrier, yang dapat dimasukkan sebagai bagian dari SDO. Sejumlah morfologi, karakteristik fisiologis, dan fungsional dari SDO memastikan bahwa substrat endogen dan eksogen dalam sirkulasi umum tidak siap menyeberang ke parenkim otak 1.
Selain itu, Sawar darah otak berfungsi melindungi susunan saraf pusat (SSP) dan milieu darah dan mempertahankan homeostasis lingkungan rnikro otak. Keuntungan sawar agak dikurangi oleh kenyataan bahwa Ia menahan antibiotika, neurotransmitter tertentu (misal dopamin), dan obat yang secara potensial berguna lainnya 2.
Neuron-neuron, sel-sel glia, cairan ekstraseluler otak dipisahkan dan darah oleh sawar darah otak. Sawar darah otak dicirikan sebagai lapisan seluler yang sempuma dan kontiniu dan sel-sel endotel yang disegel oleh tight junction. Komunikasi sel-ke-sel normal antara astrocyte, pericyte, sd endotel dan neuropil yang mengelilingi penting bagi ekspresi fenomena sawar darah-otak dan
mekanisme homeostatisnya. Transpor, fungsi yang dimediasi reseptor dan enzim, memainkan peran penting dalam regulasi komposisi cairan ekstraseluler otaic. Molekul, di atas ukuran yang dibatasi, yang bersirkulasi dalam darah dapat memperoleh akses menuju niang interstisial hanya jika terdapat sistem transpor khusus untuk molekul tersebut yang terdapat dalam endotel kapiler otak. Sistem demikian untuk asam amino, transferin, insulin, Ig G, dan albumin terkationasi menjamin bahwa SSP secara tetap menerima senyawa yang dibutuhkan 2.
Sistem serebrovaskuler mendukung kegiatan sel-sel otak dengan memberikan substrat seperti oksigen dan glukosa ke jariugan otak dan memindahkan produk metabolisme otak seperti karbon dioksida. Pembuluh darah otak juga membawa honnon dan informasi homeostatis ke otak dan mendistribusikan bahan—bahan humoral yang disintesis saraf ke sistemik. Fungsi-fungsi mi tentu turut dipengaruhi oleh struktur dan firngsi pembuhth darah otak 2, 3.
Otak berfungsi dalam suatu lingkungan yang terkontrol-baik terpisah dan milieu perfer. Mekanisme yang mengontrol lingkungan unik otak adalah sawar darah otak. Zat pewarna yang lanit air diinjeksilcan ke sirkulasi perifer tidak mewarnai otak ataupun cairan cerebrospinal (CSF), meskipun plexus choroid terwarnai. Ekspenimen lanjutan menunjukkan bahwa zat warna yang sama yang disuntikkan ke ruang subaraknoid mewarnai otak dan CSF, tetapi tidak mewarnai
jaringan perifer Pengamatan yang diambil dan studi zat wama membawa kepada konsep sawar antara darah dan otak 2.
Peneliti selanjutnya menggunakan zat warna bersifat basa yang sangat larut dalam lemak dan mampu melintasi sawar darah otak (Friedemann, 1942), memmjukkan bahwa otak terwarnai dengan transpor langsung zat warna melintasi mikrovaskulatur cerebral. Broman (1941) berpendapat bahwa fungsi sawar pada sawar darah otak berlangsung melaiui sel-sel endotel kapiler dan bukan pada astrocyte end feet. Debat apakah astrocytic end feet atau endotel kapiler yang berperan pada sawar darah otak dihentikan oleh studi sitokimia elekfron mikroskop oleh Reese dan Karnovsky (1967), dan selanjutnya oleh Brightmann dan kawan kawan (1969). Peroksidase horseradish (BM=43 000) digunakan untuk memvisualisasikan sawar darah otak. Tidak semua pembuluh darah cerebra sepenuhnya kedap. Daerah bocor, kurang memiliki SDO endotel, terletak di posisi strategis di garis tengah dari sistem ventrikel, dan secara kolektif disebut sebagai organ circumventricular (C Vos). Paling sering, daerah ini tidak dilindungi oleh SDO untuk alasan yang berhubungan dengan fungsi fisiologis. 2, 4, 5.
Dua fitur pada endotel serebral yang penting dalam membentuk sawar darah otak adalah tight junctions dan frekuensi rendah vesikel yang dihubungkan dengan transpor transendotel.
Keberadaan barrier tersebut pertama kali oleh Paul Ehrlich pada akhir abad ke-19. Erhlich adalah seorang bakteriologis yang sedang mempelajari pewarnaan, yang digunakan pada beberapa penelitian untuk membuat struktur yang kecil dapat terlihat. Ketika disuntikkan, beberapa zat warna akan mewarnai seluruh organ hewan kecuali otak. Saat itu, Ehrlich menyatakan hal ini yaitu otak
tidak menyerap cukup zat warna. Untuk memahami mekanisme pembentukan SDO, harus diteliti juga urutan generasi sel dan pembentukan SDO dalam SSP berkembang 6.
Selanjutnya, pada percobaan berikutnya tahun 1913, Edwin Goldmann (salah satu murid Ehrlich) menyuntikkan zat warna ke cairan spinal otak secara langsung. Ia menemukan bahwa pada kasus ini otak menjadi berwarna, tetapi tidak pada bagian tubuh. Ini dengan jelas mendemonstrasikan adanya barrier di antara keduanya. Saat itu, dinyatakan bahwa pembuluh darah itu sendiri berfungsi sebagai barrier, karena membran sebelumnya tidak dapat ditemukan. Konsep mengenai Blood Brain Barrier (istilahnya hematoencephalic barrier) diajukan oleh Lisa Stern tahun 1921. Ini tidak disetujui hingga ditemukannya mikroskop elektron pada riset medis thun 1960an dimana membran tersebut dapat dilihat. Selain fungsi penghalang telanjang endotel, SDO matang terdiri dari sistem selular kompleks dengan morfologi yang sangat khusus. Otak kapiler dibentuk oleh sel endotel yang terhubung ke dirinya sendiri dan juga terhubung ke sel endotel tetangga 5.
Dipercaya bahwa astrosit dibanding sel-sel epitel adalah dasar dari SDO proses kepadatan astrosit yang mengelilingi sel-sel epitelial SDO 7.
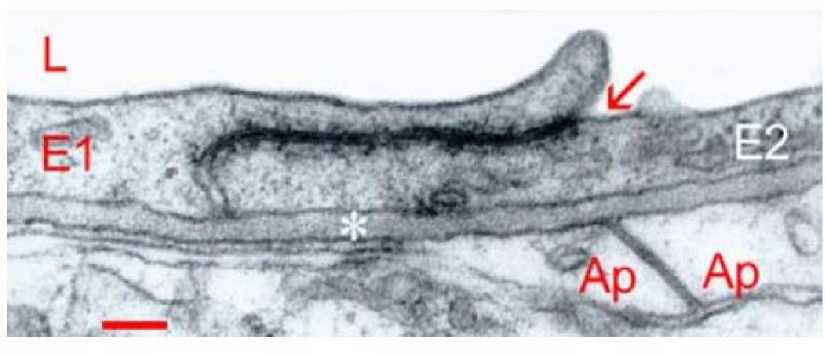
Gambar 1 Hubungon interseluler antara 2 ujung dad sel-sel endotel (El, E2, panah). L. - lumen kapiler darah; asterisk - lamina basal; Ap - asfroeyte processes dengan segera membungkus kapiler. Skala = 0,2 jam (likus, neokorteks) 2.
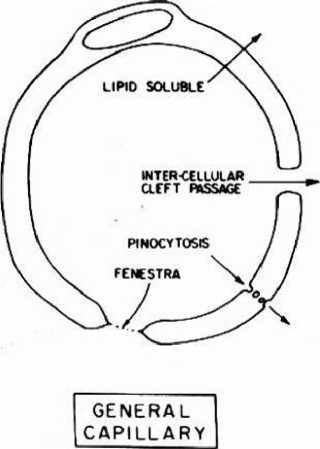
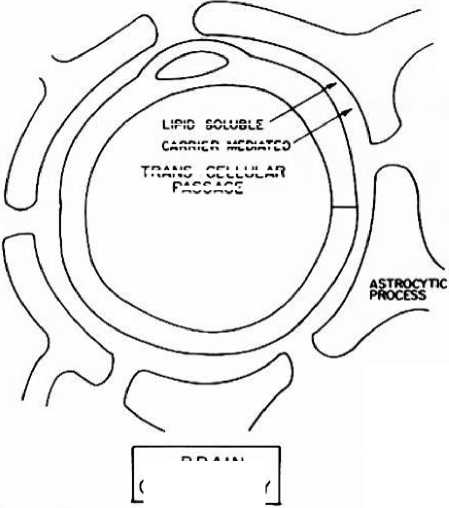
Sawar darah otak adalah suatu membran yang sangat resisten terhadap proses diffusi dan memisahkan cairan intersisial otak darah. Pemeriksaan susunan saraf pusat dengan menggunakan mikroskop elektron memperlihatkan bahwa lumen kapiler darah dipisahkan dari ruang ekstra seluler oleh 2:
-
1. sel endotelial di dinding kapiler
-
2. membran basalis di luar sel endotel, dan
-
3. kaki-kaki astrosit yang menempel pada lapisan luar dari dinding kapiler (Gambar 2)
LlPlD SOLUBLE
CARRIER MEDIATED
Trans-CELLui ar
PASSAGE
BRAIN CAPILLARY
Gambar 2. pembuluh darah kapiler susunan saraf pusat, area sawar darah otak
Dengan menggunakan electron dense-marker seperti lanthanum dan horseradish peroksidase terlihat bahwa substansi tersebut tidak dapat menembus sel endotel kapiler karena adanya tight junction diantara sel tersebut, sehingga tight junction sangat berperan di dalam sawar darah otak
Beberapa bagian otak tidak mempunyai sawar darah otak dan mempunyai struktur sel yang berbeda. (Gambar 3) Pada daerah tersebut protein dan molekul-molekul organik yang kecil dalam darah dapat masuk ke susunan saraf pusat.
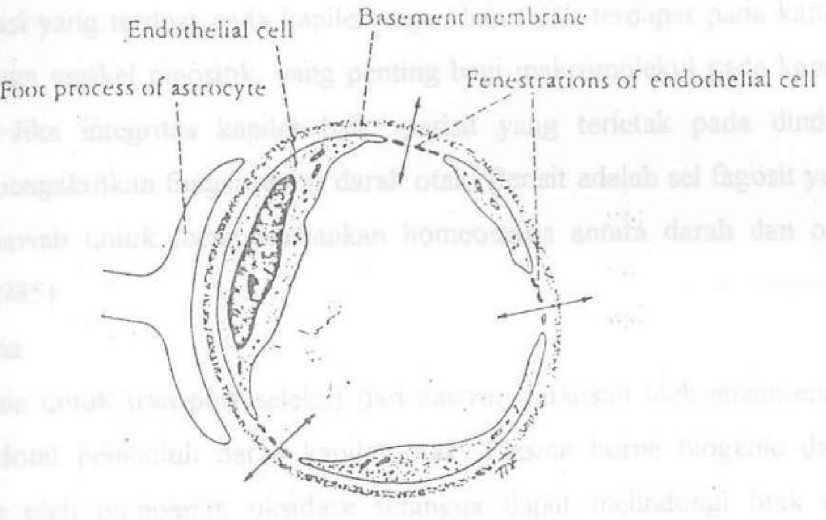
Gambar 3. Kapiler pembuluh darah otak, daerah tanpa sawar darah otak
Diseluruh tubuh selain otak, dinding-dinding kapiler (pembuluh darah terkecil) dibuat dari sel-sel endotel yang fenestrata, berarti mereka memiliki celah kecil yang disebut fenestrasi. Bahan kimia yang larut dapat melewati celah ini, dari darah ke jaringan atau dari jaringan ke darah. Selanjutnya di otak, sel-sel endotel ini tersusun lebih rapat disebut dengan tight junction. Ini membuat SDO menghambat gerakan seluruh molekul kecuali yang mampu melewati membran sel dengan kalarutan dalam lemak (mis : oksigen, karbondioksida, etanol, dan hormon-hormon steroid) dan yang dapat melewati sistem transpor spesifik (mis : gula dan asam amino). Substansi dengan berat molekul lebih dari 500 dalton (500 u) biasanya tidak dapat melewati SDO, dimana molekul yang lebih kecil dapat melewatinya. Sebagai tambahan, sel-sel endotel memetabolisme molekul-molekul
tertentu untuk mencegah mereka masuk ke SSP. Contohnya : L-DOPA, prekursor
dopamin, dapat menembus SDO, dimana dopamin sendiri tidak dapat menembusnya.
Dalam kimia, berat dihitung tidak dalam kg tetapi dalam Dalton. Faktanya, terungkap bahwa hanya molekul yang berat molekulnya kurang dari 500 dalton yang dapat menembus SDO. Sekaran berat molekul 500 dalton tidak sangat besar. Air memiliki berat molekul 18 dalton, insulin juga tidak begitu besar. Virus-virus (dengan berat molekul dalam hitungan juta) jauh lebih besar daripada ini, dan bakteri sangat jauh lebih besar lagi. Jadi jarang untuk bahan kimia, virus, dan bakteri untuk dapat menembus SDO dan masuk ke otak.
Sebagai tambahan dari tight junction yang berfungsi mencegah transpor anatara sel-sel endotel, ada 2 mekanisme untuk mencegah difusi pasif melalui membran sel. Sel-sel glia yang mengelilingi kapiler otak menyediakan rintangan kedua untuk molekul-molekul yang hidrofilik, dan konsentrasi yang rendah dari protein interstitial di otak mencegah akses molekul hidrofilik.
SDO melindungi otak dari aliran bahan-bahan kimia dalam darah. Banyak fungsi tubuh dikendalikan oleh hormon dalam dalam darah, dan ketika sekresi hormon-hormon tersebut dikendalikan oleh otak, hormon-hormon ini umumnya tidak memasuki otak dari darah. Ini akan mencegah otak untuk langsung memonitor tingkat hormon. Dalam tujuan untuk mengendalikan sekresi hormon secara efektif, ada tempat khusus dimana neuron dapat “mencontohkan” komposisi sirkulasi darah. Di tempat ini, SDO lemah; tempat ini termasuk tiga “organ sirkumventrikular”, yaitu organ subfornikal, area postrema, dan organum vasculosum dari lamina terminalis (OVLT).
SDO berfungsi sangat efektif untuk melindungi otak dari infeksi. Karena
ini, infeksi pada otak sangat jarang. Antibodi terlalu besar untuk menembus SDO, infeksi otak sering sangat serius dan sulit diobati.
Pada keadaan normal terdapat dua sawar yang semipermeabel dan berfungsi untuk melindungi otak dan medula spinalis dari substansi yang membahayakan. Fungsi sawar darah otak adalah melindungi otak dari berbagai variasi subtansi darah, terutama senyawa toxic.
Ada tiga Fungsi peting sawar darah otak adalah: Fungsi anatomi ,. Fungsi biokimika, Fungsi regulasi 5, 8. Berikut ini akan dijelaskan masing masing fungsi tersebut secara lebih mendalam:
-
(1). Fungsi Anatomi
Secara anatomis sawar darah otak adalah melindungi otak dari bermacam-macam toksin eksogen yang berasal dari darah. Fungsi ini dapat terjadi karena struktur sawar darah otak yang mempunyai tight junction antara sel endotel yang tidak permeabel terhadap molekul berukuran besar. Fenetrasi yang terdpat pada kapiler organ lain tidak terdapat pada kapiler otak, begitu juga vesikel pinositik, yang penting bagi makromolekul pada kapiler jaringan lain. Jika integritas kapiler baik, perisit yang terletak pada dinding kapiler akan mengaktifkan fungsi sawar darah otak. Perisit adalah sel fagosit yang bertanggung jawab untuk mempertahankan homeostasis antara darah dan otak.
-
(2). Fungsi biokimia
Fungsi biokimia untuk transport selektif dari zat-zat, tersusun oleh enzim-enzim alam sel endotel pembuluh darah kapiler otak. Plasma borne biogenic dapat dimetabolisme oleh monoamin oksidase sehingga dapat melindungi otak dari pemecahan epinefrin sistemik. Transport oleh asam amino secara signifikan dapat menyebabkan penetrasi prodrug levodopa pada sawar darah otak sehingga dopamin dapat dimetabolisme untuk pengobatan pasien parkinson
-
(3). Fungsi regulasi
Agar dapat mencapai otak, cairan ekstraseluler dari darah harus melewati/menemnbus epitel koroid atau endotel kapiler. Zat dapat segera masuk apabila molekul dapat larut dalam air (plasma) dan membran lipid. Molekul yang lain memerlukan protein pembawa agar dapat menembus sawar darah otak
Glukosa adalah sumber energi terbesar yang diperlukan oleh otak. Lebih 98% energi yang dipergunakan untuk menunjang fungsi saraf idapat dari pembakaran glukosa dalam darah. Transport aktif glukosa dibantu oleh protein pembawa yang spesifik. Di dalam cairan serebrospinal, konsentrasi glukosa hanya 2/3 dari konsentrasi dalam darah. Hal ini disebabkan karena glukosa secara konstan dipergunakan oleh otak. Kadar glukosa otak relatif lebih stabil dibandingkan dgnkadar glukosa dalam darah, sebab sistem transport akan berhenti/jenuh pada saat terjadi peningkatan glukosa dan akanaktif bila kadar glukosa plasma menurun (pada keadaan hipoglikemi).
Keadaan glukosa ini sangat penting untuk menjaga agar fungsi saraf tetap
normal. Pada keadaan hiperglikemi yang berat dengan kadar glukosa dalam plasma darah meningkat tiga kali,benda keton dan asam laktat akan terakumulasi dalam otak dan akan menekan fungsi saraf sehingga terjadi koma diabetik. Pada keadaan hipoglikemi yang berat susunan saraf pusat menjadi overaktif, pasien akan mengalami mental confusion, berkeringat dgnnadi yang cepat. Hipoglikemi akan menyebabkan kerusakan neuron-neuron otak jika energi utama yang dibutuhkan oleh otak tidak terpenuhi (insulin koma) .
Kadar ion Kalium dalam cairan ekstaselular otak dan cairan serebrospinal adalah 3 mmol/I, sedangkan kadar ion Kalium dalam darah antara 4-5 mmol/I. Kadar ion Kalium dan Natrium dalam otak diatur oleh Natrium Kalium ATPase yang terletak pada endotel membran sel pembuluh darah kapiler otak. Neurotransmisi yang optimal memerlukan kadar kalium yang konstan di dalam otak. Hal ini dapat dicapai dengan menghentikan diffusi ion kalium ke otak melalui transport yang spesifik di endotel yang secara aktif mengatur kadar ion kalium. Na+/K+ ATPase banyak terdapat di kapiler otak 9.
Mikrovaskuler otak mengandung 500 kali . Na+/K+ ATPase dan 1,6 kali di pleksus koroid. . Na+ /K+ ATPase secara aktif mengubah danmengatur kadar ion kalium dalam otak. Pada glioma maligna kemungkinan terdapat peningkatan . Na+/K+ ATPase yang akan menyebabkan peningkatan Na dan air yang akan menyebabkan terjadinya edem vasogenik. Kortikosteroid dapat menghambat aktivitas . Na+/K+ ATPase pada glioma, sehingga beberapa penulis memperkirakan bahwa efek terapi kortikosteroid adalah berkurangnya . Na+/K+
ATPase . Selain transport Kalium dan ion Natrium, ion bikarbonat juga dapat
menembus sawar darah otak walaupun sistem transport spesifiknya belun diketahui 10, 11 .
Sebagian besar asam amino netral dapat melalui sawar darah otak melalui sistem transport berbeda, yaitu sistem L, sistem A dan sistem ASC. Sistem L cenderung berkaitan dengan asam amino netral yang bercabang atau rantai dengan bentuk cincin (leusin, valin), merupakan asam amino yang tergantung dengan ion natrium dan secara kompetitif dihambat oleh asam 2 aminobisikloheptan-2-karboksilat. Sistem A cenderung berikatan dengan asam amina netral dengan pendek (alanin, serin), tergantung pada natrium dan dihambat oleh asam alfametilaminisobutirat. Sistem ASC cenderung berikatan alanin, serin dan sistein, tergantung dengan natrium dam tidak sensitif terhadap asam 2-aminosikloheptan-2-karboksilat dan sama affametilaminisobutirat 9.
Otak memerlukan semua vitamin, kecuali vitamin K dan vitamin D. Hampir semua vitamin dapat menembus sawar darah otak melalui sistem transport yang berbeda. Proses transport vitamin diatur sebagai berikut:
-
• Pada saat kadar vitamin dalam darah tinggi, sedangkan dalam otak sudah cukup, maka mediator transport akan menghalangi masuknya vitamin ke otak
-
• Pelepasan vitamin yang lambat melalui sawar darah otak bertujuan untuk mencegah kehilangan vitamin yang tiba-tiba di otak. Hal ini terjadi pada keadaan defisiensi Untuk mengembangkan dan mempertahankan fungsinya otak juga memerlukan trace metals seperti Zn, Fe, Cu dan Meninioma.
Transport elemen-elemen tersebut bergantung pada adanya ion bebas, organomolekule atau metalloprotein. Besi dapat masuk ke otak melalui ikatan kompleks transferin dengan reseptor endotel spesifik dan melalui endositosis
Sawar darah otak impermeabel terhadap epinefrin, norepinefrin, asetilkholin, dopamin. Apabila sistem ini tidak ada, maka efek dari neurotransmiter tersebut akan merusak. Epinefrin terdapat banyak di dalam sirkulasi sebagai respon terhadap stress fisik ataupun emosional dan akan mengganggu fungsi otak bila dapat mencapai otak.
Terdapat hubungan antara Sawar Darah Otak, dimana SDO sendiri dapat rusak dalam beberapa penyakit yang penyimpanan lisosom yang berperan pada gejala-gejala neurologis, masalah secara langsung disebabkan oleh terkumpulnya produk-produk yang tersimpan dalam sel-sel otak. Karena adanya SDO, terapi penggantian enzim sekarang digunakan untuk mengobati beberapa penyakit penyimpanan lisosom yang tidak dapat mencapai sel otak. Beberapa hubungannnya antara lain:
-
1. Kelainan anatomi
Kemicterus adalah suatu kondisi pada neonatus dengan otak (terutama striatum) tampak berwarna kuning. Hal ini terjadi karena penyakit hemolitik pada bayi baru lahir, karena terdapat rhesus incomtabiliti antara kedua orang tuanya. Dahulu diperkirakan hal ini terjadi karena imaturitas dari sawar darah otak, tetapi
pada kenyataannya maturitas tight junction telah terjadi pada usia kehamilan 12
minggu. Dama keadaan normal bilirubin dengan protein plasma sehingga tidak dapat melewati sawar darah otak. Fungsi tersebut belum sempurna pada beberapa bayi baru lahir sehingga sebagian besar bilirubin dalam keadaan bebas dan dapat menembus sawar darah otak.
Pendapat lain mengatakan bahwa imaturitas dari sawar darah otak pada bayi baru lahir berdasarkan pada
-
a. terdapat peningkatan protein dalam cairan serebrospinal pada bayi baru lahir b. terdapat bilirubin didalam otak pada beberapa bayi imatur yang disebut kernikterus
-
c. terdapat perbedaan penetrasi beberapa substans di dalam otak, pada bayi lebih cepat dibandingkan dengan orang dewasa.
-
2. Edem otak
Defenisi dari edem otak adalah peningkatan kandungan air di dalam jaringan otak. Edem otak dibedakan menjadi 3 tipe, yaitu: (1) edem otak sitotoksik, (2) edem otak interstisial, (3) edem otak vasogenik
Edem otak sitotoksik disebabkan karena akumulasi cairan intra seluler, yang biasanya terjadi pada hipoksia otak. Hipoksia berpengaruh terhadap mekanisme pompa Na+ ATP pada membran sel, menyebabkan akumulasi Na intra seluler, kemudian air akan masuk ke sel untuk mempertahankan tekanan osmotik. Dengan demikian edem yang terjadi adalah edem intraseluler primer danakan berpengaruh terhadap sel endotel, astrosit dan neuron. Pembengkakan sel tersebut mengakibatkan ruang interstisial akan menyempit. (Gambar 4)
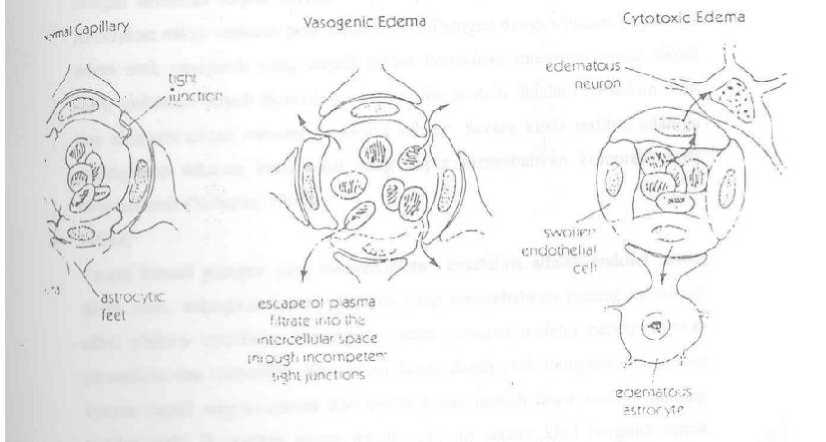
Gambar 4. Kapiler otak normal dan perubahannya saat terjadi edem otak vasogenik dan edem otak sitotoksik 2
Edem otak interstisial merupakan akibat dari peningkatan tekanan intraventrikuler dan hidrosefalus, sehingga menyebabkan transudasi cairan serebrospinal. Edem otak vasogenik merupakan akibat dari peningkatan permeabilitas sawar darah otak, dapat terjadi pada tumor otak dan abses otak. Tight junction menjadi tidak kompoten, sehingga menyebabkan cairan plasma masuk ke ruang interseluler. Edem vasogenik ini banyak dijumpai pada trauma, tumor, dan abses. Pada keadaan normal mekanisme otoregulasi akan bekerja keras jika terjadi hiperkapnia berat atau hipertensi berat. Bila alirandarah kapiler meningkat cukup besar dapat terjadi kerusakan tight junction. Penelitian pada hewan memperlihatkan bahwa hal tersebut menyebabkan terjadinya aktivitas pinositosis,akibatnya timbul peningkatan cairan di ekstra seluler dan edem otak.
-
3. Trauma otak
Struktur pembuluh darah serbral dan endotelnya dapat rusak karena trauma, dengan demikian terjadi kerusakan pula pada tight junction. Kerusakan mikro vaskuler post trauma, berhubungan dengan proses terjadinya edem otak vasogenik yang terjadi akibat kerusakan integritas sawar darah otak, akibatnya terjadi akumulasi natrium dan protein didalam parenkim otak dan ekspansi cairan osmoler ke ekstra seluler. Secara klinis terlihat adantya peningkatan tekanan intrakranial yang dapat menyebabkan kompresi pada struktur otak.
-
4. Infeksi
Target kuman patogen yang menyebabkan ensefalitis adalah endotel sawar darah otak, sedangkan kuman patogen yang menyebabkan meningitis adalah efitel pleksus koroideus. Masuknya kuman patogen melalui penetrasi pada paraseluler dan transeluler. Kerusakan sawar darah otak mungkin disebabkan karena terjadi migrasi lekosit dari darah dalam jumlah besar melalui dinding kapiler otak. Kerusakan sawar darah otak ini secara klini berguna untuk pemberian antibiotika yang tidak larut dalam lemak . Patogenesanya dapat dilihat pada Gambar 5.
LeuKocvw Migration into CSF
BreeHdown of
Blood-Sraln Barrier
Gambar 5 Patogenesa meningitis 2
Infeksi susunan saraf pusat, mekanisme terjadinya kerusakan sawar darah
otak tidak hanya karena adanya kuman patogen dalam meningen, tetapi juga karena terjadinya fragmentasi dinding sel, endotoksin, dan aktifitas dari sel-sel lekosit.
-
5. Tumor otak
Tumor otak dapat menyebabkan: (1). Peningkatan permeabilitas sawar darah otak, sehingga albumin dan protein lain dapat melewati sawar darah otak; (2). Pembengkakan jaringan sekitar tumor; (3)Terjadi absorpsi dan pengeluaran cairan dan protein dengan cairan serebrospinal di ventrikel.
Penyebaran air dan protein di jaringan otak tidak hanya menyebabkan terbentuk suatu massa, tetapi juga mengganggu keseimbangan elektrolit yang diperlukan untuk mempertahankan fungsi neuron normal. Gumerloc mengemukakan bahwa tumor otak akan merubah permeabilitas sawar darah otak secara signifikan bila ukuran diameter tumor mencapai lebih dari 3-4 mm, akan menyebabkan peningkatan vesikel pinositosis, gap junction dan fenetrasi, kemudian jumlah kapiler akan bertambah, ruangan perivaskuler bertambah dan akhirnya menyebabkan berkurangnya fungsi sawar darah otak.
Tumor otak yang banyak dijumpai adalah astrositoma, dan tumor ini menyebabkan kerusakan sawar darah otak. Bila astrositoma merupakan tumor sekunder dari paru atau mammae, terjadi penetrasi.
-
6. Penyakit antoimun
Tight junction pada sel endotel pembuluh darah otak dapat dilalui oleh limfosit yang tergolong dalam T-sel. Pada beberapa penyakit saraf yang disebabkan oleh otoimum seperti, Guillain-Barre Syndrome, motoneuron
disease, demyelinisasi polineuropati, terjadi serangan imunologi pada sel
endotel mikrovaskuler oleh glikolipid. Secara langsung autoantibodi menyebabkan kerusakan selular yang luas, yang berakibat terjadi peningkatan permeabilitas sawar darah otak.
-
7. Perubahan suhu
Dari hasil penelitian diketahui bahwa keadaan iskemik otak, perubahan suhu mempengaruhi permeabilitas sawar darah otak. Jika hipotermi dengan suhu 30 atau 330C maka tidak terjadi perubahan sawar darah otak, sedangkan pada suhu 390C terjdai kerusakan sawar darah otak.
Untuk mencapai sel target, suatu obat harus dapat menembus sawar biologic, dapat berupa membrane yang terdiri atas satu atau beberapa sel. Pada sawar darah otak, obat-obatan yang larut dalam air sulit melewatinya dan pada sawar plasenta hanya obat-obatan dengan BM besar. Banyak proses dengan demikian terlibat dalam pengambilan dan pengolahan obat atau partikel di SDO. Dari sudut pandang farmasi, adalah menarik untuk mengetahui pada tingkat apa dan untuk apa pengambilan sejauh terjadi 8. Secara umum terdapat 3 faktor yang mempengaruhi masuknya obat dari darah ke otak, yaitu: (1) kelarutan obat dalam lemak; (2). Ikatan obat dengan plasma protein; (3). Ionisasi obat.
Jenis – jenis obat tertentu seperti antibiotika, kemoterapi dan zat radioaktif yang pemakaiannya diperuntukkan bagi penyakit penyakit otak juga mempertimbangkan SDO.
Konsep sawar darah otak telah dijabarkan oleh Ehrlich lebih dan 100 tahun lalu. Sawar darah otak berfungsi melindungi otak dari lingkungan darah dan memelihara homeostasis lingkungan mikro otak dan sawar darah otak merupakan suatu dinding yang impermeable, serta untuk melindungi otak dari berbagai gangguan yang dapat menyebabkan disfungsi otak. Dalam beberapa keadaan, fungsi sawar darah otak ini dapat terganggu, keadaan ini ada yang menguntungkan dan digunakan untuk terapi pada kelainan susunan saraf pusat.
Secara umum terdapat 3 faktor yang mempengaruhi masuknya obat dari darah ke otak, yaitu: (1). Kelarutan obat dalam lemak; (2). Ikatan obat dengan plasma protein; (3) Ionisasi obat
Terdapat 3 jenis obat dan cara pengobatan yang dipengaruhi oleh SDO: (1) Antibiotika; (2). Kemoterapi; (3). Zat Radioaktif.
DAFTRAR PUSTAKA
-
1. JohnF. Deeken, WolfgangLoscher. 2007. The Blood-Brain Barrier and Cancer:Transporters,Treatment, and Trojan Horses. lin Cancer Res 2007;13(6) March15, 2007. www.aacrjournals.org. Halaman 1663-1647.
-
2. Zuiham. 2005. Sawar Darah Otak. Jurnal Kedokteran Nusantara Vol 38 No 2 Juni 2005. Halaman 199-203.
-
3. Hartanto OS. 2006. Perubahan Sawar Darah Otak Pada Proses Inflamasi. Jurnal Berkala Neurosains Vol 7, No 2, Pebruari 2006. Halaman 49-57
-
4. Gitau E.N, Newton C.R. 2005. Blood-Brain Barrier in Falciparum Malaria. Tropical Medicine and International Health Volume 10 No 3 Maret 2005. Halaman 285-292.
-
5. Elga de Vries, Alexandre Prat. 2005. The Blood–Brain Barrier and Its Microenvironment Basic Physiology to Neurological Disease. New York: Taylor & Francis Group, LLC
-
6. Richard Daneman, LuZhou, Amanuel A. Kebede, Ben A. Barres. 2010. Pericytes Required for Blood–Brain Barrier Integrity During Embryogenesis. Nature Vol 468 25 Nopember 2010. Halaman 562 - 568.
-
7. Enming J Su, Linda Fredr iksson, Melissa Geyer. 2008. Activation of PDGF-CC by tissue plasminogen activator impairs blood-brain barrier integrity during ischemic stroke. Nature Medicine Volume 14 Number 7 JULY 20 08. http://www.nature.com/naturemedicine. Halaman 731-737.
-
8. Inge van Rooy. 2011. Targeted liposomes for drug delivery across the bloodbrain barrier. Utrecht Institute for Pharmaceutical Sciences, Utrecht
-
9. Hsuchou H, Kastin AJ, Tu H, Markadakis EN, Stone KP, Wang Y, Heymsfield SB, Chua SC Jr, Obici S, Magrisso IJ, Pan W. 2011. Effects of cell-type specific leptin receptor mutation on leptin transport across the BBB. Peptides 32: 1392-9, 2011
-
10. Nitta, T. et al. 2003. Size-selective loosening of the blood-brain barrier in claudin-5-deficient mice, The Journal of Cell Biology, volume 161, May 2003 :653-660.
-
11. Itoh, M. et all. 2001. Junctional adhesion molecule (JAM) binds to PAR-3 : a possible mechanism for the recruitment of PAR-3 to tight junctions, The Journal of Cell Biology, volume 154, August 2001: 491-497.
21
Discussion and feedback